芹菜素诱导膀胱癌5637细胞凋亡研究
2016-08-03谢杨春邓永诚
谢杨春 邓永诚 田 黎
广东省深圳市坪山新区人民医院中医科,广东 深圳 518118
实验研究
芹菜素诱导膀胱癌5637细胞凋亡研究
谢杨春邓永诚田黎
广东省深圳市坪山新区人民医院中医科,广东深圳518118
【摘要】目的:研究芹菜素对人膀胱癌5637细胞增殖及凋亡的影响。方法:采用20~80μmol/L 芹菜素处理5637细胞,MTT法检测膀胱癌5637细胞增殖抑制率;细胞软琼脂克隆形成实验检测细胞成瘤能力的抑制效率;Hoechst 33258细胞核染色法观察细胞凋亡的形态学改变。结果:芹菜素呈浓度依赖的抑制5637细胞的增殖;80μmol/L芹菜素处理组细胞出现核固缩、染色质凝集和核碎片化等典型的细胞凋亡特征;5637细胞的克隆形成能力随着芹菜素浓度增加而显著降低。结论:芹菜素能够抑制人膀胱癌5637细胞的增殖,抑制5637的克隆形成,并诱导细胞凋亡。
【关键词】芹菜素;膀胱癌;细胞增殖;细胞凋亡
膀胱癌是最常见的泌尿系统肿瘤,其中移行细胞癌(Transitional Cell Carcinoma,TCC)占90%,又称为尿路上皮癌,其中70%~85%的移行细胞癌为表浅性膀胱癌[1]。临床中非肌层浸润性膀胱癌的常用治疗方法为经尿道膀胱肿瘤切除术[2]。然而,经尿道膀胱肿瘤切除术后的患者有50%~80%的复发,10%~25%的患者复发后发展为肌层浸润性膀胱癌[3]。为了抑制膀胱肿瘤的复发及进一步恶化,化疗以及免疫治疗被广泛用于浅表性膀胱癌患者的术后治疗中。较常用的膀胱内化疗及免疫治疗的药物包括顺铂、丝裂霉素 C、卡介苗以及干扰素-α[4-5]。这些方法虽然在一定程度上取得疗效,但是通常给患者带来不可逆转的系统毒性以及严重的膀胱局部刺激,例如出血性膀胱炎等[6]。因此,寻求无毒副作用且有效的膀胱癌治疗药物十分迫切。
芹菜素(5,7,4′-三羟基黄酮,Apigenin, API),又称芹黄素,是一种广泛存在于多种水果和蔬菜中的黄酮类化合物,具有多方面的药理作用[7-8],以抗肿瘤作用最为突出。实验证明芹菜素在体外能够显著抑制多种类型的癌细胞的生长和诱导其凋亡,包括:宫颈癌[9]、卵巢癌[10]、结肠癌[11]、胃癌[12]等,而在膀胱癌中的作用研究鲜有报道。本实验观察了芹菜素对人膀胱癌5637细胞的生长抑制以及诱导凋亡作用。
1材料与细胞
1.1试剂芹菜素(质量分数≥98%,批号:22806)购自阿拉丁公司;MTT,低熔点琼脂糖、二甲基亚砜(DMSO),蛋白酶抑制剂购自Sigma;Hoechst 33258,购置南京碧云天。RPMI 1640培养基,胎牛血清(Fetal bovine serum,FBS)均购自GIBCO公司;其余试剂均为国产分析纯。
1.2细胞株及细胞培养人膀胱癌细胞株5637购自中国科学院上海细胞库;培养于含10% 胎牛血清的RPMI 1640培养液中,于37 ℃、5% CO2、95% O2细胞培养箱内常规传代培养,取对数生长期细胞用于实验。
2实验方法
2.1MTT法检测芹菜素对膀胱癌细胞5637增殖的影响将5637细胞以3×103/孔接种于96孔板中,细胞贴壁后分别加入不同浓度的芹菜素(20、40、80μmol/L),每孔100μl,每个浓度设4个复孔,同时以不加芹菜素为空白对照组培养72h 后,向每孔中加入5.0g/L的MTT 20μl继续培养4h,弃上清,向每孔中加入DMSO 200μl溶解结晶体,置于摇床振荡30min,至蓝紫色颗粒完全溶解后,于酶标仪490nm波长处测定每孔吸光度值(A),并计算细胞增殖率(%)=(药物处理孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。实验重复3次,计算平均值。
2.2Hoechst 33258细胞核染色法观察细胞凋亡的形态学改变将5637细胞以2×105/孔接种于6孔板中,80μmol/L芹菜素(以不加芹菜素为空白对照组)作用24h后,吸去培养液,用PBS清洗2次,迅即加入4%的多聚甲醛液固定10min后,吸去固定液,以PBS清洗1次,加入5.0mg/L的Hoechst 33258,染色10min,用PBS 清洗3次后,在Zeiss Axio Observer A1荧光倒置显微镜下以340nm 激发光观察细胞凋亡形态并随机拍照。
2.3软琼脂克隆形成实验检测芹菜素对5637克隆形成能力的影响将1×103个5637细胞悬浮液1ml RPMI 1640 (0.3%低熔点琼脂糖,10%FBS, 1%双抗)并加入不同浓度的芹菜素(40、80μmol/L),接种于预处理的6孔板中,同时以不加芹菜素为空白对照组。6孔板预先放入1ml RPMI 1640 (0.6%低熔点琼脂糖, 10%FBS, 1%双抗)。培养3周以后,细胞克隆形成,采用0.01%结晶紫染色,观察计数。实验重复3次。
2.4统计学分析采用SPSS 11.0统计软件进行数据处理,实验数据均以均数±标准差表示,组间比较采用t检验,以P< 0.05表示差异具有统计学意义。
3结果与分析
3.1芹菜素对5637细胞增殖的抑制作用不同浓度芹菜素处理的细胞的增殖均受到不同程度的抑制,与空白对照组相比差异有统计学意义(P<0.05)。芹菜素对5637细胞增殖的抑制作用呈一定的浓度依赖性,采用不同浓度(20、40、60、80μmol/L)处理后,随着浓度的增加,其抑制效果更明显。见图1。
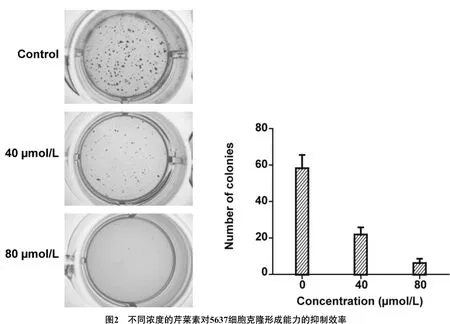
3.2芹菜素对5637细胞克隆形成能力的抑制作用不同浓度芹菜素处理的细胞克隆形成能力均受到严重的抑制,与空白对照组相比差异有统计学意义(P<0.05)。芹菜素对5637细胞的克隆形成能力的抑制作用呈一定的浓度依赖性,采用不同浓度(40、80μmol/L)芹菜素处理后,随着浓度的增加,其抑制效果更明显。见图2。(图2左图为芹菜素对5637细胞克隆形成抑制作用的观察;右图为芹菜素对5637细胞克隆形成抑制作用的统计学分析。)

3.3 芹菜素诱导5637细胞凋亡的形态学变化采用Hoechst 33258染色的细胞核结果显示,80μmol/L芹菜素处理后,大量的5637细胞出现核固缩、染色质凝集和核碎片化等典型的细胞凋亡特征;与此相比,对照组的活细胞,细胞核膜完整,核呈圆形或椭圆形,染色质分布较均匀,细胞核为蓝色均匀淡染,并未见凋亡细胞(图3左图为芹菜素对5637细胞凋亡诱导的细胞核形态观察;右图为芹菜素对5637细胞凋亡诱导的统计学分析)。以上实验结果表明芹菜素可诱导5637细胞凋亡。
4讨论
芹菜素作为一种广泛存在于植物中的天然黄酮类化合物,近年来已成为研究的热点[13],但有关芹菜素抗膀胱癌作用的实验研究比较少。逃逸了正常细胞增殖的调控体系而自主地无限生长是肿瘤细胞的典型特征。通过MTT实验实验结果显示,20、40、60、80μmol/L芹菜素对人膀胱癌5637细胞的增殖能力具有显著的抑制的作用,且随着浓度的增加抑制效果更加明显,呈现出良好的和量效关系。芹菜素抑制膀胱癌细胞增值的主要机制,可能与其直接抑制5637细胞生长,并诱导5637细胞凋亡等有关。

在有机体中,细胞凋亡是一个复杂的生理和病理过程,肿瘤的增值与凋亡是调控肿瘤的发生、发展的最重要的因素之一。研究肿瘤的发生发展机制,寻找抑制肿瘤细胞增值,增加肿瘤细胞凋亡的分子药物,是抑制肿瘤生长,阻碍肿瘤发生、发展的一个重要途径。我们通过Hoechst 33258细胞核染色结果显示,80μmol/L芹菜素处理人膀胱癌5637细胞,大部分细胞细胞出现核固缩、染色质凝集和核碎片化等典型的细胞凋亡特征。肿瘤的自我更新能力是肿瘤细胞一个重要特征,我们采用软琼脂克隆形成实验检测芹菜素对膀胱癌5637细胞自我更新能力的影响[14],结果显示,40、80μmol/L芹菜素对人膀胱癌5637细胞的克隆形成能力具有显著的抑制的作用,且随着浓度的增加抑制效果更加明显,呈现出良好的和量效关系。
总之,我们的研究发现芹菜素作为一种植物提取的活性成分,能够抑制人膀胱癌5637细胞的增殖以及克隆形成,并诱导其凋亡,芹菜素有望成为无毒副作用且有效的膀胱癌治疗药物。
参考文献
[1] Torre L. A.,Bray F.,Siegel R. L.,et al. Global cancer statistics, 2012[J]. CA Cancer J Clin,2015, 65(2):87-108.
[2] Kang M.R.,Yang, G.,Place R. F.,et al. Intravesical delivery of small activating RNA formulated into lipid nanoparticles inhibits orthotopic bladder tumor growth[J]. Cancer Res,2012, 72(19):5069-5079.
[3]Richards K. A.,Smith N. D.,Steinberg G. D. The importance of transurethral resection of bladder tumor in the management of nonmuscle invasive bladder cancer: a systematic review of novel technologies[J].J Urol,2014, 191(6):1655-1664.
[4] Griffin J. G.,Holzbeierlein J. Side effects of perioperative intravesical treatment and treatment strategies for these side effects[J].Urol Clin North Am,2013, 40(2):197-210.
[5] Logan C.,Brown M., Hayne D. Intravesical therapies for bladder cancer - indications and limitations[J]. BJU Int,2012, 110(Suppl 4):12-21.
[6] Singh C. K.,George J.,Ahmad N. Resveratrol-based combinatorial strategies for cancer management[J].Ann N Y Acad Sci,2013, 1290:113-121.
[7] Bao Y. Y.,Zhou S. H.,Fan J.,et al. Anticancer mechanism of apigenin and the implications of GLUT-1 expression in head and neck cancers[J]. Future Oncol,2013, 9(9):1353-1364.
[8] Venigalla M., Gyengesi E.,Munch G. Curcumin and Apigenin-novel and promising therapeutics against chronic neuroinflammation in Alzheimer′s disease[J]. Neural Regen Res,2015, 10(8):1181-1185.
[9] Zheng P. W.,Chiang L. C.,Lin C. C. Apigenin induced apoptosis through p53-dependent pathway in human cervical carcinoma cells[J]. Life Sci,2005, 76(12):1367-1379.[10] Suh Y. A., Jo S. Y., Lee H. Y., et al. Inhibition of IL-6/STAT3 axis and targeting Axl and Tyro3 receptor tyrosine kinases by apigenin circumvent taxol resistance in ovarian cancer cells[J]. Int J Oncol,2015, 46(3):1405-1411.
[11] Lee Y., Sung B., Kang Y. J., et al. Apigenin-induced apoptosis is enhanced by inhibition of autophagy formation in HCT116 human colon cancer cells[J]. Int J Oncol,2014, 44(5):1599-606.
[12] Kuo C. H., Weng B. C., Wu C. C., et al. Apigenin has anti-atrophic gastritis and anti-gastric cancer progression effects in Helicobacter pylori-infected Mongolian gerbils[J]. J Ethnopharmacol,2014, 151(3):1031-1039.
[13] Lim W., Park S.,Bazer F., et al. Apigenin Reduces Survival of Choriocarcinoma Cells by Inducing Apoptosis via the PI3K/AKT and ERK1/2 MAPK Pathways[J].J Cell Physiol,2016, DOI: 10.1002/jcp.25372
[14] Borowicz S., Van Scoyk M., Avasarala S.,et al. The soft agar colony formation assay[J]. J Vis Exp,2014, (92):e51998.
[15] Naseri M. H.,Mahdavi, M.,Davoodi J., et al. Up regulation of Bax and down regulation of Bcl2 during 3-NC mediated apoptosis in human cancer cells[J].Cancer Cell Int,2015, 15:55.
[16] Kondo K.,Obitsu S.,Ohta S.,et al. Poly(ADP-ribose) polymerase (PARP)-1-independent apoptosis-inducing factor (AIF) release and cell death are induced by eleostearic acid and blocked by alpha-tocopherol and MEK inhibition[J].J Biol Chem,2010, 285(17):13079-13091.
基金项目:广东省深圳市龙岗区科技计划医疗卫生(扶持类)基金(编号:201406113001012)。
作者简介:谢杨春(1979-),男,硕士,主治医生,从事中医药治疗泌尿科疾病相关研究工作。Email:xieyc123@163.com
【中图分类号】R285.5
【文献标志码】A
【文章编号】1007-8517(2016)12-0047-03
(收稿日期:2016.05.09)
Effects of apigenin on apoptosis of human bladder cancer 5637 cells
XIE YangchunDENG YongchengTIAN Li
Guangdong Provincial Shenzhen City Pingshan District Pepole’s Hospital, Shenzhen 518118, China
Abstract:Objective To study the effects of apigenin on the apoptosis of human bladder cancer cell line 5637. Methods 5637 cells were cultured with different concentrations of apigenin, the MTT assay was used to evaluate the cell inhibition rates. Apoptosis of 5637 cells was observed under a fluorescence microscope using Hoechst 33258 staining, 5637 tumorigenicity was messaured by soft colony formation assay. Results Apigenin causes concentration-dependent inhibition of the proliferation of bladder cancer 5637 cells. 5637 cells treated with apigenin showed significant morphological changes of apoptosis, and the cell tumorigenicity was inhibited as apigenin concentration increased. Conclusion Apigenin can inhibit the proliferation and induce apoptosis of 5637 cells.
Key words:Apigenin; Bladder cancer; Proliferation; Apoptosis
