外源NO对NaCl胁迫下夏枯草幼苗抗氧化能力及光合特性的影响
2016-08-02常青山张利霞杨伟周姗姗黄青哲吕凤娟黄玥葛淑慧张天蒙
常青山,张利霞,杨伟,周姗姗,黄青哲,吕凤娟,黄玥,葛淑慧,张天蒙
(1.河南科技大学林学院,河南 洛阳471003;2.河南科技大学农学院,河南 洛阳471003;3.扬子江药业集团江苏龙凤堂中药有限公司,江苏 泰州225321)
外源NO对NaCl胁迫下夏枯草幼苗抗氧化能力及光合特性的影响
常青山1,张利霞2*,杨伟3,周姗姗1,黄青哲1,吕凤娟1,黄玥1,葛淑慧1,张天蒙1
(1.河南科技大学林学院,河南 洛阳471003;2.河南科技大学农学院,河南 洛阳471003;3.扬子江药业集团江苏龙凤堂中药有限公司,江苏 泰州225321)
摘要:试验采用硝普钠(SNP)为NO供体,夏枯草幼苗为材料,研究外源0.01~0.50 mmol/L SNP对70 mmol/L NaCl胁迫下夏枯草幼苗抗氧化系统、光合参数与叶绿素荧光参数的影响。结果表明,0.05~0.10 mmol/L SNP可以缓解NaCl胁迫对夏枯草幼苗造成的伤害,其中0.10 mmol/L SNP 缓解效果最显著,该处理显著提高了NaCl胁迫下夏枯草幼苗叶片的过氧化物酶(POD)、过氧化氢酶(CAT)活性,降低了电导率与丙二醛(MDA)的含量。显著提高了夏枯草叶片叶绿素a含量、叶绿素b含量、总叶绿素含量、净光合速率(Pn)、气孔导度(Gs)与蒸腾速率(Tr),降低了胞间CO2浓度(Ci)。叶绿素荧光动力学参数显示,0.10 mmol/L SNP处理显著降低了NaCl胁迫下夏枯草幼苗的初始荧光(Fo)与非光化学荧光猝灭系数(NPQ),提高了最大荧光(Fm)、PSⅡ潜在光化学效率(Fv/Fo)、PSⅡ最大光化学效率(Fv/Fm)和PSⅡ有效光化学量子产量(Fv′/Fm′)。外源NO通过提高抗氧化酶活性,来减少脂质过氧化作用,减少光抑制对PSⅡ的破坏,提高光化学能力,增强夏枯草叶片的光合能力,从而最终提高夏枯草的抗盐能力。本试验条件下,以0.10 mmol/L SNP处理效果最为显著。
关键词:夏枯草;NaCl胁迫;NO;光合特性;叶绿素荧光
夏枯草(Prunellavulgaris)为唇形科夏枯草属多年生草本植物,具有较高药用价值与园林绿化价值[1-2]。夏枯草含有多种药用成分,主要为三萜类、甾体类、黄酮类、香豆素类等,具有降压、降糖、抗菌、抗病毒、抗炎和抗肿瘤等活性[1],在医药卫生与保健饮料等行业得到广泛应用[3]。当前我国有高达9913 万hm2的盐碱地[4],化肥和农药过度施用,则造成越来越多的土地发生次生盐渍化[5]。由于夏枯草野生资源的日渐匮乏,各地多采用建立夏枯草良好农业规范(GAP,good agricultural practice)生产基地来生产夏枯草[6],然而农艺措施的应用不可避免地导致土壤的次生盐渍化;其次,由于我国耕地资源的不足,在一些天然盐渍地考虑开展夏枯草的种植成为扩大夏枯草产量的另一个可行途径,因此提高夏枯草的产量和品质必须要考虑土壤盐害问题对其生长造成的不利影响。主要以播种繁殖的夏枯草,在种植中其幼苗极易受到盐胁迫危害,并最终影响夏枯草的产量与品质。因此,采用外源物质缓解盐害,并籍以提高夏枯草的抗盐能力成为一种行之有效的途径。
一氧化氮(NO)是植物体内一种重要的信号分子,已有大量研究表明NO在植物生长及响应干旱[7]、盐碱[8]、冷害[9-10]等逆境胁迫中具有显著作用。据研究,适宜浓度的NO供体硝普钠(SNP)可缓解NaCl胁迫对棉苗(Gossypiumhirsutum)[11]、长春花(Catharanthusroseus)[12]、半夏(Pinelliaternata)[13]、拟南芥(Arabidopsisthaliana)[14]等植物的抑制作用,从而增强植物的抗盐能力。目前,关于NO增强夏枯草幼苗对盐胁迫耐受能力的研究少见报道。本研究以夏枯草为材料,通过NaCl模拟盐害环境,研究不同浓度的外源NO供体SNP对NaCl胁迫下夏枯草幼苗抗氧化与光合特性的影响,探究NO对提高夏枯草抗盐能力的作用,为夏枯草在盐胁迫地区的推广种植提供理论依据与技术支持。
1材料与方法
1.1材料与培养
供试夏枯草种子2014年采收于河南南阳,所用SNP 为 NO 供体硝普钠Na2Fe(CN)5,纯度 99%,购自上海晶纯生物科技有限公司。试验于河南科技大学林学院园林植物生理实验室与校内大棚进行,温度(25±5) ℃,自然光照。2014年10月份开始育苗,2015年3-6月份开展相关实验。将种子消毒后播于装有基质的穴盘中育苗,待夏枯草长到3~4片真叶时,挑选长势一致的幼苗移栽到周转箱中。采用泡沫板悬浮法,每个周转箱中40棵幼苗,加入1/2 HoagLand营养液进行培养,每3~5 d更换一次营养液。幼苗培养期间用电动气泵每天通气12 h。营养液预培养至少两周,待其适应生存环境并长到6片真叶时进行实验处理。
1.2试验设计
待幼苗6片真叶完全展开时,采用前期预实验筛选出的用盐胁迫处理8 d后夏枯草表现出明显盐害症状的70 mmol/L NaCl浓度作为盐胁迫浓度,对夏枯草幼苗进行处理:1) CK (1/2 HoagLand营养液); 2) NaCl 胁迫 (1/2 HoagLand营养液+70 mmol/L NaCl);3) 0.01 mmol/L SNP (1/2 HoagLand营养液+70 mmol/L NaCl+0.01 mmol/L SNP);4) 0.05 mmol/L SNP (1/2 HoagLand营养液+70 mmol/L NaCl+0.05 mmol/L SNP); 5) 0.1 mmol/L SNP (1/2 HoagLand营养液+70 mmol/L NaCl+0.1 mmol/L SNP); 6) 0.5 mmol/L SNP (1/2 HoagLand营养液+70 mmol/L NaCl+0.5 mmol/L SNP)。处理液用低浓度HCl或KOH调到pH 6.0,每隔3~5 d更换一次溶液。连续处理8 d后,此时SNP处理相对于盐胁迫对照表现出明显的缓解效果,取样用于抗氧化酶与光合特性指标的测定。
1.3测定指标及方法
采用愈创木酚法测定过氧化物酶(peroxidase,POD)活性[15],紫外吸收法测定过氧化氢酶(catalase,CAT)活性[15]、电导仪法测定电导率[16],硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)含量[17],丙酮提取法测定叶绿素含量[17],每个处理重复3次。
气体交换参数测定:采用LI-6400便携式光合作用测定系统 (LI-COR,Lincon,NE,USA) 在晴天上午9:00-11:00测定幼苗叶片倒数2~3片功能叶的净光合速率(net photosynthetic rate,Pn)、气孔导度 (stomatal conductance,Gs)、胞间CO2浓度 (intercellular CO2concentration,Ci)、蒸腾速率 (transpiration rate,Tr) 等气体交换参数,每个处理重复3次。测定时叶室设置温度为25 ℃,CO2浓度为380 μmol/mol,光量子通量密度为1000 μmol/(m2·s)。
叶绿素荧光参数的测定:采用PAM-2100 便携式调制荧光仪(PAM 2100, Walz, Germany)进行测定。测定前先用2030-B叶夹夹住叶片进行暗适应20~30 min,然后测定初始荧光(Fo)、最大荧光(Fm)、最大光化学效率(Fv/Fm)、非光化学荧光猝灭系数(NPQ)与PSⅡ有效光化学量子产量 (Fv′/Fm′)等指标,每个处理重复6次。
1.4数据统计分析
使用Excel 2007录入数据,利用软件SPSS 16.0进行Oneway ANOVA方差分析,采用Duncan法进行多重比较,并采用Origin 8.0作图。
2结果与分析
2.1外源NO对NaCl胁迫下夏枯草叶片POD和CAT活性的影响
从表1可以看出,NaCl胁迫下夏枯草幼苗叶片的POD活性显著高于对照CK,比CK增加了2.18倍。随着SNP处理浓度增加,夏枯草叶片POD活性呈现先升高后下降的趋势,且各SNP处理下POD活性均高于NaCl胁迫处理,显著高于CK。与NaCl胁迫处理相比,0.01~0.10 mmol/L SNP处理的POD活性升高,0.05与0.10 mmol/L SNP处理达到显著水平,0.10 mmol/L SNP处理POD活性最高,比CK增加了4.06倍,比NaCl胁迫处理提高了59.13%。0.50 mmol/L SNP处理POD活性低于NaCl胁迫处理,但显著高于对照CK。上述结果表明,SNP各处理均可以提高POD的活性,其中0.05与0.10 mmol/L SNP处理可以显著提高NaCl胁迫下夏枯草幼苗叶片POD活性,以0.10 mmol/L SNP处理效果最佳。
从CAT指标来看,NaCl胁迫显著降低了夏枯草幼苗叶片的CAT活性,比CK降低了77.36%。随着SNP处理浓度的升高,夏枯草叶片CAT活性呈现先上升后下降的趋势,0.01~0.50 mmol/L SNP处理下的CAT活性均低于对照CK,但均高于NaCl胁迫处理。其中0.05和0.10 mmol/L SNP处理CAT活性显著高于NaCl胁迫;0.10 mmol/L SNP处理CAT活性高于NaCl胁迫处理达3.42倍,该处理提高CAT活性效果最为显著。
2.2外源NO对NaCl胁迫下夏枯草叶片MDA含量与电导率的影响
从表1可知,NaCl胁迫显著提高了MDA含量,高于CK 66.73%。随着SNP处理浓度升高,夏枯草叶片MDA含量呈现先降低后升高的特征。SNP各处理均可以显著降低NaCl胁迫下夏枯草叶片的MDA含量,0.10 mmol/L SNP处理下的MDA含量最低,其MDA含量比NaCl胁迫处理降低了46.69%。
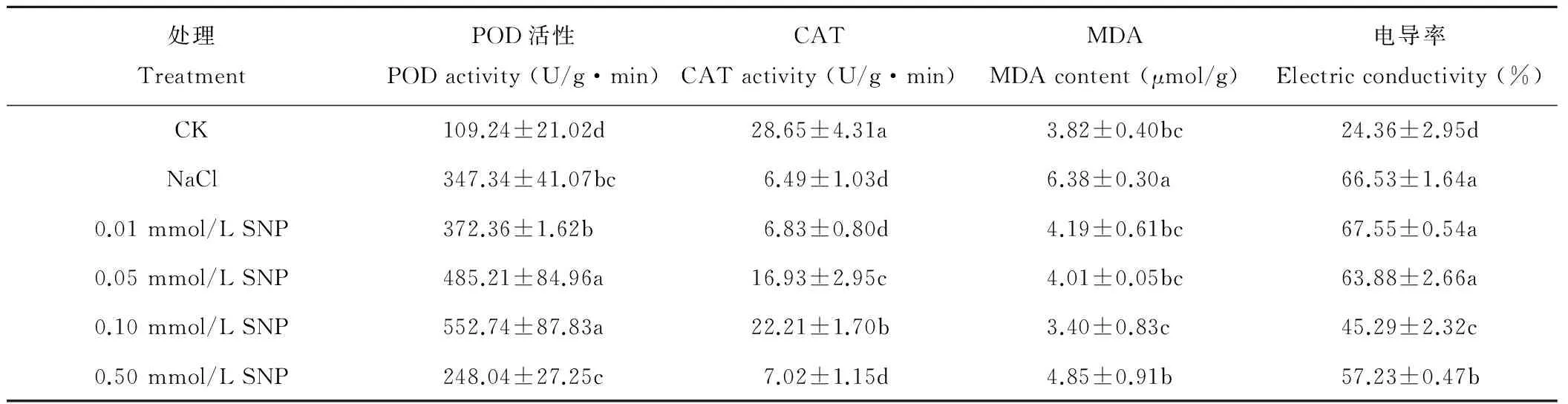
表1 NO对NaCl胁迫下夏枯草POD活性、CAT活性、MDA含量与电导率的影响Table 1 Effect of NO on the activity of POD, CAT, MDA content and electric conductivity ofP. vulgaris seedling leaves under NaCl stress
注: 同列不同小写字母表示5%差异显著,SNP:硝普钠Sodium nitroprusside。下同。
Note: Different small letters in the same column mean significant differences at 5% level, the same below.
NaCl胁迫处理的电导率比对照CK增加了1.73倍。随着SNP浓度的增加,SNP处理下夏枯草叶片的电导率表现出先下降后增高的趋势,0.05~0.50 mmol/L SNP处理降低了叶片的电导率,0.10和0.50 mmol/L SNP处理的电导率显著低于NaCl胁迫处理,其中0.10 mmol/L SNP处理的电导率比NaCl胁迫处理降低了31.93%,降低效果最为明显。
2.3外源NO对NaCl胁迫下夏枯草叶片叶绿素含量的影响
由表2可看出,NaCl胁迫处理下夏枯草各种色素含量均显著低于对照CK。在SNP处理下,夏枯草幼苗叶片的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量的变化都呈现先升高后下降趋势。与NaCl胁迫处理相比,0.01~0.50 mmol/L SNP处理均可以提高叶绿素a、叶绿素b与总叶绿素的含量,其中0.05 与0.10 mmol/L SNP 处理达到显著水平;0.01~0.10 mmol/L SNP处理均可以提高叶片的类胡萝卜素含量,但与NaCl胁迫处理相比差异不显著。在各SNP处理中,0.10 mmol/L SNP处理叶绿素a、叶绿素b与总叶绿素含量的提高幅度最高,分别比NaCl胁迫处理提高了39.71%,75.11%与47.89%。0.01~0.10 mmol/L SNP处理可以提高NaCl胁迫下夏枯草叶片类胡萝卜素含量,显著提高叶绿素a、叶绿素b与总叶绿素含量,最终有效缓解NaCl胁迫处理对夏枯草幼苗叶绿素造成的破坏,以0.10 mmol/L SNP处理效果最佳。
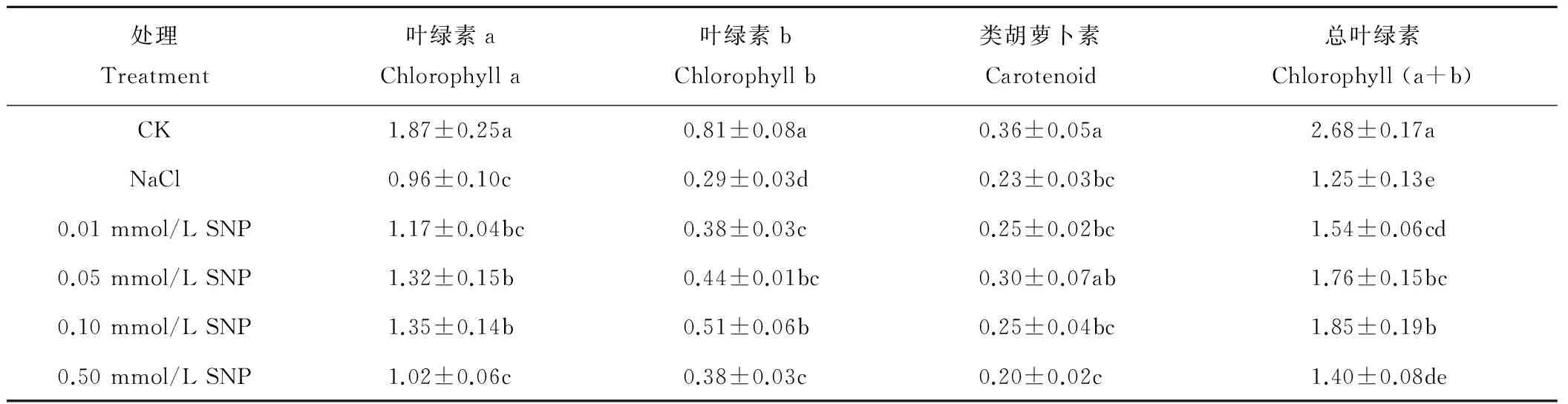
表2 外源NO对NaCl胁迫下夏枯草叶绿素含量的影响Table 2 Effects of NO on chlorophyll content in the leaves of P. vulgaris seedling under NaCl stress mg/g FW
2.4外源NO对NaCl胁迫下夏枯草叶片光合作用的影响
由图1可知,NaCl胁迫处理下的Pn、Gs和Tr均显著低于对照CK,而Ci显著高于对照CK。SNP处理下的Pn、Gs和Tr均呈现先升高后降低的趋势,Ci则表现为先下降后上升的趋势。0.01~0.10 mmol/L SNP处理均可以提高夏枯草叶片的Pn、Gs和Tr,所有SNP处理均可以降低NaCl胁迫下夏枯草叶片的Ci。0.10 mmol/L SNP处理比NaCl胁迫处理的Pn显著提高93.29%,Gs显著提高54.13%,Ci显著降低13.01%,Tr显著提高41.23%。以上结果表明,适宜浓度的SNP处理能够有效提高NaCl胁迫下夏枯草幼苗叶片的Pn、Gs与Tr,降低叶片的Ci,最适宜的SNP处理浓度为0.10 mmol/L。
2.5外源NO对NaCl胁迫下叶片叶绿素荧光的影响
从表3可知,与对照CK相比,NaCl胁迫处理的Fo与NPQ显著升高,Fm、Fv、Fv/Fo、Fv/Fm与Fv′/Fm′显著降低。经SNP处理后,Fo与NPQ均表现为先降低后升高的趋势,而Fm、Fv、Fv/Fo、Fv/Fm与Fv′/Fm′表现为先升高后下降的趋势。0.10 mmol/L SNP处理的各指标与NaCl胁迫相比均达显著水平,其中Fm、Fv、Fv/Fo、Fv/Fm与Fv′/Fm′分别比NaCl胁迫处理提高72.06%,1.76倍,2.76倍,61.75%与58.58%,Fo与NPQ则分别比NaCl胁迫降低了24.37%与52.71%,且与对照CK差异不显著。以上指标说明了SNP处理提高了夏枯草的PSⅡ光化学活性,减轻了光抑制对类囊体膜的破坏,并有效地降低了非光化学热耗散。
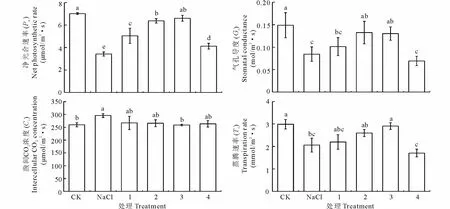
图1 NO对NaCl胁迫下夏枯草叶片Pn、Gs、Ci和Tr的影响Fig.1 Effects of NO on Pn, Gs, Ci and Tr in the leaves of P. vulgaris seedlings under NaCl stress 图中不同小写字母表示5%差异显著; 1, 2, 3, 4分别代表0.01, 0.05, 0.10, 0.50 mmol/L SNP。Different small letters in the figure mean significant differences at 5% level; 1, 2, 3, 4 represent 0.01, 0.05, 0.10, 0.50 mmol/L SNP, respectively.

处理TreatmentFoFmFvFv/FoFv/FmNPQFv'/Fm'CK318.00±13.74b1429.00±97.82a1111.00±102.71a3.50±0.40a0.78±0.02a1.87±0.19c0.50±0.03aNaCl426.33±24.01a819.00±94.50c392.67±84.32c0.92±0.19c0.48±0.05d4.04±0.59a0.30±0.06bc0.01mmol/LSNP461.00±20.52a1074.33±17.67b613.33±11.02b1.33±0.07bc0.57±0.01bc2.81±0.06b0.36±0.08b0.05mmol/LSNP405.00±82.64a1144.00±146.78b739.00±223.86b2.00±1.17b0.64±0.10b2.62±0.42b0.43±0.08a0.10mmol/LSNP322.43±49.76b1409.14±79.66a1086.71±106.11a3.46±0.74a0.77±0.04a1.91±0.15c0.48±0.08a0.50mmol/LSNP472.00±11.28a1042.25±72.82b570.25±66.82bc1.21±0.13bc0.55±0.03cd2.94±0.27b0.29±0.07c
Fo: 初始荧光;Fm: 最大荧光;Fv:可变荧光;Fv/Fo: PSⅡ潜在活性;Fv/Fm: 最大光化学效率; NPQ: 非光化学萃灭系数;Fv′/Fm′: 光下PSⅡ 的光化学效率。Fo: Initial fluorescence;Fm: Maximum fluorescence;Fv: Variable fluorescence;Fv/Fo: PSⅡ potential activity;Fv/Fm: Maximal photochemical efficiency; NPQ: non-photochemical quenching coefficient;Fv′/Fm′: photochemical efficiency of PSⅡ in the light.
3讨论与结论
植物在NaCl胁迫下会产生大量的活性氧自由基,造成植物膜脂过氧化,增加质膜透性,并使得电解质大量渗漏,表现在膜脂过氧化的重要产物MDA含量增加与电导率的升高,进一步导致植物代谢紊乱[18]。植物为防御活性氧带来的伤害,通过自身的酶促与非酶促抗氧化系统来清除氧自由基等活性氧,以维持体内的自由基动态平衡[9]。SNP是一种常用的NO供体,作为一种信号分子,NO具有减少非生物胁迫下活性氧的积累、提高植物抗氧化损伤的能力[19]。本研究发现,70 mmol/L的氯化钠胁迫会导致夏枯草叶片受到严重破坏, MDA含量与电导率均显著高于对照,采用适宜浓度SNP处理可以降低电导率,保持膜的稳定性。
抗氧化酶在植物体内可以协同清除逆境胁迫下的活性氧(ROS,reactive oxygen species),维持ROS的代谢平衡,保护膜结构,从而增强植物对逆境胁迫的抵抗能力[20]。在本研究中,0.05~0.50 mmol/L SNP可以提高NaCl胁迫处理下夏枯草叶片的POD与CAT抗氧化酶活性,进而提高活性氧的防御能力,缓解NaCl胁迫对夏枯草幼苗的氧化损伤作用,减少细胞膜遭受活性氧的损害,保护了膜结构[21]。NaCl胁迫下夏枯草叶片POD活性高于对照CK,而CAT活性则低于CK,该结果与外源NO处理NaCl胁迫下燕麦(Avenasativa)8 d后的酶活性结果类似[22],而与吴雪霞等[23]在番茄(Lycopersiconesculentum)上的研究不太一样,原因可能在于NaCl胁迫下CAT等酶活性因植物种类、盐处理浓度以及处理时间不同而表现各异[11,24]。
NO提高抗氧化酶活性的原因可能在于NO可以直接或间接清除ROS,以及诱导体内抗氧化酶或相关酶类基因的表达[24]。与0.10 mmol/L SNP相比,0.50 mmol/L SNP处理下的夏枯草叶片抗氧化酶活性降低,丙二醛含量与电导率均升高,原因可能在于过量NO可以与活性氧形成过氧亚硝酸,破坏抗氧化酶基因的表达,导致膜渗漏,最终降低抗氧化酶含量和活性[25]。在本研究中,NO对NaCl胁迫下抗氧化酶的提高作用,与吴雪霞等[23]和苏桐等[26]的研究较为类似。
植物在光合作用过程中,叶绿素对光能的吸收、传递与转化起着至关重要的作用。一般地,NaCl胁迫会诱发膜脂过氧化,引起叶绿体与细胞壁解离,进而使叶绿体被膜遭受损坏,破坏类囊体膜的超微结构,从而引起叶绿体的解体,导致光合色素含量的降低,最终降低光能的传递与吸收能力,引起光合作用的下降[27-28]。在本研究中,NaCl胁迫导致夏枯草叶片叶绿素a、叶绿素b与总叶绿素含量显著下降,经适宜浓度SNP处理后,夏枯草叶片中的光合色素含量均有所上升。在较高浓度SNP处理下,光合色素含量下降,可能是因为过量的NO与活性氧形成的过氧亚硝酸,其对叶绿素的氧化作用强于活性氧,所以过量的NO处理非但不利于叶绿素含量的增加,反而促进NaCl胁迫对叶绿素的破坏[12]。前人研究证实适宜浓度的外源NO 能够提高盐胁迫下棉苗[11]、苜蓿(Medicagosativa)[24]、番茄[29]叶片中叶绿素含量,本研究进一步佐证了NO对NaCl胁迫下植物叶绿素的提高作用。
一般认为引起植物叶片光合功能下降的原因可以分为气孔限制与非气孔限制,当Ci与Gs同时下降时,Pn下降主要是由于气孔因素引起;当Ci升高而Gs下降,认为Pn的下降主要是由非气孔因素引起[30]。本研究表明,NaCl胁迫处理下,夏枯草叶片的Pn与Gs均显著降低,而Ci显著上升,说明非气孔因素是主要因素,NaCl胁迫下夏枯草光合速率下降的原因可能是叶片中叶肉细胞光合活性下降引起的。本研究与吴雪霞等[31]和樊怀福等[18]的研究结果相似。与NaCl胁迫处理相比,0.10 mmol/L的SNP处理显著提高了NaCl胁迫下夏枯草叶片的Gs,使得夏枯草叶片具有较高的光合底物传导能力,利于叶片同化更多的光合产物;而Tr的显著增加,使得叶片的吸水与运输能力得以增强,利于夏枯草叶片光合作用及增强植株对NaCl胁迫的抗性;Ci显著降低进一步证明了碳同化能力的提高,同时叶绿素含量的升高,最终使得夏枯草叶片在NaCl胁迫下的Pn得以升高,这些结果说明施加外源SNP处理对于NaCl胁迫下夏枯草叶肉细胞光合活性下降有显著的缓解作用,能够使夏枯草叶片在NaCl胁迫下依然可以维持较高的光合能力[32]。
叶绿素荧光技术被称为测定叶片光合功能的无损伤探针。通过对荧光参数的测定,可以用来评价光合机构的功能和环境胁迫的影响[33]。Fo代表 PSⅡ 反应中心处于完全开放状态时的荧光产量,主要表征叶绿体类囊体膜超微结构的受破坏程度;而Fm则代表PSⅡ反应中心处于完全关闭状态下的荧光产量,主要反映PSⅡ 的电子传递情况[34]。Fv/Fm降低表明植物受到了光抑制,而Fv/Fm降低的同时伴随有Fo的上升,则表明光系统Ⅱ遭受了破坏[35]。在本研究中,夏枯草Fm、Fv、Fv/Fo、Fv/Fm均显著降低,Fo显著升高,表明夏枯草在NaCl胁迫下PSⅡ潜在活性中心受到损害,叶片原初光能转换效率降低,产生光抑制,夏枯草叶片的光合机构可能已受到破坏。NPQ反映了PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散的部分,NaCl胁迫下植物通过提高NPQ,从而消耗PSⅡ不能利用的过剩光能,从而起到保护PSⅡ反应中心免受因吸收过多光能而引起的光氧化和光抑制伤害[36-37]。本试验结果显示,外源NO显著缓解了NaCl胁迫引起的夏枯草叶片Fm、Fv、Fv/Fo、Fv/Fm下降及Fo和NPQ上升的幅度,说明NO不仅能够减轻NaCl胁迫对PSⅡ反应中心的损伤,维持PSⅡ的光化学活性,而且对于激发能的非光化学热耗散有明显的降低效果,类似的结果同样出现在刘建新等[38]的研究中。
NO对胁迫下植物的缓解效果表现出一种双重性,即一定的低浓度下表现为提高缓解效应,而高浓度下表现为降低缓解效果,并且其最佳浓度因所试植物材料及处理方法不同而存在差异[8,26]。如经0.10 mmol/L SNP处理后,盐胁迫下板蓝根(Isatisindigotica)的种子萌发和幼苗生长的各项指标最高,而1.00 mmol/L SNP处理下幼苗生理指标显著降低[5];0.05~0.60 mmol/L SNP 在提高水飞蓟(Silybummarianum)种子和幼苗的抗盐能力上表现为低浓度促进高浓度抑制,0.10 mmol/L SNP 对白色种皮品种处理效果最好,而0.40 mmol/L SNP 对黑色种皮品种处理效果最好[19];通过浸种方法研究SNP对盐胁迫下小麦(Triticumaestivum)种子萌发影响表明,0.06 mmol/L SNP浸种处理效果最好[39]。本研究同样发现,低浓度NO(0.05~0.10 mmol/L SNP)可以缓解NaCl胁迫对夏枯草幼苗生理的抑制,其中0.10 mmol/L SNP处理效果最好,而高浓度(0.50 mmol/L SNP)则降低其对NaCl胁迫下夏枯草幼苗的缓解效果。本研究可以为解决夏枯草在栽培生产中遇到的盐害问题提供理论依据,为促进夏枯草种植、提高产量提供理论基础。
References:
[1]Yang W. Study on Reproductive Characteristics and Growth ofPrunellavulgarisL.[D]. Nanjing: Nanjing Agricultural University, 2013.
[2]Wang X D, Ma J. Study on application of native ground covers to urban landscaping. Journal of Zhejiang Forestry Science and Technology, 2005, 25(3): 66-69.
[3]Guo Q S, Chen Y H. Textual research on original plant and dietotherapy history ofPrunellavulgaris. China Journal of Chinese Materia Medica, 2011, 36(21): 3057-3062.
[4]Pei Y, Yang X J, Chen X F,etal. Effects of NaCl and NaHCO3stress on seed germination ofSinapisalbaL. Lishizhen Medicine and Materia Medica Research, 2015, 26(7): 1750-1752.
[5]Jia H F, Zhang H Y. Effects of exogenous nitric oxide on seed germination and seedling physiological characteristics ofIsatisindigoticaunder NaCl stress. Chinese Traditional and Herbal Drugs, 2014, 45(1): 118-124.
[6]Yu M M, Liu L, Guo Q S,etal. Influence of nitrogen forms ratio on growth and photosynthetic characteristics inPrunellavulgaris. China Journal of Chinese Materia Medica, 2011, 36(5): 530-534.
[7]Cai Z S, Shi S L, Xie S L,etal. Effects of exogenous nitric oxide on germination of alfalfa seeds under water stress. Journal of Nuclear Agricultural Sciences, 2013, 27(11): 1777-1782.
[8]Shi Z Z, Li S, Yang K,etal. Physiological and biochemical response of pea seedlings to endogenous and exogenous NO under salt stress. Acta Prataculturae Sinica, 2014, 23(5): 193-200.
[9]Yang M S, Wang Y F, Gan X X,etal. Effects of exogenous nitric oxide on growth, antioxidant system and photosynthetic characteristics in seedling of cotton cultivar under chilling injury stress. Scientia Agricultura Sinica, 2012, 45(15): 3058-3067.
[10]Zhao M, Wei X H. Effects of nitric oxide onMedicagosativaseed germination under imbibitional chilling. Acta Prataculturae Sinica, 2015, 24(4): 87-94.
[11]Li C F, Liu L T, Sun H C,etal. Effects of exogenous nitric oxide on main growth and physiological characteristics of seedlings of cotton under NaCl stress. Scientia Agricultura Sinica, 2012, 45(9): 1864-1872.
[12]Hu F B, Liu L, Long X H,etal. Effects of exogenous nitric oxide on biomass and chlorophyll fluorescence ofCatharanthusseedlings under NaCl stress. Chinese Journal of Ecology, 2011, 30(8): 1620-1626.
[13]Xu F F, Xie Y Z, Fang W,etal. Effects of sodium nitroprusside (SNP) on the physiological characteristics of the leaves ofPinelliaternateseedlings and the total alkaloid content of its comb under salt stress. Journal of Southwest University (Natural Science Edition), 2013, 35(10): 42-49.
[14]Wu J, Yang H Y, Yang M Z,etal. Effects of SNP and cPTIO on physiology ofArabidopsisseedling under NaCl stress. Guihaia, 2010, 30(5): 666-671.
[15]Wang X K. Experimental Principle and Technology of Plant Physiology and Biochemistry[M]. Beijing: Higher Education Press, 2006.
[16]Chang Q S, Zhang L X, Wan T,etal. Effects of Ca2+on germination characteristics ofFestucaarundinaceaseeds under simulated acid rain stress. Pratacultural Science, 2012, 29(12): 1903-1909.
[17]Li H S. Experimental Principle and Technology of Plant Physiology and Biochemistry[M]. Beijing: Higher Education Press, 2004.
[18]Fan H F, Guo S R, Jiao Y S,etal. The effects of exogenous nitric oxide on growth, active oxygen metabolism and photosynthetic characteristics in cucumber seedlings under NaCl stress. Acta Ecologica Sinica, 2007, 27(2): 546-553.
[19]Zhang X Q, Wang K C, Zhang Y N,etal. Effects of exogenous nitric oxide on physiology of seed germination and seedling growth ofSilybummarianumunder NaCl stress. Chinese Traditional and Herbal Drugs, 2013, 44(22): 3216-3222.
[20]Zhang Y K, Cui X M, Yang S X,etal. Effects of exogenous nitric oxide on active oxygen metabolisn and photosynthetic characteristics of tomato seedlings under cadmium stress. Chinese Journal of Applied Ecology, 2010, 21(6): 1432-1438.
[21]Yuan L, Karmi A, Zhang L Q. Effects of NaCl stress on active oxygen metabolism and membrane stability inPistaciaveraseedlings. Acta Phytoecologica Sinica, 2005, 29(6): 985-991.
[22]Lu X, Shi W D, Wang Y L,etal. Effects of exogenous nitric oxide on activity of antioxidative enzyme and growth of oat seedlings under salt stress. Pratacultural Science, 2011, 28(12): 2150-2156.
[23]Wu X X, Zhu Y L, Zhu W M,etal. Physiological effects of exogenous nitric oxide in tomato seedlings under NaCl stress. Scientia Agricultura Sinica, 2006, 39(3): 575-581.
[24]Xu Y, Wei X H, Li B B,etal. Effects of exogenous nitric oxide on seed germination and seedling oxidative damage inMedicagosativaunder NaCl stress. Acta Prataculturae Sinica, 2013, 22(5): 145-153.
[25]Zhang S Y, Ren X L, Cheng S C,etal. Effects of seed soaking with exogenous nitric oxide on the seed germination and the seedling growth of maize. Plant Physiology Communications, 2004, 40(3): 309-310.
[26]Su T, Long R J, Wei X H,etal. Protective effects of exogenous nitric oxide on oxidative damage in oat seedling leaves under NaCl stress. Acta Prataculturae Sinica, 2008, 17(5): 48-53.
[27]Qin L, Kang W H, Qi Y L,etal. Effects of salt stress on mesophyll cell structures and photosynthetic characteristics in leaves of wine grape (Vitisspp.). Scientia Agricultura Sinica, 2012, 45(20): 4233-4241.
[28]Li X C, Wu Y G, Yang D M,etal. Respond of salt stress on ultrastructure of mesophyll cells inPogostemoacabin. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(2): 300-304.
[29]Wu X X, Zhu Y L, Zhu W M,etal. Effects of exogenous nitric oxide on seedling growth of tomato under NaCl stress. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(6): 1206-1211.
[30]Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(3): 317-345.
[31]Wu X X, Zhu Y L, Zhu W M,etal. Effects of exogenous nitric oxide on photosynthesis and ionic contents of tomato seedlings under NaCl stress. Plant Nutrition and Fertilizer Science, 2007, 13(4): 658-663.
[32]Xie Y F, Yang W H, Yang Y,etal. Effects of exogenous nitric oxide on photosynthetic characteristic ofIndocalamusbarbatusunder a simulated acid rain stress condition. Acta Ecologica Sinica, 2007, 27(12): 5193-5201.
[33]Zhang Y R. Cultivation of Sargassum horneri: Stress Resistance of Young Sporophytes to A Variety of Temperatures, Irradiance Levels and Salinities Revealed by Chlorophyll Fluorescence Measurements[D]. Qingdao: Ocean University of China, 2009.
[34]Yang W L, Huang F D, Cao Z Z,etal. Effects of high temperature stress on PSⅡ function and its relation to D1 protein in chloroplast thylakoid in rice flag leaves. Acta Agronomica Sinica, 2013, 39(6): 1060-1068.
[35]Sun L, Zhou Y F, Li F X,etal. Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of sorghum seedlings. Scientia Agricultura Sinica, 2012, 45(16): 3265-3272.
[36]Zhang C P, Zhou L X, Zhou H,etal. Effect of exogenous carbon monoxide donor hematin on photosynthesis parameters and chlorophyll fluorescence characteristics ofCoptischinensisseedlings under NaCl stress. Chinese Traditional and Herbal Drugs, 2015, 46(2): 262-272.
[37]Wu X X, Yu L, Zhu W M. Effect of exogenous nitric oxide on chlorophyll fluorescence characteristics in tomato seedlings under NaCl stress. Chinese Journal of Eco-Agriculture, 2009, 17(4): 746-751.
[38]Liu J X, Hu H B, Wang X. Effects of exogenous nitric oxide on active oxygen metabolism, polyamine content and photosynthesis of ryegrass (LoliumperenneL.) seedlings under salt stress. Bulletin of Botanical Research, 2009, 29(3): 313-319.
[39]Cheng L P, Liu J X, Hu Q P. Effects and exogenous nitric oxide on the contents of MDA and chlorophyll and the activities of oxidases in leaves of wheat seedlings under salt. Journal of Triticeae Crops, 2013, 33(6): 1222-1225.
参考文献:
[1]杨伟. 夏枯草的繁殖及生长特性研究[D]. 南京: 南京农业大学, 2013.
[2]王小德, 马进. 乡土地被植物在城市绿化中的应用研究. 浙江林业科技, 2005, 25(3): 66-69.
[3]郭巧生, 陈宇航. 夏枯草基原植物及其食疗历史考证. 中国中药杂志, 2011, 36(21): 3057-3062.
[4]裴毅, 杨雪君, 陈晓芬, 等. 氯化钠和碳酸氢钠胁迫对白芥种子萌发的影响. 时珍国医国药, 2015, 26(7): 1750-1752.
[5]贾海凤, 张海艳. 外源NO对NaCl胁迫下板蓝根种子萌发和幼苗生理特性的影响. 中草药, 2014, 45(1): 118-124.
[6]于曼曼, 刘丽, 郭巧生, 等. 氮素不同形态配比对夏枯草苗期生长及光合特性的影响. 中国中药杂志, 2011, 36(5): 530-534.
[7]蔡卓山, 师尚礼, 谢森林, 等. 外源NO对水分胁迫下苜蓿种子萌发的影响. 核农学报, 2013, 27(11): 1777-1782.
[8]时振振, 李胜, 杨柯, 等. 盐胁迫下豌豆幼苗对内外源NO的生理生化响应. 草业学报, 2014, 23(5): 193-200.
[9]杨美森, 王雅芳, 干秀霞, 等. 外源一氧化氮对冷害胁迫下棉花幼苗生长、抗氧化系统和光合特性的影响. 中国农业科学, 2012, 45(15): 3058-3067.
[10]赵萌, 魏小红. 吸胀冷害下外源NO对紫花苜蓿种子萌发及抗氧化性的影响. 草业学报, 2015, 24(4): 87-94.
[11]李翠芳, 刘连涛, 孙红春, 等. 外源NO对NaCl胁迫下棉苗主要形态和相关生理性状的影响. 中国农业科学, 2012, 45(9): 1864-1872.
[12]胡凡波, 刘玲, 隆小华, 等. 外源NO对NaCl胁迫下长春花幼苗生物量和叶绿素荧光的影响. 生态学杂志, 2011, 30(8): 1620-1626.
[13]徐封丰, 谢英赞, 方文, 等. 硝普钠(SNP)对盐胁迫下半夏幼苗叶片生理特性和球茎总生物碱含量的影响. 西南大学学报(自然科学版), 2013, 35(10): 42-49.
[14]吴嘉, 杨红玉, 杨明挚, 等. SNP和cPTIO对NaCl胁迫下拟南芥的生理影响. 广西植物, 2010, 30(5): 666-671.
[15]王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[16]常青山, 张利霞, 万涛, 等. 模拟酸雨胁迫下钙离子对高羊茅种子发芽的影响. 草业科学, 2012, 29(12): 1903-1909.
[17]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2004.
[18]樊怀福, 郭世荣, 焦彦生, 等. 外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响. 生态学报, 2007, 27(2): 546-553.
[19]张晓倩, 王康才, 张彦南, 等. 外源NO对NaCl胁迫下水飞蓟种子萌发和幼苗生长生理的影响. 中草药, 2013, 44(22): 3216-3222.
[20]张义凯, 崔秀敏, 杨守祥, 等. 外源NO对镉胁迫下番茄活性氧代谢及光合特性的影响. 应用生态学报, 2010, 21(6): 1432-1438.
[21]袁琳, 伊力克热木, 张利权. NaCl胁迫对阿月浑子实生苗活性氧代谢与细胞膜稳定性的影响. 植物生态学报, 2005, 29(6): 985-991.
[22]芦翔, 石卫东, 王宜伦, 等. 外源NO对NaCl胁迫下燕麦幼苗抗氧化酶活性和生长的影响. 草业科学, 2011, 28(12): 2150-2156.
[23]吴雪霞, 朱月林, 朱为民, 等. 外源一氧化氮对NaCl 胁迫下番茄幼苗生理影响. 中国农业科学, 2006, 39(3): 575-581.
[24]徐严, 魏小红, 李兵兵, 等. 外源NO对NaCl胁迫下紫花苜蓿种子萌发及幼苗氧化损伤的影响. 草业学报, 2013, 22(5): 145-153.
[25]张少颖, 任小林, 程顺昌, 等. 外源一氧化氮供体浸种对玉米种子萌发和幼苗生长的影响. 植物生理学通讯, 2004, 40(3): 309-310.
[26]苏桐, 龙瑞军, 魏小红, 等. 外源NO对NaCl胁迫下燕麦幼苗氧化损伤的保护作用. 草业学报, 2008, 17(5): 48-53.
[27]秦玲, 康文怀, 齐艳玲, 等. 盐胁迫对酿酒葡萄叶片细胞结构及光合特性的影响. 中国农业科学, 2012, 45(20): 4233-4241.
[28]李贤超, 吴友根, 杨东梅, 等. 海南广藿香叶肉细胞超微结构对盐胁迫的响应. 江西农业大学学报, 2014, 36(2): 300-304.
[29]吴雪霞, 朱月林, 朱为民, 等. 外源一氧化氮对NaCl胁迫下番茄幼苗生长和光合作用的影响. 西北植物学报, 2006, 26(6): 1206-1211.
[31]吴雪霞, 朱月林, 朱为民, 等. 外源一氧化氮对NaCl胁迫下番茄幼苗光合作用和离子含量的影响. 植物营养与肥料学报, 2007, 13(4): 658-663.
[32]谢寅峰, 杨万红, 杨阳, 等. 外源一氧化氮对模拟酸雨胁迫下箬竹(Indocalamusbarbatus)光合特性的影响. 生态学报, 2007, 27(12): 5193-5201.
[33]张玉荣. 利用叶绿素荧光技术揭示人工培育的铜藻幼苗对胁迫温度、光照和盐度的反应[D]. 青岛: 中国海洋大学, 2009.
[34]杨卫丽, 黄福灯, 曹珍珍, 等. 高温胁迫对水稻光合 PSⅡ 系统伤害及其与叶绿体 D1 蛋白间关系. 作物学报, 2013, 39(6): 1060-1068.
[35]孙璐, 周宇飞, 李丰先, 等. 盐胁迫对高粱幼苗光合作用和荧光特性的影响. 中国农业科学, 2012, 45(16): 3265-3272.
[36]张春平, 周立鑫, 周慧, 等. 外源一氧化碳供体高铁血红蛋白对盐胁迫下黄连幼苗光合参数及叶绿素荧光特性的影响. 中草药, 2015, 46(2): 262-272.
[37]吴雪霞, 于力, 朱为民. 外源一氧化氮对NaCl胁迫下番茄幼苗叶绿素荧光特性的影响. 中国生态农业学报, 2009, 17(4): 746-751.
[38]刘建新, 胡浩斌, 王鑫. 外源NO对盐胁迫下黑麦草幼苗活性氧代谢、多胺含量和光合作用的影响. 植物研究, 2009, 29(3): 313-319.
[39]程丽萍, 刘晋秀, 胡青平. 外源NO对盐胁迫下小麦幼苗叶片丙二醛、叶绿素及氧化酶的影响. 麦类作物学报, 2013, 33(6): 1222-1225.
DOI:10.11686/cyxb2015454
*收稿日期:2015-09-23;改回日期:2015-11-23
基金项目:河南省高等学校重点科研资助项目(15A180037,16A220005),河南省科技攻关计划项目(162102110095),河南科技大学高级别项目培育基金(2015GJB029),河南科技大学青年基金资助项目(4024-13350066,4026-13350041),河南科技大学博士科研启动基金资助项目(4024-13480054,4026-13480038)和河南科技大学大学生研究训练计划(SRTP)项目(2014254,2014281,2015152)资助。
作者简介:常青山(1979-),男,河南安阳人,讲师,博士。E-mail: hkdcqs@126.com *通信作者Corresponding author. E-mail: hkdzlx@126.com
* 1Effects of exogenous nitric oxide on antioxidant activity and photosynthetic characteristics ofPrunellavulgarisseedlings under NaCl stress
CHANG Qing-Shan1, ZHANG Li-Xia2*, YANG Wei3, ZHOU Shan-Shan1, HUANG Qing-Zhe1, LV Feng-Juan1, HUANG Yue1, GE Shu-Hui1, ZHANG Tian-Meng1
1.CollegeofForestry,HenanUniversityofScienceandTechnology,Luoyang471003,China; 2.CollegeofAgriculture,HenanUniversityofScienceandTechnology,Luoyang471003,China; 3.JiangsuLongfengHallChineseMedicineLimitedCompany,YangtzeRiverPharmaceuticalGroup,Taizhou225321,China
Abstract:The objective of these experiments was to determine the effects of exogenous nitric oxide (NO) on the antioxidant activity and photosynthetic characteristics of Prunella vulgaris seedlings under salt stress. Seedlings of P. vulgaris under salt stress (70 mmol/L NaCl) were treated with sodium nitroprusside (SNP, an exogenous NO donor) at different concentrations (0.01, 0.05, 0.10 and 0.50 mmol/L) and their antioxidant enzyme activity, photosynthetic pigment contents, gas exchange, and chlorophyll fluorescence characteristics were analyzed. The results showed that 0.05-0.10 mmol/L SNP alleviated symptoms of NaCl stress in P. vulgaris seedlings. The 0.10 mmol/L SNP treatment produced the best results. The seedlings in this treatment showed significantly increased (P<0.05) activities of peroxidase and catalase, decreased malondialdehyde content and electric conductivity, significantly increased (P<0.05) chlorophyll content, net photosynthetic rate, stomatal conductance, and transpiration rate, and decreased intercellular CO2 concentration. Analyses of chlorophyll fluorescence data showed that the 0.10 mmol/L SNP treatment resulted in a significant decrease (P<0.05) in initial fluorescence and non-photochemical quenching, and increased maximum fluorescence, photosystem Ⅱ (PSⅡ) potential fluorescence efficiency, PSⅡ maximum fluorescence efficiency, and PSⅡ excitation capture efficiency in leaves of salt-stressed P. vulgaris seedlings. These results showed that application of SNP at certain concentrations stabilized membranes by increasing the activities of antioxidant enzymes, and improved photochemical efficiency. These changes alleviated photoinhibition damage resulting from salt damage to the PSⅡ center, and enhanced the photosynthetic capacity to increase the salt resistance of P. vulgaris seedlings. The 0.10 mmol/L SNP treatment had the greatest effect on improving salt tolerance of P. vulgaris seedlings under these experimental conditions.
Key words:Prunella vulgaris; NaCl stress; nitric oxide; photosynthetic characteristic; chlorophyll fluorescence
http://cyxb.lzu.edu.cn
常青山, 张利霞, 杨伟, 周姗姗, 黄青哲, 吕凤娟, 黄玥, 葛淑慧, 张天蒙. 外源NO对NaCl胁迫下夏枯草幼苗抗氧化能力及光合特性的影响. 草业学报, 2016, 25(7): 121-130.
CHANG Qing-Shan, ZHANG Li-Xia, YANG Wei, ZHOU Shan-Shan, HUANG Qing-Zhe, LV Feng-Juan, HUANG Yue, GE Shu-Hui, ZHANG Tian-Meng. Effects of exogenous nitric oxide on antioxidant activity and photosynthetic characteristics ofPrunellavulgarisseedlings under NaCl stress. Acta Prataculturae Sinica, 2016, 25(7): 121-130.
