热休克蛋白质DnaK的纯化及其二聚体性质研究
2016-08-02刘清岱苏家跃田雪利杨营赵盛长忠天津科技大学食品工程与生物技术学院天津00457天津天隆种业科技有限公司天津00457丹娜天津生物科技有限公司天津00457
刘清岱,苏家跃田雪利杨 营赵 飞,盛长忠(. 天津科技大学食品工程与生物技术学院,天津 00457;. 天津天隆种业科技有限公司,天津 00457;. 丹娜(天津)生物科技有限公司,天津 00457)
热休克蛋白质DnaK的纯化及其二聚体性质研究
刘清岱1,2,苏家跃1,田雪利1,杨 营1,赵 飞1,2,盛长忠1,3
(1. 天津科技大学食品工程与生物技术学院,天津 300457;2. 天津天隆种业科技有限公司,天津 300457;3. 丹娜(天津)生物科技有限公司,天津 300457)
通过定点突变技术构建了两个DnaK蛋白质突变体,研究腺嘌呤核苷三磷酸(ATP)和腺苷二磷酸(ADP)条件对热休克蛋白质DnaK二聚体性质的影响.首先诱导表达DnaK蛋白质的两个突变体DnaK-A303C和DnaK-H541C,并采用硫酸镍亲和层析和阴离子交换层析对重组蛋白质进行纯化.对等量的DnaK蛋白质进行氧化交联处理,然后采用聚丙烯酰胺凝胶电泳(SDS-PAGE)检测ATP、ADP对DnaK二聚体的影响.研究表明DnaK突变体在ADP的存在下以同二聚体的形式存在,但是在ATP条件下能够形成异二聚体.由此为深入认识热休克蛋白质两个亚基之间的协同作用提供了实验依据.
DnaK;ATP;二聚体;突变体
热休克蛋白70s(heat shock proteins,Hsp70s)是从细菌到哺乳动物中均广泛存在的一类保守的蛋白质家族,是维持蛋白内稳态所必需的分子伴侣[1].在果蔬保鲜中,适当的热处理诱导产生的热休克蛋白能够提高果蔬抗冷性,降低冷害[2],并能通过帮助调节果蔬采后的生理生化代谢[3],保持果蔬原有品质并延长保鲜期[4-5].同时在生物医学领域,热休克蛋白及其自身抗体可能参与了许多疾病的发病过程[6].
DnaK是大肠杆菌中的Hsp70蛋白质,能够促进蛋白合成、折叠、装配和运输并且参与变性蛋白的清除[7].DnaK包括两个结构域,其中N末端是腺嘌呤核苷三磷酸(ATP)水解酶结构域,C末端是底物结合结构域.DnaK与ATP的结合影响着DnaK蛋白质的结构,在没有ATP的情况下,纯化的DnaK形成无序的低聚物,当DnaK与ATP结合时DnaK更倾向于形成二聚体结构[8].但是,其具体反应机理和生化意义并不清楚,因此有必要对DnaK进行纯化,研究ATP与腺苷二磷酸(ADP)对DnaK蛋白质二聚体的影响,进而为医学研究以及在食品科学领域中的应用提供基本理论依据.
1 材料与方法
1.1 菌株、质粒
受体菌为dnak基因缺失的大肠杆菌(E.coli)菌株BB205(卡那霉素和氯霉素抗性),表达载体质粒为pBB46(氨苄抗性),均由美国弗吉尼亚联邦大学医学院惠赠.
1.2 试剂和仪器
DNA提取试剂盒,Qiagen公司;定点突变试剂盒,Agilent Technologies公司;蛋白质marker,Biolabs公司;40%,丙烯酰胺、β-巯基乙醇、苯甲基磺酸钠、十二烷基磺酸钠等试剂,Sigma公司.
主要仪器包括AKTA prime蛋白质纯化系统、Ni亲和层析柱和阴离子交换柱(HisTrap)、12500,SERIES型摇床、1938型超声仪、Mini-PROTEAN Ⅲ型电泳槽、RS232型分光荧光计等.
1.3 突变体质粒的获得
根据DnaK-ATP的空间结构,本实验构建了两个突变体,即将第303位、541位氨基酸突变为半胱氨酸(A303C和H541C).突变后经纯化的DNA经测序,序列分析正确后进行下一步实验.A303C,正向引物为5′-AAAGTGACTCGTTCAAACTGGAAAGC-3′,反向引物为5′-GCTTTCCAGTTTGAACGAGTCA CTTT-3′;H541C,正向引物为5′-CTGGTACAGACT ACCTGCTGCACAGC-3′,反向引物为5′-GCTGTGC AGCAGGTAGTCTGTACCAG-3′.PCR反应体系为50,μL体系,PCR buffer 5,μL,PCR solution 1.5,μL,脱氧核糖核苷三磷酸(dNTP)1,μL,模板2,μL,5′引物2,μL,3′引物2,μL,DNA聚合酶1,μL.反应程序为94,℃模板预变性3,min,94,℃变性15,s,55,℃退火30,s,68,℃延伸4,min,68,℃充分延伸10,min,用4,℃进行保存.
1.4 重组DnaK蛋白质的诱导表达
本实验所需的蛋白均是将dnak表达载体pBB46导入到dnak缺失菌株BB205中进行表达而得到的.挑取转化后的单菌落于100,mL含有卡那-氯霉素-氨苄的LB培养基中,30,℃过夜进行预培养,经预培养后的菌体1﹕100接种于1,L培养基中进行扩大培养,待菌体密度A600达到0.6时加入1,mmol/L IPTG进行诱导表达,4,h后诱导完成,离心收集菌体并用2倍磷酸盐缓冲液(PBS)冲洗菌体[9].
菌体充分重悬后加入100,μL 30,mg/mL的裂解酶充分裂解菌体,冰上孵育30,min后,置于冰水浴中进行超声裂解.超声结束后,将裂解后的菌体于4,℃、20,000g离心1,h,上清液经0.22,μm滤膜过滤后作为蛋白质上样液.
1.5 DnaK蛋白质的纯化
1.5.1 Ni亲和层析纯化
采用Ni亲和柱进行亲和层析,上样流量为1,mL/min.上样结束后用裂解液PBS平衡洗脱柱子时,流量为5,mL/min,洗脱体积为300,mL,之后用含200,μmol的ATP、10,mmol醋酸镁的裂解液以同样流量清洗100,mL[10].然后采用含4%,、8%,的洗脱液(2× PBS+300,mmol/L NaCl+400,mmol/L pH 为7.5的咪唑)对柱子进行梯度洗脱,保持同样流量,各洗200,mL.最后进行梯度洗脱,洗脱流量为2,mL/min,总体积为120,mL,洗脱液的含量从8%,上升至60%,并收集样品,每管3,mL.洗脱结束后,选取有紫外吸收值的样品,取样,利用聚丙烯酰胺凝胶电泳(SDSPAGE)进行检测[11].
收集蛋白浓度较高且杂蛋白较少的样品,置于相对分子质量为1.0×104的透析袋中,在2倍PBS中过夜透析,同时加入1,mmol/L二硫苏糖醇(DTT)还原被氧化的蛋白.
1.5.2 阴离子交换柱进一步纯化
采用阳离子交换柱进一步纯化,选择5,mL/min的上样流量.上样结束后用溶液A(25,mmol/L pH 7.5的4-羟乙基哌嗪乙磺酸(Hepes)+50,mmol/L NaCl+ 1,mmol/L DTT)冲洗柱子,流量为5,mL/min,体积为100,mL,之后用5%,溶液B(25,mmol/L pH 7.5,Hepes +1,mol/L NaCl+1,mmol/L DTT)继续冲洗,流量为5,mL/min,体积为100,mL[12].然后进行蛋白梯度洗脱,洗脱流量为2,mL/min,总体积为120,mL,洗脱液(25,mmol/L pH 7.5,Hepes+1,mol/L NaCl+1,mmol/L DTT)的含量从5%,上升至60%,并收集样品,每管3,mL[13].洗脱后选取有紫外吸收值的样品进行SDSPAGE检测其纯度,然后收集样品,浓缩,并用洗脱液稀释,蛋白最终质量浓度应高于10,mg/mL.分装后用液氮速冻并保存于-80,℃冰箱中.
1.6 蛋白质交联实验
利用溶液A(25,mmol/L pH 7.5,Hepes+ 150,mmol/L KCl+10,mmol/L Mg(OAc)2,10%,丙三醇+5,mmol/L DTT)将蛋白稀释至5,mg/mL,并在冰上孵育2,h,以彻底除去产生的半胱氨酸残基[14].然后将样品加到事先用溶液B(25,mmol/L pH 7.5,Hepes +150,mmol/L KCl+10,mmol/L Mg(OAc)2,10%,丙三醇)平衡好的除盐柱子中,离心使蛋白通过柱子而除去DTT[15].用超微量分光光度计测定蛋白质量浓度,并用溶液B将蛋白稀释至0.5,mg/mL,然后加入100,μmol/L 的硫酸铜和200,μmol/L的邻菲罗啉开始氧化蛋白,氧化过程需在冰上进行,1,h后加入终浓度为5,mmol/L 的二乙烯三胺(DETA)终止反应.通过聚丙烯酰胺凝胶检测蛋白质交联结果[16].
2 结果与讨论
2.1 定点突变DNA测序结果
为了研究DnaK蛋白质的结构,根据已经报道的DnaK的两个结构域功能,设计DnaK-A303C、DnaKH541C两个蛋白质突变体,并构建带有突变位点的表达载体.将经快速定点突变实验(Quickchange)之后所得到的质粒进行测序,图1为DnaK-A303C与DnaK野生型碱基序列比对图,上一排显示DnaKA303C碱基序列,下一排显示DnaK碱基序列,其中第303位氨基酸对应由907~909位碱基编码,密码子GCG突变成为UGU,对照氨基酸序列表,即由丙氨酸突变为半胱氨酸(DnaK-A303C).测序结果进行比对分析,所有结果全部正确,进行下一步实验.共得到DnaK-A303C、DnaK-H541C两个突变质粒.
2.2 蛋白质的诱导表达
经IPTG诱导后的菌体,需要经SDS-PAGE检测表达并进行下一步纯化,结果如图2所示,即DnaKA303C诱导表达前,蛋白质分布均匀(泳道1、2).经IPTG诱导后,在大于6.6×104的位置有明显的诱导条带,此蛋白质诱导表达量占蛋白质总量的50%,以上(泳道3、4).通过计算迁移率可知此蛋白质相对分子质量约为7.0×104,即为所需要的目标蛋白质DnaK-A303C.

图1 DnaK-A303C与DnaK野生型测序碱基比对结果Fig. 1 Sequence comparison of DnaK-A303C and the wild DnaK
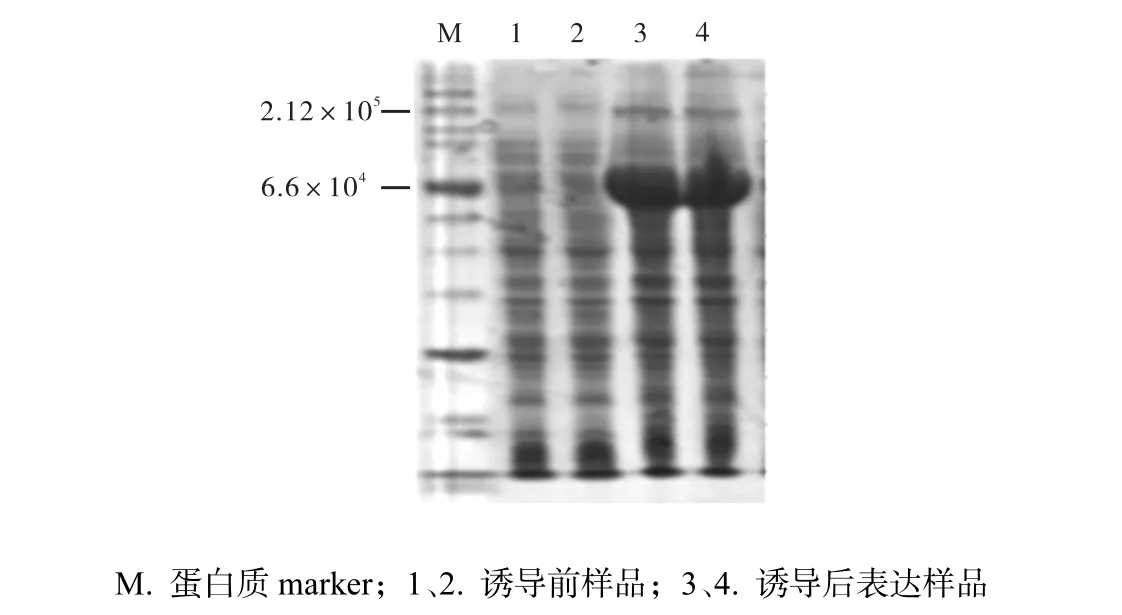
图2 DnaK-A303C蛋白质表达电泳图Fig. 2 SDS-PAGE expression of DnaK-A303C
2.3 纯化结果
2.3.1 Ni亲和层析纯化
Ni离子柱亲和层析是一种高效的蛋白质纯化方法.本实验采用DnaK表达载体pBB46,重组表达的DnaK-A303C蛋白质产物带有6个组氨酸标签,可以采用Ni亲和层析进行高效纯化.首先研究DnaKA303C蛋白质在上清液和沉淀中的含量,比较图3中第1、2、3泳道样品,大部分目标蛋白质存在于上清液中,仅有少量目标蛋白质在沉淀中,说明重组表达的DnaK-A303C蛋白质溶解性极好.
重组蛋白质上柱后,分析上样流出液的组成,发现少量目标蛋白质进入流出液,说明目标蛋白质与Ni亲和柱结合的较好(图3,泳道4).第5泳道为裂解液冲洗柱子的流出液样品,由SDS-PAGE显示,有杂蛋白质脱离柱子.洗脱液以每管3,mL的体积进行收集.凝胶第5泳道直至16泳道,所有样品均为洗脱所得到的样品.
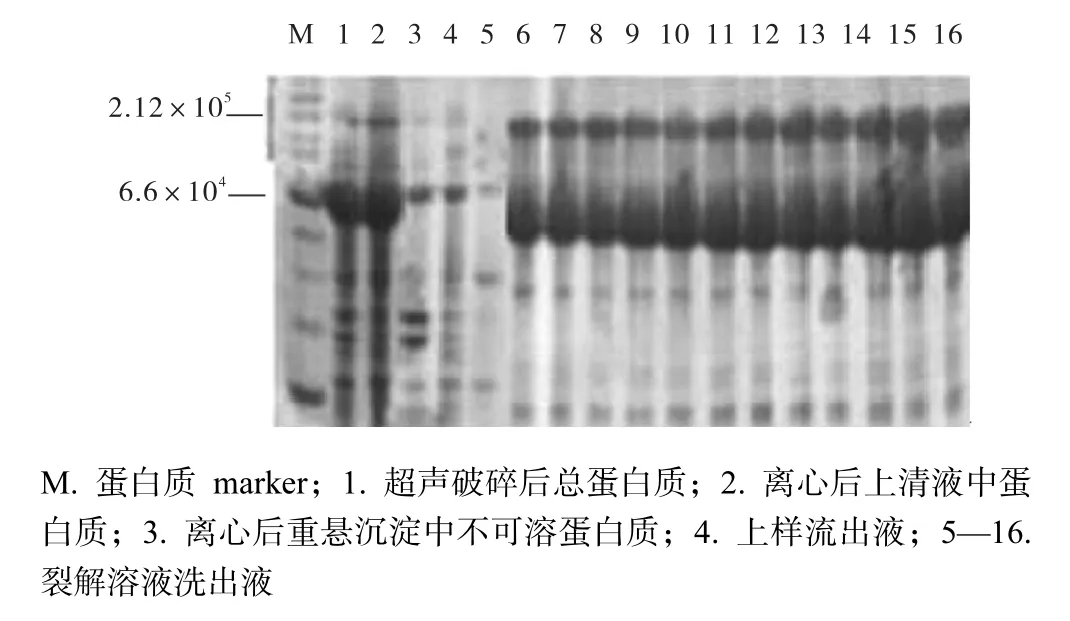
图3 Ni亲和层析纯化蛋白质电泳图Fig. 3 SDS-PAGE analysis of Ni-clumn purification
2.3.2 离子交换纯化
由于DnaK-A303C蛋白质的等电点为4.83,根据阴、阳离子交换柱的不同性质,继续使用阴离子交换柱对2×PBS透析后的蛋白质进行进一步纯化.首先分析了样品与阴离子交换柱的结合,其中第1泳道是上样前的样品,第2泳道为流出液,对比第1、2泳道,可以发现仅有少量蛋白质没有很好地与柱子结合,随流出液流出(图4).从第3泳道至最后10泳道全部为梯度洗脱阴离子交换柱所得到的样品.由电泳图可见,阴离子交换柱对蛋白质的进一步纯化具有较好的效果,特别是在2.7×104附近有一条杂蛋白质在较高的盐浓度时被洗脱下来,与大部分目标蛋白质分离开来.
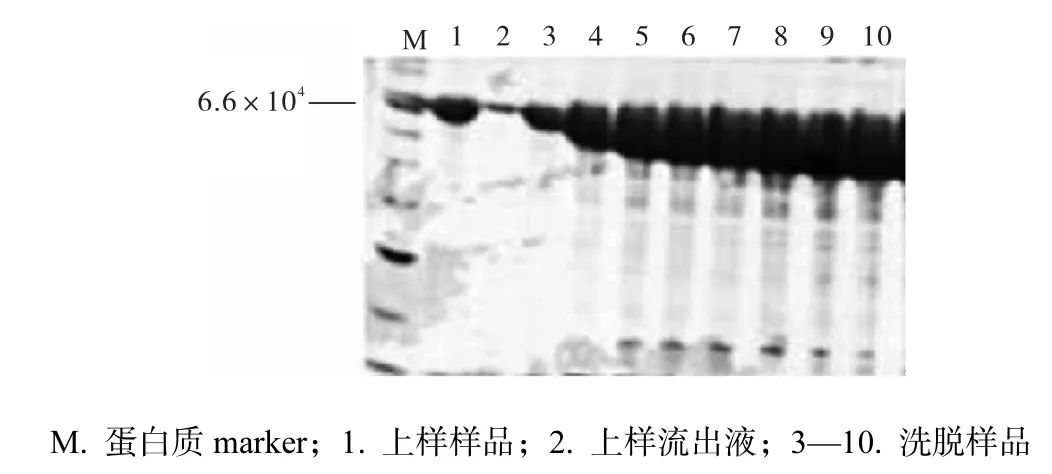
图4 阴离子交换柱纯化蛋白质电泳图Fig. 4 SDS-PAGE analysis of Q-clumn purification
2.3.3 DnaK突变体的纯化
将DnaK的两个突变体(DnaK-A303C、DnaKH541C)依照两步层析的方法分别进行纯化,并将所纯化的蛋白质同时稀释至1,mg/mL,用7.5%,的SDSPAGE检测其纯度.纯化结果如图5所示,DnaK的两个突变体在SDS-PAGE条件下呈现单独的电泳带,纯度达85%,以上.
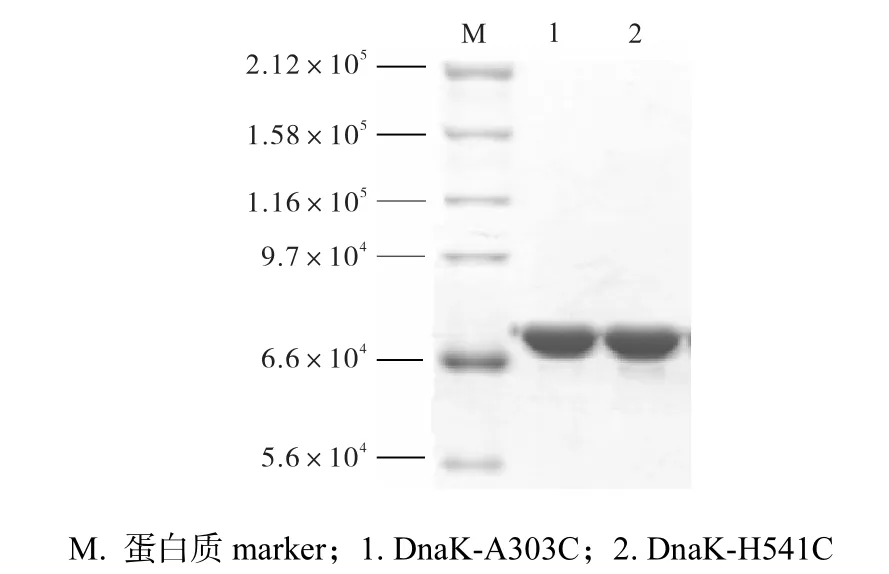
图5 DnaK突变蛋白质纯化结果Fig. 5 Purified DnaK mutant proteins
2.4 蛋白质交联结果
为了研究ATP和ADP对DnaK二聚体的影响,将两种蛋白质等量混合后,采用铜-邻菲罗啉氧化DnaK蛋白之间的二硫键,通过特殊二硫键的形成来研究二聚体的状态.两个DnaK突变体在没有ATP或ADP存在下,以相对分子质量约为7.0×104的蛋白质单体形式存在(图6,泳道1—3).在ADP条件下,DnaK-A303C形成相对分子质量约为2.2×105同二聚体,DnaK-H541C形成相对分子质量约为1.6× 105同二聚体(图6,泳道4、5).当两种突变体混合氧化后,同二聚体没有变化,分别形成2.2×105和1.6×105两条电泳带(图6,泳道6).DnaK-A303C和DnaK-H541C之间二硫键氧化后形成的异二聚体结构.
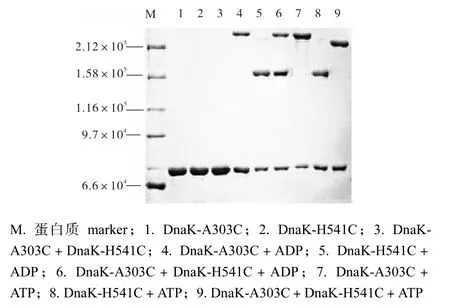
图6 Dnak蛋白质交联结果Fig. 6 Crosslinked Dnak protein
3 结 语
DnaK是原核生物中的热休克蛋白质,具有分子伴侣功能,需要从ATP水解过程获取能量,以结合多肽底物并执行正常功能.本文通过构建两个DnaK的突变体,研究在ATP或ADP条件下,对DnaK二聚体性质的影响.研究表明两个DnaK突变体在ADP的存在下以同二聚体的形式存在,但是在ATP条件下能够形成异二聚体,ATP能够影响DnaK蛋白质的结构.已有研究报道了ATP结合热休克蛋白后,诱导其发生变构效应实现对底物的结合[8].本文通过两个DnaK突变体在ATP条件下生成异二聚体,从生物化学的角度验证了该理论,对于揭示蛋白正确折叠和维持蛋白内稳态具有重要意义.DnaK突变体蛋白质经IPTG高效诱导表达后,Ni亲和层析柱纯化与阴离子交换柱纯化后可得到纯度达85%,以上的蛋白质,符合生物化学实验的要求.
DnaK突变体纯化是整个实验中最为基础,也最为关键的一步,因此需要在最大程度上提高蛋白的纯度,并且保持蛋白活性.具体应注意:蛋白质对理化因素的影响特别敏感,特别是pH、温度等.因此应根据蛋白质自身的等电点,结合所用层析柱的特性,选择合适pH的缓冲液.同时,为了最大程度降低蛋白的变性和降解,整个纯化过程都在4,℃层析柜中进行.
[1] Ellis J. Proteins as molecular chaperones[J]. Nature,1987,328(6129):378-379.
[2] 张晓勇,陈发河,吴光斌. 热激蛋白及其与果蔬的抗冷性关系[J]. 食品科学,2008,29(12):726-730.
[3] Wang C Y. Effect of moist hot air treatment on some postharvest quality attributes of strawberries[J]. Journal of Food Quality,2000,23(1):51-59.
[4] 杨志伟,胡波,尹秀华. 热处理对芒果贮藏特性影响的研究[J]. 安徽农业科学,2009,37(13):6131-6133.
[5] Mcdonald R E,Mccollum T G,Baldwin E A. Temperature of water heat treatments influences tomato fruit quality following low-temperature storage[J]. Postharvest Biology and Technology,1999,16(2):147-155.
[6] Lindquist S,Craig E. The heat-shock proteins[J]. Annual Review of Genetics,1988,22(1):631-677.
[7] Janson J C. Protein purification:Principles,high resolution methods,and applications[M]. Hoboken:Wiley,2012.
[8] Qi R F,Sarbeng E B,Liu Q,et al. Allosteric opening of the polypeptide-binding site when an Hsp70 binds ATP[J]. Nature Structural & Molecular Biology,2013,20(7):900-907.
[9] Flaherty K M,Deluca F C,Mckay D B. Threedimensional structure of the ATPase fragment of a 70 K heat-shock cognate protein[J]. Nature,1990,346(6285):623-628.
[10]Diogo M M,Silva S,Cabral J M S,et al. Hydrophobic interaction chromatography of Chromobacterium viscosum lipase on polypropylene glycol immobilised on Sepharose[J]. Journal of Chromatography A,1999,849(2):413-419.
[11]Porath J,Carlsson J,Olsson I,et al. Metal chelate affinity chromatography,a new approach to protein fractionation[J]. Nature,1975,258(5536):598-599.
[12]Wisniewsa M,Karlberg T,Lehtio L,et al. Crystal structures of the ATPase domains of four human Hsp70 isoforms[J]. PLoS One,2010,5(1):8625.
[13]Porath J. Immobilized metal ion affinity chromatography[J]. Protein Expression and Purification,1992,3(4):263-281.
[14]Janson J C,Feeney R E,Whitaker J R. Importance of cross-linking reactions in proteins[J]. Advances in Cereal Science and Technology,1988,9:21-43.
[15]Singh H. Modification of food proteins by covalent crosslink[J]. Trends in Food Science and Technology,1991,2:196-200.
[16]Tissieres A,Mitchell H K,Tracy U M. Protein synthesis in salivary glands of Drosophila melanogaster:Relation to chromosome puffs[J]. Journal of Molecular Biology,1974,84(3):389-398.
责任编辑:郎婧
Purification of DnaK Mutants and the Characteristics of DnaK Dimer
LIU Qingdai1,2,SU Jiayue1,TIAN Xueli1,YANG Ying1,ZHAO Fei1,2,SHENG Changzhong1,3
(1.College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2.Tianjin Tianlong Seeds Science and Technology Co.,Ltd,Tianjin 300457,China;3.Dynamiker Biotechnology(Tianjin)Co.,Ltd,Tianjin 300457,China)
Two DnaK mutants were constructed by site-directed mutagenesis to study the effect of ATP or ADP on heat shocked protein.DnaK-A303C and DnaK-H541C were expression through induction.Then the recombined proteinswere purified by using sulfate nickel affinity chromatography and anion exchange chromatography.The same amount of proteins was oxidized and the protein cross-linking was detected by SDS-PAGE.The results show that DnaK mutants formed dimmer in the presence of ADP.However,the heterodimer was found under the condition of ATP.This study provides an experimental basis for understanding the synergism between the two subunits of heat shocked protein.
DnaK;ATP;dimer;mutant
TS201
A
1672-6510(2016)03-0011-05
10.13364/j.issn.1672-6510.20150071
2015-06-07;
2015-09-06
国家自然科学基金资助项目(31571029);天津市应用基础与前沿技术研究计划资助项目(15JCYBJC30300,15JCQNJC46300,15JCTPJC55400)
刘清岱(1975—),男(满),河北保定人,副研究员,lqd@tust.edu.cn.
数字出版日期:2015-12-10;数字出版网址:http://www.cnki.net/kcms/detail/12.1355.N.20151210.1045.002.html.
