UPLC-MS/MS法同时测定何首乌中二苯乙烯、蒽醌、黄酮及酚酸类成分
2016-08-02罗益远刘娟秀刘训红兰才武王胜男华愉教
罗益远,刘娟秀,刘 廷,刘训红,兰才武,王胜男,华愉教
(1.南京中医药大学,江苏 南京 210023;2.贵州昌昊中药发展有限公司,贵州 凯里 556000)
UPLC-MS/MS法同时测定何首乌中二苯乙烯、蒽醌、黄酮及酚酸类成分
罗益远1,刘娟秀1,刘廷1,刘训红1,兰才武2,王胜男1,华愉教1
(1.南京中医药大学,江苏 南京210023;2.贵州昌昊中药发展有限公司,贵州 凯里556000)
摘要:建立了超高效液相色谱-串联质谱(UPLC-MS/MS)同时测定何首乌中二苯乙烯(二苯乙烯苷、虎杖苷、白藜芦醇)、蒽醌(大黄素、大黄素甲醚、大黄素-8-β-D-吡喃葡萄糖苷、芦荟大黄素、大黄酸)、黄酮(表儿茶素、芦丁、金丝桃苷、紫云英苷、槲皮素)和酚酸(没食子酸)等4类共14种目标成分的方法。何首乌样品用70%甲醇在室温下以料液比1∶25超声提取45 min,提取液以12 000 r/min离心10 min,取上清液,经0.22 μm微孔滤膜过滤。采用Waters BEH C18色谱柱(100 mm×2.1 mm×1.7 μm),以水(含0.1%甲酸)-乙腈为流动相,梯度洗脱,柱温35 ℃,体积流量0.25 mL/min,电喷雾离子源(ESI),多反应离子监测(MRM)扫描方式进行检测。结果表明:14种目标化合物在一定浓度范围内均呈现良好的线性关系,线性相关系数大于0.991 5;精密度、重复性和稳定性良好;加样回收率在95.85%~102.13%之间,RSD均小于5%。该方法操作简便、灵敏度高、重现性好,可用于何首乌中多元功效物质或指标成分的同时测定,为何首乌药材内在质量的综合评价和全面控制提供新的方法参考。
关键词:何首乌;超高效液相色谱-串联质谱(UPLC-MS/MS);二苯乙烯类;蒽醌;黄酮;酚酸
何首乌为大宗常用中药材,系蓼科植物何首乌Polygonum multiflorumThunb.的干燥块根,具有解毒、消痈、截疟、润肠通便之功效,用于疮痈、瘰疬、肠燥便秘等症状。制首乌是何首乌的炮制加工品,具有补肝肾、益精血、乌须发、强筋骨之功效,常用于血虚萎黄、眩晕耳鸣、须发早白、腰膝酸软、高血脂等症状,自古便为延年益寿之补品[1-2]。现代研究表明,何首乌中的二苯乙烯苷是一种植物抗毒素,是药材中特有的生物活性成分,具有抗衰老、降低胆固醇、提高免疫力、防止动脉硬化、保护肝脏的作用[3-4];蒽醌类化合物具有调血脂、抗菌、强心、抗癌、保护心肌、润肠通便的作用[5];黄酮及酚酸类成分除具有抗氧化作用外,还有抗衰老、抗肿瘤、降低血糖血脂等多方面的生理活性[6]。
目前,对于何首乌的质量评价分析方法主要有薄层色谱法[7-8]、毛细管电泳法[9-10]、高效液相色谱法(HPLC)[11-13]、液相色谱-串联质谱法[14-15]等。与HPLC法相比,超高效液相色谱法(UPLC)具有分离效率高、峰容量大及灵敏度高等优点,更适于中药复杂体系的分离分析;超高效液相色谱-串联质谱法(UPLC-MS/MS)采用多重反应监测(MRM)模式进行定量分析,对目标物质做中性碎片扫描,可解决HPLC难以分离复杂体系的问题。MS/MS与MS相比,灵敏度及选择性均显著提高,在复杂样品测定中,MS/MS能降低信噪比,消除基质干扰,同时给出每一个组分的相对分子质量和丰富的结构信息,测定结果更加准确、可靠[16-17]。
针对何首乌多指标多类型药效成分的特点,通过建立同时测定多指标成分含量的方法,探讨多指标成分的评价体系,使其更具实用性和有效性。本实验在前期研究的基础上[18-21],拟采用UPLC-MS/MS法同时测定何首乌中3种二苯乙烯(二苯乙烯苷、虎杖苷和白藜芦醇)、5种蒽醌(芦荟大黄素、大黄酸、大黄素-8-β-D-吡喃葡萄糖苷、大黄素和大黄素甲醚)、5种黄酮(表儿茶素、芦丁、金丝桃苷、紫云英苷和槲皮素)和1种酚酸(没食子酸)等14种目标成分的含量,旨为何首乌药材内在质量的综合评价和全面控制提供新的方法参考。
1实验部分
1.1主要仪器
AcquityTM超高效液相色谱仪、XevoTQ质谱系统、MasslynxV4.1 工作站:美国Waters公司产品;KQ-500B超声波清洗机:超声功率500W,频率40kHz,昆山超声仪器有限公司产品;BSA2245型电子分析天平(精度十万分之一)、ME36S型电子分析天平(精度百万分之一):均为德国赛多利斯公司产品;H1650-W高速离心机:湖南湘仪实验仪器开发有限公司产品。
1.2主要材料与试剂
二苯乙烯苷(批号:110844-200607)、大黄素(批号:110756-200110)、芦荟大黄素(批号:0795-9803)、大黄酸(批号:0757-200206)、大黄素甲醚(批号:0758-200206)、表儿茶素(批号:10878-200102)、没食子酸(批号:110831-200302)、槲皮素(批号:100081-200907)、芦丁(批号:0080-9705)、金丝桃苷(批号:111521-200303)、紫云英苷(批号:11092001):纯度均大于98%,购自中国药品生物制品检定所;虎杖苷(批号:YY90052)、白藜芦醇(批号:YY90051)、大黄素-8-β-D-吡喃葡萄糖苷(批号:YY90555):纯度均大于98%,购自上海源叶生物科技有限公司;水为超纯水:由Millipore纯水器制备;乙腈、甲醇(色谱纯):德国Merck公司产品;甲酸(色谱纯):美国ROE公司产品;其余试剂均为分析纯。14种目标成分的化学结构式示于图1。
何首乌药材:均为实地采集或购自当地药材公司。制首乌药材编号及来源如下:S1~S4为江苏产,由南京中医药大学校医院提供(批号分别为:121122,130223,130314,131201);S5为广东产,由南京宣德堂中医门诊药房提供;S6为四川产,由江苏省中医院提供(批号为131209);S7为湖北产,由南京大华中药店提供(批号为131101);S8为四川产,由南京益大药店提供(批号为131207);S9为广东产,由北京同仁堂南京店提供(批号为130512002);S10为四川产,由南京益丰大药房提供(批号为130812);S11和S12为实地采集于贵州省赫章县的生首乌,根据《中国药典》[1]何首乌的炖法和蒸法制得对应的制何首乌样品。所有样品均经南京中医药大学药学院刘训红教授鉴定为何首乌PolygonummultiflorumThunb.的块根,留样凭证保存于南京中医药大学中药鉴定实验室。
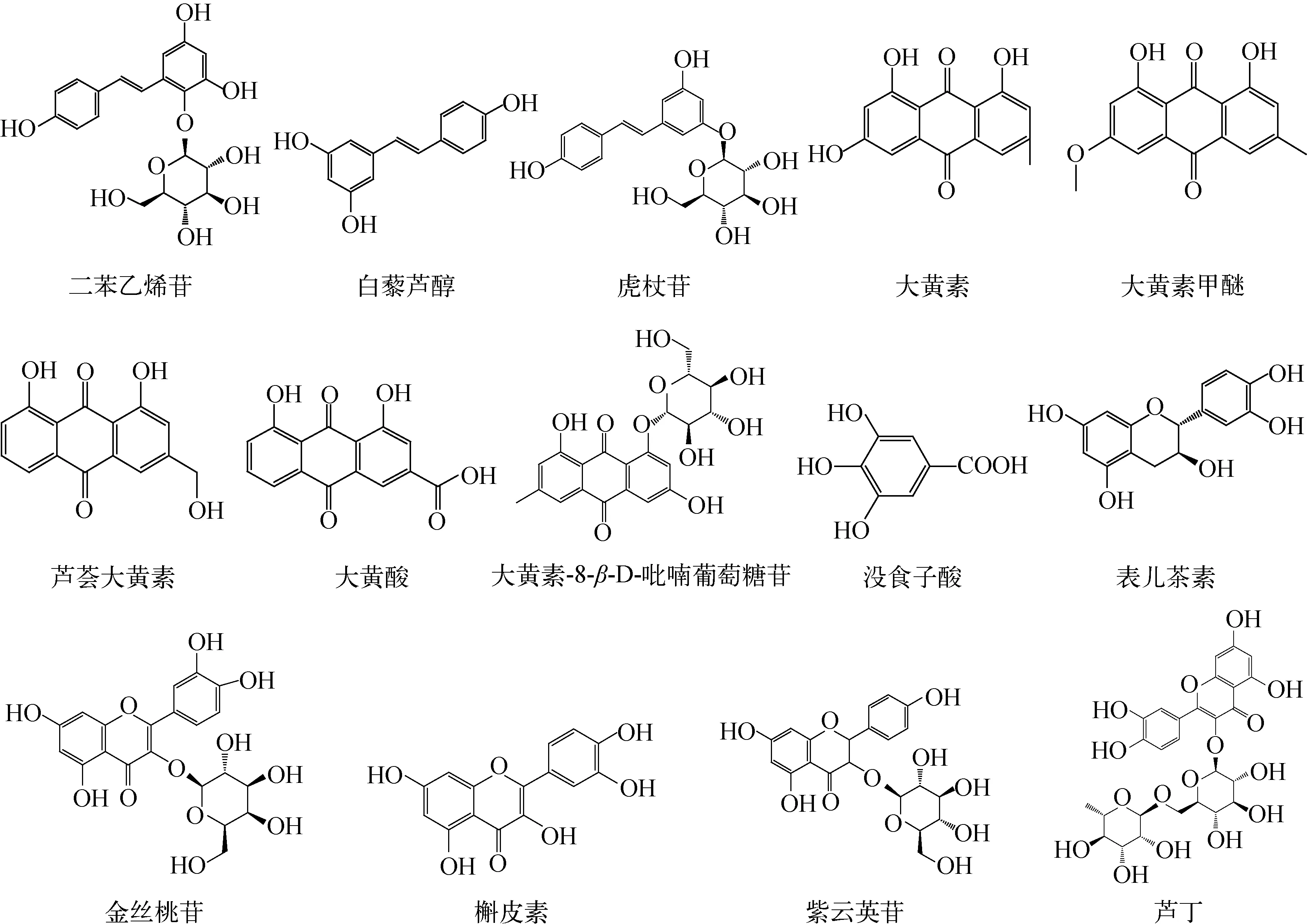
图1 14种目标成分的结构式
1.3实验条件
1.3.1色谱条件色谱柱:Waters BEH C18柱(100 mm×2.1 mm×1.7 μm);流动相:水(含0.1%甲酸)(A相)-乙腈(B相);梯度洗脱:0~1 min、10%B,1~2 min、10%~90%B,2~3 min、90%B,3~4 min、90%~10%B,4~5 min、10%B;柱温35 ℃;流速0.25 mL/min;进样量5 μL。
1.3.2质谱条件Waters三重四极杆串联质谱仪(TQD),电喷雾离子化源(ESI),多反应监测离子扫描模式(MRM)测定。脱溶剂温度400 ℃;锥孔气流速50 L/h;正离子模式下,毛细管电压3.5 kV,脱溶剂气流速800 L/h;负离子模式下,毛细管电压2.5 kV,脱溶剂气流速550 L/h。14种目标成分的质谱参数列于表1。
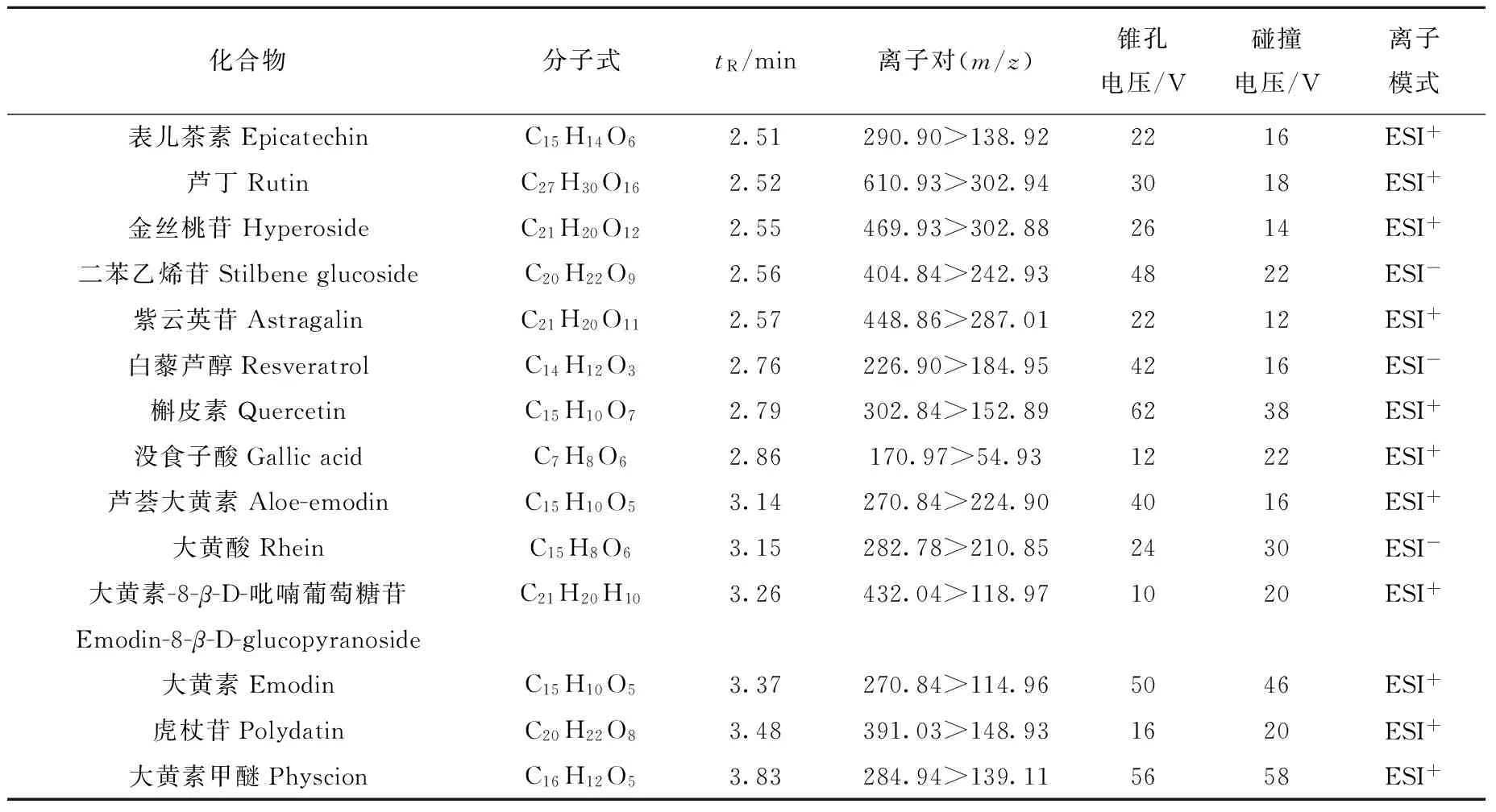
表1 14种目标成分的质谱分析参数
1.3.3对照品溶液的制备精密称取6.42 mg表儿茶素、2.11 mg芦丁、1.50 mg金丝桃苷、21.3 mg二苯乙烯苷、1.78 mg紫云英苷、2.63 mg白藜芦醇、1.55 mg槲皮素、5.49 mg没食子酸、0.27 mg芦荟大黄素、1.34 mg大黄酸、25.20 mg大黄素-8-β-D-吡喃葡萄糖苷、14.85 mg大黄素、23.8 mg虎杖苷、14.60 mg大黄素甲醚对照品,分别置于10 mL容量瓶中,加甲醇溶解并稀释至刻度;取适量的各对照品母液,加甲醇配制成含上述对照品的混合储备液,并逐级稀释,得到一系列不同浓度的混合对照品溶液,于4 ℃保存,备用。
1.3.4供试品溶液的制备取干燥至恒重的样品粉碎,过80目筛,精密称定1.0 g样品粉末,置于100 mL具塞锥形瓶中,加入25 mL 70%甲醇,称其质量,于室温下超声提取45 min后取出,冷却,以70%甲醇补足质量损失,静置冷却,平行制得2份样品,于4 ℃保存。测定时,精密吸取1 mL溶液,置于100 mL容量瓶中,用初始流动相乙腈-0.1%甲酸溶液(1∶9,V/V)定容,摇匀,以12 000 r/min离心10 min,取上清液,经0.22 μm微孔滤膜过滤,即得供试品溶液。
1.4分析方法
用Waters BEH C18色谱柱对色谱分离条件进行优化,以确定最佳的分离条件。按照选定的最佳色谱-质谱条件进行UPLC-MS/MS分析,平行测定2次,通过外标标准曲线计算各成分的含量。
2结果与讨论
2.1色谱条件的优化
实验考察了甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水等溶剂作为流动相时的分离效果。结果发现,采用乙腈作为流动相时的分离效果明显优于甲醇,在流动相中加入一定比例的甲酸可以增强样品中待测物的保留,并减少色谱峰的拖尾,提高分析方法的分离效果和灵敏度。因此,本实验采用乙腈-0.1%甲酸水溶液作为流动相。
2.2质谱条件的优化
实验选用正负两种离子模式测定14种目标成分的含量,其中,二苯乙烯苷、白藜芦醇、大黄酸选择负离子模式,其他成分选择正离子模式。经过反复实验,发现各成分在检测条件下具有较好的稳定性、较高的响应值和较好的峰形。
2.3供试品制备方法的优化
实验对提取溶剂(60%、70%、80%、90%、100%甲醇)、料液比(1∶15、1∶20、1∶25、1∶30、1∶35)及提取时间(15、30、45、60 min)进行了考察。结果表明,以70%甲醇作为溶剂,料液比1∶25、超声提取45 min时的提取率最高。
2.4线性方程、检测限和定量限
精密吸取1.3.3节的混合对照品标准溶液,置于10 mL容量瓶中,用初始流动相乙腈-0.1%甲酸水溶液(1∶9,V/V)逐级稀释,制成一系列浓度的混合对照品溶液,按2.1节和2.2节条件进样分析,以对照品的峰面积(y)对相应的浓度(x)进行线性回归,得到回归方程、线性相关系数和线性范围;以各化合物的3倍信噪比(S/N=3)相对应的浓度为最低检测限(LOD),以各化合物的10倍信噪比(S/N=10)相对应的浓度为最低定量限(LOQ),结果列于表2,混合对照品的色谱图示于图2。
2.5方法学考察
2.5.1精密度、重复性、稳定性实验精密吸取5 μL同一混合对照溶液,分别重复进样6次,计算14种目标成分峰面积的RSD;取同一样品,按1.3.4节方法制备供试品溶液,吸取5 μL进样,重复测定6次,计算各目标成分含量的RSD;取同一样品制备供试品溶液,分别在0、2、4、8、12、24 h测定14种目标成分峰面积的RSD,结果列于表3。
2.5.2加样回收率实验取0.5 g(6份)已知含量的样品,精密称定,置于锥形瓶中,分别加入一定量的各对照品溶液,按1.3.4节方法制备加样回收率供试品溶液,进样测定后,计算各成分的平均回收率及RSD,结果列于表3。
2.6样品含量测定及分析
取按1.3.4节方法制备的何首乌供试品溶液,按1.3.1节和1.3.2节条件测定,根据相应的线性关系计算供试样品中14种目标成分的含量和变异系数(变异系数=标准偏差/平均值),结果列于表4。
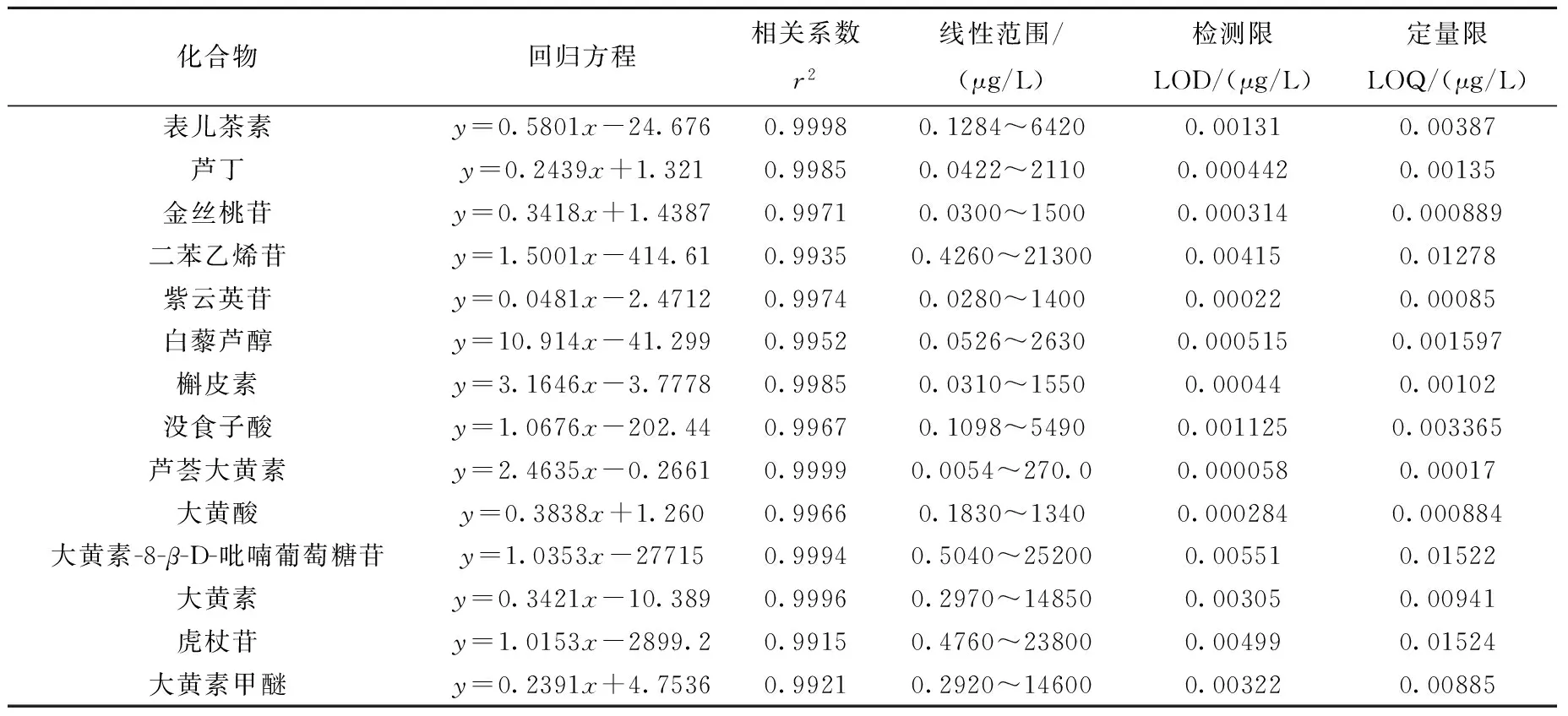
表2 14种化合物的线性关系、检测限和定量限
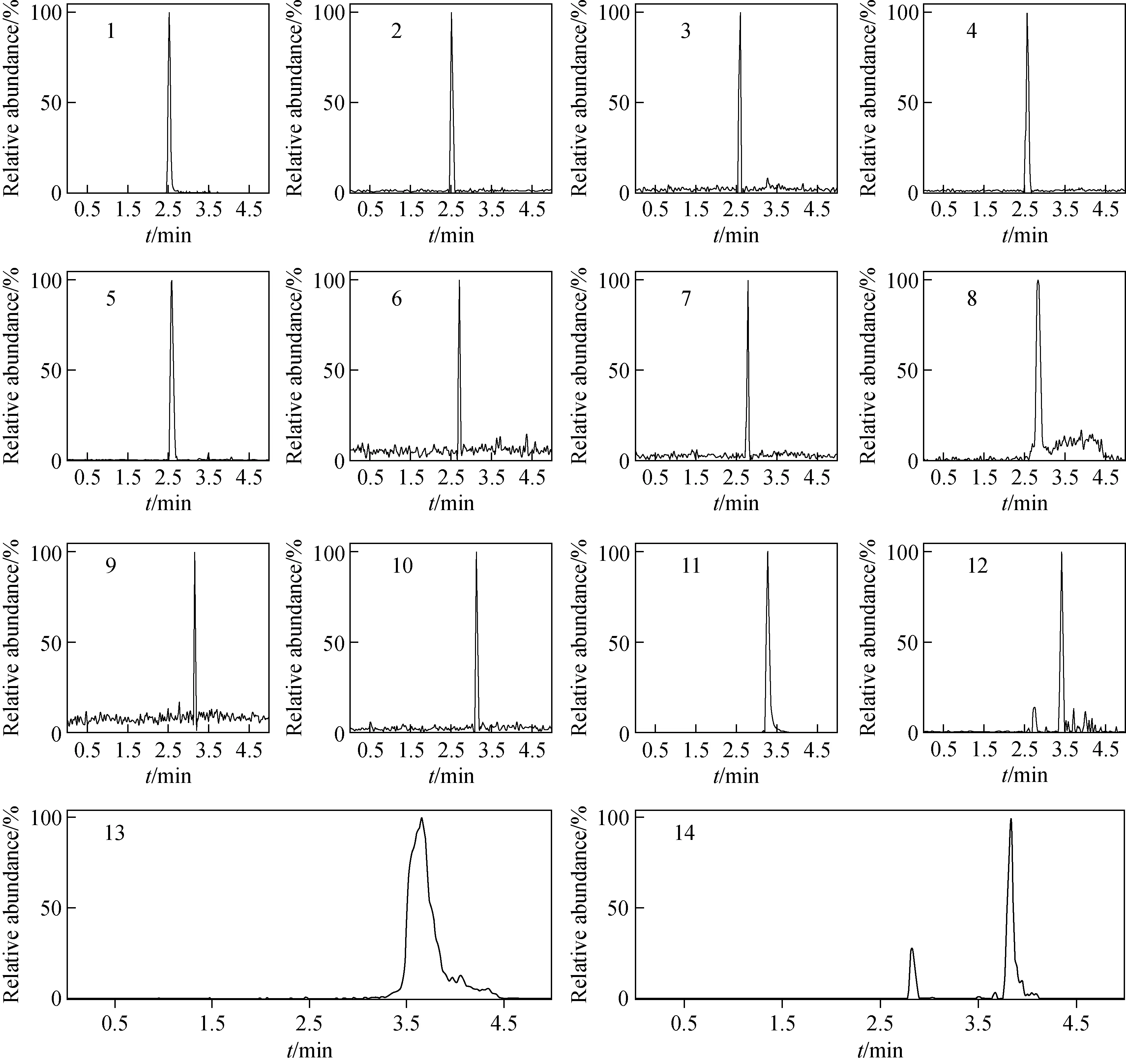
注:1.表儿茶素;2.芦丁;3.金丝桃苷;4.二苯乙烯苷;5.紫云英苷;6.白藜芦醇;7.槲皮素;8.没食子酸;9.芦荟大黄素;10.大黄酸;11.大黄素-8-β-D-吡喃葡萄糖苷;12.大黄素;13.虎杖苷;14.大黄素甲醚图2 14种目标成分混合对照品的MRM色谱图
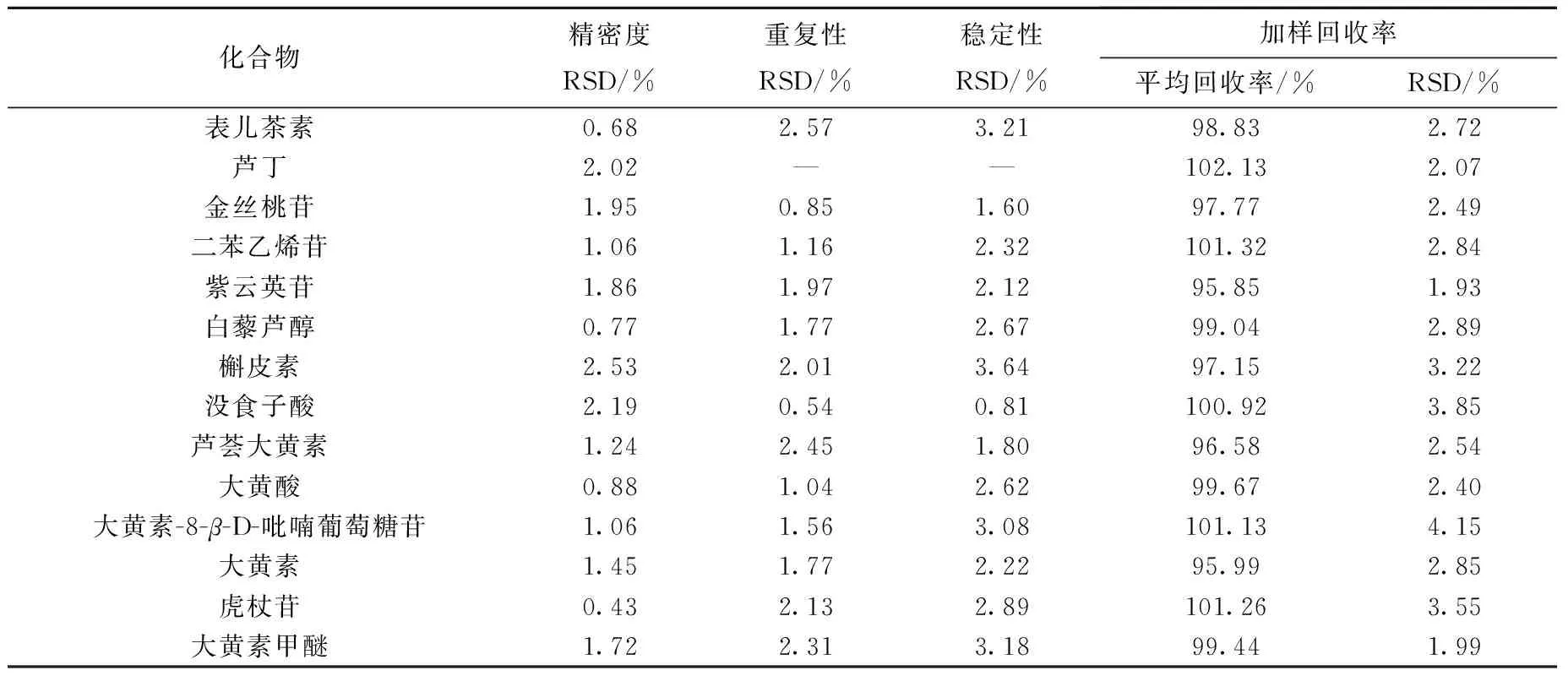
化合物精密度RSD/%重复性RSD/%稳定性RSD/%加样回收率平均回收率/%RSD/%表儿茶素0.682.573.2198.832.72芦丁2.02——102.132.07金丝桃苷1.950.851.6097.772.49二苯乙烯苷1.061.162.32101.322.84紫云英苷1.861.972.1295.851.93白藜芦醇0.771.772.6799.042.89槲皮素2.532.013.6497.153.22没食子酸2.190.540.81100.923.85芦荟大黄素1.242.451.8096.582.54大黄酸0.881.042.6299.672.40大黄素-8-β-D-吡喃葡萄糖苷1.061.563.08101.134.15大黄素1.451.772.2295.992.85虎杖苷0.432.132.89101.263.55大黄素甲醚1.722.313.1899.441.99
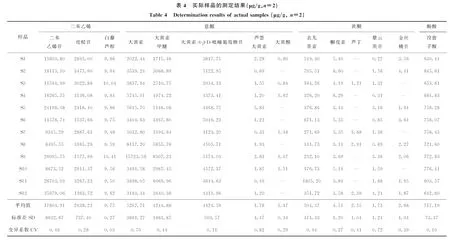
结果表明,制首乌样品中二苯乙烯苷的质量分数最高,为8.495~35.979 mg/g,平均质量分数为17.803 mg/g;其次为大黄素-8-β-D-吡喃葡萄糖苷、大黄素、虎杖苷和大黄素甲醚,平均质量分数分别为4.424、5.267、2.638、4.244 mg/g。这5种成分总含量占制首乌的2.23%以上。此外,表儿茶素、没食子酸的平均质量分数分别为0.504、0.717 mg/g。《中国药典》2015版中规定:二苯乙烯苷、大黄素和大黄素甲醚是制首乌质量评价的指标成分,其最高质量分数分别为35.979、15.723、8.307 mg/g,最低质量分数分别为8.495、2.022、1.715 mg/g,本实验结果与之相符。
由表4可见,同一成分在各产地何首乌样品中的含量差异明显,不同成分的变化或波动范围也明显不同,且不同炮制方法制备的制首乌样品化学成分差异明显。为了比较不同成分含量的波动差异,引入了质量变异系数,其数值可以反映某一成分在不同样品质量分数变异的范围。其中,表儿茶素、芦荟大黄素的质量分数变异系数较大,分别为0.94、0.82,而白藜芦醇的变异系数相对较小。这说明,制首乌中表儿茶素和芦荟大黄素可能比白藜芦醇更容易受到产地的因素影响而产生变化。
3结论
本研究建立了超高效液相色谱-串联质谱同时测定何首乌中3种二苯乙烯(二苯乙烯苷、虎杖苷和白藜芦醇)、5种蒽醌(芦荟大黄素、大黄酸、大黄素-8-β-D-吡喃葡萄糖苷、大黄素和大黄素甲醚)、5种黄酮(表儿茶素、芦丁、金丝桃苷、紫云英苷和槲皮素)和1种酚酸(没食子酸)等14种目标成分的定性、定量分析方法,通过优化色谱-质谱条件,确定最佳的提取条件为:70%甲醇作为溶剂,料液比1∶25、超声提取45 min。结果表明,14种化合物的线性关系良好,线性相关系数均大于0.991 5,平均回收率在95.85%~102.13%之间,相对标准偏差均小于5%。该方法操作简单、分析时间短、灵敏度高、稳定性好,可以为何首乌药材质量的综合评价和全面控制提供方法参考。
参考文献:
[1]国家药典委员会. 中华人民共和国药典2015版(一部)[M]. 北京:中国医药科技出版社,2015:175-177.
[2]LIN L F, NI B, LIN H M, et al. Traditional usages, botany, phytochemistry, pharmacology and toxicology ofPolygonummultiflorumThunb.: A review[J]. Journal of Ethnopharmacology, 2015, 159(1): 158-183.
[3]LI S G, CHEN L L,HUANG X J, et al. Five new stilbene glycosides from the roots ofPolygonummultiflorum[J]. Journal of Asian Natural Products Research, 2013, 15(11): 1 145-1 151.
[4]郭倩倩,谢艳华,杨倩,等. 二苯乙烯苷的一般药理研究[J]. 西北药学杂志,2013,28(2):174-177.
GUO Qianqian, XIE Yanhua, YANG Qian, et al, Study on the general pharmacological effect of tetrahydroxysitlbene-2-O-β-D-glucoside[J]. No-rthwest Pharmaceutical Journal, 2013, 28(2): 174-177(in Chinese).
[5]HE D X, CHEN B, TIAN Q Q, et al, Simultaneous determination of five anthraquinones in medicinal plants and pharmaceutical preparations by HPLC with fluorescence detection[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009, 49(4): 1 123-1 127.
[6]宋士军,李芳芳,岳华,等. 何首乌的抗衰老作用研究[J]. 河北医科大学学报,2003,24(2):90-91.
SONG Shijun, LI Fangfang, YUE Hua, et al. Study on the anti-aging effects ofPolygonummultiflorumRadix[J]. Journal of Hebei Medical University, 2003, 24(2): 90-91(in Chinese).
[7]张雪. 薄层色谱法检测何首乌大黄素方法的建立[J]. 食品工业科技,2008,29(9):271-272.
ZHANG Xue. TLC analysis of emodin inPolygonummutiflorumThunb. by TLCS[J]. Science and Technology of Food Industry, 2008, 29(9): 271-272(in Chinese).
[8]蔡力行,戈早川,赖小辉. 薄层色谱成像法定量分析何首乌中大黄素的含量[J]. 时针国医国药,2009,20(3):538-539.
CAI Lixing, GE Zaochuan, LAI Xiaohui. Determination of emodin in radixPolygoniMultifloriby thin layer chromatography imaging method[J]. Lishizhen Medicine and Materia Medica Research, 2009, 20(3): 538-539(in Chinese).
[9]TIAN K, ZHANG H G, CHEN X G, et al. Detemination of five anthraquinones in medicinal plants by capillary zone electrophoresis with beta-cyclodextrin addition[J]. Journal of Chromatography A, 2006, 1 123(1): 134-137.
[10]吴虹,王炎,温棚,等. 胶束电动毛细管色谱法同时测定何首乌中二苯乙烯苷和5种蒽醌类化合物[J]. 华南理工大学学报:自然科学版,2012,40(9):32-37.
WU Hong, WANG Yan, WEN Peng, et al. Simultaneous determination of stilbene glucoside and five anthraquinones inPolygonummultiflorumThunb. by MEKC[J]. Journal of South China University of Technology (Natural Science Edition), 2012, 40(9): 32-37(in Chinese).
[11]杨艳菁,兰才武,贺定翔,等. 不同加工方法对何首乌饮片质量的影响[J]. 中国实验方剂学杂志,2015,21(15):31-34.
YANG Yanjing, LAN Caiwu, HE Dingxiang, et al. Effect of different processing methods on quality ofPolygoniMultifloriRadix decoction[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(15): 31-34(in Chinese).
[12]XU L Y, DONG Q, HU F Z. Simultaneous quantitative determination of eight active components inPolygonummultiflorumThunb. by RP-HPLC[J]. Journal of Chinese Pharmaceutical Sciences, 2009, 18(4): 358-361.
[13]李帅锋,郑传柱,张丽,等. 不同产地何首乌 HPLC指纹图谱研究[J]. 中草药,2015,46(14):2 149-2 154.
LI Shuaifeng, ZHENG Chuanzhu, ZHANG Li, et al. HPLC fingerprint on roots ofPolygonummultiflorumfrom different habitats[J]. Chinese Traditional and Herbal Drugs, 2015, 46(14): 2 149-2 154(in Chinese).
[14]LIN L F, NI B, LIN H M, et al. Simultaneous determination and pharmacokinetic study ofP-hydroxybenzaldehyde, 2,3,5,4-tetrahydroxystilbene-2-O-β-glucoside, emodin-8-O-β-D-glucopyr-anoside, and emodin in rat plasma by liquid chromatography tandem mass spectrometry after oral administration ofPolygonummultiflorum[J]. Analytical Methods, 2015, 7(1): 244-252.
[15]ZHU Z W, LI J, GAO X M, et al. Simultaneous determination of stilbenes, phenolic acids, flavonoids and anthraquinones in RadixPolygonimultifloriby LC-MS/MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 62(1): 162-166.
[16]王常顺,刘永利,王晓蕾,等. UPLC、 HPLC 测定血栓通注射液中5个皂苷类成分含量的比较研究[J]. 药物分析杂志,2013,33(9):1 617-1 620.
WANG Changshun, LIU Yongli, WANG Xiaolei, et al. Comparison of UPLC and HPLC for determination of five saponins in Xueshuantong injection[J]. Chinese Journal of Pharmaceutical Analysis, 2013, 33(9): 1 617-1 620(in Chinese).
[17]范晓苏. 超髙效液相色谱-串联质谱法在中药多组分含量分析及大鼠血菜中血药浓度测定的应用研究[D]. 南宁:广西大学,2014.
[18]罗益远,刘娟秀,刘训红,等. 胶束电动毛细管电泳同时测定何首乌中7种指标成分含量的研究[J]. 中国药学杂志,2015,50(9):802-807.
LUO Yiyuan, LIU Juanxiu, LIU Xunhong, et al. Simultaneous determination of seven components inPolygoniMultifloriRadix by MEKC-DAD[J]. Chinese Pharmaceutical Journal, 2015, 50(9): 802-807(in Chinese).
[19]罗益远,刘娟秀,侯娅,等. 何首乌不同产地及商品药材中无机元素的ICP-MS分析[J]. 中草药,2015,46(7):1 056-1 064.
LUO Yiyuan, LIU Juanxiu, HOU Ya, et al. ICP-MS analytical studies on the inorganic celements inPolygoniMultifloriRadix from different areas and commercial herbs[J]. Chinese Traditional and Herbal Drugs, 2015, 46(7): 1 056-1 064(in Chinese).
[20]罗益远,刘娟秀,刘训红,等. 何首乌和首乌藤的挥发性成分GC-MS分析[J]. 中药材,2015,38(10):2 113-2 116.
LUO Yiyuan, LIU Juanxiu, LIU Xunhong, et al. ICP-MS analytical studies on the volatile constituents ofPolygoniMultifloriRadix andPolygoniMultifloriCaulis[J]. Journal of Chinese Medicinal Materials, 2015, 38(10): 2 113-2 116(in Chinese).
[21]罗益远,刘娟秀,刘训红,等. 超高液相色谱-四级杆/线性离子阱质谱法同时测定不同产地何首乌中10种核苷类成分[J]. 分析测试学报,2015,34(5):519-524.
LUO Yiyuan, LIU Juanxiu, LIU Xunhong, et al. Simultaneous determination of nucleosides and nucleobases ofPolygoniMultifloriRadix from different origins by UPLC-QTRAP-MS/MS[J]. Journal of Instrumental Analysis, 2015, 34(5): 519-524(in Chinese).
收稿日期:2015-09-13;修回日期:2015-11-08
基金项目:国家科技支撑计划项目(2011BAI13B04);江苏高校优势学科建设工程资助项目(ysxk-2014)资助
作者简介:罗益远(1989—),男(汉族),福建连城人,硕士研究生,从事中药品质评价研究。E-mail: luoyiyuan0012@sohu.com 通信作者:刘训红(1959—),男(汉族),江苏滨海人,教授,从事中药鉴定与品质评价研究。E-mail: liuxunh1959@sohu.com
中图分类号:O657.63
文献标志码:A
文章编号:1004-2997(2016)04-0327-09
doi:10.7538/zpxb.youxian.2016.0016
Simultaneous Determination of Stilbenes, Anthraquinones,Flavonoids and Phenolic Acids inPolygoniMultifloriRadix by UPLC-MS/MS
LUO Yi-yuan1, LIU Juan-xiu1, LIU Ting1, LIU Xun-hong1,LAN Cai-wu2, WANG Sheng-nan1, HUA Yu-jiao1
(1.NanjingUniversityofChineseMedicine,Nanjing210023,China;2.GuizhouChangHaoChineseMedicineCo.,Ltd.,Kaili556000,China)
Abstract:A comprehensive analytical method based on UPLC-MS/MS was developed for the simultaneous determination of fourteen components include three stilbenes (stilbeneglucoside, polydatin, resveratrol), five anthraquinones (emodin, physcion, emodin-8-β-D-glucopyranoside, aloe-emodin, rhein), five flavonoids (epicatechin, quercetin, rutin, astragalin, hyperoside), and one phenolic acid (gallic acid) in Polygoni Multi-flori Radix. The samples was extracted with 70% methanol water solutions and assisted by ultrasonic machine. The extraction conditions which were optimized by experiment as following: the solid liquid ratio was 1∶25, the extraction time was 45 min at room temperature, the extractant phase was separated by centrifugation at 12 000 r/min for 10 min, then filtered through 0.22 μm nylon membranes. Under the optimized chromatographic conditions, good separation for fourteen target compounds were obtained on a Waters BEH C18 (100 mm×2.1 mm×1.7 μm) eluted by a mobile phase of water (0.1% acetic acid, A)-acetonitrile (B) at a flow rate of 0.25 mL/min. The target compounds were analyzed by multiple reaction monitoring (MRM) mode. The results show that fourteen components have good linearity, the linearity of the detected components is excellent more than 0.991 5, and the limits of detection are all satisfied. The average recoveries of standard addition for the compounds are between 95.85% and 102.13%, and the relative standard deviations are less than 5%. The established method is simplify, sensitive and accurate, which is suitable for determination of fourteen components in Polygoni Multiflori Radix, and also can provide a reliable and effective technique for the quality control of Polygoni Multiflori Radix.
Key words:Polygoni Multiflori Radix; UPLC-MS/MS; stilbenes; anthraquinones; flavonoids; phenolic acid
网络出版时间:2016-03-28;网络出版地址:http:∥www.cnki.net/kcms/detail/11.2979.TH.20160328.1443.014.html
