低频电刺激对耐药癫痫大鼠海马细胞外液谷氨酸及γ-氨基丁酸的影响*
2016-08-01唐太峰伍国锋
唐太峰, 伍国锋
(1.贵阳市第二人民医院 神经内科, 贵州 贵阳 550081; 2.贵州医科大学附院 神经内科, 贵州 贵阳 550004)
低频电刺激对耐药癫痫大鼠海马细胞外液谷氨酸及γ-氨基丁酸的影响*
唐太峰1, 伍国锋2
(1.贵阳市第二人民医院 神经内科, 贵州 贵阳550081; 2.贵州医科大学附院 神经内科, 贵州 贵阳550004)
[摘要]目的: 观察低频电刺激(LFS)海马对杏仁核电点燃耐药癫痫模型大鼠脑内谷氨酸(Glu)及γ-氨基丁酸(GABA)的影响。方法: 选取60只雄性健康SD大鼠制作杏仁核点燃模型,采用苯妥英钠(PHT)和苯巴比妥(PB)对杏仁核点燃癫痫鼠进行耐药筛选,对明确耐药大鼠给予海马LFS治疗,收集电刺激海马治疗前后脑组织微透析液,采用高效液相色谱法(HPLC)观察治疗前后Glu及GABA含量。结果: 筛选出的耐药癫痫模型大鼠7只,海马刺激前GABA浓度为(29.114 0±7.236 2)mg/L,刺激后为(37.130 0±7.622 5)mg/L,刺激前后比较差异有统计学意义(P<0.05);Glu刺激前浓度为(2 527.742 0±514.831 1)mg/L,刺激后为(2 243.906 0±329.277 8)mg/L,有降低趋势,但差异无统计学意义(P>0.05),GABA/Glu刺激前为0.011 63±0.002 34,刺激后为0.016 50±0.002 36,差异有统计学意义(P<0.05)。结论: 耐药癫痫大鼠海马LFS可增加刺激部位脑组织透析液中GABA水平,提高GABA/Glu比值,这可能是LFS抑制癫痫发作的机制之一。
[关键词]癫痫; 耐药; 电刺激疗法; 海马; 谷氨酸; γ-氨基丁酸; 微透析; 色谱法,高压液相
1987年Velasco等[1]首次报道用双侧丘脑中央中核电刺激治疗人类耐药癫痫控制发作后,多项相关研究在世界各地相继展开。目前认为电刺激治疗时的刺激部位通常选择在癫痫触发点或痫性放电神经网络中扮演重要角色的结构,如丘脑底核、尾状核、丘脑前核、丘脑正中核、黑质、海马、小脑等。脑深部电刺激(DBS)治疗被证实是治疗各类成人和青少年癫痫发作的有效方法[2],但尚不清楚其确切机制。本研究利用杏仁核电刺激点燃大鼠模型,予抗癫痫药物筛选建立耐药癫痫模型,通过低频电刺激(LFS)海马,观察耐药癫痫模型大鼠脑内的γ-氨基丁酸(GABA)和谷氨酸(Glu)的变化,探讨LFS海马控制耐药大鼠癫痫发作的作用机制。
1材料和方法
1.1动物及设备
200~250 g的雄性SD大鼠60只单笼标准饲养。 主要仪器:BL-420E生物技能实验系统,江湾Ⅱ型脑立体定位仪,微量恒速灌流泵(美国Bioanalytical systems.Inc),微透析套管(美国Bioanalytical systems.Inc),微透析探针(美国Bioanalytical systems.Inc),0.22 μm无菌滤膜(美国Millipore公司),AGILENT 1100高效液相色谱仪(美国AGILENT公司)。人工脑脊液(138mmol/L NaCl,11 mmol/L Na2HCO3,5 mmol/L KCl,1 mmol/L CaCl2,1 mmol/L MgCl2,1mmol/L NaH2PO4,使用双蒸馏水配制,其中CaCl2单独溶解)实验时与其他溶液混合,并通入95%O2和5%CO2混合气体,待pH 7.4时停止通气,0.22 μm无菌滤膜过滤,4 ℃冰箱保存,2周内用于微透析实验。
1.2癫痫动物模型制作
予4%水合氯醛10 mL/kg腹腔注射麻醉大鼠后,固定于脑立体定位仪,暴露颅骨及前囟,按Paxinos和Watson大鼠脑立体定位图谱确定大鼠左侧杏仁基底外侧核(前囟后2.0 mm,矢状缝旁开5.0 mm,深度8.5 mm),选择右侧杏仁基底外侧核的颅骨表面投影点钻孔,植入双极螺旋镍铬电极并固定于颅骨表面。术后连续3 d腹腔注射青霉素钠(10万U/d)预防感染,一周后开始电刺激点燃,每日1次(细电流,串刺激,波宽1 ms,频率60 Hz,持续时间1 s,电流强度0.450 mA)。发作强度按Racine法分级[3],连续3次4~5级以上发作则记为完全点燃。点燃24 h记录后放电阈值(ADT,ADT为引起脑电图出现后发放时的最小电流强度;起始电流强度为0.02 mA,此后按每次叠加20%刺激,每5 min记录1次,直至测出ADT)。
1.3药物筛选耐药癫痫模型
ADT 测定完毕24 h,癫痫模型大鼠予生理盐水(与筛选药物同体积)腹腔注射,1 h后测ADT。24 h后腹腔注射苯妥英钠(PHT,75 mg/kg),1 h后测ADT(起始电流强度为生理盐水组ADT值的20%,此后按每次叠加20%刺激,每5 min 1次)。将注射PHT与注射生理盐水后所测得ADT进行对比,若波动范围在±20%内,则一周后再进行PHT筛选一次,3次均通过的大鼠,考虑对PHT耐药;并于一周以后进行苯巴比妥(PB,25 mg/kg)筛选,方法同前。所有PHT及PB筛选均通过的大鼠即为耐药癫痫大鼠模型,纳入微透析实验。
1.4检测海马脑组织液GABA和Glu
1.4.1电极及微透析套管的植入4%水合氯醛10 mL/kg腹腔注射麻醉大鼠,固定于脑立体定位仪,拔除原有左侧杏仁核刺激电极,创面止血消毒,清洁颅骨表面,按Paxinos和Watson大鼠脑立体定位图谱,选择右侧海马,坐标为前囟后4.8 mm,矢状缝旁开5.0 mm,深度4.0 mm。钻开颅骨,将连接有刺激电极的微透析套管沿坐标点缓慢植入(保证电极与微透析套管平行并紧贴于微透析套管,双极电极末端超出引导管末端1.5 mm),植入深度为4.0 mm,牙托粉和502胶水固定。术后大鼠置于较大的笼中,单笼饲养,防止大鼠将套管及电极撞脱。连续3日注射青霉素预防感染,单笼静养24 h后用于微透析实验。
1.4.2海马电刺激前微透析液的收集植入电极24 h后移去微透析套管针芯,植入微透析探针,输入端接微量恒速灌流泵,输出端用EP管收集微透析液。用人工微透析液以2 μL/min速率持续灌注2 h平衡,大鼠清醒后,开始收集,每管15 min,连续收集2管并立即置-20 ℃冰箱保存,并在透析结束后转存-80 ℃冰箱,择日测定。每只实验大鼠实验前均取2管作为基础值。
1.4.3海马电刺激后微透析液的收集 按该参数予海马低频电刺激治疗:频率1 Hz、持续15 min、波宽0.1 ms、电流强度100 mA,连续单刺激,延时0.05 ms,每日一次(09∶00~11∶00时),连续14 d。第14日刺激结束24 h后,按照1.4.2项下方法再次收集微透析液。
1.4.4检测海马组织液中的Glu、GABA含量检测系统为Waters 2475 Multi Fluorescence Detector,Nova-pak C18(150 mm×3.9 mm,粒径5 μm)反相色谱柱,利用单泵恒流洗脱,设定柱温30 ℃,流速0.9 mL/min,荧光检测器设定激发波长为Ex330 nm,发射波长为Em420 nm。取微透析样品中的某一成分峰的保留时间与标准品中相应峰的保留时间相一致者作为其Glu、GABA峰。
1.5统计学处理
2结果
2.1造模结果
60只大鼠,7只术后死亡,余下53只给予电点燃刺激。成功点燃24只,平均发作天数15 d。24只点燃大鼠,其中7只通过PHT及PB筛选,视为耐药癫痫大鼠模型,耐药率29.17%。
2.2海马微透析液中Glu和GABA量
予海马LFS治疗14 d之后,各鼠GABA浓度较电刺激治疗前升高,而GABA/Glu比值升高趋势更为显著,均有统计学意义(P<0.05),Glu浓度较电刺激治疗前降低,但差异无统计学意义(P>0.05)。见表1。
3讨论
对于耐药癫痫患者,外科手术切除病灶可作为药物治疗之外的另一个选择,但部分患者癫痫灶无法定位,或病灶位于语言、感觉、运动区等不宜手术部位,因此只有部分患者可外科手术控制发作[4]。对于药物控制不佳又不适宜手术的癫痫患者来说,神经电刺激或可成为较好的治疗手段,其中DBS这种新的治疗手段,由于其疗效让人鼓舞,已经受到广泛的关注,但其机制尚不明确。本研究使用两种不同作用机制的抗癫痫药物(AEDs)对癫痫模型进行耐药筛选,建立耐药癫痫模型,探索DBS治疗机制。
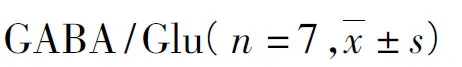
表1 耐药癫痫大鼠海马LFS前后Glu、GABA及
DBS治疗耐药癫痫根据刺激参数的不同,可分为低频率电刺激(LFS,≤10 Hz)和高频率电刺激(HFS,>60 Hz)两种类型,均有抗癫痫作用,具体机制尚不明确,但随着电刺激强度的增大,不良反应也随之增加[5]。本研究选择LFS作为治疗手段。对于刺激靶点的选择,目前尚存争议,针对不同的癫痫类型,刺激靶点选择可能亦有所不同。在耐药癫痫患者中,大部分为颞叶癫痫,而海马与颞叶癫痫密切相关[6],故本研究将刺激靶点定于海马,且已有人将其运用于临床[7],但未阐明其机制。目前对于目前DBS治疗癫痫可能的机制尚不明确,但与Papez环路、 皮质-丘脑网络密切相关[6],而Glu和GABA作为重要的兴奋性和抑制性神经递质代表,成为研究的热点。因为兴奋性递质增加和抑制性递质减少均可改变神经网络的兴奋-抑制平衡,这是痫性电活动的分子学基础。因而以Glu/ GABA来研究癫痫的发生或许比单纯测定Glu或GABA的绝对浓度更有意义。但目前尚没有合适的药物对两者的平衡进行调节,而采用DBS进行神经调节的方式则有可能达到此目的。
在本实验中,GABA浓度和GABA/Glu比值治疗后均升高,结果具有统计学意义(P<0.05),且以GABA/Glu比值升高趋势最为显著,Glu浓度有升高趋势,但无统计学意义(P>0.05),推测可能与样本量较小有关,又或者因Glu升高并非LFS治疗的主要机制,提示相对于兴奋性神经递质Glu的变化,抑制性神经递质GABA可能在电刺激海马抗癫痫的机制中扮演着更为重要的角色,故由此可推测LFS海马可选择性调节脑内神经递质的释放,从而使GABA浓度相对升高更为明显,致使GABA、Glu之间的平衡发生变化,抑制性作用增强,从而抑制脑电的异常发放达到控制癫痫发作的治疗效果。而癫痫发作时已证实尚伴有其他神经递质的改变,如去甲肾上腺素、5-HT、多巴胺、乙酰胆碱等,是否电刺激也会引起这些神经递质的相应变化,尚需进一步研究。
LFS海马可增加刺激局部的GABA水平,调节GABA/Glu比值,使之升高,可能是LFS控制癫痫发作的作用机制之一。
4参考文献
[1] Velasco F,Velasco M,Ogarrio C,et al.Electrical stimulation of the centromedian thalamic nucleus in the treatment of convulsive seizures: A preliminary report[J]. Epilepsia, 1987(28):421-425.
[2] Tykocki T,Mandat T,Kornak A, et al. Deep brain stimulation for refractory epilepsy[J].Arch Med Sci, 2012(10):805-806.
[3] 刘智良,徐如祥,张新伟.点燃效应癫痫动物模型研究状况及评价[J].第一军医大学学报, 2001(8):621-623.
[4] West S,Nolan SJ,Cotton J,et al.Surgery for epilepsy [M].John Wiley & Sons Ltd, 2013:729.
[5] Jaseja H.Deep brain stimulation in intractable epilepsy: postulated optimal stimulation parameters[J]. Epilepsy Behav, 2013(29):597-601.
[6] Laxpati NG, Kasoff WS, Gross RE.Deep brain stimulation for the treatment of epilepsy: circuits,targets,and trials[J].Neurotherapeutics, 2014(11):508-511.
[7] Cukiert A, Cukiert CM, Burattini JA,et al. Seizure outcome after hippocampal deep brain stimulation in a prospective cohort of patients with refractory temporal lobe epilepsy [J].Seizure, 2014(23):6-11.
(2016-02-07收稿,2016-05-21修回)
中文编辑: 潘娅; 英文编辑: 刘华
*[基金项目]国家自然科学基金(81241129/H0913); 长江学者和创新团队发展计划资助项目(TRT13058)
[中图分类号]R742.1
[文献标识码]A
[文章编号]1000-2707(2016)07-0793-04
DOI:10.19367/j.cnki.1000-2707.2016.07.012
Influence of Low Frequency Electrical Stimulation on Glutamate and Gama-Aminobutyric Acid in Hippocampal Extracellular Fuid of Rats with Drug Resistant Epilepsy
TANG Taifeng1, WU Guofeng2
(1.DepartmentofNeurology,theSecondPeople'sHospitalofGuiyangCity,Guiyang550081,Guizhou,China; 2.DepartmentofNeurology,theAffiliatedHospitalofGuizhouMedcialUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To observe the influence of low frequency electrical stimulation (LFS) of hippocampus on glutamate(Glu) and Gama-Aminobutyric Acid (GABA) in brain tissues of amygdala kindling epilepsy rat model. Methods: 60 healthy male SD rats were selected to make the amygdala kindling epilepsy model. Amygdala kindling rats were screened by Pheytoin sodium and Phenobarbital for their drug resistance. The rats with clear drug resistance received LFS treatment. Hippocampal brain microdialysate liquid was collected before and after LFS treatment and HPLC was adopted to detect Glu and GABA content. Results: 7 amygdale kindling rats with drug resistance were obtained through screening. Among the 7 selected rats with drug resistance, GABA concentration was (29.114±7.236 2) mg/L before LFS compared with (37.13±7.622 5) mg/L after LFS, and the differences were statistically significant (P<0.05). Glu concentration was (2 527.742 0±514.831 1) mg/L before LFS compared with (2 243.906 0±329.277 8) mg/L after LFS, with Glu concentration showing a reducing trend but no significant differences(P>0.05). However, the ratio of GABA/Glu was 0.011 63±0.002 34 before LFS compared with 0.016 50±0.002 36 after LFS, and the differences were statistically significant(P<0.05). Conclusions: LFS on hippocampus can increase the level of GABA and ratio of GABA to Glu, which may be one of mechanisms to suppress the epileptic seizure.
[Key words]epilepsy; drug resistance; electric stimulation therapy; hippocampus; glutamate; gama-aminobutyric acid; microdialysis; chromatography; HLPC,high pressure liquid
网络出版时间:2016-07-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160717.1318.024.html
