Irx5a在野生型斑马鱼早期发育中的表达*
2016-08-01舒莉萍何志旭丁可军
舒莉萍, 何志旭, 许 威, 丁可军
(1.贵州医科大学 组织工程和干细胞实验中心, 贵州 贵阳 550004; 2.贵州医科大学 实验动物中心, 贵州 贵阳 550004; 3.贵州医科大学 免疫学教研室, 贵州 贵阳 550004; 4.贵州医科大学 儿科学教研室, 贵州 贵阳 550004)
Irx5a在野生型斑马鱼早期发育中的表达*
舒莉萍1,2,3, 何志旭1,4**, 许威4, 丁可军4
(1.贵州医科大学 组织工程和干细胞实验中心, 贵州 贵阳550004; 2.贵州医科大学 实验动物中心, 贵州 贵阳550004; 3.贵州医科大学 免疫学教研室, 贵州 贵阳550004; 4.贵州医科大学 儿科学教研室, 贵州 贵阳550004)
[摘要]目的: 观测Irx5a基因在Tuebingen野生型斑马鱼胚胎发育过程中的表达。方法: 利用Trizol法提取斑马鱼胚胎的总RNA,应用RT-PCR方法扩增Irx5a 基因,将其克隆入pCS2+质粒中,经菌落PCR、双酶切法及DNA测序鉴定正确后,利用体外转录体系制备Irx5a的反义mRNA探针;用该反义mRNA探针进行斑马鱼全胚胎原位杂交。结果: 构建和鉴定了Irx5a-pCS2+重组质粒,经斑马鱼全胚胎原位杂交检测Irx5a基因的表达,发现从3.7 hpf开始有表达,并且在胚胎神经系统和造血系统都有明显表达。结论: Irx5a基因可能参与了Tuebingen野生型斑马鱼胚胎发育早期的神经系统和造血系统的发育。
[关键词]Irx5a; pCS2+质粒; DNA,重组; RNA探针; 全胚胎原位杂交技术
Irx基因(Iroquoisgene)是Bosse等[1]于1996年在研究果蝇的外部感知器官形成过程中最早发现的一类重要的同源盒基因家族,主要有Irx1、Irx2、Irx3、Irx4、Irx5和Irx6共6个家族成员,其中Irx5在早期胚胎发育过程中起重要作用,主要与肺组织分化及视网膜视锥细胞形成有关[2-3]。Irx5对小鼠的心肌发育也有重要作用[4],但其作用机制尚不明确。本研究以斑马鱼作为研究对象,构建pCS2+-Irx5a重组质粒,通过体外转录获得Irx5a基因的地高辛标记的反义mRNA探针,并用全胚胎原位杂交技术(whole mount in situ hybridization,WISH)检测了Irx5a基因在野生型Tuebingen斑马鱼发育过程中的基因表达,探讨Irx5a基因在斑马鱼发育过程中的作用。
1材料与方法
1.1实验动物与试剂
野生型Tuebingen斑马鱼系,养殖在带有过滤消毒系统、(28±2)℃恒温的循环水系统, 光照时间12 h/d[5],课题组自行繁育。pCS2+质粒和DH5α菌株由本研究中心留存、PCR引物由北京三博远志生物有限公司合成,Trizol、First-strand plus kit购于Invitrogen公司;质粒小抽试剂盒购于Axygen公司,DNA凝胶回收试剂盒购于上海申能公司,BamH I和EcoR I内切酶、T4连接酶均购于FBI公司,KOD DNA聚合酶购于TOYOBO公司,T3 RNA polymease和spin column购于Ambion公司,地高辛RNA标记和检测试剂盒及NucAwaylM Spin Columns购于Ambion公司,BCIP/NBT购于VECTOR Lab。
1.2方法
1.2.1斑马鱼胚胎总RNA提取分别收集受精后0.75~72 h(hours post-fertilization,hpf)不同时相的Tuebingen野生型斑马鱼胚胎, 胚胎脱膜后,收集于1.5 mL的Epp管中,移入1 mL Trizol将其充分匀浆, 室温下放置5 min,用酚氯仿法提取总RNA,75%乙醇洗涤,加入适量DEPC水溶解,冷冻保存备用。
1.2.2Irx5a基因扩增采用逆转录-PCR(RT-PCR)方法,以抽提的斑马鱼总RNA为模板,利用SuperScriptTMⅢ First-Strand Systhesis System kit的随机引物进行逆转录,反应在AG22331型热循环仪(eppendorf公司)上按试剂盒说明操作步骤进行。扩增Irx5a目的基因,PCR上下游引物分别引入BamH I及EcoR I酶切位点。上游引物(F)序列为5′-CGGGATCCTATGGAGACCCAGCTT-3′,下游引物(R)序列为5′-CGGAATTCAGAACGGAGGGAGAGG-3′;以逆转录得到的cDNA为模板,进行Irx5a的RT-PCR扩增,扩增条件为:40 ℃ 30 min,94 ℃预变性5 min,94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸2 min,共30次循环,72 ℃最后延伸10 min, PCR产物经1.5%琼脂糖凝胶电泳后,以DNA胶回收试剂盒回收进行胶Irx5a扩增产物。
1.2.3Irx5a体外转录载体的构建将上述回收的Irx5aPCR产物片段及pCS2+质粒分别用BamH I及EcoR I双酶切,经电泳割胶回收后,用T4 DNA连接酶进行连接反应。将连接产物运用钙转法转入大肠杆菌E.coliDH5α感受态,经氨苄抗性筛选出阳性克隆并扩增后,运用碱裂解法提取Irx5a-pCS2+重组质粒。
1.2.4Irx5a-pCS2+重组质粒的鉴定分别用以下3种方法对Irx5a-pCS2+重组质粒进行鉴定:(1)用BamH I和EcoR I对Irx5a-pCS2+重组质粒双酶切后,琼脂糖凝胶电泳鉴定;(2)加入1.2.2项下提及的引物,对阳性克隆进行菌落PCR扩增, 通过琼脂糖凝胶电泳判断扩增产物大小;(3)将Irx5a-pCS2+重组质粒DNA送北京三博远志公司进行在测序鉴定。
1.2.5地高辛标记的Irx5a反义mRNA探针制备将Irx5a-pCS2+重组质粒用BamH I进行单酶切,经1%琼脂糖凝胶电泳鉴定后,用DNA纯化试剂盒割胶回收得到线性化的Irx5a-pCS2+重组质粒。利用体外转录体系,以线性化的Irx5a-pCS2+重组质粒DNA为模板,以地高辛标记的寡核苷酸为原料,经体外转录得到地高辛标记的Irx5a反义mRNA探针后,用NucAwayTMSpin Columns纯化吸附柱回收Irx5a反义mRNA探针,经2%琼脂糖凝胶电泳鉴定后,于-70 ℃保存备用。
1.2.6斑马鱼全胚胎原位杂交选取0.75~72 hpf不同时间点野生型斑马鱼胚胎进行全胚胎原位杂交,用1×PBST溶液洗去固定液,甲醇进行梯度脱水,将胚胎置于68 ℃杂交炉中进行预杂交1 h,加入制备好的地高辛标记的Irx5a反义mRNA探针,于68 ℃杂交炉中过夜,用不同浓度的SSCT将多余的探针洗去,加入地高辛标记的抗体后过夜,用MABT将多余的抗体洗掉,加入BCIP/NBT染液对杂交胚胎进行染色,在体视显微镜下观察并记录结果后,用固定液对杂交胚胎进行再固定并且照相。
2结果
2.1Irx5a目的基因
经1.5%琼脂糖凝胶电泳检测PCR产物,在500~600 bp处见一特异扩增条带,与预期511 bp片段大小一致(图1)。
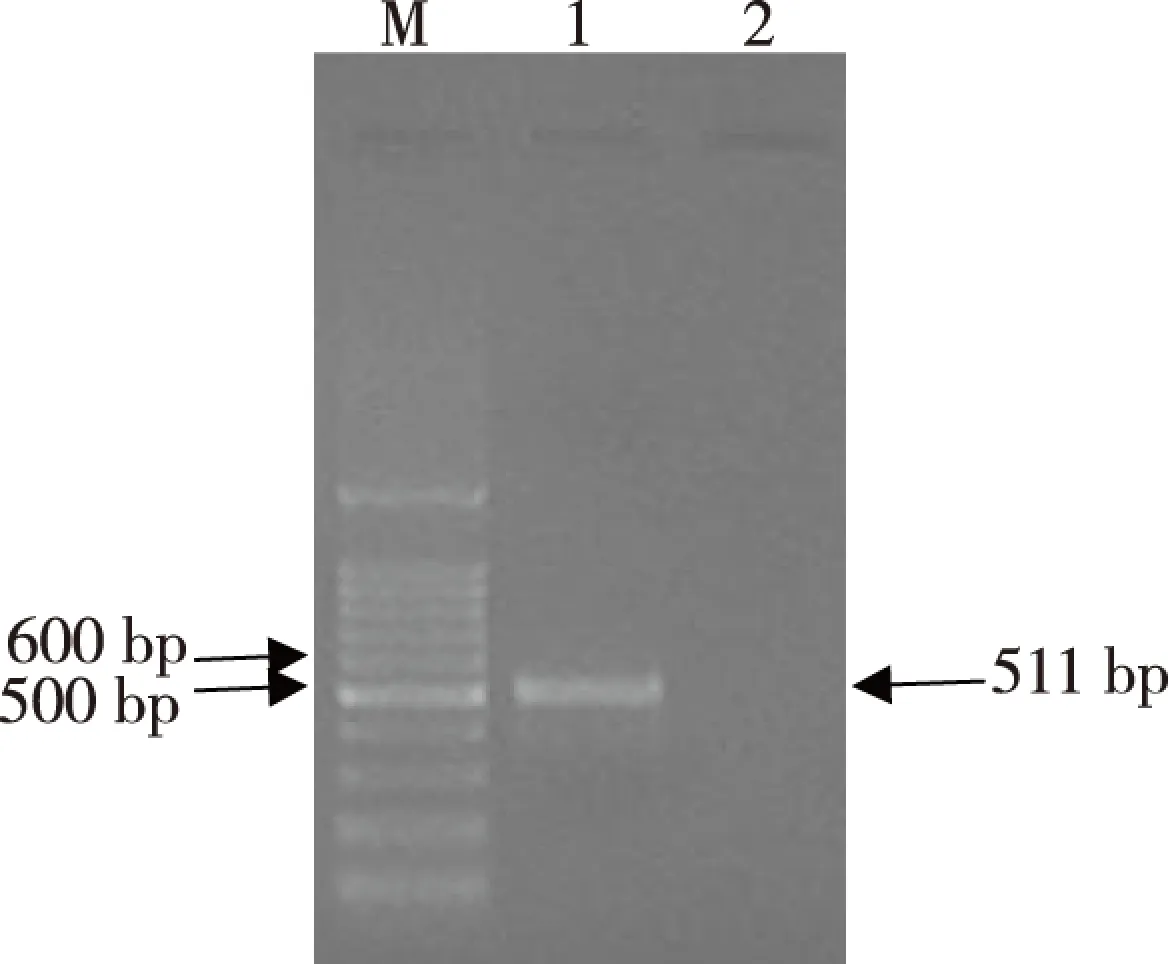
注:M为DNA Marker,1为PCR扩增产物,2为空白对照图1 RT-PCR扩增Irx5a基因琼脂糖凝胶电泳Fig.1 Results of agarose gel electrophoresis of RT-PCR amplified Irx5a gene
2.2Irx5a-pCS2+重组质粒鉴定
Irx5a-pCS2+重组质粒DNA经BamH I及EcoR I双酶切后,酶切产物经1.5%琼脂糖凝胶电泳得到一大小约为511 bp的片段,与RT-PCR产物大小一致,而另一片段大小与空质粒酶切得到的片段大小一致(图2)。将重组质粒Irx5a-pCS2+作为模板进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳,可见500~600 bp之间有一特异性条带(图3),与预期的511 bp相符。重组质粒Irx5a-pCS2+测序结果经检索比对,与斑马鱼Irx5a的基因序列及方向正确,见图4。
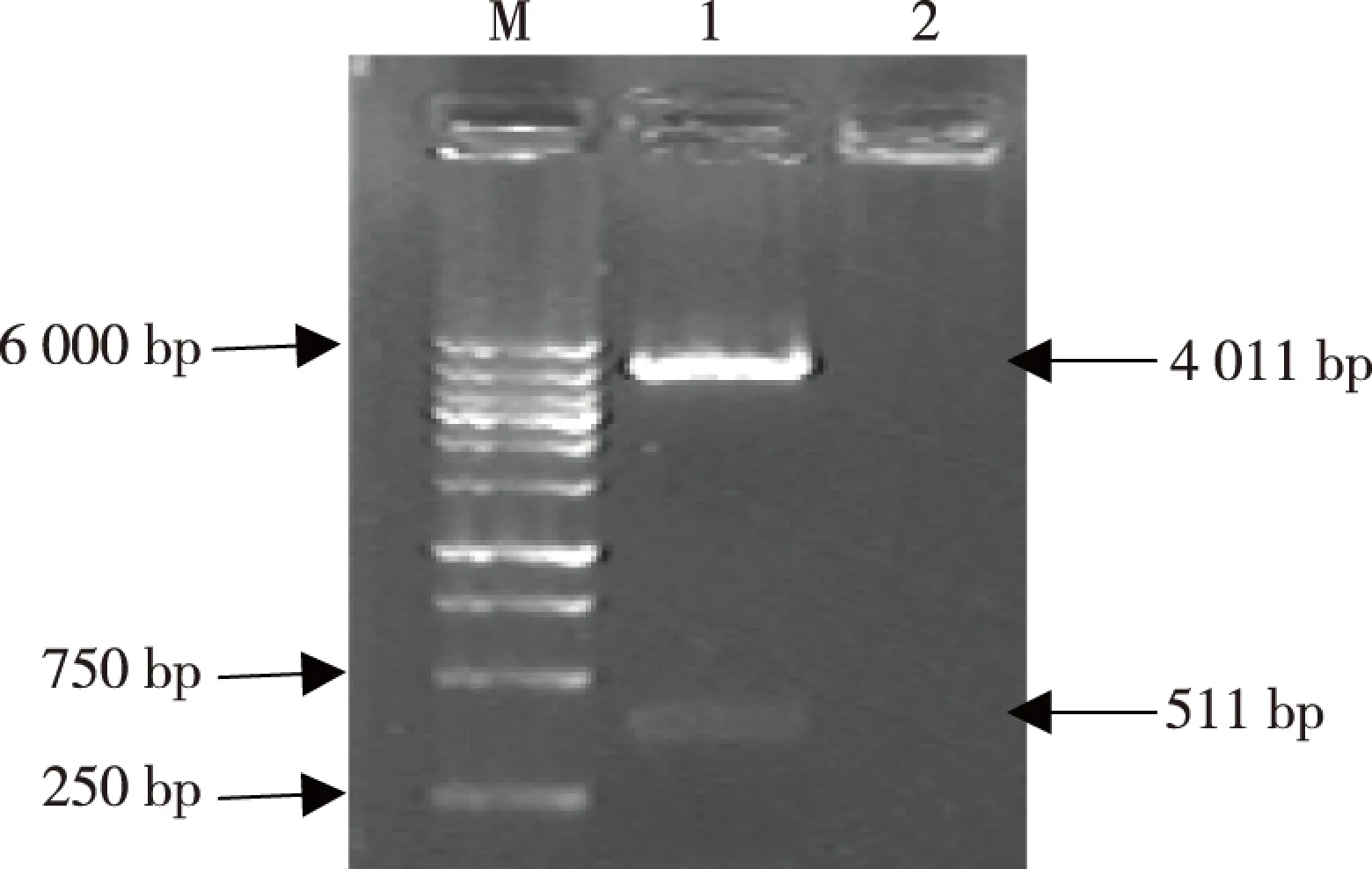
注:M为DNA Marker,1为 Irx5a-pCS2+重组质粒经BamH I及EcoR I双酶切产物,2为空白对照图2 Irx5a-pCS2+重组质粒经BamH I及EcoR I双酶切产物的琼脂糖凝胶电泳Fig.2 Results of agarose gel electrophoresis of BamH I and ECOR I double enzyme digestion of recombinant plasmid Irx5a-pCS2+
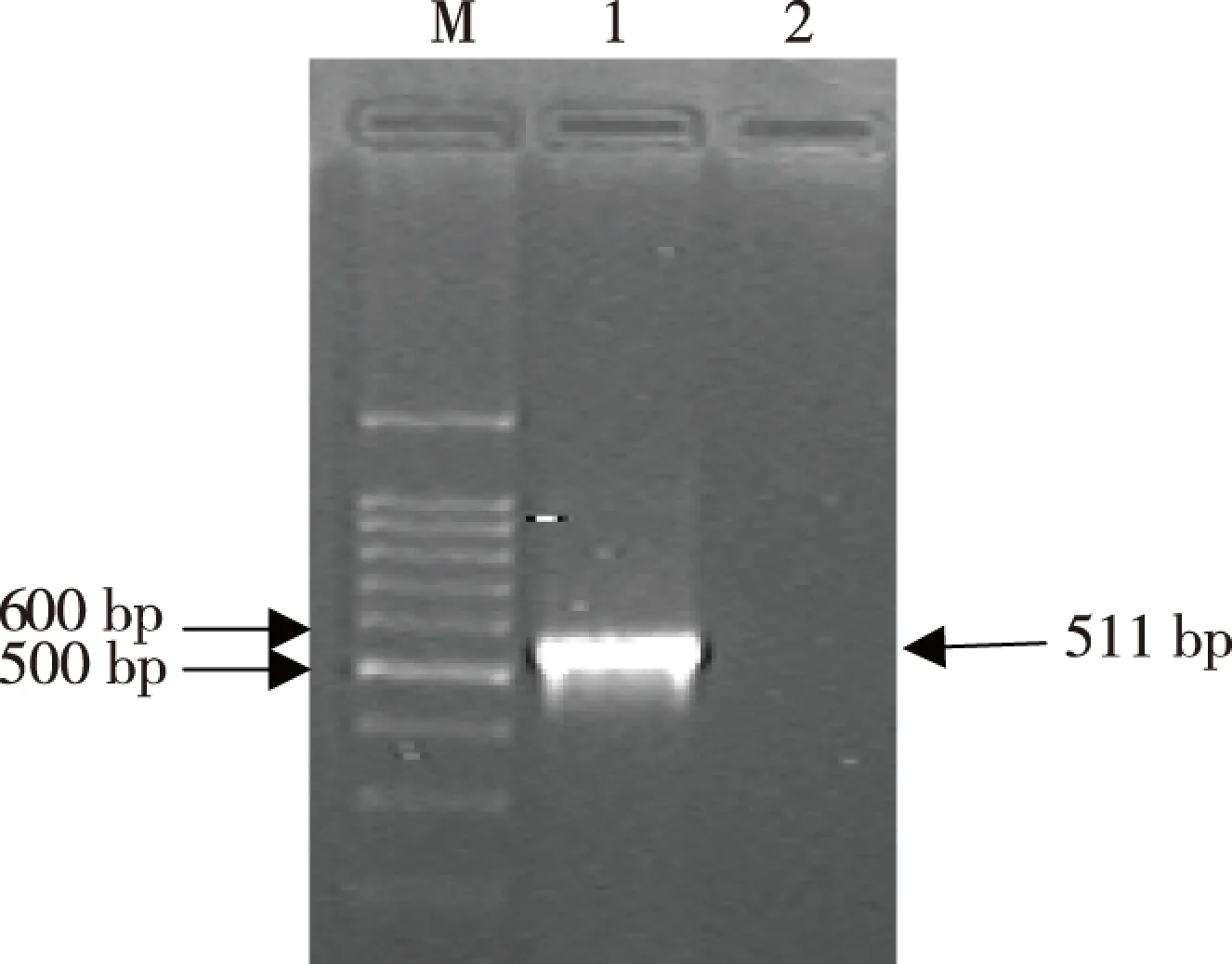
注:M为DNA Marker,1为菌落PCR产物,2为空白对照图3 菌落PCR产物的琼脂糖凝胶电泳Fig.3 Bacterial colony PCR analysis of recombinant plasmid Irx5a-pCS2+
2.3斑马鱼全胚胎原位杂交
0.75~72 hpf的Tuebingen野生型斑马鱼胚胎的原位杂交结果显示, 3.7 hpf可以观察到Irx5a基因的表达信号(箭头所示),9、12 hpf斑马鱼胚胎后脑神经板及腹部中胚层可观察到明显的阳性杂交信号,18 hpf胚胎中脑、间脑、后脑、咽弓及侧板中胚层可观察到阳性杂交信号,24、30、36及48 hpf斑马鱼胚胎中脑、间脑、后脑、咽弓、脊索、耳泡囊及脊髓可见黑色的阳性杂交信号,72 hpf斑马鱼胚胎中脑、间脑、后脑、耳泡囊及视网膜神经节细胞层可见黑色的阳性杂交信号。见图5。
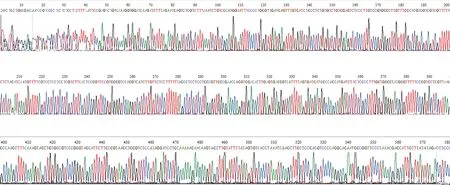
图4 Irx5a-pCS2+重组质粒测序结果Fig.4 Gene sequencing analysis of recombinant plasmid Irx5a-pCS2+
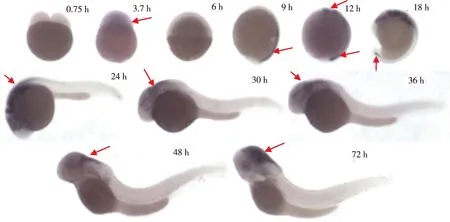
图5 0.75~72 hpf野生型斑马鱼胚胎Irx5a基因表达谱Fig.5 Expression pattern of Irx5a in 0.75~72 hpf of wild type zebrafish embryo
3讨论
斑马鱼是从上世纪末开始新兴的模式生物,其体外受精并发育,并且早期发育胚胎通体透明,有利于进行胚胎动态地活体观察和科学研究[6-8],这些重要优势为研究观察生物早期组织器官的发生和形成,以及胚胎早期的生长发育提供便利。
本研究首先提取野生型斑马鱼胚胎总RNA,经RT-PCR克隆得到Irx5a基因片段,通过限制性内切酶将其定向插入到pCS2+载体中,经菌落PCR、双酶切及DNA测序鉴定,证实插入的Irx5a目的基因片段大小和方向正确无误,成功获得Irx5a-pCS2+重组质粒。接着将Irx5a-pCS2+重组质粒通过体外转录得到了地高辛标记的Irx5a反义mRNA探针,通过WISH, 对Tuebingen野生型斑马鱼胚胎Irx5a基因的表达情况进行了检测和观察。通过WISH从整体水平上反映了胚胎发育过程中Irx5a基因表达的时空顺序。
Irx基因作为一个古老的基因家族在进化过程中高度保守。Irx5基因在斑马鱼分为Irx5a、Irx5b两个基因,分别定位于斑马鱼的第8和13号染色体。根据产物蛋白质氨基酸序列近似性以及染色体定位分析,Irx5a与人类、小鼠的Irx5基因同源性更为接近。以往的研究提示,Irx5基因可能与小鼠神经系统发育、心肌发育、肺泡表面物质的形成等都有密切的关系[9-12],但是该基因在发育过程中确切的表达谱以及生物学功能迄今为止仍不清楚。鉴于此,本研究旨在了解Irx5a在斑马鱼发育过程中的表达情况。本研究发现, 0.75 hpf斑马鱼胚胎细胞发生了第1次有丝分裂期,没有观察到Irx5a基因的表达,提示Irx5a基因可能未参与胚胎单细胞首次分裂为2细胞的过程;在3.7 hpf的胚胎中观察到有表达,提示Irx5a基因可能是母源性基因, 6 hpf斑马鱼胚胎逐渐向三个胚层开始分化,9 hpf是斑马鱼第1个体节形成期,Irx5a基因持续有表达,其表达位置主要在腹部中胚层;斑马鱼原始造血初期(12 hpf),Irx5a基因表达位置主要在后脑神经节及腹部中胚层,而腹部中胚层是原始造血初期造血组织的重要起始位置; 18 hpf观察到Irx5a基因在斑马鱼胚胎中脑、间脑、后脑、咽弓及侧板中胚层高表达,以及在尾部的动静脉血管丛低表达,其中侧板中胚层是早期巨噬细胞及其它髓系细胞的前体的起源区,与原始造血发育密切相关; 24、30及36 hpf斑马鱼胚胎的Irx5a基因主要在中脑、间脑、后脑等神经组织中表达;在初步具有成鱼相关组织形态及器官功能的48和72 hpf斑马鱼胚胎中Irx5a基因在中脑、间脑、后脑、耳泡囊表达强度较高,在72 hpf斑马鱼胚胎Irx5a基因在视网膜神经节细胞层表达。综上,Irx5a基因系母源性基因,其在胚胎发育过程中贯穿于整个神经系统的发育时期,其对神经系统的发育可能发挥着重要作用;Irx5a基因同样在原始造血过程中的重要造血组织中高表达,这就提示Irx5a基因可能参与斑马鱼原始造血的发育;同时,在视网膜神经节细胞开始发育的72 hpf斑马鱼胚胎Irx5a基因在视网膜神经节细胞层的表达,结合与往的研究对视网膜双极细胞分化影响的研究,充分说明Irx5a基因在促进视网膜神经节细胞分化、发育过程中起重要作用,为进一步研究Irx5a的功能奠定了重要的理论基础。
4参考文献
[1] Bosse A, Stoykova A, Nieselt-Struwe K, et al. Identification of a novel mouse Iroquois homeobox gene, Irx5, and chromosomal localisation of all members of the mouse Iroquois gene family[J]. Dev Dyn, 2000 (1):160-174.
[2] Cheng CW, Chow RL, Lebel M, et al. The Iroquois homeobox gene, Irx5, is required for retinal cone bipolar cell development[J]. Dev Biol, 2005 (1):48-60.
[3] Van Tuyl M, Liu J, Groenman F, et al. Iroquois genes influence proximo-distal morphogenesis during rat lung development[J]. Am J Physiol Lung Cell Mol Physiol, 2006 (4):L777-L789.
[4] Costantini DL, Arruda EP, Agarwal P, et al. The homeodomain transcription factor Irx5 establishes the mouse cardiac ventricular repolarization gradient[J]. Cell, 2005 (2):347-358.
[5] Zhou T, Wang L, Zhu KY, et al. Dominant-negative C/ebpα and polycomb group protein Bmi1 extend short-lived hematopoietic stem/progenitor cell life span and induce lethal dyserythropoiesis[J]. Blood, 2011(14):3842-3852.
[6] Shu LP, Zhou ZW, Zhou T, et al.Ectopic expression of Hoxb4a in hemangioblasts promotes hematopoietic development in early embryogenesis of zebrafish[J]. Clin Exp Pharmacol Physiol, 2015 (11):1275-1286.
[7] He ZX, Shu LP, Yang XY,et al. The Role of rap1b in Hoxb4 Transgenic Zebrafish Line[J]. Blood, 2011(21): 3413.
[8]舒莉萍,何志旭,姚冬静,等.野生型斑马鱼胚胎中hoxd3基因mRNA的表达谱[J].浙江大学学报:医学版, 2012(1):69-74.
[9] Theokli C, Morsi El-Kadi AS, Morgan R. TALE class homeodomain gene Irx5 is an immediate downstream target for Hoxb4 transcriptional regulation[J]. Dev Dyn, 2003 (1):48-55.
[10]Myrthue A, Rademacher BL, Pittsenbarger J, et al. The iroquois homeobox gene 5 is regulated by 1,25-dihydroxyvitamin D3 in human prostate cancer and regulates apoptosis and the cell cycle in LNCaP prostate cancer cells[J]. Clin Cancer Res, 2008 (11):3562-3570.
[11]Bonnard C, Strobl AC, Shboul M, et al. Mutations in IRX5 impair craniofacial development and germ cell migration via SDF1[J]. Nat Genet, 2012 (6):709-713.
[12]Wu Y,Davison J,Qu X, et al. Methylation profiling identified novel differentially methylated markers including OPCML and FLRT2 in prostate cancer[J]. Epigenetics, 2016 (4): 247-258.
(2016-05-30收稿,2016-06-29修回)
中文编辑: 吴昌学; 英文编辑: 刘华
*[基金项目]国家自然科学基金(31260284); 贵州省科技基础条件平台项目[2009-4005 ]; 贵州省优秀科技省长专项基金(S2008-4)
[中图分类号]P321-33
[文献标识码]A
[文章编号]1000-2707(2016)07-0755-05
DOI:10.19367/j.cnki.1000-2707.2016.07.003
Expression ofIrx5aGene in Early Development of Wide Type Zebrafish
SHU Liping1,2,3, HE Zhixu1,4, XU Wei4, DING Kejun4
(1.TissueEngineeringandStemCellResearchCenter,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China;2.ExperimentalAnimalCenter,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.DepartmentofImmunology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 4.DepartmentofPediatrics,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To observe the expression of Irx5a gene in early development of the wild type zebrafish embryo of with whole mount in situ hybridization(WISH). Methods: Total RNA of zebrafish embryos in different development stage was extracted by Trizol. The cDNA of Irx5a gene was amplified by RT-PCR, and then cloned into pCS2+vector by BamH I and EcoR I restrictive enzyme sites. The recombinant gene was identified and confirmed by bacterial colony PCR, double enzyme digestion and DNA sequencing. Antisense mRNA probes of Irx5a gene was prepared by in vitro transcription system and underwent whole mount in situ hybridization with zebrafish embryos. Results: Irx5a-pCS2+recombinant plasmid was constructed and identified. After whole mount in situ hybridization, it was observed that Irx5a mRNA was expressed from 3.7hpf and highly expressed in embryonic nervous system and hematopoietic system. Conclusion: Irx5a gene may be involved in the development of nervous system and hematopoietic system in the early stage of Tuebingen wild type zebrafish embryo development.
[Key words]Irx5a; pCS2+plasmid; DNA, recombination; RNA probe; whole mount in situ hybridization
**通信作者 E-mail:hzx@gmc.edu.cn
网络出版时间:2016-07-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160717.1318.046.html
