胚性愈伤率不同的普通小麦成熟胚生化及形态特性的差异
2016-07-29雒盼妮王志成王勇锋崔桂宾张舒梦
雒盼妮,王志成,王勇锋,崔桂宾,张舒梦,
胚性愈伤率不同的普通小麦成熟胚生化及形态特性的差异
雒盼妮1,王志成2,王勇锋1,崔桂宾1,张舒梦1,
杨国玉1,孙风丽1,张 超1,刘曙东1,奚亚军1
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.陇县种子管理站,陕西陇县 721200)
摘要:胚性愈伤率直接决定组织培养中植物再生的效率。为探究胚性愈伤率诱导效果不同的普通小麦成熟胚之间的差异性,以根据胚性愈伤率诱导效果高低所取得的共10种小麦基因型的成熟胚为材料,分别对可溶性糖、可溶性蛋白、纤维素、谷胱甘肽和游离氨基酸5种生化指标进行测定与分析,并利用实体显微镜和石蜡切片的方法分别观察10种小麦基因型成熟胚的外部形态和内部结构。生化指标测定结果显示,两类小麦成熟胚的可溶性蛋白和纤维素含量存在显著性差异,而可溶性糖、谷胱甘肽和游离氨基酸含量在两者间差异并不显著。相关性分析发现,小麦成熟胚胚性愈伤率与纤维素含量存在极显著正相关,与可溶性蛋白含量存在显著负相关。在对外部形态进行的观察中,发现两类小麦成熟胚的高度之间存在显著性差异。而对内部结构进行的观察中,并未发现两类小麦成熟胚之间存在显著性差异。
关键词:普通小麦;成熟胚;胚性愈伤组织;差异性
转基因技术具有打破种间隔离限制、缩短育种年限等优点,在品种改良方面存在十分广阔的应用前景[1]。到目前为止,世界各国已成功培育了大约200多种转基因植物,其中,棉花、大豆、油菜、玉米和马铃薯等一些作物的转基因品种在生产上已开始大面积推广应用,并且取得了一定的经济效益[2]。小麦是世界上种植面积最大和分布范围最广的粮食作物,开展其转基因技术研究具有十分重要的意义。目前,植物转基因受体主要采用外植体经脱分化得到的愈伤组织。诱导小麦愈伤组织的外植体包括幼胚、幼穗、花药、成熟胚、幼叶、种子、子房、茎尖和根尖分生组织等[3-4],其中,幼胚被认为是十分理想的外植体材料,其愈伤组织的诱导率及植株的再生率均相对较高[5]。目前获得转基因小麦植株的报道多以幼胚或幼胚诱导的愈伤组织为受体[6]。然而,由于小麦幼胚的取材受到季节的限制,并且适当的取材时期、所取材料的状态和发育阶段的一致性很难得到保障,这在某些程度上就影响了小麦的转基因研究。而小麦成熟胚因为取材方便,不受生长季节、发育阶段等因素约束,并且不同个体间生理状态都具有一致性,所以被认为是进行小麦遗传转化最为方便的外植体[7]。
在小麦成熟胚离体培养过程中,愈伤组织质量特别是胚性愈伤率的高低存在较大的基因型差异。目前已有众多报道从小麦成熟胚培养方式、培养基类型、激素种类与浓度、继代方式及次数和基因型等方面研究了小麦成熟胚愈伤组织诱导的影响因素[8-10]。研究发现,不同基因型小麦成熟胚诱导的胚性愈伤率差异极为显著,从0到67.8%不等[11],但目前国内外关于成熟胚特性与胚性愈伤率是否具有相关性的研究尚未见报道。本研究根据本课题组研究结果挑选出胚性愈伤率高(大于43%)、低(小于10%)的两类小麦基因型各5个[11],分别对其成熟胚的生化指标、外部形态结构和内部细胞结构进行测定和观察,探索胚性愈伤率诱导效果不同的小麦成熟胚之间是否存在差异,以期为小麦和其他植物组织培养及其转基因技术的发展提供参考。
1材料与方法
1.1试验材料
供试材料共计10份,包括CW2、90(147)-1、SQ04、9129、宝丰228、QX2、ZMD4、S534、091和西农2208,其中,前5份(第Ⅰ类)为本研究所选的胚性愈伤率高的小麦基因型材料,胚性愈伤率分别为67.80%、46.49%、44.44%、43.93%和43.53%;后5份(第Ⅱ类)为本研究所选的胚性愈伤率低的小麦基因型材料,胚性愈伤率分别为9.55%、9.15%、8.18%、4.97%和2.33%,所有材料均于2013年6月收获,并由西北农林科技大学农学院小麦分子育种课题组保存。
1.2试验方法
1.2.1成熟胚的获取
取两类共10份基因型材料的成熟种子,用刀片切取成熟胚并剔除胚乳。
1.2.2成熟胚生化指标的测定
将成熟胚研磨过筛(40目)后,采用蒽酮硫酸法测定可溶性糖含量和纤维素含量[12],考马斯亮蓝G-250染色法测定可溶性蛋白质含量[12],DTNB法测定谷胱甘肽含量[13],茚三酮法测定游离氨基酸含量[14]。测定每个生化指标时,每个基因型的成熟胚称取0.2 g(大约70个胚),且重复3次。
1.2.3成熟胚的外部形态结构观察
利用连续变倍实体显微镜SMZ1500观察两类小麦成熟胚的形态结构。利用ImageJ对图片上成熟胚的长、宽、高以及面积进行测量,所测量指标均重复5次。
1.2.4成熟胚的内部显微结构观察
利用石蜡切片的方法,根据小麦成熟胚的硬度将切片厚度定为8 μm,并放大40倍观察两类小麦成熟胚的内部结构[15]。
1.3数据处理
利用Excel 2010对数据进行整理和图表的绘制,使用SPSS v19.0进行数据的统计分析。
2结果与分析
2.1两类小麦成熟胚生化指标的差异及其与胚性愈伤率的相关性
成熟胚占小麦籽粒的1.4%~3.9%,其中含有大量的营养物质,包括蛋白质、谷胱甘肽、不饱和脂肪酸、碳水化合物、矿物质和纤维素等[16-17]。从表1可以看出,第Ⅱ类小麦成熟胚的可溶性蛋白质含量显著高于第Ⅰ类的小麦成熟胚。可溶性糖含量在两类成熟胚中的变化没有明显规律。两类小麦成熟胚相比,纤维素含量存在显著性差异,且第Ⅰ类的成熟胚中的纤维素含量显著高于第Ⅱ类成熟胚。游离氨基酸含量在两类成熟胚之间并没有明显规律。谷胱甘肽含量在各基因型中变化较大,在两组成熟胚内部各基因型之间差异比较显著。
将各指标测定结果与胚性愈伤率做相关性分析,发现10份材料中可溶性蛋白质含量与胚性愈伤率呈显著的负相关(P=0.01,P<0.05),纤维素含量与胚性愈伤率呈极显著的正相关(P=0.002,P<0.01),其他生化指标的测定结果与胚性愈伤率的相关性均未达到显著水平。
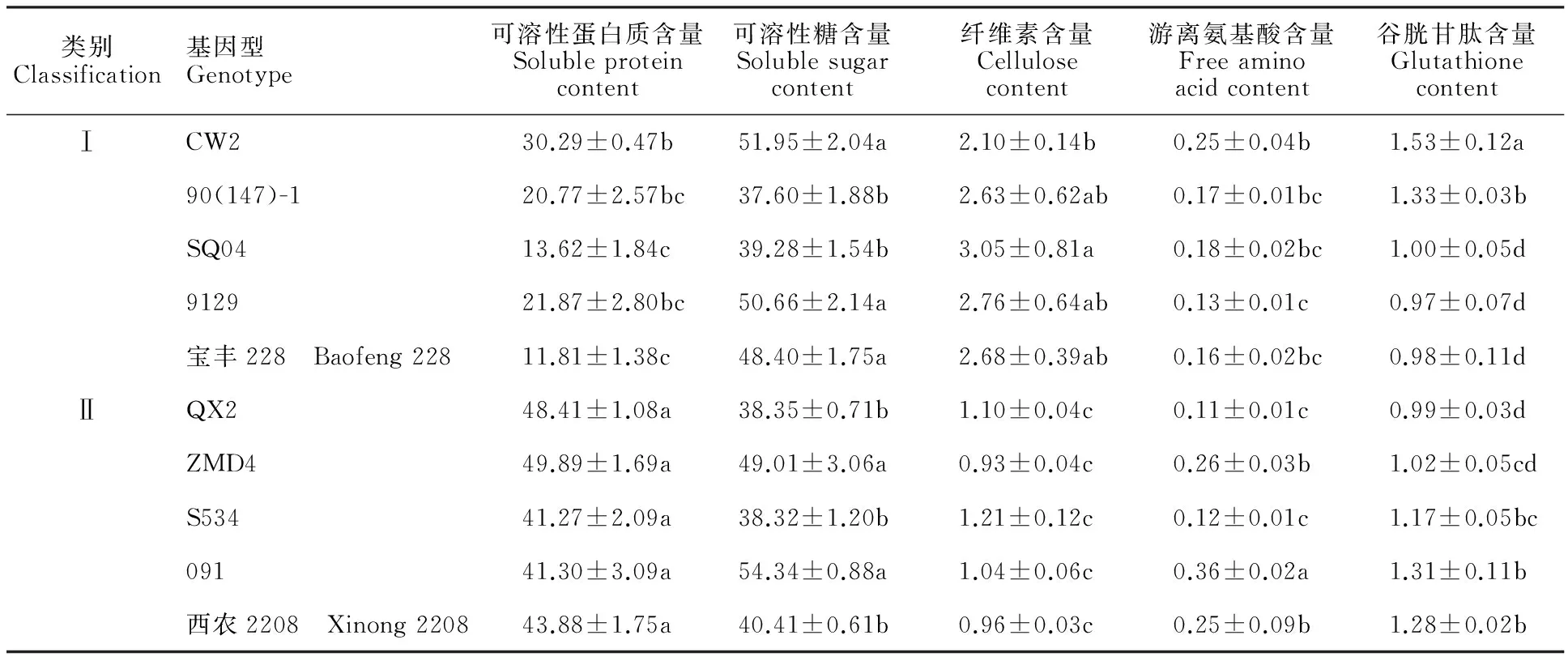
表1 10个小麦基因型成熟胚生化指标测定结果的多重比较
同列数字后不同字母表示不同材料间差异在0.05水平上显著;DW表示干重。下表同
Different lower-case letters indicate significant differences among different materials at 0.05 level; DW indicates dry weight. The same as below
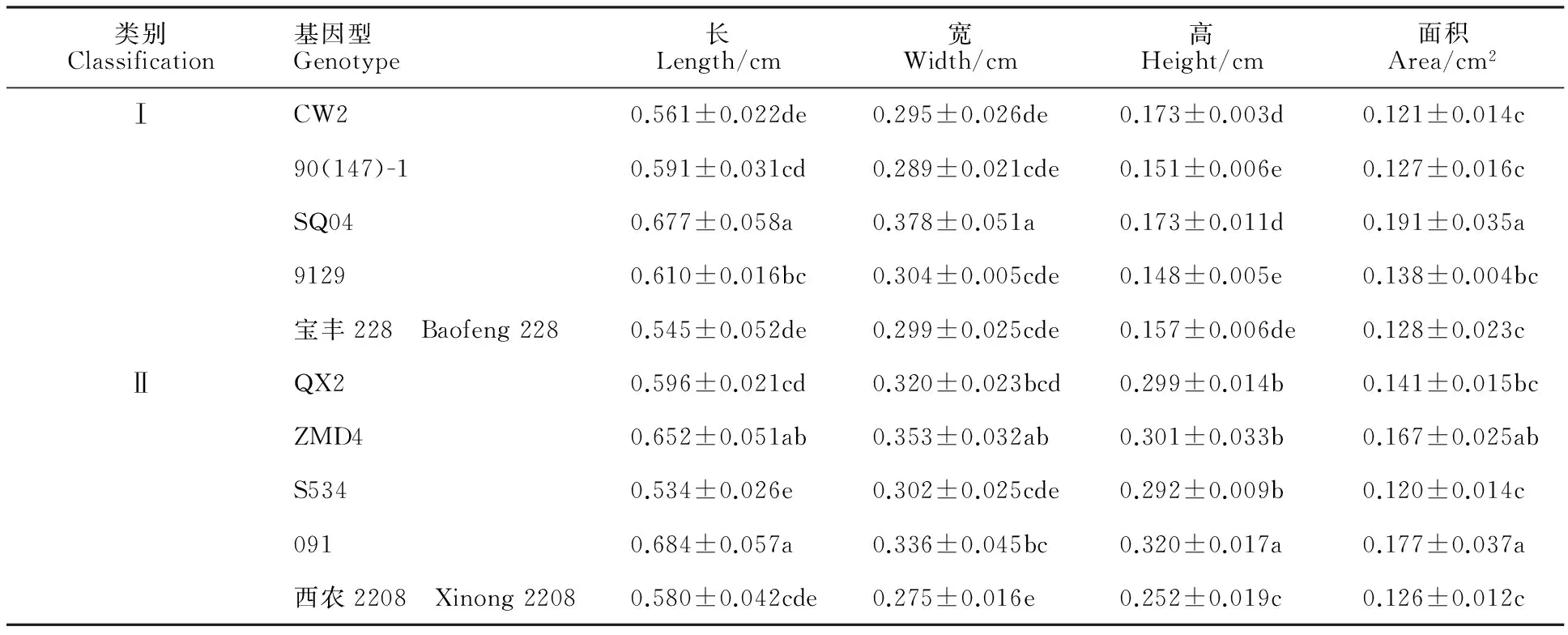
表2 10个小麦基因型成熟胚长、宽、高和面积测定结果的多重比较
2.2两类小麦成熟胚外部形态结构的差异
从外部形态整体观察来看,小麦第Ⅰ类与第Ⅱ类成熟胚之间无明显差异(图1)。利用ImageJ对各个基因型成熟胚的长、宽、高和面积进行统计,发现10种小麦成熟胚的长、宽、高和面积之间存在显著差异,其中,仅有成熟胚的高在两类基因型间差异显著(表2)。图2是小麦成熟胚的侧面观察结果,从侧面图中可以清楚观察到小麦成熟胚的胚芽、胚轴和胚根。由于基因型不同,成熟胚内部的颜色也有所不同。基因型90(147)-1、9129、QX2、S534、091和西农2208的成熟胚颜色偏白,其他4种基因型成熟胚的颜色偏透明。
2.3成熟胚的内部显微结构差异
从图3中可以看出,两类小麦成熟胚的盾片、胚芽鞘、胚芽和胚根并无明显差异,成熟胚的细胞均表现致密均匀且排列有序。

比例尺长度为100 μm;a~j分别表示CW2、90(147)-1、SQ04、9129、宝丰228、QX2、ZMD4、S534、091和西农2208。图2中同
Scale bar is 100 μm; a to j indicate CW2,90(147)-1,SQ04,9129,Baofeng 228,QX2,ZMD4,S534,091 and Xinong 2208,respectively. The same as in Fig.2
图1小麦成熟胚实体显微镜观察图
Fig.1 Wheat mature embryos observed by steromicroscope
3讨 论
在植物组织培养研究中,人们更多关注的是怎样筛选合适的基因型[18-20],或者是如何调整培养基基本成分[21-22]以及外源激素的种类与浓度[23-24]来获得更多的胚性愈伤组织,而外植体的状态关注较少。本研究对小麦成熟胚的部分生化指标进行测定,且利用植物显微技术对小麦成熟胚的外部形态及内部结构进行观察,发现胚性愈伤率不同的小麦成熟胚之间存在一定差异。在白皮松的相关研究中,胚性愈伤组织的可溶性蛋白含量明显高于非胚性愈伤组织,这表明胚性愈伤组织在形成的过程中代谢十分旺盛,从培养基中获得的各种成分后,将它们转变为能量和细胞的组成物质,并大量的积累蛋白质,为后期细胞分化做好准备[25]。本研究所用的愈伤组织外植体为小麦成熟胚,它的蛋白质含量相对较高,占整个麦胚的26.0%~31.5%[26],其中20%~40%属于膜蛋白,其他的蛋白质多以各种酶的形式存在,比如氧化还原酶、转移酶、水解酶、裂解酶和连接酶等。它们主要为种子萌发提供能量,并参与蛋白质降解、蛋白质折叠和构成细胞骨架[27]。但由于基因型的不同,蛋白质的含量也有所不同。试验发现,两类小麦成熟胚的可溶性蛋白质含量存在显著差异。与白皮松不同的是,小麦成熟胚的可溶性蛋白质含量与胚性愈伤率呈负相关。不同胚性愈伤率的外植体和不同胚性愈伤组织中可溶性蛋白含量的差异,推测植物胚性愈伤组织的形成过程与可溶性蛋白可能有着重要联系。

图2 小麦成熟胚侧面实体显微镜观察图

比例尺长度为200 μm;SC:盾片;CO:胚芽鞘;PL:胚芽;RA:胚根;a~j分别表示CW2、90(147)-1、SQ04、9129、宝丰228、QX2、ZMD4、S534、091和西农2208
Scale bar is 200 μm; SC:Sculellum; CO:Coleoptile; PL:Plumule; RA:Radical; a to j indicate CW2,90(147)-1,SQ04,9129,Baofeng 228,QX2,ZMD4,S534,091 and Xinong 2208,respectively
图3小麦成熟胚石蜡切片放大40倍后显微镜观察图
Fig.3Paraffin section of wheat mature embryos under 40 magnifications
在愈伤组织形成和分化的过程中,谷胱甘肽可以促进细胞分化,并与愈伤组织绿点形成呈现正相关[28],而游离氨基酸含量与愈伤组织绿苗分化关系密切[29]。与其他作物相比,在小麦的成熟胚中谷胱甘肽和游离氨基酸的含量相对较多,它们对小麦成熟胚的营养价值和功能特性都有重要的影响[30]。测定发现,胚性愈伤率不同的两类小麦成熟胚的谷胱甘肽和游离氨基酸含量差异不显著,这说明谷胱甘肽和游离氨基酸在愈伤组织形成过程中,可能更多的是参与愈伤组织后期的形成与分化,与愈伤组织最初的形成并没有太大关系。在小麦成熟胚中,纤维素的含量并不多,约占麦胚营养成分的2.0%~4.3%[26],经测定发现两类小麦成熟胚当中纤维素含量有显著性差异,并与胚性愈伤率呈正相关。但具体存在着怎样的关系,尚需要进一步的研究。
碳水化合物作为渗透调节剂对体细胞胚的诱导具有重要的作用,其中可溶性糖的积累与植物胚性愈伤组织的形成密切相关,在植物体细胞胚胎发生中,可溶性糖为胚性细胞的新陈代谢活动提供充足的能源物质[31]。在小麦成熟胚中碳水化合物含量占总营养成分的35%~45%,其中糖分含量占25%左右,主要是葡萄糖和戊聚糖,还有10%左右的膳食纤维[32]。经测定,胚性愈伤率不同的两类小麦成熟胚可溶性糖含量差异性并不显著,说明小麦成熟胚作为外植体在愈伤组织形成的过程中,大部分能源物质可能是从培养基中获取,因此成熟胚中可溶性糖含量对最终小麦胚性愈伤率的差异影响并不显著。
胚性愈伤组织与非胚性愈伤组织的外部形态和内部结构上都存在明显的差异,胚性愈伤组织的质地紧密,有光泽,每个球状体用镊子很容易从愈伤组织上分离下来;非胚性愈伤组织质地疏松且湿软,常伴有粘液物质,没有光泽。通过石蜡切片的微观结构观察能明显观察到胚性愈伤组织细胞轮廓清晰,细胞核明显,细胞质浓厚;而非胚性愈伤组织的内部存在大的空隙,空隙周围愈伤组织的细胞轮廓比较明显,可以清楚地看到细胞壁和细胞核,但是细胞质浓度并不高[33]。通过实体显微镜对小麦成熟胚外部形态进行观察和统计,发现两类小麦成熟胚的高度之间存在显著性差异,通过石蜡切片的方法对小麦成熟胚的内部结构进行观察,虽然各个基因型在一定程度上存在着显著差异,但是在两类成熟胚之间并未发现有显著差异。
4结 论
本研究对两类不同胚性愈伤率小麦成熟胚的5种生化指标进行了测定,发现2个有差异的生化指标,即可溶性蛋白质和纤维素,且它们与胚性愈伤率存在着显著相关性;对成熟胚的外观进行观察和统计分析时,发现1个差异指标,即成熟胚的高度。这些结果从一定程度上说明了两类小麦成熟胚特性具有一定差异性,为小麦和其他植物脱分化和再分化研究提供了新的数据和研究思路。
参考文献:
[1]栗 聪,雒景吾,张 磊,等.小麦成熟胚再生体系优化及优良受体基因型筛选 [J].麦类作物学报,2014,34(5):583-590.
Li C,Luo J W,Zhang L,etal.Optimizing the regeneration system from mature embryo and screening of elite wheat genotyps [J].JournalofTriticeaeCrops,2014,34(5):583-590.
[2]范学科,王亚红,奚亚军,等.小麦幼胚愈伤组织诱导影响因素的研究 [J].中国农学通报,2007,23(11):68-71.
Fan X K,Wang Y H,Xi Y J,etal.Studies on the factors affecting callus induction from wheat immature embryo [J].ChineseAgriculturalScienceBulletin,2007,23(11):68-71.
[3]Delporte F,Mostade O,Jacquemin J M.Plant regeneration through callus initiation from thin mature embryo fragments of wheat [J].PlantCellTissueandOrganCulture,2001,67(1):73-80.
[4]Ozgen M,Turet M,Altinok S,etal.Efficient callus induction and plant regeneration from mature embryo culture of winter wheat(TriticumaestivumL.)genotypes [J].PlantCellReports,1998,18(3-4):331-335.
[5]左静静,刘少翔,闫贵云,等.小麦幼胚组织培养研究进展 [J].中国农学通报,2010,26(19):81-87.
Zuo J J,Liu S X,Yan G Y,etal.Research advance in tissue culture of wheat immature embryo [J].ChineseAgriculturalScienceBulletin,2010,26(19):81-87.
[6]叶兴国,陈 明,杜丽璞,等.小麦转基因方法及其评述 [J].遗传,2011,33(5):422-430.
Ye X G,Chen M,Du L P,etal.Description and evaluation of transformation approaches used in wheat [J].Hereditas,2011,33(5):422-430.
[7]陶丽莉,殷桂香,叶兴国.小麦成熟胚组织培养及遗传转化研究进展 [J].麦类作物学报,2008,28(4):713-718.
Tao L L,Yin G X,Ye X G.Progress outline of wheat tissue culture and genetic transformation by using wheat mature embryos as explants [J].JournalofTriticeaeCrops,2008,28(4):713-718.
[8]张东武,刘 辉,赵惠贤.小麦成熟胚组织培养再生体系的优化及高再生率基因型的筛选 [J].麦类作物学报,2011,31(5):847-852.
Zhang D W,Liu H,Zhao H X.Optimization of regeneration system of tissue culture from mature embryos and screening of wheat genotypes with high regeneration frequency [J].JournalofTriticeaeCrops,2011,31(5):847-852.
[9]邓 莉,于月华,冯 魁,等.小麦成熟胚愈伤组织诱导的影响因素研究 [J].现代农业科技,2014(1):30-32.
Deng L,Yu Y H,Feng K,etal.The research of factors for wheat mature embryo callus induction [J].ModernAgriculturalScienceandTechnology,2014(1):30-32.
[10]叶 健,王小霞,符书兰,等.优良小麦转基因受体品种的筛选及成熟胚半胚培养的研究 [J].安徽农业科学,2007,35(12):3561-3562,3569.
Ye J,Wang X X,Fu S L,etal.Selection of transgenic recipients from elite wheat cultivar and study on the half mature embryo culture [J].JournalofAnhuiAgriculturalSciences,2007,35(12):3561-3562,3569.
[11]汤 益,徐开杰,孙风丽,等.黄淮麦区部分普通小麦品种(系)高频再生基因型的筛选 [J].西北农业学报,2014,23(6):73-80.
Tang Y,Xu K J,Sun F L,etal.Screening of genotypes with high frequency wheat cutivars of Huanghuai region [J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(6):73-80.
[12]张志良,瞿伟菁.植物生理学实验指导 [M].北京:高等教育出版社,2006:144-148.
Zhang Z L,Qu W J.Plant Physiology Experimental Guidance [M].Beijing:Higher Education Press,2006:144-148.
[13]黄纪念,宋国辉,孙 强,等.脱脂麦胚中谷胱甘肽与麦胚蛋白提取 [J].食品科学,2010,31(22):139-144.
Huang J N,Song G H,Sun Q,etal.Extraction of glutathione and wheat germ protein from defatted wheat germ [J].FoodScience,2010,31(22):139-144.
[14]李兴军,姜 平,陆 晖.小麦及加工品中游离氨基酸总量测定 [J].粮食科技与经济,2013,38(1):35-36.
Li X J,Jiang P,Lu H.Determination of free amino acids in wheat and processed products [J].GrainScienceandTechnologyandEconomy,2013,38(1):35-36.
[15]赵 俊,木万福,张志星.植物石蜡切片技术改进 [J].安徽农学通报,2009,15(5):69.
Zhao J,Mu W F,Zhang Z X.Improvement of plant paraffin section technical [J].AnhuiAgriculturalScienceBulletin,2009,15(5):69.
[16]翟爱华.麦胚成分及其营养价值和功能性 [J].食品研究与开发,2004,25(2):6-8.
Zhai A H.Wheat germ ingredient and nutritional value and functionality [J].FoodResearchandDevelopment,2004,25(2):6-8.
[17]樊永华.麦胚的综合开发利用研究 [J].粮食科技与经济,2013,38(2):58-60.
Fan Y H.Comprehensive development and utilization of wheat germ [J].GrainScienceandTechnologyandEconomy,2013,38(2):58-60.
[18]李惠林.影响水稻成熟胚愈伤组织增殖力和再生力的因素 [J].南方农业,2015,19(15):20-21.
Li H L.Factors of affecting rice mature embryo callus growth and regeneration force [J].SouthChinaAgriculture,2015,9(15):20-21.
[19]刘 芳,周翠红,李丽雅,等.不同遗传背景小麦成熟胚再生体系的初步研究 [J].麦类作物学报,2010,30(1):39-42.
Liu F,Zhou C H,Li L Y,etal.Prelimilary study on the regeneration system of mature wheat embryos with different genetic backgrounds [J].JournalofTriticeaeCrops,2010,30(1):39-42.
[20]阎丽娜,李 霞,吴 丹.不同类型水稻材料成熟胚组织培养力的比较 [J].中国农业科学,2010,43(6):1127-1135.
Yan L N,Li X,Wu D.The comparison in tissue culture ability from mature embryo in different rice cultivars [J] .ScientiaAgriculturaSinica,2010,43(6):1127-1135.
[21]李伟艳,刘新伦,陈春环,等.小麦成熟胚诱导胚性愈伤组织的影响因素 [J].麦类作物学报,2011,31(6):1020-1024.
Li W Y,Liu X L,Chen C H,etal.Study on the conditions of wheat embryonic callus induction from mature embryos [J].JournalofTriticeaeCrops,2011,31(6):1020-1024.
[22]李朝炜,刘 颖,朱 昀,等.旱稻成熟胚愈伤组织诱导的影响因素 [J].江苏农业科学,2015,43(2):52-54.
Li C W,Liu Y,Zhu Y,etal.Factors of upland rice callus induction from mature embryos [J].JiangsuAgriculturalScience,2015,43(2):52-54.
[23]贾小霞,王汉宁,孔维萍,等.玉米幼胚和成熟胚愈伤组织诱导过程中内源激素的比较 [J].核农学报,2009,23(4):555-560.
Jia X X,Wang H N,Kong W P,etal.Comparison of dynamic changes of endogenous hormones in callus between mature and immature embryos of maize [J].JournalofNuclearAgriculturalSciences,2009,23(4):555-560.
[24]刘 清,朱允华,吴 顺,等.遗传转化过程中水稻愈伤组织的内源植物激素变化动态研究 [J].中国农业科学,2007,40(10):2361-2367.
Liu Q,Zhu Y H,Wu S,etal.Studies on the content changes of endogenous phytohormonesin rice calli for genetic transformation [J].ScientiaAgriculturaSinica,2007,40(10):2361-2367.
[25]李 茜,张存旭,秦 萍.白皮松胚性和非胚性愈伤组织生理生化特性研究 [J].西北农林科技大学学报(自然科学版),2008,36(8):151-155.
Li Q,Zhang C X,Qin P.Physiological and biochemical characteristics of embryogenic callus and non-embryogenic callus inPinusbungeana[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2008,36(8):151-155.
[26]程云辉,王 璋,许时婴.麦胚蛋白的研究进展 [J].食品与机械,2006,22(2):105-108.
Cheng Y H,Wang Z,Xu S Y.Advances in studies on wheat germ protein [J].Food&Machinery,2006,22(2):105-108.
[27]Juhász A,Moolhuijzen P,Bellgard M,etal.Proteomics in Foods Principles and Applications [M].USA:Springer,2013:344-349.
[28]廖祥儒,刘小丽,陈 彤,等.谷胱甘肽对小麦幼穗胚性愈伤组织形成以及几种相关酶活性的影响 [J].植物生理学通讯,2002,38(4):327-329.
Liao X R,Liu X L,Chen T,etal.Effect of glutathione on formation of embryogenetic callus and activity of some related enzymes of immature wheat inflorescence [J].PlantPhysiologyCommunications,2002,38(4):327-329.
[29]何玉池,陈建国,陶采成,等.大麦籽粒及花药愈伤组织的游离氨基酸含量分析 [J].氨基酸和生物资源,2004,26(4):23-26.
He Y C,Chen J G,Tao C C,etal.Free amino acid content analysis of barley grains and anther callus [J].AminoAcids&BioticResources,2004,26(4):23-26.
[30]韩文凤,邱 泼.小麦胚芽的开发利用研究动态 [J].粮食加工,2008,33(3):64-67.
Han W F,Qiu B.The dynamic of development and utilization for wheat germ [J].GrainProcessing,2008,33(3):64-67.
[31]臧运祥,郑伟尉,孙仲序,等.植物胚状体发生过程中主要代谢产物变化动态研究进展 [J].山东农业大学学报(自然科学版),2004(1):131-136.
Zang Y X,Zheng W W,Sun Z X,etal.Advances in the dynamic process of plant somatic embryogenesis major metabolite changes [J].JournalofShandongAgriculturalUniversity(NaturalScienceEdition),2004(1):131-136.
[32]林志芳,马文领,刘 军,等.浅述麦胚的营养成分及抗氧化功能 [J].海军医学杂志,2008,29(2):173-174.
Lin Z F,Ma W L,Liu J,etal.Brief description of nutrients and antioxidant wheat germ [J].JournalofNavyMedicine,2008,29(2):173-174.
[33]刘振虎,卢欣石,葛 军.紫花苜蓿愈伤组织及体细胞胚的细胞学观察 [J].草业科学,2005,22(2):37-40.
Liu Z H,Lu X S,Ge J.Cytological observation of alfalfa callus and somatic embryos [J].PrataculturalScience,2004,22(2):37-40.
收稿日期:2016-01-02修回日期:2016-03-11
基金项目:国家转基因生物新品种培育科技重大专项(2208ZX080022003);陕西省科技统筹创新工程计划项目(2015KTZDNY01-08)
通讯作者:奚亚军(E-mail:xiyajun11@126.com)
中图分类号:S512.1;S312
文献标识码:A
文章编号:1009-1041(2016)06-0728-08
Characteristic Differences of Mature Wheat Embryos with Different Inducing Embryonic Callus Rates
LUO Panni1,WANG Zhicheng2,WANG Yongfeng1,CUI Guibin1,ZHANG Shumeng1,YANG Guoyu1,SUN Fengli1,ZHANG Chao1,LIU Shudong1,XI Yajun1
(1.College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China;2.Longxian Seed Management Station,Longxian,Shaanxi 721200,China)
Abstract:Efficiency of plant regeneration is directly determined by embryonic callus rate. To explore the differences between wheat mature embryos with different embryonic callus rates,ten kinds of genotypes of wheat mature embryos were chosen and five kinds of physiological and biochemical indices were measured,according to embryonic callus rates,including soluble sugar,soluble protein,cellulose,glutathione and free amino acid. External and internal structures for mature embryos of ten kinds of genotypes were observed by stereomicroscope and paraffin section method. Biochemical tests showed that there were significant differences in soluble protein and cellulose content between two types of wheat mature embryos. Other indices like contents of soluble sugar,free amino acid and glutathione had no significant difference between the two groups of mature embryos. Correlation analysis showed that the induction rates of embryonic callus had highly significantly positive correlation with cellulose contents,but significantly negative correlation with soluble protein content. In observation of the external morphology,there was significant difference between the height of two types of wheat mature embryos. However,in the observation of the internal structure,no significant difference was found between the two types of wheat mature embryos.
Key words:Triticum aestivum L.; Mature embryo; Embryonic callus; Difference
网络出版时间:2016-05-30
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160530.1536.012.html
第一作者E-mail:luopanni@163.com
