野生一粒小麦根干旱响应蛋白的筛选与鉴定
2016-07-29李鲜花刘永华刘翠英
李鲜花,刘永华,刘 辉,刘翠英
(1.榆林学院生命科学学院,陕西榆林 719000;2.贵州省农业科学院生物技术研究所,贵州贵阳 550006)
野生一粒小麦根干旱响应蛋白的筛选与鉴定
李鲜花1,刘永华1,刘 辉2,刘翠英1
(1.榆林学院生命科学学院,陕西榆林 719000;2.贵州省农业科学院生物技术研究所,贵州贵阳 550006)
摘要:为解析野生一粒小麦根响应干旱胁迫的调控网络,用20%(w/v) PEG6000处理两叶一心期野生一粒小麦,通过对小麦根蛋白质的分离和鉴定,分析了干旱胁迫下野生一粒小麦根中的蛋白质变化。结果共分离、鉴定得到85个表达差异倍数在1.5以上的蛋白质。这些差异蛋白主要涉及碳代谢(27%)、氨基酸代谢(15%)、解毒与防御(11%)、分子伴侣(8%)、能量代谢(8%)、信号传导(6%)、蛋白质代谢(5%)、脂代谢(4%)、转录与翻译(4%)、核苷酸代谢(2%)以及骨架蛋白(1%)。对这些表达差异蛋白进行进一步的功能分析,发现大部分信号传导相关蛋白上调表达;碳代谢途径中的糖酵解相关蛋白下调表达,而磷酸戊糖途径相关蛋白上调表达。同时下调表达的还包括蛋白质代谢相关蛋白。大部分氨基酸代谢相关蛋白质下调表达,但是谷氨酸脱羧酶及甲硫氨酸合酶含量上升。结果表明,干旱胁迫增强了野生一粒小麦根中信号传导与磷酸戊糖途径代谢,促进了谷氨酸与甲硫氨酸的生物合成,降低了糖酵解与蛋白质代谢等过程。研究结果丰富了野生一粒小麦根响应干旱胁迫机制信息。
关键词:干旱胁迫;野生一粒小麦;蛋白质组学;双向电泳
作为世界主要粮食作物之一,小麦的生产很容易受到全球气候变化与水分亏缺环境的影响[1]。干旱是导致农作物减产最主要的非生物逆境胁迫因子[2],而全球气候变暖,更加深了干旱对农作物产量的影响[3]。因此,有必要从分子水平揭示小麦响应干旱胁迫的机制,为干旱耐受新品种的培育提供理论依据和技术指导。
植物配备有复杂而精细的响应机制以适应干旱缺水环境,这种复杂的响应机制是由植物感应干旱胁迫信号引起的转录翻译机制而起始,继而导致解剖结构、生理生化状态的改变,如气孔关闭、渗透调节物质与抗氧化剂的合成等[1-2]。普通小麦的祖先有很多具优良的耐旱性,如山羊草(Aegilopstauschii)、乌拉尔图(T.urartu)、野生一粒小麦(T.boeoticum)[4-6],这些小麦近源物种是改良普通小麦耐旱性的重要基因库。野生一粒小麦可以耐受各种环境胁迫因子,包括盐胁迫、病虫害等[7],其耐旱性显著强于野生二粒小麦、普通小麦[6],是当前改善小麦品种耐旱性有效、重要的潜在基因库。
通过比较转录组学技术,在野生二粒小麦中,多种胁迫耐受基因的筛选与鉴定获得成功[8]。然而,由于基因转录、翻译成蛋白质需要经历复杂的转录、翻译后修饰,使得基因与蛋白质之间的关联性较低,而蛋白质是胁迫信号感应、转录调控、解毒防御、生物大分子结构保护等的直接作用因子,因此,比较蛋白质组学是揭示植物响应干旱胁迫强有力的研究技术[9]。已经有研究通过蛋白质组学技术,分析了野生小麦与普通小麦叶片在干旱胁迫下的蛋白质变化[10]。在小麦根蛋白质组学方面,Nasser等[11]分别比较了在较高和较低氮营养水平下两个小麦品种蛋白质表达的变化,结果显示硝酸还原酶和谷氨酸脱氢酶相关蛋白与氮营养水平正相关。Kong等[12]利用凝胶和LC-MS-MS生物质谱法鉴定了水涝胁迫下小麦根系细胞壁的蛋白质组,推测小麦幼苗通过限制细胞生长来应对水涝胁迫,以避免能量消耗。然而,对干旱胁迫下野生一粒小麦根中蛋白质组变化的研究较少,目前只有一篇文献有报导[13],野生一粒小麦根的干旱响应机制仍然不明确。
为揭示耐寒性较强的野生一粒小麦响应干旱胁迫的分子机制,本研究采用2-DE和MALDI-TOF-TOF-MS生物质谱鉴定法对20%PEG6000处理24 h、48 h的野生一粒小麦根蛋白质组进行分析,以明确表达差异蛋白质与野生一粒小麦抗旱性的相关性,并对其功能与代谢途径进行进一步分析,以期从蛋白质组水平揭示野生一粒小麦响应干旱胁迫的分子机制。
1材料与方法
1.1材料与干旱处理
试验材料为野生一粒小麦(Triticumboeticum),由西北农林科技大学小麦改良中心提供。种子在室温黑暗条件下于湿润滤纸上发芽后,在光/暗比16 h/8 h、温度23~25 ℃、相对湿度65%~75%条件下培养;两叶期时转移到1/4 Hoagland培养液中,每3 d更换一次培养液;三叶期用20% PEG6000分别处理24 h、48 h后收集根,于-80 ℃下冷冻。3个重复。
1.2蛋白质提取
根蛋白样品制备参照Liu等[13]的方法,稍有修改。将冷冻根在液氮中用预冷的研钵研磨成粉末。取粉末500 mg,加入10 mL含有10%柠檬酸和0.07%β-巯基乙醇沉淀蛋白的冷丙酮,-20 ℃过夜后于4 ℃、19 000 r·min-1离心1 h,沉淀用含有0.07% β-巯基乙醇沉淀蛋白的冷丙酮清洗三次。将沉淀冻干以除去残留的丙酮,即为提取蛋白。
将提取蛋白溶解于1 mL裂解缓冲液(7 mol·L-1尿素,2 mol·L-1硫脲,4% CHAPS,65 mmol·L-1Dithiothreitol( DTT),微量蛋白质抑制剂)中,4 ℃静置1.5 h;4 ℃、19 000 r·min-1离心1 h,上清液即为蛋白样品。以BSA(1 mg·mL-1)为标准,用2-D Quant Kit定量试剂盒(GE公司)测定样品浓度,并于-80 ℃保存备用。
1.3双向电泳、图像分析与MALDI-TOF-TOF生物质谱分析
双向电泳操作参考Liu等[13]的方法进行。采用17 cm IPG胶条(pH 4~7),上样量为250 μg。SDS-PAGE电泳在11.25%聚丙稀酰胺凝胶上进行。蛋白点用银染显色。
图像分析采用PDQuest 8.0.1软件(Bio-Rad公司,Hercules,CA)。以未胁迫处理为对照样品,自动检测匹配和归一化后,人工进行进一步处理。表达差异倍数在1.5以上、P≤0.01的蛋白点为差异蛋白。
从2-DE胶中把差异蛋白点切出,胶内酶解及Ziptip脱盐,然后进行4800 Plus MALDI-TOF-TOF-MS(AB SCIEX,USA)质谱分析,所得数据在NCBI非冗余蛋白质数据库进行搜索,详细步骤及各种参数设置参照Liu 等[13]的方法。蛋白质评分C. I.%超过95%的蛋白质认定为鉴定成功的蛋白。
2结果与分析
2.1干旱胁迫下野生一粒小麦蛋白质组的总体变化
从图1可以看出 ,处理间的胶图重复性较好,表明2-DE结果的准确性和可靠性较高。通过双向电泳和MALDI-TOF-TOF生物质谱分析共鉴定出了85个差异蛋白,其中有5组蛋白质点确定为相同的蛋白质(图2)。85个差异蛋白中有49个下调表达,36个上调表达。其中,有40个差异蛋白点在24 h和48 h两个处理中均下调表达,30个蛋白点均上调表达。处理24 h的根蛋白表达水平的变化显著强于48 h处理,表明24 h处理的野生一粒小麦根系对干旱胁迫的响应比48 h更严重,可能受干旱胁迫24 h后野生一粒小麦开启了适应机制。
2.2干旱胁迫下野生一粒小麦差异蛋白质的MALDI-TOF-TOF质谱鉴定及功能分类
对已鉴定的85个差异蛋白质按功能分类,其中77个功能确定蛋白分别为碳代谢(27%)、氨基酸代谢(15%)、解毒与防御(11%)、分子伴侣(8%)、能量代谢(8%)、信号传导(6%)、蛋白质代谢(5%)、脂代谢(4%)、转录与翻译(4%)、核苷酸代谢(2%)以及骨架蛋白(1%),大约有一半以上蛋白质参与碳代谢、氨基酸代谢和解毒防御。结果表明,干旱胁迫主要影响了野生一粒小麦根的解毒和防御、碳代谢及氨基酸代谢等过程。
为了获得8个未知差异蛋白的更多信息,应用BLASTP工具(http://www.ncbi.nlm.nih.gov/BLAST/),利用未知蛋白质序列作为供体序列,查询其同源蛋白。结果表明有5个未知蛋白的氨基酸序列与已知蛋白的相似度达到90%以上,表明它们可能具有相似的功能;3个蛋白质的功能有待进一步研究验证(表1)。
2.3干旱胁迫下野生一粒小麦根信号传导相关蛋白的变化
通过2-DE及MALDI-TOF-TOF分离鉴定,在干旱胁迫下的野生一粒小麦根中,共发现5个信号相关的差异蛋白,其中有3个在干旱处理24 h、48 h均上调表达,2个在24 h、48 h均下调表达。上调表达的蛋白质为pyrabactin resistance 1(R62)、14-3-3-like protein GF14-B-like(R63)、robable calcium-binding protein CML28-like(R64),均是植物体内信号传导相关的关键蛋白。2个下调蛋白质中包含有RAB-GDP解离抑制因子(R61),可抑制GTP的合成,对细胞感应逆境信号起负调控作用。结果表明,干旱胁迫可促进野生一粒小麦根的信号传导能力。

A:对照样品的2-DE图谱;B:20%PEG6000处理24 h的2-DE图谱;C:20% PEG6000处理48 h的2-DE图谱
A:2-DE gel of the control sample; B:2-DE gel of sample treated with 20% PEG6000 for 24 h;C:2-DE gel of sample treated with 20% PEG6000 for 48 h
图1干旱胁迫下野生一粒小麦根蛋白质2-DE图谱
Fig.1Representative 2-DE gels of identified proteins in root ofT.boeoticumwith drought
2.4干旱胁迫下野生一粒小麦根抗氧化和防御相关蛋白的变化
通过蛋白质组学分析,共有9个差异蛋白参与野生一粒小麦根抗氧化与防御过程,其中有8个在干旱胁迫24 h、48 h后均上调表达,以过氧化物酶和谷胱甘肽合成相关酶为主,这些蛋白质是去除过量活性氧过程中的关键酶;只有1个蛋白在干旱处理24 h、48 h后下调表达。综合结果表明,干旱胁迫处理野生一粒小麦可促使根的解毒和防御能力增强。
2.5干旱胁迫下野生一粒小麦根碳代谢和能量代谢相关蛋白的变化
通过比较干旱胁迫与对照组中的野生一粒小麦根中的差异蛋白质组变化,发现有23个差异蛋白涉及碳代谢过程,其中有19个是糖酵解过程中的关键蛋白;16个蛋白质在干旱胁迫24 h、48 h后下调表达,包括葡萄糖磷酸变位酶、烯醇酶等;1个蛋白在干旱处理24 h、48 h后均上调表达,1个蛋白质在干旱处理24 h变化不大,而在干旱胁迫48 h后上调表达。说明干旱胁迫抑制了野生一粒小麦根的糖酵解过程。有2个蛋白是磷酸戊糖途径相关蛋白,在干旱处理24 h、48 h后均上调表达,这些蛋白质丰度的上调,可增强干旱胁迫下野生一粒小麦根的磷酸戊糖途径。没有发现TCA循环相关蛋白。
在糖酵解、TCA循环、磷酸戊糖途径等过程中,通常伴随着能量的消耗或产生。对7个能量代谢相关蛋白进行分析,发现3个蛋白在干旱胁迫24 h、48 h后均上调表达,4个下调表达,他们在各自的代谢途径中起主要作用,表明干旱胁迫导致根中能量代谢较为复杂的变化。
综合上述结果,可以推测,在干旱胁迫下的野生一粒小麦根中,可能主要通过磷酸戊糖途径供应野生一粒小麦根生长所需的物质和还原力。
A 和B为干旱处理0 h 和24 h 后根蛋白图。有5组共10个明显变化的蛋白点
A and B,root proteins after 0 and 24 h of drought treatment. A total of 10 differentially changed protein spots corresponding to 5 unique proteins are shown
图2干旱胁迫下2-DE法检测野生一粒小麦根蛋白的同源异构体蛋白点
Fig.2Close-up of possible isoforms detected by 2-DE of proteins in root ofT.boeoticumunder drought stress
2.6干旱胁迫下野生一粒小麦根氨基酸、蛋白质代谢相关蛋白的变化
干旱胁迫野生一粒小麦根中,共发现13个与氨基酸和氮代谢相关的差异蛋白质,其中有8个蛋白质在干旱处理24 h、48 h后下调表达,包括谷氨氨酰胺合酶、精氨酸合酶等,只有5个在干旱处理24 h、48 h后上调表达,包括甲硫氨酸合酶与谷氨酸脱羧酶等。表明干旱胁迫降低了野生一粒小麦根中的谷氨酰胺、精氨酸的合成,而增强了甲硫氨酸、谷氨酸的合成。
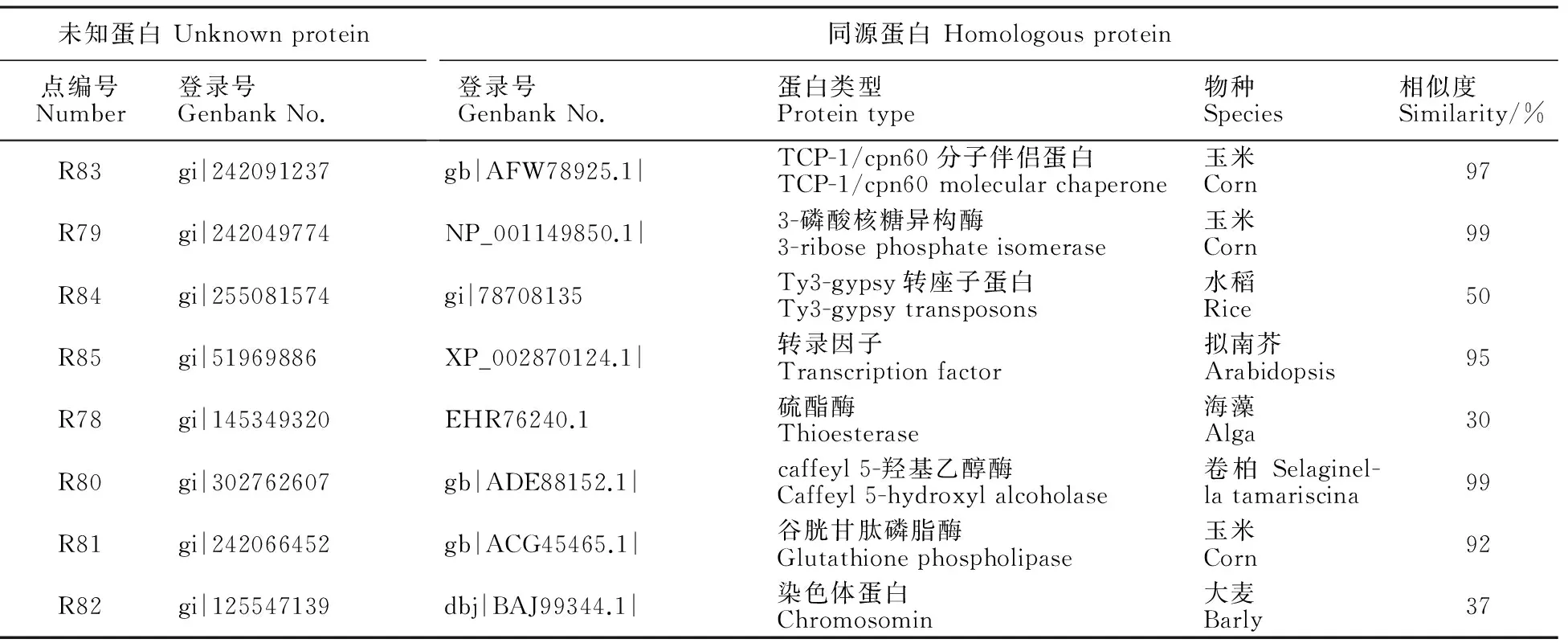
表1 未知蛋白的同源blast分析结果
蛋白质代谢通常包括蛋白质的生物合成、蛋白质折叠与蛋白质降解等过程。本研究共发现有5个差异蛋白与蛋白质生物合成相关,其中3个蛋白在干旱处理24 h、48 h后上调表达,2个下调表达,表明干旱胁迫导致小麦根蛋白质生物合成受到较大的干扰。分子伴侣蛋白与蛋白质折叠相关, 研究发现有7个分子伴侣蛋白,其中6个在干旱处理24 h、48 h后下调表达,只有1个上调表达,表明干旱胁迫导致野生一粒小麦根的蛋白质折叠过程受到抑制。干旱胁迫下,有5个差异蛋白参与野生一粒小麦根的蛋白质降解过程,其中只有1个蛋白质在干旱处理24 h、48 h后上调表达,另外4个下调表达。综合结果表明,干旱胁迫降低了野生一粒小麦根中氨基酸和氮代谢、蛋白质生物合成、蛋白质折叠、蛋白质降解等过程。
3讨 论
3.1差异蛋白质的2-DE与MALDI-TOF-TOF鉴定结果的比较
总的来说,在第二向SDS-PAGE 电泳后,蛋白点分子量实测值与理论值的误差大约为±10%。发现两个蛋白点(点编号为R72,R84)的分子量比理论值明显偏小,表明这些蛋白质可能是完整蛋白质的部分降解产物。5组蛋白质(点编号为 R48 和 R49,R10 和 R14,R11和 R16,R30 和 R36,R20 和 R23)确定为相同蛋白质,但是在双向电泳中显示不同的位点,这可能是由于转录后修饰等原因,如磷酸化和糖基化等。盐胁迫下的盐生草中有类似的发现[14],表明胁迫因子可能影响植物体内蛋白质磷酸化与糖基化水平,以适应外界环境的变化。
3.2信号转导相关蛋白
植物通常通过激活信号转导网络开始干旱胁迫响应,通过改变信号转导相关蛋白含量来适应水分胁迫。本试验中获得的pyrabactin resistance 1(PYR1) 蛋白可与2C型蛋白磷酸酶(PP2Cs)相互作用,降低ABA通路中PP2Cs磷酸酶的活性,对ABA信号通路进行负调节[15]。蛋白点R62属于PYR/PYLs,它的丰度上升使得野生一粒小麦根具有较高的抗旱性。
蛋白点R61是RAB-GDP解离抑制因子(RAB-GDI),在RAB / YPT蛋白的GTP酶循环中有重要作用,可将GDP与RABs绑定,通过抑制GDP释放,维持GDP键的非活性状态[16]。这种蛋白可下调通过GDP释放引起新一轮GTP酶循环,使野生一粒小麦根系在干旱胁迫下触发了不同的跨膜信号传导系统。
两种钙结合蛋白(点编号R60,R64)则表现出相反的表达模式,R64蛋白上调,R60蛋白下调。当使用钙调蛋白拮抗剂后,非生物胁迫中钙调蛋白或类钙调蛋白直接导致了胁迫阻力下降和基因的表达[17]。钙调蛋白或类钙调蛋白与Ca2+在EF-手形结构域结合,改变了与靶蛋白相互作用的构象,导致靶蛋白的激活或失活[18]。R60和R64分别被确定为类钙调蛋白49亚型1(CML49-like isoform 1)和类钙调蛋白28(CML28-like),它们在干旱胁迫下钙通道内的功能仍不能确定。由于R60蛋白丰度下调,R64蛋白丰度上调,其功能可能是使蛋白表达激活。
野生一粒小麦根系在干旱胁迫24 h和48 h后均诱导出了14-3-3 蛋白,它与GF14-B-like(R50)相类似。14-3-3蛋白可以结合大量的功能不同的蛋白质,包括激酶、磷酸酶和跨膜受体等,从而使14-3-3蛋白在诸如信号转导调控、细胞凋亡、细胞周期调控等许多重要调节过程中起重要作用[19]。当植物受到非生物胁迫时,这些蛋白还通过调节ATP酶保持细胞离子平衡[20]。在水稻的细胞外基质蛋白质组中也观察到类似的蛋白质GF14-C和GF14-B[21]。
总之,GF14-B-like 蛋白 和 CML28-like 蛋白的丰度上调,PYR1,RAB-GDI 和 CML49-like isoform 1蛋白丰度下调,增强了干旱胁迫下野生一粒小麦根系的信号转导网络。
3.3碳、能量、氨基酸和氮代谢相关蛋白
糖酵解可将葡萄糖转换成丙酮酸与质子H+,代谢过程所释放的自由能被转换成高能化合物ATP与NADPH。TCA循环是细胞呼吸过程中的第二阶段,可在有氧环境中将丙酮酸降解成二氧化碳与水,并伴随着能量的产生以供植物体正常生长所需,同时,TCA循环过程中产生的衍生物是氨基酸、次生代谢物等生物合成的底物,而磷酸戊糖途径可以生成5-磷酸核糖与能量物质NADPH,以供植物生长所需[22]。大多数与碳代谢相关的蛋白参与糖酵解,且多数在干旱胁迫下下调表达。而磷酸戊糖途径相关蛋白(UDP-葡萄糖/GDP-甘露糖脱氢酶、转酮醇酶、3-磷酸核糖异构酶等)则在干旱处理24 h、48 h后上调表达,表明干旱胁迫下野生一粒小麦根中形成了新的代谢平衡,以减少能量消耗,增强能量形成,保证生长所需,与Liu等[13]的研究结果一致。
为了响应干旱胁迫,植物体内离子稳态会改变,ATP酶能帮助植物细胞维持其离子平衡。本研究发现在干旱胁迫24h和48h后,有3个蛋白点(R53,R54,R55)丰度下调。Huseynova等[23]发现干旱胁迫下2种小麦giymatli-2/17(干旱敏感)和azamatli-95(耐旱)的ATP合酶β亚基丰度下调。氨基酸代谢是植物体内重要的代谢过程,且极易受干旱胁迫影响。本研究发现,根中大部分氨基酸代谢相关蛋白在干旱处理后下调表达,部分蛋白的丰度在干旱处理后上升,如谷氨酸脱羧酶(R65),在γ-氨基丁酸(GABA)的代谢过程中发挥关键作用,对维持干旱胁迫下野生一粒小麦根中碳氮平衡具有重要作用[24]。
3.4解毒和防御相关蛋白
植物主要采用两种机制来消除外界胁迫产生的有害物质,一种是非酶抗氧化剂,包括抗坏血酸和谷胱甘肽,另一种是酶途径,如超氧化物歧化酶、抗坏血酸过氧化物酶、谷胱甘肽过氧化物酶和过氧化氢酶[25]。本研究发现有9种差异表达的蛋白质(DEPS)与细胞防御相关,其中8种蛋白质在干旱处理后24 h、48 h上调表达,只有1种蛋白质下调表达,表明干旱胁迫导致野生一粒小麦根的抗氧化和防御能力提升,与干旱胁迫下野生一粒小麦叶片中抗氧化相关蛋白的变化模型一致[13]。
3.5蛋白质的生物合成和代谢相关蛋白
本研究发现有3种差异蛋白质参与了转录和翻译,分别为双链DNA结合蛋白Alba(R74),假定的核酸酶HARBI1-like(R75),肌苷单磷酸脱氢酶(R76)。这3种蛋白的过度表达,反映了对核苷酸营养的更高需求,增强了干旱胁迫下小麦根系基因的转录活性[26]。
真核生物翻译起始因子3(eIF3)的2个亚基(R72 和 R73)下调表达抑制了翻译过程,因为eIF3帮助mRNA与40 S核糖体亚基结合,使eIF2-GTP-Met-tRNAiMet三元络合物与40 S亚基更加稳定,另外,它还在扫描和识别AUG起始密码子中起作用[27]。因此,它的下调表达增加了野生一粒小麦根在干旱环境中错误蛋白质的合成和折叠。
植物可以通过产生分子伴侣纠正错误折叠的蛋白质。本试验结果显示,5个热休克蛋白(R46,R47,R48,R49 和R51) 和1个TCP-1蛋白为重要的分子伴侣,它们在干旱胁迫时显著下调。热休克蛋白主要参与其他蛋白质的折叠和展开,在植物遭受非生物逆境胁迫时一般含量增加,以重建正常的蛋白质构象和保持植物细胞稳态,如干旱胁迫下的普通小麦叶片[28]与水稻根[29]中,热休克蛋白均上调表达。本试验中所检测的分子伴侣蛋白大部分下调表达,与前人的研究结果不一致,具体原因有待进一步研究。
参考文献:
[1]Al-Ghamdi A A.Evaluation of oxidative stress tolerance in two wheat(Triticumaestivum) cultivars in response to drought [J].InternationalJournalofAgriculture&Biology,2009,11(1):1560-8530.
[2]Pyngrope S,Bhoomika K,Dubey R S.Oxidative stress,protein carbonylation,proteolysis and antioxidative defense system as a model for depicting water deficit tolerance in Indica rice seedlings [J].PlantGrowthRegulation,2013,69(2):149-165.
[3]权 畅,景元书,谭凯炎.气候变化对三大粮食作物产量影响研究进展[J].中国农学通报,2013.29(32):361-367.
Quan C,Jing Y S,Tan K Y.Progress in research of impacts of climate change on yield of three major grain crops [J].ChineseAgriculturalScienceBulletin,2013,29(32):361-367.
[4]Valkoun J J.Wheat pre-breeding using wild progenitos [J].Euphytica,2001,119(1):17-23.
[5]Mujeeb-Kazi A,Gul A,Ahmad I,etal.Aegilopstauschii,as a spot blotch(Cochliobolussativus) resistance source for bread wheat improvement [J].PakistanJournalofBotany,2007,39(4):1207-1216.
[6]Sultan M A R F,Hui L,Yang L J,etal.Assessment of drought tolerance of someTriticumL.species through physiological indices[J].CzechJournalofGenetics&PlantBreeding,2012,48(4):178-184.
[7]Chhuneja P,Kumar K,Stirnweis D,etal.Identification and mapping of two powdery mildew resistance genes inTriticumboeoticumL [J].Tag.theoretical&AppliedGenetics,2012,124(6):1051-1058.
[8]Ergen N Z,Thimmapuram J,Bohnert H J,etal.Transcriptome pathways unique to dehydration tolerant relatives of modern wheat [J].Functional&IntegrativeGenomics,2009,9(3):377-396.
[9]Abirami R,Himabindu K,Pazhamala L T,etal.Proteomics and metabolomics: two emerging areas for legume improvement [J].FrontiersinPlantScience,2015,6(209): 1116.
[10]Budak H,Akpinar B A,Unver T,etal.Proteome changes in wild and modern wheat leaves upon drought stress by two-dimensional electrophoresis and nanoLC-ESI-MS/MS[J].PlantMolecularBiology,2013,83(1-2):89-103.
[11]Bahrman N,Gouy A,Devienne-Barret F,etal.Differential change in root protein patterns of two wheat varieties under high and low nitrogen nutrition levels[J].PlantScience,2005,168(1):81-87.
[12]Kong F J,Oyanagi A,Komatsu S.Cell wall proteome of wheat roots under flooding stress using gel-based and LC MS/MS-based proteomics approaches[J].BiochimicaEtBiophysicaActaProteins&Proteomics,2010,1804(1):124-136.
[13]Liu H,Sultan M A,Liu X L,etal.Physiological and comparative proteomic analysis reveals different drought responses in roots and leaves of drought-tolerant wild wheat(Triticumboeoticum) [J].PlosOne,2015,10(4): e0121852.
[14]Juncheng W,Yaxiong M,Baochun L,etal.Physiological and proteomic analyses of salt stress response in the halophyteHalogetonglomeratus[J].PlantCell&Environment,2015,38(4):655-669.
[15]Sang-Youl P,Pauline F,Noriyuki N,etal.Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins[J].Science,2009,324(5930):1068-1071.
[16]Nielsen E,Cheung A Y,Ueda T.The regulatory RAB and ARF GTPases for vesicular trafficking[J].PlantPhysiology,2008,147(4):1516-1526.
[17]Liu H T,Li B Z,Li X Z,etal.Calmodulin is involved in heat shock signal transduction in wheat[J].PlantPhysiology,2003,132(3):1186-1195.
[18]Singh P,Virdi A.Singh.Ca2+,calmodulin and plant-specific calmodulin-binding proteins: implications in abiotic stress adaptation[M].Sarwat M.Stress Signaling in Plants:Genomics and Proteomics Perspective,Springer Science+Business Media New York,2013,1:240.
[19]Paul W J.Sinnige M P,Roobeek I,etal.Abscisic acid and 14-3-3 proteins control K+channel activity in barley embryonic root[J].PlantJournal,2005,41(1):43-55.
[20]Klychnikov O I,Boer A H D.The V-ATPase from etiolated barley(HordeumvulgareL.) shoots is activated by blue light and interacts with 14-3-3 proteins [J].JournalofExperimentalBotany,2007,58(5):1013-1023.
[21]Pandey A,Rajamani U,Verma J,etal.Identification of extracellular matrix proteins of rice(OryzasativaL.) involved in dehydration-responsive network: a proteomic approach[J].JournalofProteomeResearch,2010,9(7): 3443-3464.
[22]Hames B D,Hooper N M.Instant Notes in Biochemistry 4th ed.[M].Biosscientific Publishers Ltd.Leeds,UK: 1997:304-326.
[23]Huseynova I M,Suleymanov S Y,Aliyev J A.Structural-functional state of thylakoid membranes of wheat genotypes under water stress[J].BiochimicaEtBiophysicaActa,2007,1767(6):869-75.
[24]Hugues R,Abdelhak E A,Ravishankar P,etal.GABA accumulation causes cell elongation defects and a decrease in expression of genes encoding secreted and cell wall-related proteins inArabidopsisthaliana[J].Plant&CellPhysiology,2011,52(5):894-908.
[25]Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].AnnualReviewofPlantBiology,2004,55(1):373-399.
[26]Bell S D,Botting C H,Wardleworth B N,etal.The interaction of Alba,a conserved archaeal chromatin protein,with Sir2 and its regulation by acetylation[J].Science,2002,296(5565):148-151.
[27]Xia C,Wang Y,Li W,etal.TheArabidopsiseukaryotic translation initiation factor 3,subunit F(AteIF3f),is required for pollen germination and embryogenesis[J].PlantJournal,2010,63(2):189-202.
[28]Demirevska K,Simova-Stoilova L,Vassileva V,etal.Drought-induced leaf protein alterations in sensitive and tolerant wheat varieties [J].BulgarianJournalofPlantPhysiology,2007,34(1-2):.
[29]Mehdi M,Neda S,Elham S,etal.Shotgun proteomic analysis of long-distance drought signaling in rice roots[J].JournalofProteomeResearch,2011,11(1):348-358.
收稿日期:2015-12-26修回日期:2016-03-23
基金项目:陕西省科技厅科技攻关项目(2013K01-16); 榆林市产学研项目(2014CXY-11-11)
通讯作者:刘永华(E-mail:liuyonghuaa@126.com)
中图分类号:S512.1;S312
文献标识码:A
文章编号:1009-1041(2016)06-0721-07
Screening and Identification of the Proteins Related to Drought in Root ofT.boeoticum
LI Xianhua1,LIU Yonghua1,LIU Hui2,LIU Cuiying1
(1.College of Life Science,College of Yulin,Yulin,Shaanxi 719000,China; 2.Institute of Biotechnology,Guizhou Academy of Agricultural Sciences,Guiyang,Guizhou 550006,China)
Abstract:To uncover the regulation network of Triticum boeoticum under drought stress,a proteomic approach was applied to identify the proteins relative to drought response in root of Triticum boeoticum. About two-week old seedlings of Triticum boeoticum(at three leaves stage) were treated with 20%(w/v) PEG6000. Proteins in root were isolated through two dimensional electrophoresis and indentified by mass spectrum. Eighty-five differential expressed proteins(DEPs) with at least 1.5-fold change in abundance were detected on the 2-DE gels. These proteins were mainly associated with carbon metabolism(27%),amino acid metabolism(15%),detoxification and defense(11%),chaperones(8%),energy metabolism(8%),signal transduction(6%),protein metabolism(5%),lipid metabolism(4%),transcription and translation(4%),nucleotide metabolism(2%),and cytoskeleton and cytokinesis(1%). Further functional analysis revealed that signal sensing and transduction-associated proteins were greatly up-regulated in the root. Glycolysis was down-regulated but PPP pathway enhanced in the root,resulting in the occurrence of complex changes in energy metabolism.Protein metabolism was down-regulated in the root,as well as most of amino acid metabolism associated proteins. However,the intensity of glutamate decarboxylase and methionine synthase was increased after drought stress. These results would contribute to the existing knowledge on the complexity of root protein changes that occur in response to drought.
Key words:Drought stress; T.boeoticum; Proteomics; 2-DE
网络出版时间:2016-05-30
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160530.1535.010.html
第一作者E-mail:lxhua0321@126.com
