国际医疗器械监管机构论坛独立软件工作组进展
2016-07-29彭亮袁鹏
彭亮袁鹏
1 国家食品药品监督管理总局医疗器械技术审评中心 ( 北京 100044)2 国家食品药品监督管理总局 ( 北京 100053)
国际医疗器械监管机构论坛独立软件工作组进展
彭亮1袁鹏2
1 国家食品药品监督管理总局医疗器械技术审评中心 ( 北京 100044)
2 国家食品药品监督管理总局 ( 北京 100053)
内容提要: 介绍国际医疗器械监管机构论坛独立软件工作组的进展情况,包括独立软件的关键定义、风险框架、质量管理体系和临床评价以及我国参考借鉴情况,以增强业内对医疗器械软件监管要求的认识。
关 键 词:国际医疗器械监管机构论坛 独立软件 风险框架 质量管理体系 临床评价
软件没有物理实体,变更频繁且迅速,与硬件相比存在诸多差异,具有特殊性,因此医疗器械软件的监管要求是当前业内持续关注的焦点和热点之一。
国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF)成立了独立软件工作组(Software as a Medical Device,SaMD),致力于协调和统一全球范围内对独立软件的监管要求和共识[1]。
我国作为IMDRF正式成员国一直参与SaMD工作组的相关工作,并积极参考借鉴SaMD工作组的文件成果,因此有必要介绍SaMD工作组的进展情况,以增强业内对医疗器械软件监管要求的认识,并进一步推动和促进我国医疗器械软件的监管工作。
1.背景介绍
1.1 IMDRF简介[1]
IMDRF于2011年2月提议成立,并于2011年10月正式成立,其前身是全球医疗器械协调工作组(GHTF),旨在加速国际医疗器械监管的协调工作并达成共识。
IMDRF是由全球医疗器械监管机构组成的志愿团体,包括正式成员、官方观察员和关联组织。当前正式成员包括美国、欧盟、日本、加拿大、澳大利亚、巴西、中国和俄罗斯,官方观察员包括世界卫生组织(WHO)和亚太经合组织(APEC),关联组织包括亚洲医疗器械法规协调组织(AHWP)和泛美卫生组织(PAHO)。
IMDRF当前工作组包括注册产品申报(RPS)、监管机构报告(NCAR)、独立软件(SaMD)、患者登记(PR)、良好审评实践(GRP)和不良事件术语(AET),关闭和即将关闭的工作组有医疗器械唯一标识(UDI)、标准认可(RS)和医疗器械单一审查程序(MDSAP)。
1.2 SaMD简介[1]
SaMD工作组于2013年3月提议成立,并于2013年5月正式成立,工作组名称前期为SMDS,后期改为SaMD。工作组旨在针对独立软件建立通用术语,开发监管措施,达成共识并促进创新。
SaMD工作组负责人来自美国食品药品监督管理局(FDA),成员来自监管机构和业界,当前监管机构包括美国、欧盟、日本、加拿大、澳大利亚、巴西、中国和新加坡,业界包括行业协会、企业和研究机构。成员随工作阶段的进展而进行调整,现约20人。
SaMD工作组通过电话会议、邮件、面对面会议开展日常工作,现已完成三个阶段的工作,并发布了三份指南文件,分别是独立软件的关键定义、风险框架和质量管理体系,当前阶段工作是独立软件的临床评价,指南文件尚在制订当中。
2.SaMD工作组进展
2.1 关键定义[2]
本阶段工作时间为2013年5月至12月,定义了五个关键术语,分别是独立软件、医疗目的、独立软件变更、独立软件制造商、预期用途/预期目的,其中独立软件和独立软件变更为全新术语,而其余三个术语基于GHTF的相关定义并结合独立软件的特性进行了修改完善。因篇幅所限,仅介绍全新定义,其它术语不再赘述。
“独立软件(SaMD)”是指预期用于一个或多个医疗目的,无需作为医疗器械硬件组成部分即可完成预期用途的软件,其中“无需作为医疗器械硬件组成部分”是指软件无需医疗器械硬件即可完成预期用途。独立软件能够运行于通用(非医用)计算平台,而预期用于驱动医疗器械硬件的软件不是独立软件。独立软件是医疗器械或体外诊断器械,移动应用如符合上述定义则为独立软件。
“独立软件变更(SaMD change)”是指独立软件在整个生存周期过程(包括维护阶段)所发生的任一修改,包括适应型(如适应新的运行环境)、完善型(如提高软件性能)、纠正型(纠正已发现的问题)和预防型(修正软件潜在未知缺陷以避免出现运行故障)。
2.2 风险框架[3]
本阶段工作时间为2013年6月至2014年9月,明确了独立软件的分类因素、定义声明、风险框架和考量因素。
分类因素主要考虑独立软件对医疗决策的重要性以及独立软件使用的医疗情形,其中独立软件对医疗决策的重要性根据对用户行动的影响程度分为:
(1)治疗或诊断:独立软件提供的信息用于采取立刻或近期的用户行动;
(2)驱动临床管理:独立软件提供的信息用于辅助治疗、辅助诊断、分类识别疾病早期征兆,并用于指导用户下一步的诊断或治疗;
(3)为临床管理提供信息:独立软件提供的信息不会触发立刻的或近期的用户行动。
而独立软件使用的医疗情形根据疾病、患者和用户的类型分为:
(1)危重情形:准确和/或及时的诊断或治疗活动对于避免患者个体死亡、长期伤残或其他严重健康恶化情形或缓解公共健康影响是至关重要的。疾病类型为危及生命(包括不可治愈)、需要重大治疗干预或是时间紧迫的,患者人群是脆弱的(如儿童),需要专业训练的用户;
(2)严重情形:准确诊断或治疗对于避免不必要的干预(如活检)是至关重要的,或及时干预对于缓解患者个体或公共健康长期不可逆后果是重要的。疾病类型为温和发展常可治愈、不需要重大治疗干预或非时间紧迫的,疾病人群非脆弱的,专业训练用户或普通用户均可;
(3)非严重情形:准确的诊断或治疗对于缓解患者个体或公共健康长期不可逆后果是重要的但不是决定性的。疾病类型为进程缓慢(包括轻微慢性病)、虽不可治愈但可有效管理的、仅需要轻微的治疗干预(如非侵入)的,预期人群是不全是患者(如健康人群),专业训练用户或普通用户均可。
独立软件制造商应根据上述分类因素出具独立软件的定义声明,内容包括独立软件对医疗决策的重要性、独立软件使用的医疗情形、独立软件的核心功能(独立软件在预期使用医疗情形中提供预期决策信息所必需的关键功能,包括安全性功能)。
独立软件的风险框架根据分类因素可分为四种类型(详见表1),其中I型风险最低,IV型风险最高,风险越高则风险控制措施越严格。
独立软件的考量因素包括通用考量和专用考量,其中通用考量包括软件设计开发(含上市后监测)和软件变更,而专用考量包括社会技术环境、技术与系统环境、信息安全。社会技术环境主要关注独立软件的使用设置,包含硬件、网络、软件和人;技术与系统环境主要关注独立软件所处的生态环境,包括系统、互连设备和硬件平台;信息安全主要关注独立软件的保密性、完整性和可得性。
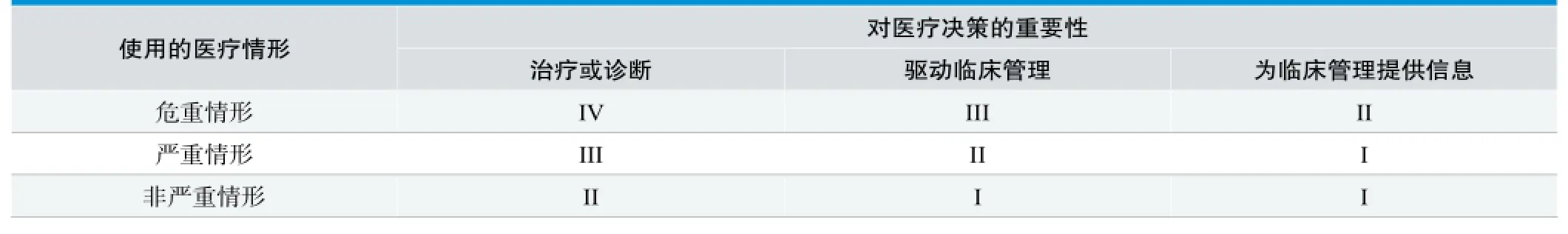
表1.独立软件风险框架
2.3 质量管理体系[4]
本阶段工作时间为2014年9月至2015年10月,基于ISO 13485:2003《医疗器械质量管理体系用于法规的要
求》明确了独立软件的质量管理原则,包括领导和组织支持、生存周期支持过程、实现和使用过程。
领导和组织支持包括领导和职责、资源和基础设施管理(含人力资源、基础设施和工作环境);生存周期支持
过程包括产品策划、风险管理、文件和记录控制、配置管理、过程和产品的测量、分析和改进、管理外包流程、活动和产品;实现和使用过程包括需求管理、设计、开发、验证
与确认、部署、维护、停运,重点关注患者安全与临床环境、技术与系统环境。
领导和组织支持是生存周期支持过程的基础,生存周期支持过程贯穿于实现和使用过程,实现和使用过程确保独立软件的安全性与有效性。
2.4 临床评价
在上一阶段工作即将结束之际,工作组拟定了后续工作的四个议题,分别是独立软件的临床评价、需经上市批准的独立软件类型、独立软件上市后监管(含软件变更、配置管理)、独立软件体系考核的时机和方式,经网络调查后最终确定为独立软件的临床评价。
为此,本阶段调整了工作组成员,重组了工作组,于2015年12月正式启动工作,目前正在起草工作组内部讨论稿,计划于2016年7月完成征求意见稿,2017年2月完成本阶段工作。
3.我国参考借鉴情况
3.1 独立软件
医疗器械分类规则(国家食品药品监督管理总局令第15号)将独立软件定义为“具有一个或者多个医疗目的,无需医疗器械硬件即可完成自身预期目的,运行于通用计算平台的软件”,医疗器械软件注册技术审查指导原则(以下简称软件指导原则)明确“独立软件应同时具备以下三个特征:具有一个或多个医疗用途,无需医疗器械硬件即可完成预期用途,运行于通用计算平台;软件组件应同时具备以下两个特征:具有一个或多个医疗用途,控制(驱动)医疗器械硬件或运行于专用(医用)计算平台”,均是依据SaMD工作组关于独立软件的定义[2,5~6]。虽然文字描述略有不同,但本质上是一致的,主要是结合我国监管实际情况进行了适当调整。
3.2 软件更新
软件指导原则明确“医疗器械软件更新是指制造商在整个软件生存周期过程中对软件所做的任一修改”,依据SaMD工作组关于软件变更的定义[2,6],同样结合我国监管实际情况进行了适当调整:一是将“软件变更”改为“软件更新”,避免和法规所述的“注册变更”相混淆[7];二是明确软件更新的实施主体是“制造商”。
3.3 安全性级别
软件指导原则明确“软件安全性级别应结合软件的预期用途、使用环境和核心功能(软件在预期使用环境完成预期用途所必需的功能)进行判定”,主要是依据SaMD工作组关于独立软件风险框架和定义声明的要求[3,6]。
3.4 核心算法
软件指导原则明确“核心算法是指实现软件核心功能(软件在预期使用环境完成预期用途所必需的功能)所必需的算法”,主要是与SaMD工作组关于独立软件核心功能的要求相关联”[3,6]。核心算法是从技术角度关注软件的特性,而核心功能是从使用角度关注软件的特性,二者是多对多的关系,即同一核心算法可为多个核心功能所使用,一个核心功能可以采用多个核心算法。因此,核心算法和核心功能虽然关注角度不同,但本质上要求相同。
总之,随着IMDRF独立软件工作组的工作推进,独立软件监管要求会逐渐完善并形成国际共识,有利于推动医疗器械软件的监管工作。同时,我国作为IMDRF的正式成员,有责任有义务参考借鉴IMDRF相关文件成果,结合我国医疗器械监管的实际情况调整和落实IMDRF的相关要求,以进一步促进我国医疗器械监管工作。
参考文献
[1] IMDRF Website.http://www.imdrf.org.[OL]
[2] IMDRF.Software as a Medical Device: Key Defnitions(IMDRF/SaMD WG/N10FINAL:2013)[EB/OL].(2013-12-18)[2016-6-7].http://www.imdrf.org/docs/imdrf/fnal/technical/imdrf-tech-131209-samd-key-defnitions-140901.pdf
[3] IMDRF.Software as a Medical Device: Possible Framework for Risk Categorization and Corresponding Considerations(IMDRF/SaMDWG/N12FINAL:2014)[EB/OL].(2014-9-18)[2016-6-7].http://www.imdrf.org/docs/imdrf/fnal/technical/imdrf-tech-140918-samd-framework-risk-categorization-141013.pdf
[4] IMDRF.Software as a Medical Device: Application of Quality Management System(IMDRF/SaMD WG/N23 FINAL:2015)[EB/OL].(2015-10-2)[2016-6-7].http://www.imdrf.org/docs/imdrf/fnal/technical/imdrf-tech-151002-samd-qms.pdf
[5] 国家食品药品监督管理总局.《医疗器械分类规则》(总局令第15号)[EB/OL].(2015-7-14)[2016-6-7].http://www.sda.gov.cn/WS01/ CL0053/124222.html
[6] 国家食品药品监督管理总局.《医疗器械软件注册技术审查指导原则》[EB/OL].(2015-8-5)[2016-6-7].http://www.sda.gov.cn/WS01/ CL0087/126243.html
[7] 国家食品药品监督管理总局.《医疗器械注册管理办法》(总局令第4号)[EB/OL].(2014-7-30)[2016-6-7].http://www.sda.gov.cn/WS01/ CL0053/103756.html
文章编号:1006-6586(2016)01-0102-04 中图分类号:R197
文献标识码:D
作者简介:彭亮,工学博士,国际医疗器械监管机构论坛(IMDRF)独立软件工作组(SaMD)成员;袁鹏,国际医疗器械监管机构论坛(IMDRF)独立软件工作组(SaMD)成员。
Progress of IMDRF SaMD Working Group
PENG Liang1YUANPeng2
1 Center for Medical Device Evaluation, CFDA (Beijing 100044)
2 China Food and Drug Administration (Beijing 100053)
Abstract:The progress of IMDRF SaMD Working Group was introduced, including the key defnitions, risk framework, quality management system and clinical evaluation of SaMD, and the chinese references to IMDRF SaMD documents, in order to enhance the industry understanding on the regulation requirements of medical device software.
Key words:IMDRF, SaMD, risk framework, quality management system, clinical evaluation
