磁敏感加权成像在肺癌脑转移瘤诊断中的应用价值
2016-07-29刘子姗詹茸婷王明磊赵超云葸燕燕高文奇张伟黄雪莹王晓东
刘子姗詹茸婷王明磊赵超云葸燕燕高文奇张 伟黄雪莹王晓东,3
磁敏感加权成像在肺癌脑转移瘤诊断中的应用价值
刘子姗1詹茸婷2王明磊2赵超云1葸燕燕2高文奇1张 伟2黄雪莹2王晓东2,3
【摘要】目的:研究肺癌脑转移瘤在磁敏感加权图像(SWI)上的影像特点,比较其与常规MRI在脑转移瘤显示方面的不同,探讨SWI对脑转移瘤的诊断价值。方法:回顾性分析经临床证实的肺癌脑转移患者24例,其中单发8例,多发16例。所有病例均行MR常规平扫(T1WI、T2WI、T2flair)、增强扫描及SWI扫描。结果:MR常规平扫检出146个病灶,T1WI增强扫描检出221个病灶,SWI扫描检出222个病灶,其中常规序列检出出血的瘤灶35个,SWI 检出出血瘤灶113个。Friedman秩和检验显示在脑转移灶检出数目方面,常规MR平扫明显少于T1WI增强扫描和SWI序列(P<0.05),但T1WI增强扫描与SWI序列之间无统计学差异(P >0.05);在出血性瘤灶数目检出方面,SWI明显优于常规序列(P<0.05)。结论:SWI对于脑转移瘤的显示具有较高的敏感性,并在肺癌脑转移瘤内部出血显示具有一定优势。与常规MR相比,SWI能够在肺癌脑转移瘤的诊断中提供更多影像学信息。
【关键词】磁敏感加权成像;脑转移瘤;磁共振成像
脑转移瘤 ( brain metastasis,BM) 是常见的颅脑继发性肿瘤,发病率为颅内肿瘤的10%~15%[1],近些年其发病率逐渐升高。发生脑转移的原发肿瘤中最常见的是肺癌,约1/3的肺癌病人会发生脑转移,肺癌脑转移约占所有脑转移瘤的50%[2]。T1WI增强目前被公认为是发现脑转移瘤的最佳序列[3]。某些早期、体积较小的脑转移瘤可因强化不明显及瘤周无明显水肿而漏诊,随着磁共振技术不断发展,SWI作为一种新型的MR功能成像技术,在静脉血流及含去氧血红蛋白丰富的微小病灶的显示方面,表现出非常高的检出率。肺癌脑转移瘤早期就可发生出血,此时的病灶体积尚小,SWI因其成像特点对于这类病灶的检出会明显优于常规MR。本文通过观察SWI提供的脑转移瘤的影像学信息,探讨其在脑转移瘤诊断中的应用价值。
方 法
1.一般资料
收集自2015年4月-2015年9月于宁夏医科大学总医院经临床证实的24例肺癌脑转移患者,男性17例,女性7例,平均年龄52.5岁(35~68岁),均有明确原发性肺癌病史(其中腺癌14例,鳞癌3例,小细胞癌7例),所有患者原发肿瘤均经病理证实。所有病例经随访确诊为脑转移瘤。临床表现有头痛、癫痫发作、恶心、呕吐、肢体活动功能障碍等症状。所有病例的病史及颅内病灶影像特征符合脑转移瘤特点。
2.检查方法
采用GE Signa EXCITE 3.0T HDMR扫描仪8通道头线圈,所有病例均行常规MRI平扫、增强及SWI序列检查。常规MRI扫描包括T1液体衰减反转恢复序列(T1 FLAIR,TR/TE=2072/26.7ms,TI=920ms)、T2液体衰减反转恢复序列(T2FLAIR,TR/TE=8002/146.4ms,TI=2150.0ms)和T2WI(TR/TE=4600/107ms)。层厚为6.0mm,间隔为0.5mm,FOV=24cm×24cm。对比剂为钆喷酸二葡甲铵,其使用剂量为 0.1mmol/kg 。SWI采用3D SPGR序列,TR/TE=36/20ms,矩阵448×384,NEX=0.75,带宽为15.6kHz,反转角为20°,层厚2mm,间距0mm。患者检查时,先行常规平扫,然后行SWI,最后行T1WI 增强扫描。
3.图像后处理
在ADW4.4工作站上对采集到的SWI原始图像进行后处理,用functool软件进行SWI计算,得到校正后的相位图(CPI)及磁敏感加权图像(SWI),磁敏感加权图像行最小信号强度投影(MinIP)得到SWIminIP图像。
4.图像分析
两位高年资神经影像学诊断医师采用盲法分别对常规MR图像及SWI图像进行分析。分析图像内容包括:脑实质内病变数目、位置及信号特点。常规MR平扫图像上:以T2 FLAIR图像作为观察病灶最佳序列,T2 FLAIR图像上病灶呈与周围组织对比明显的高信号,将这类信号灶暂定为可疑转移灶,对照观察T1WI增强图像与T2 FLAIR图像,与T1WI增强图像转移灶相一致者即为平扫图像转移灶(图1A、图1C);常规T1WI增强图像上转移病灶识别:颅内单发或多发结节状、环状均匀或不均匀强化灶。转移灶SWI图像的辨别:病灶呈圆形或椭圆形稍低信号,信号稍低于脑白质信号,周边伴有不同程度的类似T2WI序列样高信号的水肿带;坏死区信号高而肿瘤内实质信号为低信号;瘤内出血的信号与瘤内及瘤周静脉的信号接近,出血在SWIminIP图连续层面上无延续性,呈大小不一的点、簇状低信号,而血管在SWIminIP图像上下层面可连续观察到并相连在一起似管状,边缘光整。在相位图上对出血和钙化进行区分,出血在校正后的相位图表现为低信号,钙化在校正后的相位图表现为高信号。常规MR图像上出血灶的判断:常规T1WI平扫上示高信号灶,对照观察常规T1WI与SWI图像,与SWI图像出血灶相一致者即为常规图像出血灶(图1B、图1D)。
5.统计学方法
对各序列所得结果进行非参数统计,所有变量资料采用Friedman秩和检验,将P<0.05定义为差异有统计学意义,所有统计学处理用SPSS 17.0完成。
结 果
24例肺癌脑转移瘤患者中,肺癌病理类型包括:腺癌14例(58%),鳞癌3例(12.5%),小细胞癌7例(29.5%);均为脑实质转移,其中8例(33.3%)单发,16例(66.7%)多发。24例患者常规MR平扫均未能显示瘤内血管,增强后病灶实性部分及供血动脉强化,同样未能清楚显示瘤内静脉血管;SWI可清晰显示瘤内出血及肿瘤内静脉血管影(图2)。
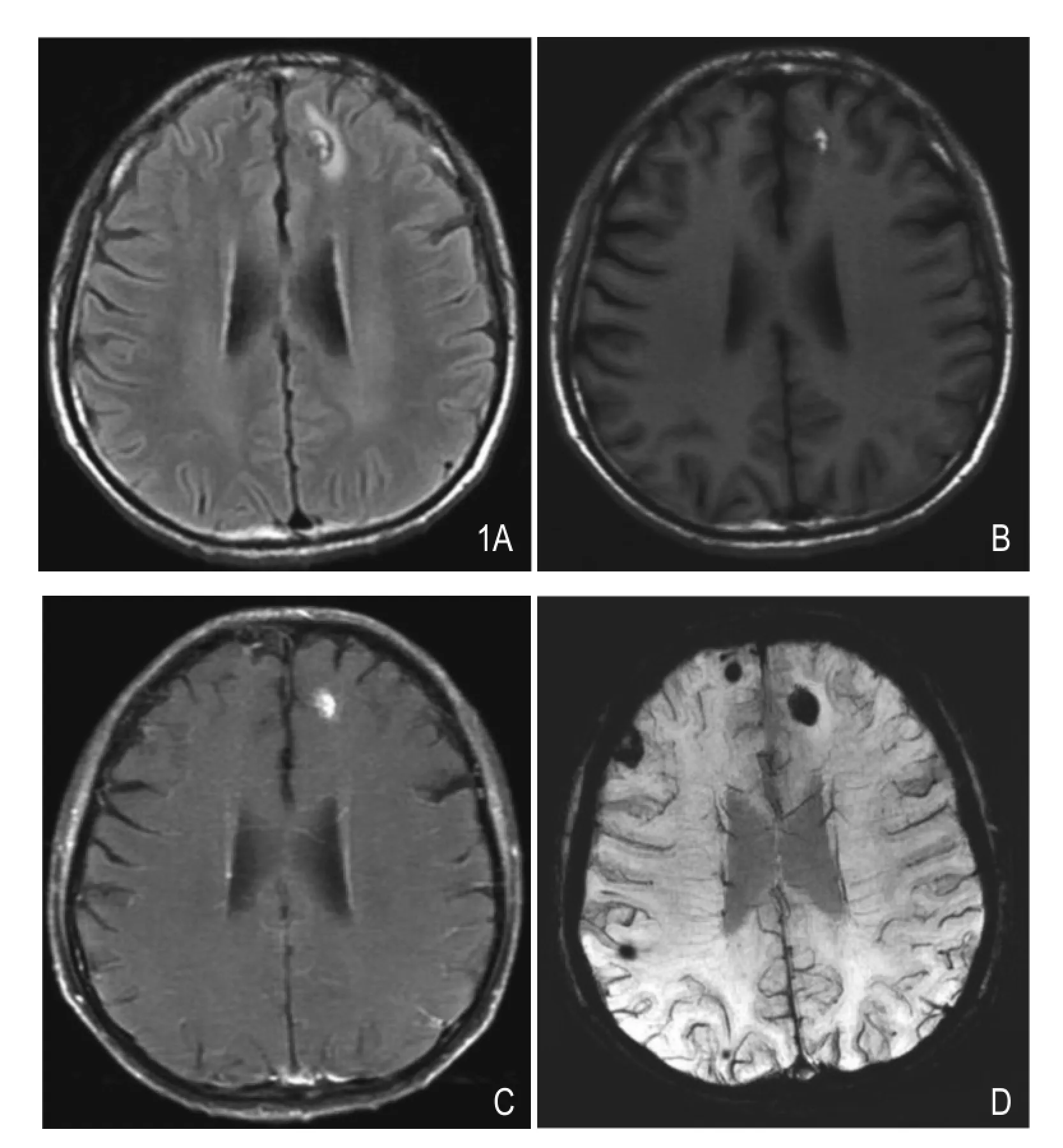
图1 男,52岁,左上肺中分化腺癌脑转移。A. T2 FLAIR图像示左侧额叶皮髓交界区见一小片状混杂稍高信号,可见含铁血黄素沉积,周边水肿呈高信号。B.T1WI平扫图像,病灶呈高信号,周边水肿呈低信号。C.T1WI增强示病灶呈结节样强化。D.SWIminIP图像,除左侧额叶病灶外,还可见右侧额、顶叶多发病灶(A、B图均未见明确显示,C图于相应部位出现信号稍不均,但未见明确病灶显示),病灶呈片状低信号,提示出血。
1.脑转移瘤的位置、数目及信号特点
24例肺癌脑转移瘤患者,常规MR平扫共检出146个病灶,常规T1WI增强扫描共检出221个病灶,SWI检出222个病灶,24例患者中有21例患者在常规T1WI增强与SWI图像上检出病灶数目相等,另外3例患者中有2例患者在常规T1WI增强较SWI显示出的病灶个数一共多8个,这8个病灶中有5个位于额底部,另外3个病灶位于颞叶贴近颅骨处,这些病灶在SWI图像上均未能显示(图3)。另1例患者的常规T1WI增强较SWI显示出的病灶个数少。病灶位置及数目分布如表1。多数病灶呈长T1长T2信号灶,部分病灶伴出血、囊变坏死,呈混杂信号,出血在T1WI图像呈高信号,囊变坏死呈明显长T1 长T2信号;病灶的强化方式也各不相同:不均匀强化、环形强化、结节状强化;不同病灶周边伴有不同程度水肿,较小病灶(<1.0cm)周边可不伴有水肿;SWI上出血病灶呈明显低信号,瘤内肿瘤相关静脉在连续层面上呈具有延续性的点状、细线状低信号。
2. 三种序列检出脑转移灶数目比较
常规MR平扫检出最少,为146个,显著少于T1WI增强扫描的221个和SWI序列的222个(P均<0.05)见表2;后两者之间没有明显差异(P>0.05)。
3. 三种序列检出出血性瘤灶数目比较
SWI对出血敏感,检出出血性瘤灶(113个)显著多于常规序列(包括T1WI平扫、T2WI平扫、T2 FLAIR平扫)和 T1WI增强扫描序列(35个)(P<0.05)。
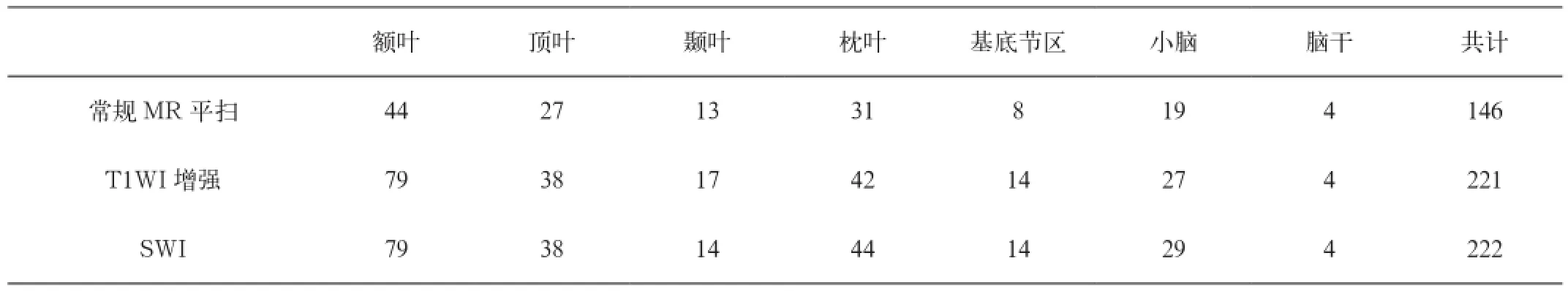
表1 各序列检出病灶位置及数目(个)
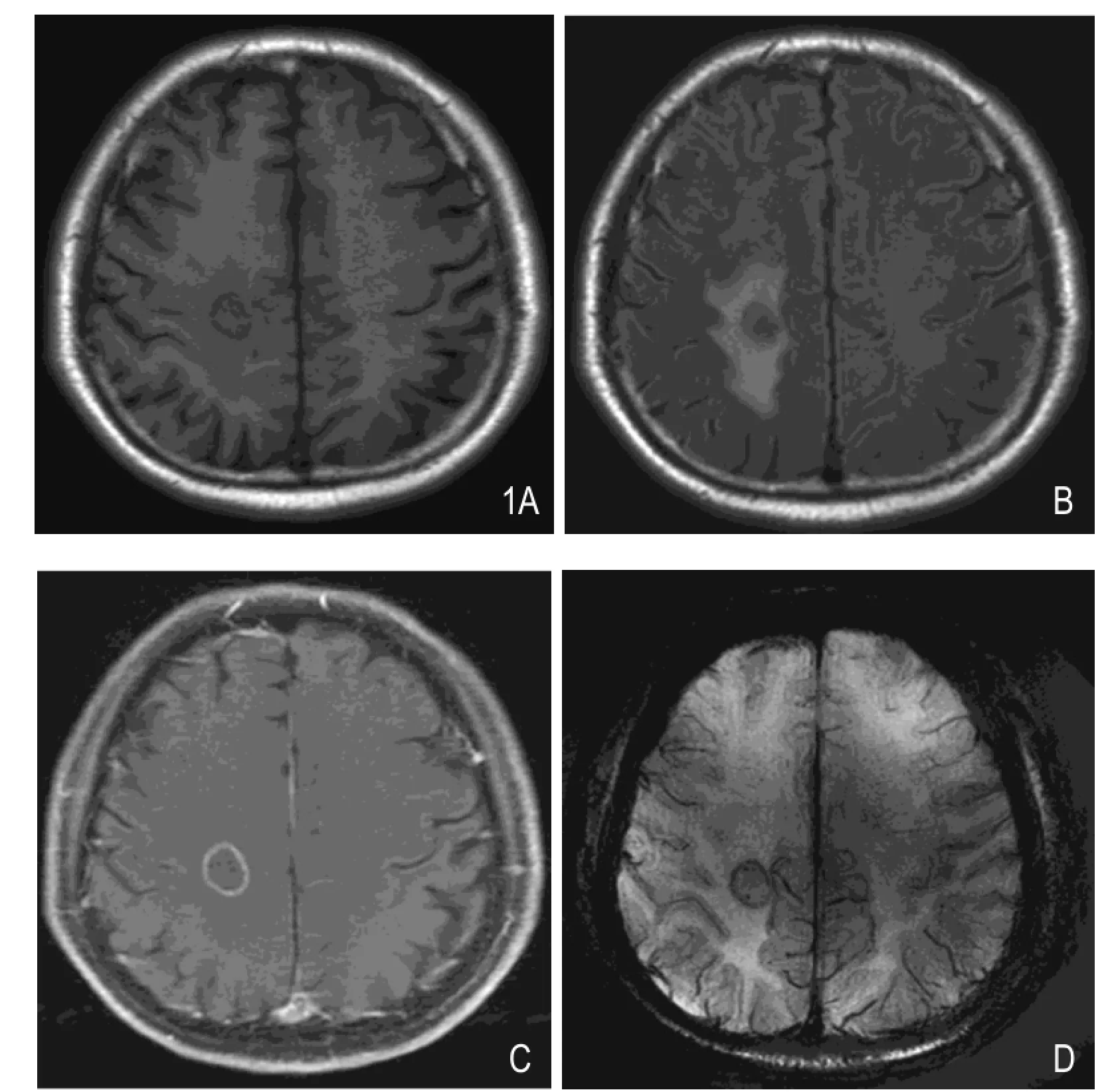
图2 男,52岁,左上肺低分化鳞癌脑转移。A.T1WI平扫示右侧额叶见一类圆形混杂低信号病灶,瘤周见片状低信号水肿。B.T2-flair图像示病灶呈混杂低信号,瘤周水肿呈片状高信号。C.T1WI增强图像示病灶呈环形强化,最大径约1.8cm。D. SWIminIP图像示病灶内可见点状低信号,连续层面观察证实为瘤内引流静脉。
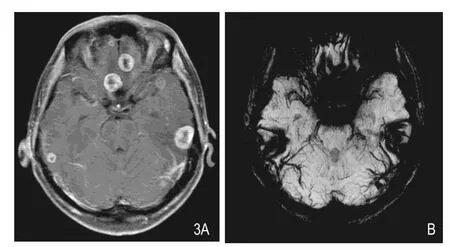
图3 男性,31岁,肺小细胞癌脑转移。A.增强扫描示双侧额叶、颞叶多发病灶,呈环形强化。B. SWIminIP图像于相应层面未能显示A图中所示病灶,由于病灶处于额底部及颞叶近颅骨处,磁化率伪影的影响而导致病灶未能显示。
讨 论
近些年,我国肺癌发病率和死亡率不断升高,肺癌极易在早期发生远处转移,脑是肺癌远处转移最常受累的器官。脑转移瘤严重影响患者存活率和生存质量,若不进行治疗,脑转移患者的中位生存期仅为1~2个月[4]。因此,脑转移瘤早期准确的诊断对其治疗及预后是非常重要的。既往有研究显示,SWI在脑转移瘤的显示方面优于T1WI增强,其对于肿瘤边界的显示较清晰,SWI在脑转移瘤的检测方面有更高的敏感性和更高的检出率[5-6]。同时,国内也有学者指出SWI能显示肿瘤内出血及引流静脉[7],这些是常规MRI可能难以显示的。Kim等[8]的研究结果也显示SWI对脑内异常强化灶诊断的正确率远大于常规MRI。迄今为止,常规MRI仅利用了质子的磁距信息,相位信息常常被忽略,一些重要信息如不同组织的磁敏感信息就无从获得,而这些磁敏感信息是可以用来对造成局部磁场改变的物质如铁进行定量分析研究的。在临床实践中,常规磁共振成像方式从根本上其实是组织弛豫时间的加权。在这些图像上,研究区域组织间的对比是基于横向弛豫(T2)和/或纵向弛豫(T1)的显著差异。但是,由于顺磁性和抗磁性原子分别产生的磁场不均匀性使他们的弛豫时间都减少,因此弛豫加权图像无法区分含铁血黄素和钙化。磁敏感信息是对传统自旋密度成像(T1,T2,PD加权成像)方法的补充,能够显示更加详细的信息。磁敏感加权成像能够增加钙化与含铁血黄素沉积之间的对比。随着SWI逐渐被广泛运用于临床,更多疾病的诊治都会受益。目前,SWI已经广泛应用于神经系统疾病,如颅脑外伤、血管畸形、脑梗死、肿瘤及神经系统传染性疾病(神经弓形虫病、囊虫病)的临床诊断[9-11]。
本研究显示,常规MR平扫对脑转移瘤的检出率明显低于SWI及T1WI增强扫描,而SWI与T1WI增强扫描对于脑转移瘤的检出率差异不大,这与崔恒武等[12]的研究结果是一致的。但由于SWI可以清晰显示肿瘤内出血及瘤内引流静脉,这些成分在SWI图像上呈明显低信号,使病灶与周围组织形成鲜明对比,发生瘤内出血的病灶在SWI上的清晰度更优于T1WI增强图像。肺癌脑转移瘤很易发生出血,其中以腺癌脑转移瘤发生出血最为多见,常规MR平扫及增强对出血小病灶的显示远不如SWI图像上清晰,无法及时检测病灶存在,将会延误治疗。本研究中常规MR扫描发现出血病灶共35个,SWI发现113个,印证了SWI在显示瘤内出血方面较常规MRI占有明显的优势。SWI在显示瘤内出血、静脉血管方面明显优于常规MR扫描,提高了图像的对比度。在不使用对比剂的情况下,就可以很清晰地显示病灶,其诊断效果可以与常规MR增强相媲美,这对于有对比剂禁忌证或不能耐受团注对比剂的脑肿瘤患者是非常适用的[13]。除了与常规平扫及常规增强比较对病灶的检出率,本次研究对SWI图像的观察中,在24例患者的SWIminIP图像上除了病灶内出血还可以分辨出病灶内静脉血管影,Brem等[14]提出肿瘤内新生血管数量能间接反映肿瘤级别及其侵袭性的可能。新生血管的变化与肿瘤治疗的疗效评估息息相关,以上都为进一步研究奠定了重要基础。
本次研究中,样本数目较少,尚不能对不同病理类型肺癌脑转移瘤的影像学表现进行归纳总结,由于SWI利用组织间磁敏感差异成像,血浆内蛋白、pH值、温度、血流等因素均可造成局部磁场不均匀,继而影响图像质量。脑组织贴近颅骨处、鼻窦旁及气/骨交界处的磁敏感差异较大,会产生磁化率伪影。本研究中有2例患者SWI图像病灶检出数目比T1WI图像少。其中1例患者有4个病灶位于额底部,另外3个病灶位于颞叶贴近颅骨处,这些位置均会产生磁化率伪影,从而影响了这些病灶在SWI图像上的显示。另1例患者SWI病灶检出数目比T1WI增强少1个,漏诊病灶位于额底近鼻窦处,这样的结果也是上述原因造成的。同时,陈旧性出血灶、小静脉、钙化在SWI上均为低信号,上述因素造成SWI信号的复杂性,如本次研究中某些病灶因出血较多而掩盖了瘤内静脉血管的显示,仅依靠SWI对疾病进行诊断就有一定的局限性,临床上可以结合CT和常规MR对比增强SWI提高疾病诊断准确率。在今后的研究中,扩大样本数量,对不同病理类型的肺癌脑转移瘤在SWI上的表现进行分类总结,并对脑转移瘤放疗前后SWI图像上变化进行对比分析,观察其前后变化,以期为临床观察疗效、评估预后及制定后续诊疗方案提供帮助。
综上所述,SWI在肺癌脑转移瘤的检出中具有较高的敏感性,并可显示瘤内微小出血灶及肿瘤相关静脉,作为常规序列的重要补充,在肺癌脑转移瘤的诊断方面具有较高的价值及应用前景。SWI应该作为一种常规检查序列应用于临床,从而更早、更多地检测出更小的病灶,可以更早地为患者进行临床治疗,提高患者存活率及生存质量。通过进一步的研究,在SWI上观察脑转移瘤放疗前后的变化,探究其在脑转移瘤放射治疗方面的应用价值,为评估疗效提供一种新的方法。
参 考 文 献
[1]Kim ES,Chang JH,Choi HS,et al.Diagnostic yield of double-dose gadobutrol in the detection of brain metastasis:intraindividual comparison with double-dose gadopentetate dimeglumine. AJNR,2010,31:1055-1058.
[2]刘 懿, 陈 军.肺癌脑转移的诊治进展.中国肺癌杂志, 2013,7:382-386.
[3]孙朋朋,庄培恋,郑林丰,等. 3.0T MR不同序列扫描技术在肺癌脑转移诊断中的应用.实用放射学杂志,2011,27:5-8.
[4]Ohta y,Oda M,Sunezuka Y,et al.Results of recent therapy for nonsmall-cell lung cancer with brain metastasis as the initial replapse.Am J Clin Oncol,2002,25:476-479
[5]Travis W D,Brambilla E,Muller-Hermelink H K,et al.World Health Organization classification of tumours.pathology and genetics of tumours of the lung,pleura,thymus and hear Lyon:LARC,2004:26-27.
[6]Kim T S,Han J,Lee K S,et al.CT findings of surgically resected pleomorphic carcinoma of the lung in 30 patients.AJR,2005,185:120-125.
[7]詹茸婷,和 鸿,黄雪莹,等.脑肿瘤病变增强后磁敏感加权成像的临床价值.中国医学计算机成像杂志, 2014, 20:105-109.
[8]Kim H S,Jahng G H,Ryu C W.Added value and diagnostic performance of intratumoral susceptibility signals in the differential diagnosis of solitary enhancing brain lesions: preliminary study. AJNR,2009,30:1574-1579.
[9]Gupta D, Saini J, Kesavadas C, et al. Utility of susceptibility weighted MRI in differentiating Parkinson's disease and atypical parkinsonism. Neuroradiology, 2010,52:1087-1094.
[10]Berberat J, Grobholz R, Boxheimer L, et al. Differentiation between calcification and hemorrhage in brain tumors using susceptibility weighted imaging: a pilot study. AJR Am J Roentgenol,2014,202:847-850.
[11]郭子义,脑磁共振成像原理.北京:北京大学医学出版社,2012:160-198.
[12]崔恒武, 董津邑,葛宇曦,等.脑转移瘤放疗前后的SWI及增强T1WI对比研究. 实用放射学杂志, 2014, 30: 1955-1981.
[13]闫晴晴,章作铨,黄穗乔,等.磁共振功能成像在脑肿瘤诊断中的应用.中国神经肿瘤杂志,2011,9:247-252.
[14]Brem S, Cotran R, Folkman J.Tumor angiogenesis: Aquantitative method for histologic grading. J Natl Cancer Inst ,1972,48:347-356.
中国医学计算机成像杂志,2016,22:198-203
Chin Comput Med Imag,2016,22:198-203
1 Ningxia Medical University
2 Department of Radiology, General Hospital of Ningxia Medical University
3 Ningxia Key Laboratory of Cerebrocranial Diseases
Address: 804 Shenglinan Rd.,Yinchuan,750004,P.R.C.
Address Correspondence to WANG Xiao-dong(E-mail: xdw80@yeah.net)
中图分类号:R445.2
文献标志码:A
文章编号:1006-5741(2016)-03-0198-06
收稿时间:(2015.11.06;修回时间:2016.02.01)
作者单位:1宁夏医科大学临床学院2宁夏医科大学总医院放射科3宁夏颅脑疾病重点实验室
通信地址:宁夏自治区银川市兴庆区胜利南街804号, 银川 750004 s: 1.Ningxia Hui Autonomous Region Health Department focused research programs (No.2008043); 2. Open topic of Ningxia Key Laboratory of Cerebrocranial Diseases(XY201407)
通信作者:王晓东(电子邮箱:xdw80@yeah.net)
基金项目:1宁夏回族自治区卫生厅重点科研计划(No.2008043)2宁夏颅脑疾病重点实验室开放课题(XY201407)
The Clinical Application of Susceptibility Weighted Imaging in the Diagnosis of Brain Metastases from Lung Cancer
LIU Zi-shan1, ZHAN Rong-ting2, WANG Ming-lei2, ZHAO Chao-yun1, XI Yan-yan2,GAO Wen-qi1, ZHANG Wei2, HUANG Xue-ying2, WANG Xiao-dong2,3
【Abstract】Purpose: To study the features of brain metastases from lung cancer on susceptibility weighted imaging (SWI), and to evaluate the diagnostic value of susceptibility weighted imaging in detection of brain metastases. Methods: Twenty-four cases of brain metastasis from lung cancer were analyzed retrospectively. There were 8 cases with single lesion and 16 cases with multiple lesions. Conventional MR imaging (including pre- and post-contrasted T1 weighted imaging(T1WI), T2 weighted imaging(T2WI) and T2 fast fuid attenuated inversion recovery) (FLAIR)and SWI were undergone in all cases. Results: More lesions were detected on post-contrasted T1WI (n=221) and SWI (n=222) than those on the pre-contrast MRI (n=146). The difference was with statistical signifcance between post-contrasted T1WI and pre-contrast MRI (P<0.05), and between SWI and pre-contrast MRI (P<0.05); there wasno statistical signifcance between post-contrasted T1WI and SWI in lesion detection (P>0.05); the number of tumors with hemorrhage detected on SWI (n=113) was signifcantly more than those on conventional MRI (n=35) (P<0.05). Conclusion: SWI is with high sensitivity to detect the brain metastasis, and it has certain advantages in detecting intratumoral small vessels and micro-hemorrhage in brain metastasis from lung cancer. SWI can provide more imaging information than conventional MRI in the diagnosis of brain metastases from lung cancer.
【Key words】Susceptibility weighted imaging;Brain metastasis;MRI
