氧化还原反应高频考点精析
2016-07-28广东雷范军乐善堂
◇ 广东 雷范军 乐善堂
重点辅导
氧化还原反应高频考点精析
◇广东雷范军1,2乐善堂1
氧化还原反应属于高中化学的基本概念和重要理论,在历年高考中出现的频率较高.本文结合《考试说明》的要求提炼该部分常见的重要考点,并精选典型试题进行分析.
1有关氧化还原反应的重要概念
该考点通常涉及化合价、氧化还原反应、非氧化还原反应、4大反应类型、氧化反应、还原反应、被氧化、被还原、氧化作用、还原作用、氧化性、还原性、电子转移的简单计算等内容,一般与元素化合物的主要性质和制备、原电池原理、电解原理、金属的腐蚀与防护、化学实验等综合在一起考查.

①Na2O2用作呼吸面具的供氧剂、工业上电解熔融状态的Al2O3制备Al、实验室用NH4Cl和Ca(OH)2制备NH3,均涉及氧化还原反应;
② 铜锌原电池工作时,铜电极上发生氧化反应;
③ 2Na2O2+2H2O=4NaOH+O2↑、Cl2+H2O=HCl+HClO,二者都是氧化还原反应,且水都既不是氧化剂又不是还原剂;
④Cl2+2Br-=2Cl-+Br2、Zn+Cu2+=Zn2++Cu,二者均是单质被还原的置换反应;
⑤ 大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,该反应的还原产物为MnSO4(或Mn2+);
⑥ 海绵铜(主要成分是Cu和少量CuO)用NH4NO3、H2O、H2SO4溶解时得到的氧化产物是CuSO4或Cu2+;
⑦SO2能使溴水褪色,说明SO2具有漂白性;
⑧ 假如草酸晶体(H2C2O4·2H2O)热分解产生的气体中含有CO,就必然含有CO2.
A①③④⑦;B②④⑤⑦;
C①②⑥⑧;D③⑤⑥⑧


2有关氧化还原反应的重要规律
该考点主要涉及有升必有降规律、优先转化为相邻价态规律、化合价升降总数相等、电子得失守恒原理、氧化性和还原性强弱顺序、氧化或还原的先后规律、氧化还原反应方程式的配平和简单计算等内容,一般与元素化合物的主要性质、元素周期律、化工生产工艺流程、电化学、化学实验方案的设计与评价等综合在一起考查.

① 工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2∶1;
③ 单质氧化性的强弱,能作为判断硫、氯2种元素非金属性强弱的依据;
④ 1molFe与足量的稀HNO3反应,转移2mol电子;
⑤Mg在CO2中燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性;
⑥ 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,溶液变成蓝色,说明Cl2的氧化性强于I2;
⑦SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4;
⑧ 已知Br2的氧化性强于Fe3+,FeBr2溶液中通入少量的Cl2,首先发生反应的离子方程式为2Br-+Cl2=Br2+2Cl-.
A①③④⑥;B②⑤⑥⑧;
C①③⑤⑦;D②④⑦⑧


3有关氧化还原反应方程式的配平及计算
该考点通常涉及化合价升降的最小公倍数法、设“1”法、电子守恒定律、质量守恒定律、物质的量及其在方程式计算中的应用等内容,一般与元素化合物的性质、工艺流程、滴定原理的应用、原电池原理、电解原理、物质推断等综合在一起考查.

□NaBO2+□SiO2+Na+□H2=
□NaBH4+□Na2SiO3.
(2) 纤维素还原法制ClO2是一种新方法,其原理是纤维素水解得到的最终产物D与NaClO3反应生成ClO2.完成如下反应的化学方程式:
□______+24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□______.

(4) 汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则被氧化的N原子的物质的量为________.


C6H12O6+24NaClO3+12H2SO4=
24ClO2↑+6CO2↑+18H2O+12Na2SO4.


(4)NaN3中氮元素由-1/3升高为0价,KNO3中氮元素由+5价降低为0价,则NaN3是还原剂,KNO3是氧化剂,N2既是氧化产物又是还原产物.设KNO3为2xmol,则NaN3为10xmol,则属于还原产物的N2为xmol,属于氧化产物的N2为15xmol,由题意可知,15x-x=1.75,则x=0.125,被氧化的N原子的物质的量为10×3×0.125mol=3.75mol.
答案(1) 1、2、4、2、1、2;
(2) 1、C6H12O6、24、6、12、Na2SO4;


4真题演练

A明矾作净水剂;
B甘油作护肤保湿剂;
C漂粉精作消毒剂;
D铁粉作食品袋内的脱氧剂


A2Na+2NH3→ 2NaNH2+H2↑;
B2NH3+3CuO→ 3Cu+N2+3H2O;
C4NH3+6NO→ 5N2+6H2O;
D3SiH4+4NH3→Si3N4+12H2


A明矾净化水;B纯碱去油污;
C食醋除水垢;D漂白粉漂白织物


A硫元素既被氧化又被还原;
B氧化剂与还原剂的物质的量之比为1∶2;
C每生成1molNa2S2O3,转移4mol电子;
D相同条件下,每吸收10m3SO2就会放出2.5m3CO2


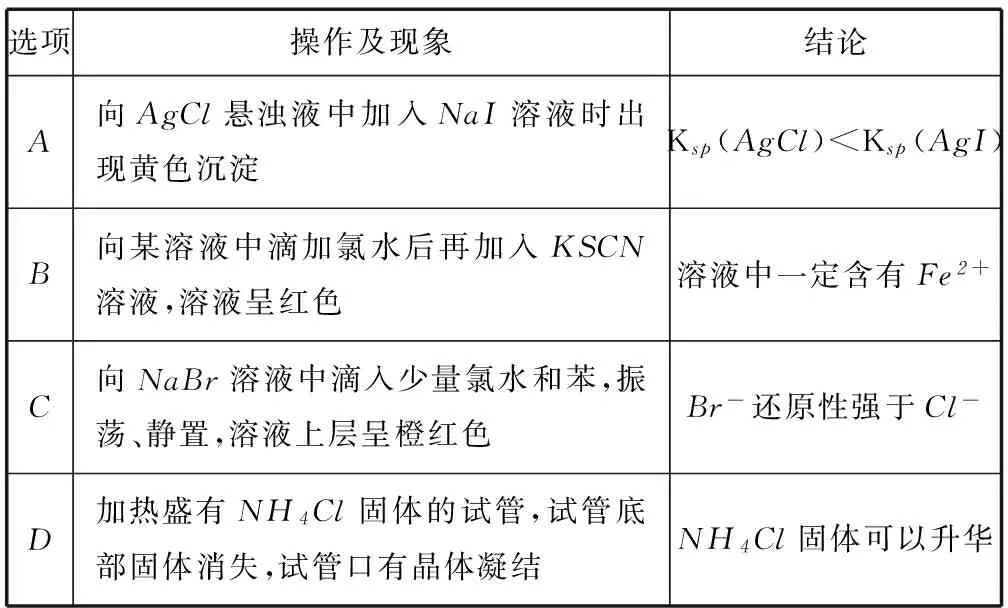
选项操作及现象结论A向AgCl悬浊液中加入NaI溶液时出现黄色沉淀Ksp(AgCl) 2KClO3+H2C2O4+2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O. (作者单位


