超声引导下微波消融一线治疗原发性肝癌:临床疗效以及预后影响因素
2016-07-28马思聪王涛丁敏明雅南戚星星张源翟博
马思聪 王涛 丁敏 明雅南 戚星星 张源 翟博
·论著·
超声引导下微波消融一线治疗原发性肝癌:临床疗效以及预后影响因素
马思聪王涛丁敏明雅南戚星星张源翟博
200127上海交通大学医学院附属仁济医院肿瘤介入科(马思聪,王涛,丁敏,戚星星,张源,翟博);消化内科(明雅南)
【摘要】目的评估超声引导下微波消融一线治疗原发性肝癌的临床疗效以及预后影响因素。方法2010年6月到2014年11月,201例首次诊断为原发性肝癌的患者在本中心接受超声引导下微波消融治疗,随访时间4~53个月。使用单因素(Kaplan-Meier模型)以及多因素(Cox 回归)分析对患者肿瘤复发以及生存的预后因素进行评估。结果肿瘤初次完全消融率为96%,部分患者接受了2次消融,总计完全消融率为99%。微波消融治疗后并发症发生率为5.6%(12/201)。患者术后平均无瘤生存时间为18个月、肝功能Child B级、肿瘤多发、肿瘤直径>5 cm、AFP>20 μg/L是影响患者术后无瘤生存时间的独立危险因素。患者平均总生存时间为38个月,与之相关的独立危险因素为肝炎病史、肿瘤多发以及肿瘤直径>5 cm。结论超声引导下微波消融一线治疗原发性肝癌是安全和有效的,肿瘤直径、数量以及患者肝功能状况是影响患者预后的主要因素。
【关键词】肝癌; 微波消融; 临床疗效; 预后
在过去10年中,原发性肝癌的发生率及死亡率在我国呈现逐步升高趋势,给我国人民生命带来了严重的危害[1, 2]。肝切除术被认为是治疗原发性肝癌的首要治疗手段,然而既往文献报道,仅有20%~25%的患者有机会接受肝切除治疗[3, 4]。
近年来,以射频消融以及微波消融为代表的肝肿瘤局部热消融治疗因其微创和有效而逐步受到临床医生及患者的认可,越来越多的临床研究机构将局部热消融作为治疗早期原发性肝癌的一线治疗手段[5, 6],而大量回顾性和前瞻性研究均已证实,安全部位的小肝癌可获得与外科切除类似的彻底性和有效性[7, 8]。
在过去的5年中,本中心对原发性肝癌的微波消融治疗进行了深入的研究并将其作为一线治疗手段治疗原发性肝癌患者201例,积累了宝贵的经验。本研究观察经皮微波消融一线治疗原发性肝癌患者的肿瘤复发以及远期生存情况,并评估对患者预后的影响因素。
资料和方法
一、研究对象
从2010年8月至2014年11月,201例原发性肝癌患者在上海交通大学医学院附属仁济医院肿瘤介入科接受了超声引导下经皮微波消融治疗,并随访至2015年3月,原发性肝癌的诊断符合以下标准之一:(1)2种以上的影像学检查诊断结果并伴有AFP的升高;(2)病理结果确定为原发性肝癌。患者信息的基本情况见表1 。

表1 患者基本特征
患者入选标准:(1)年龄18岁以上;(2)肿瘤数量不多于3个;(3)最大肿瘤直径≤10 cm;(4)肝功能评级Child A或Child B;(5)胆红素<50 μmol/L,血小板>40×109/L,白蛋白>40 g/L;(6)患者无血管侵犯或者远处转移;(7)之前未进行过任何肿瘤相关治疗;(8)超声下肿瘤显示明确,有合适的穿刺路径。
二、方法
(一)术前准备肝肿瘤微波消融策略,包括穿刺路径、消融时间、患者评估、麻醉方式,分别由3位经皮消融经验10年、5年、4年的医生共同完成。经皮消融在超声引导下实时引导完成(MyLab Twice scanner or HM1498XS1 scanner)并使用3.5 Mhz探头。
(二)微波仪器所有患者使用2450 MHz MTC-3C微波消融仪,并配有25 cm长的15G水冷微波发射电极(维京九洲公司,中国南京)。按照我们的消融策略,在超声引导下,电极首先穿刺进入肿瘤底部的边缘层次,功率调整到100 w开始消融至超声下观察到强回声将该消融平面完全覆盖,调整电极角度并穿刺到同一层次其他平面继续消融,重复上述步骤确定该层次肿瘤完全被强回声覆盖,将电极回撤1~1.5 cm至未消融层次继续上述消融策略,消融治疗结束直到强回声覆盖至肿瘤边缘0.5~1 cm的安全区域。
(三)疗效评价肿瘤是否完全坏死作为评价微波消融近期疗效的主要标准,患者术后1个月复查增强CT或者MR无明显活性病灶且无肿瘤标志物AFP升高被定义为术后完全消融。微波消融术后肿瘤的复发以及患者的生存情况作为远期疗效的评判标准。
三、统计学分析
所有的数据分析采用SPSS软件(版本19.0)。采用Kaplan-Meier法计算患者平均无瘤生存时间以及总生存时间。采用COX 回归法计算无瘤生存时间以及总生存时间的相关影响因素。
结果
一、治疗效果
在接受治疗的201例患者中,初次消融完全消融率为96%,193例患者经过首次微波消融治疗使肿瘤达到完全缓解。剩余的8例患者由于首次消融后肿瘤残留进行了二次微波消融治疗,其中6例患者肿瘤达到完全消融,经过2次消融后总消融率为99%。
二、并发症
12例患者在接受微波消融治疗后产生并发症,总并发症发生率为5.9%。其中4例患者术后出现不同程度的肾功能损害,3例患者术后出现高胆红素血症,3例患者术后出现胸腔积液,1例患者术后出现消融灶感染,1例患者术后出现肝性脑病,所有12例出现并发症的患者经过治疗恢复正常出院,无消融治疗导致的死亡。
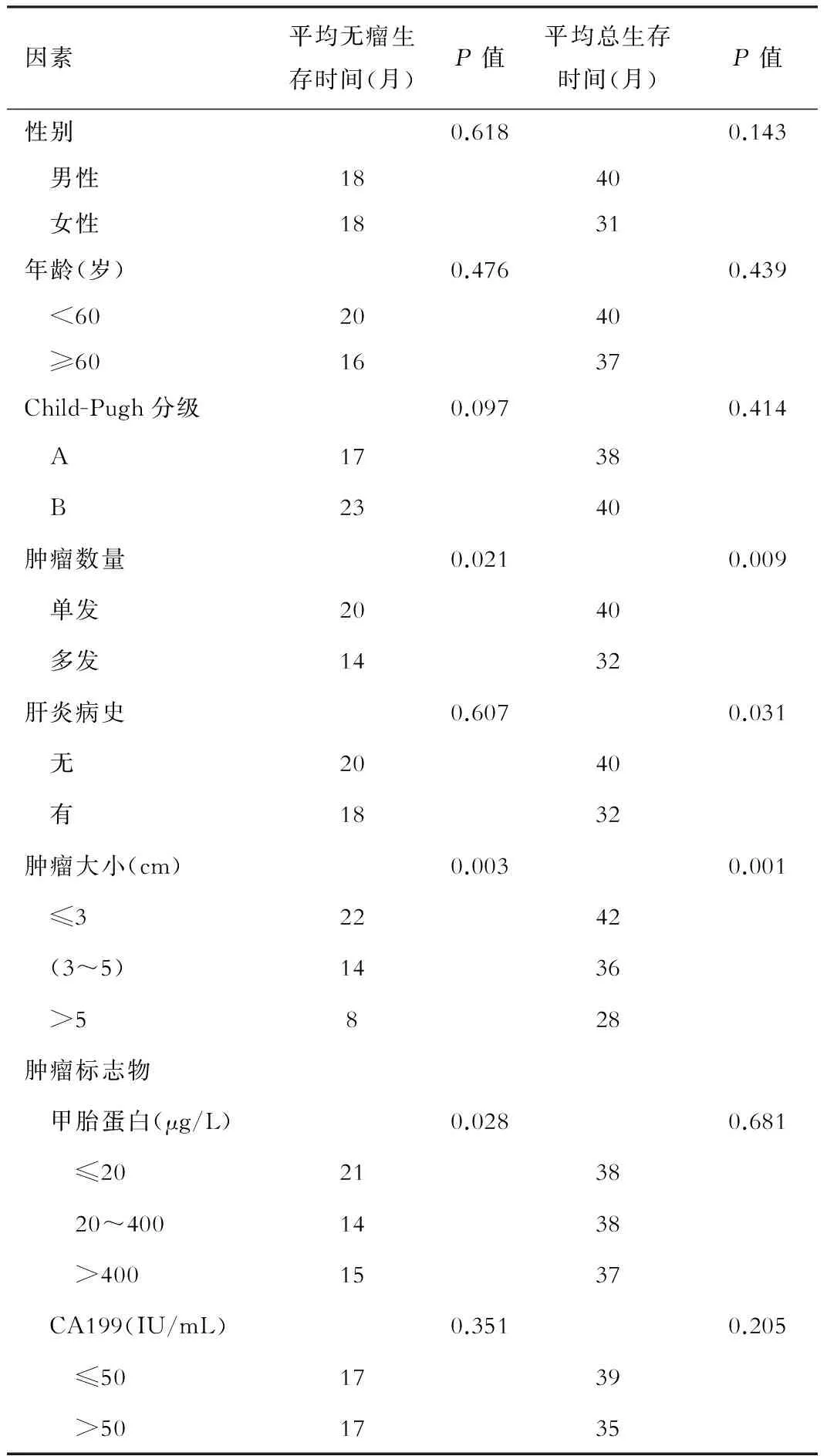
表2 无瘤生存时间以及总生存时间的单因素分析
三、无瘤生存时间
130例患者在肿瘤消融治疗后出现复发,患者平均无瘤生存时间为18个月(见图1),11例患者消融术后出现肝外转移,其中7例患者发生肺转移,3例患者发生腹腔转移,1例患者发生骨转移,消融术后肝外转移发生率为 5.5%。在对无瘤生存时间的单因素分析中我们发现,肿瘤多发、肿瘤直径>3 cm 以及甲胎蛋白>20 μg/L的患者平均无瘤生存时间明显较短(P<0.05,见表2)。而在COX回归的多因素分析中,Child B级、肿瘤多发、肿瘤直径>5 cm、甲胎蛋白>20 μg/L是导致患者平均无瘤生存时间缩短的独立危险因素(见表3)。
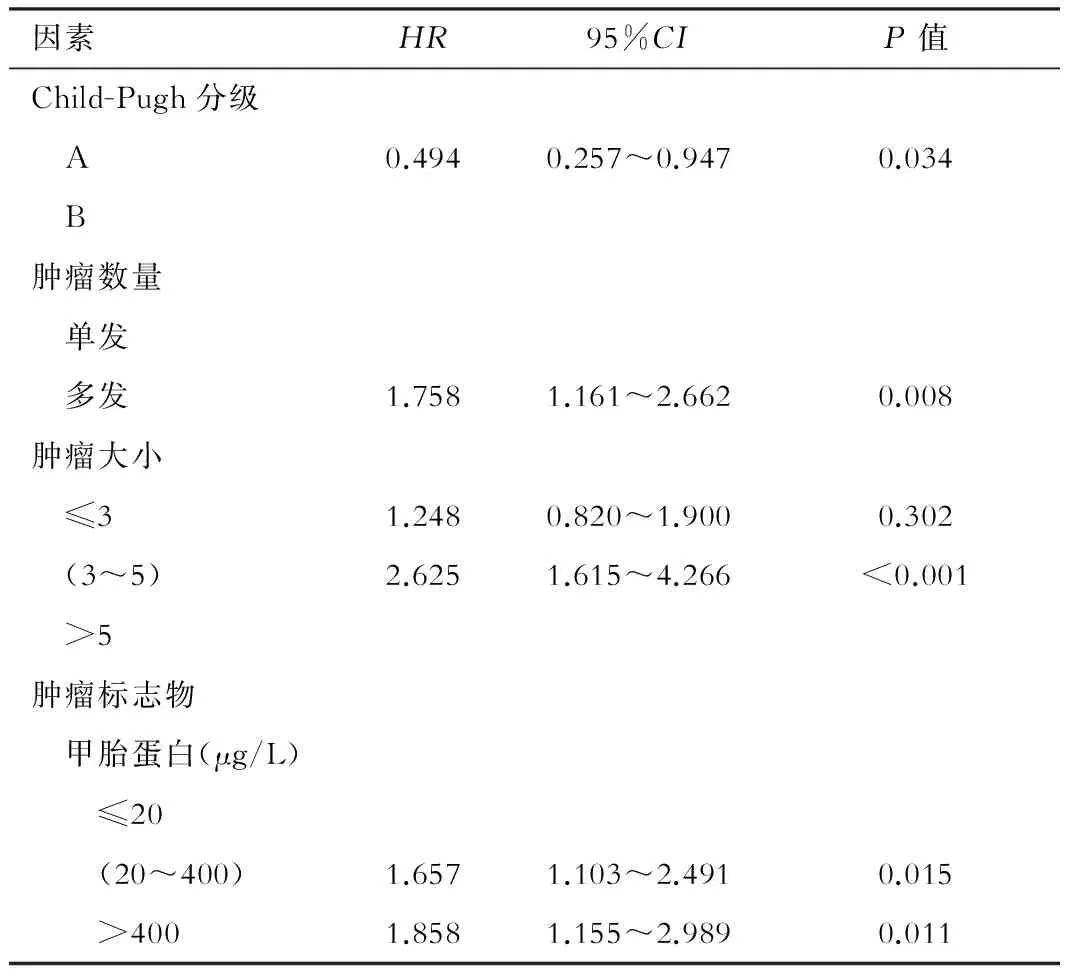
表3 无瘤生存时间多因素分析

图1 无瘤生存时间生存曲线
四、总生存时间
截止到本研究结束,1例患者在接受微波消融治疗后9个月失随访,中位随访时间为22个月(范围4~53个月)。在所有200例患者中,总平均生存时间为38个月,见图2。50例患者在随访截止日前死亡,其中22例患者死于肿瘤进展,16例患者死于肝硬化相关并发症,5例患者死于肿瘤肝外转移,7例患者死于肿瘤相关的其他原因。
平均总生存时间单因素分析结果显示,肿瘤多发、有肝炎病史、肿瘤直径>5 cm患者平均总生存时间明显缩短(P<0.05,见表2)。而多因素分析结果表明,患者肿瘤多发、有肝炎病史以及肿瘤直径>5 cm是影响患者总生存时间的独立危险因素(见表4)。
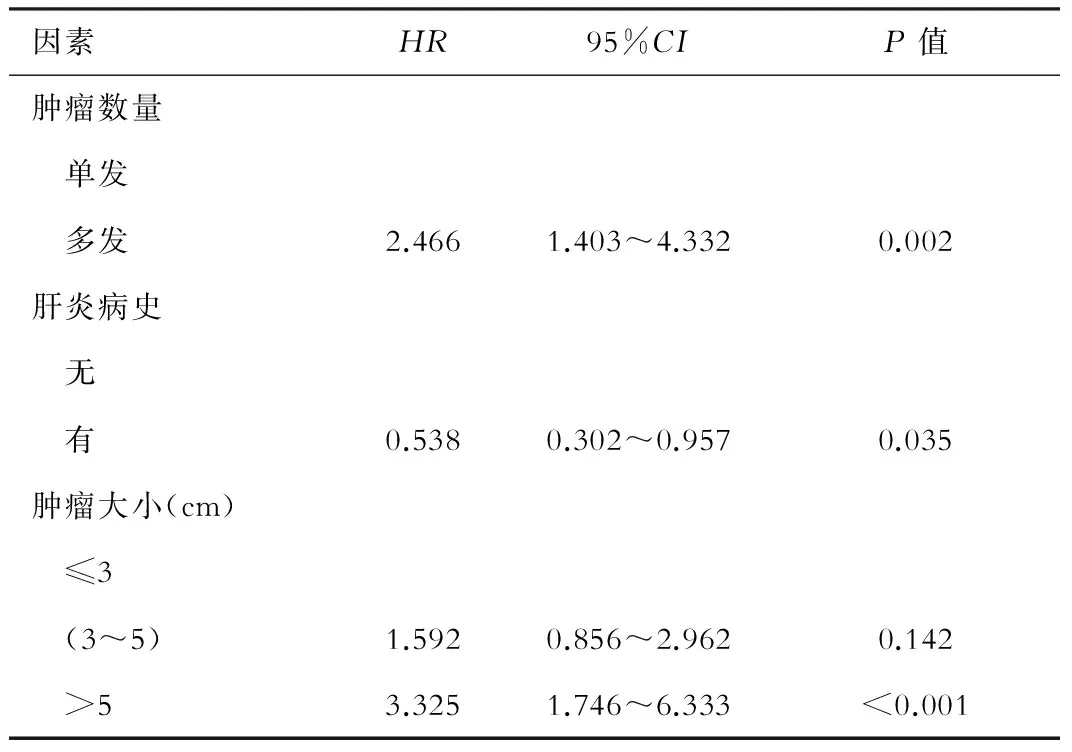
表4 总生存时间多因素分析
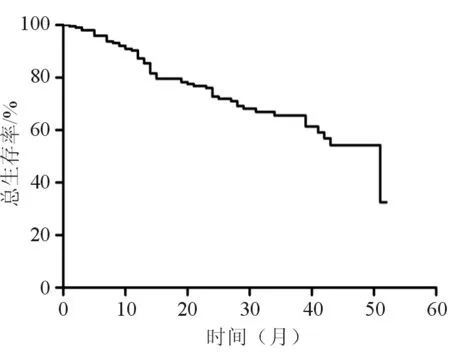
图2 总生存时间生存曲线
讨论
近些年来,肝肿瘤热消融治疗逐步开始做为一线治疗手段治疗原发性肝癌并取得良好的治疗效果,与传统的肝切除相比,局部热消融治疗相对安全、微创[9, 10]。诸多国内外随机对照临床研究表明,对于≤3 cm的肝脏肿瘤,接受肿瘤局部热消融治疗的患者能够取得与肝切除相近的临床疗效以及生存预后[7, 8]。而随着消融技术以及影响引导技术的改进,对于>3 cm,甚至>5 cm肝脏肿瘤,使用局部热消融治疗手段同样可以取得较好的临床疗效[11]。与之前文献报道类似[12],在本中心进行的临床研究中,201例患者经过1次或者2次消融后99%的患者可以达到肿瘤完全缓解,而这其中有28例患者肿瘤直径>5 cm(13.9%),说明对于较大体积的肿瘤,采用合理的消融策略以及手术方法,同样可以取得良好的治疗效果。
尽管微波消融治疗通常被认为是低损伤、安全的[13],但在我们的研究中仍有11例患者出现了与治疗相关的并发症(5.9%),特别引人注意的是,4例肿瘤直径>5 cm的患者治疗后出现了不同程度的肾功能损害,这一并发症在之前的文献中鲜有报道。目前这一并发症发生的机制未明,我们考虑在对较大肿瘤消融过程中,由于较长的消融时间所导致的红细胞以及血红蛋白的破坏可能是产生患者术后肾功能损害的原因之一,我们也将针对这一问题在之后的研究中进行深入探讨。
肿瘤易复发转移的特性是肿瘤难以彻底治愈的主要原因之一,而不管是消融、肝切除术,还是肝移植等局部治疗手段都很难从根本上解决肿瘤的复发转移问题,在本研究中,130例患者在治疗后复发,平均无瘤生存时间为18个月,对于治疗后复发的患者,95例肿瘤复发后在本中心接受了后续的微波消融治疗(1~4次),由此可以看出,与肝切除手术相比,局部热消融治疗的可重复性也是其近年来快速发展的优势之一。肿瘤复发的相关因素分析发现,Child B 级、肿瘤多发、肿瘤直径>5 cm 以及AFP>20 μg/L是导致治疗后肿瘤复发的独立危险因素,对于这些患者,肿瘤复发的危险性较高且大部分患者并不适合进行肝切除肝移植等有创治疗手段。因而,术前严格的评估。术中合理消融方式以及术后密切的观察随访就显得尤为重要。
肝炎病史是影响患者远期生存预后的独立危险因素,我们认为有肝炎病史的患者往往肝功能状况较差且存在利于肿瘤新生的病理生理基础 ,因而临床治疗中应给予患者积极的抗病毒和保肝治疗。与之前的文献报道类似[14],肿瘤大小以及肿瘤数量仍是影响患者术后远期预后的重要危险因素,对于这部分患者,由于肿瘤复发风险较高,而肿瘤转移及侵袭的特性使得这部分患者更易于形成癌栓以及肝外转移,因而往往预后不佳。针对这一状况,国内外研究学者在消融联合治疗上进行了一系列探索(TACE、PEI等),并取得了良好的疗效[15, 16],而近些年来以CART细胞为代表的生物治疗技术的兴起,也为联合治疗原发性肝癌提供了新的武器。
参考文献
[ 1 ]Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002. CA Cancer J Clin, 2005, 55: 74-108.
[ 2 ]Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin, 2015, 65: 87-108.
[ 3 ]Lee WC, Jeng LB, Chen MF. Estimation of prognosis after hepatectomy for hepatocellular carcinoma. Br J Surg, 2002, 89: 311-316.
[ 4 ]Fan ST, Poon RT, Yeung C, et al. Outcome after partial hepatectomy for hepatocellular cancer within the Milan criteria. Br J Surg, 2011, 98: 1292-300.
[ 5 ]Choi D, Lim HK, Rhim H, et al. Percutaneous radiofrequency ablation for early-stage hepatocellular carcinoma as a first-line treatment: long-term results and prognostic factors in a large single-institution series. Eur Radiol, 2007, 17: 684-692.
[ 6 ]Kim YS, Lim HK, Rhim H, et al. Ten-year outcomes of percutaneous radiofrequency ablation as first-line therapy of early hepatocellular carcinoma: analysis of prognostic factors. J Hepatol, 2013, 58: 89-97.
[ 7 ]Feng K, Yan J, Li X, et al. A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma. J Hepatol, 2012, 57: 794-802.
[ 8 ]Chen MS, Li JQ, Zheng Y, et al. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Ann Surg, 2006, 243: 321-328.
[ 9 ]Shi J, Sun Q, Wang Y, et al. Comparison of microwave ablation and surgical resection for treatment of hepatocellular carcinomas conforming to Milan criteria. J Gastroenterol Hepatol, 2014, 29: 1500-1507.
[10]Ni JY, Xu LF, Sun HL, et al. Percutaneous ablation therapy versus surgical resection in the treatment for early-stage hepatocellular carcinoma: a meta-analysis of 21,494 patients. J Cancer Res Clin Oncol, 2013, 139: 2021-2033.
[11]Yin XY, Xie XY, Lu MD, et al. Percutaneous thermal ablation of medium and large hepatocellular carcinoma: long-term outcome and prognostic factors. Cancer, 2009, 115: 1914-1923.
[12]Lu MD, Yin XY, Xie XY, et al. Percutaneous thermal ablation for recurrent hepatocellular carcinoma after hepatectomy. Br J Surg, 2005, 92: 1393-1398.
[13]Martin RC, Scoggins CR, Mcmasters KM. Safety and efficacy of microwave ablation of hepatic tumors: a prospective review of a 5-year experience. Ann Surg Oncol, 2010, 17: 171-178.
[14]Shiina S, Tateishi R, Arano T, et al. Radiofrequency ablation for hepatocellular carcinoma: 10-year outcome and prognostic factors. Am J Gastroenterol, 2012, 107: 569-77; quiz 78.
[15]Veltri A, Moretto P, Doriguzzi A, et al. Radiofrequency thermal ablation (RFA) after transarterial chemoembolization (TACE) as a combined therapy for unresectable non-early hepatocellular carcinoma (HCC). Eur Radiol, 2006, 16: 661-669.
[16]陈俊卯, 刘艳华, 陈建立, 等. 无水酒精注射联合射频消融治疗射频消融困难部位的肝癌. 现代肿瘤医学, 2012, 20: 122-124.
(本文编辑:钱燕)
基金项目:国家自然科学基金项目(81472845)
通信作者:翟博,Email: zhaiboshi@sina.com
(收稿日期:2016-03-08)
Ultrasound-guided percutaneous microwave ablation as first-line treatment for HCC: A study on clinical efficacy and prognostic factors
MASi-cong,WANGTao,DINGMin,MINGYa-nan,QIXing-xing,ZHANGYuan,ZHAIBo.
DepartmentofInterventionalOncology,RenjiHospital,SchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200127,China
【Abstract】ObjectiveTo investigate the clinical efficacy of ultrasound (US)-guided percutaneous microwave ablation as a first-line treatment for hepatocellular carcinoma (HCC), and its prognostic factors analysis. MethodsFrom June 2010 to November 2014, 201 patients who were first diagnosed HCC and receiving US-guided microwave ablation treatment in Shanghai Renji hospital were enrolled, and followed up for 4 to 53 months. Univariate (Kaplan-Meier method) and multivariate (Cox-regression) analysis were applied to determine the prognostic factors for progression-free survival and overall survival. ResultsComplete ablation rate after first ablation was 96%. For some patients receiving a second ablation, the total complete ablation rate was 99%. Twelve of the 201 (5.6%) patients suffered ablation associated complications. Mean progression-free survival (PFS) of microwave ablation therapy was 18 months. In addition, liver function Child B, multiple tumors, tumor diameter > 5 cm and AFP>20 were independent risk factors associated with worse PFS. Hepatitis history, multiple tumors and tumor diameter > 5cm were independent predictors for overall survival (OS) of which mean value was 38 months. ConclusionUS-guided microwave ablation as a first-line therapy for HCC is safe and efficacious. Tumor diameter, tumor number and liver status of patients might be main prognostic factors affecting PFS and OS.
【Key words】HCC; Microwave ablation; Clinical efficacy; Prognosis
