猪鼻支原体可变脂蛋白家族重组蛋白的构建表达及黏附细胞功能检测
2016-07-28熊祺琰张必雄马庆红冯志新刘茂军邵国青
纪 燕,熊祺琰,王 佳,张必雄,倪 博,马庆红,冯志新,刘茂军,邵国青
猪鼻支原体可变脂蛋白家族重组蛋白的构建表达及黏附细胞功能检测
纪燕1,2,熊祺琰1,王佳1,张必雄1,倪博1,马庆红1,冯志新1,刘茂军1,邵国青1
1.江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,南京210014;2.金宇保灵生物药品有限公司,呼和浩特010030
摘要:目的本研究以猪鼻支原体表面的可变脂蛋白(vlp)家族为研究对象,鉴定其各成员对宿主细胞的黏附能力。方法根据已公布的猪鼻支原体vlp家族7种成员的基因序列设计引物,构建重组表达质粒pET-32a(+)/vlp,筛选获得阳性克隆。重组工程菌经IPTG诱导表达目的蛋白,经镍柱亲和层析获得7种纯化的vlp重组蛋白。利用间接免疫荧光法及微孔板定量法分别对vlp各个成员的黏附功能进行鉴定。结果成功构建了7种重组表达质粒pET-32a(+)/vlp,获得阳性重组工程菌。经IPTG诱导及镍柱亲和层析纯化,获得了较纯的7种vlp重组蛋白。间接免疫荧光及微孔板黏附定量试验检测结果显示,重组蛋白vlpA、vlpB、vlpC、vlpE、vlpG可黏附PK细胞,而重组vlpD和vlpF蛋白黏附能力不明显。结论本研究成功构建了猪鼻支原体7种vlp的重组蛋白,并对其黏附功能进行了初步鉴定,证明部分vlp属于猪鼻支原体的黏附因子。
关键词:猪鼻支原体;可变脂蛋白;细胞黏附
Supported by the National Natural Science Foundation of China (No.31300155), the Natural Science Foundation of Jiangsu Province (No. BK20130702) and the Special Fund for Independent Innovation of Agricultural Science and Technology in Jiangsu Province of China (No. CX(14)5039)
猪鼻支原体(Mycoplasmahyorhinis)可引起猪的多发性浆膜炎、关节炎、肺炎及中耳炎等多种慢性炎症[1-4],通常由母猪或大猪经呼吸道传染给小猪,进而从呼吸道侵染全身引发疾病的发生。猪鼻支原体也是实验室细胞培养物的常见污染物[5],同时近年来证实其与多种人类肿瘤的发生有明显的相关性[6-9]。黏附是支原体感染致病的关键步骤,但目前有关猪鼻支原体的研究较少,其黏附因子以及致病机制尚未明确。
支原体基因组大小十分有限,但含有大量能够实现菌体表面抗原性变化的基因,从而有效地逃避宿主的免疫系统[10-11]。这些基因通常编码膜表面的脂蛋白,基因可发生高频率、可逆的突变,从而可以选择性的表达编码产物或者混合表达几种特定组合的编码产物,同时可通过重复区域的突变实现产物分子大小的改变,最终实现表面抗原性的多样性。目前有研究报道牛支原体等多种支原体的表面可变脂蛋白除了介导抗原性变化、免疫逃避外,还与病原菌的细胞黏附有关[12-16]。vlp(variable lipoprotein, vlp)为猪鼻支原体表面的可变脂蛋白家族[17-18],共包含7个成员,分别为vlpA, vlpB, vlpC, vlpD, vlpE, vlpF, vlpG。本研究拟构建表达7种vlp家族成员的重组蛋白,利用间接免疫荧光法及微孔板定量法对vlp各个成员的黏附功能进行初步鉴定。
1材料与方法
1.1试验材料
1.1.1菌种与质粒猪鼻支原体、原核表达载体pET-32a(+)由本实验室保存;大肠杆菌BL21(DE3)感受态细胞、Trans1-T1感受态细胞、pEASY-E1载体购自北京全式金生物技术有限公司。
1.1.2PK15细胞培养PK15细胞用含10%小牛血清、100 U/mL青霉素和100 μg/mL的DMEM培养液培养,待细胞汇合至90%以上时,胰蛋白酶消化。细胞以2×105个/孔接种于96孔细胞板,于37 ℃、5% CO2培养箱中培养24 h。
1.1.3材料与试剂HRP-羊抗兔IgG、FITC-羊抗兔IgG购自武汉博士德公司;兔抗硫氧还蛋白多抗购自武汉三鹰生物技术有限公司;细胞裂解液、BCA蛋白浓度测定试剂盒购自碧云天股份有限公司;其他试剂均为国产分析纯。
1.2试验方法
1.2.17种vlp家族成员重组蛋白表达质粒的构建根据GenBank中已公布的猪鼻支原体 vlp基因序列,利用Oligo7软件设计引物,扩增除信号肽之外的vlp编码区,见表1。两端添加酶切位点,PCR引物序列见表1。扩增的PCR产物与pEASY-E1载体酶连构建pEASY-E1/vlp重组质粒。经PCR及测序验证正确后以vlp上下游引物扩增目的基因片段,经限制性内切酶双酶切后插入pET-32a(+)空载体质粒的多克隆位点中,构建得到7种重组质粒pET-32a(+)/vlp。转化大肠杆菌BL21感受态细胞,以T7启动子和终止子引物PCR筛选阳性克隆,并测序鉴定序列的正确性。制备甘油管保存菌种。
表1引物Tab.1Primers

PrimerSequences(5'→3')PrimersforamplificationofvlpgenesA-FGACGGATCCTGTGGACAAACAGATAATAAA-RCGCAAGCTTCTATTGTGTGTTTTCAGTTTTTGB-FGCGGAATTCTGTGGACAAACTAATACB-RGCGCTCGAGTTAATCTTGTGAATCTGATCC-FCCGGAATTCTGTGGACAAACTAATACC-RGACCTCGAGTTATTGTGATCCTGATTD-FCCGGAATTCTGTGGTCAAACTAATACD-RGGCAAGCTTTTATGAAGTTGAATCTGATGE-FCGCGGATCCTGTGGTCAAACTACTGATAAE-RGCGAAGCTTTTATTGTCCATCTGATGTTGF-FCCGGAATTCTGTGGACAAACTAATACTGATCF-RCAGAAGCTTTTAACAGATGCTGTTTTTTAATAT-TATG-FCCGGAATTCTGTGGTCAAACTACTAATAAACCG-RGACCTCGAGCTATCCTGAAGTTGAATCTGPrimersforidentificationofpositiveclonesT7promoterTAATACGACTCACTATAGGGT7terminatorTGCTAGTTATTGCTCAGCGG
Note: The underlined regions are the restriction enzyme sites.
1.2.2重组vlp蛋白的表达与纯化重组蛋白与pET-32a(+)载体中的硫氧还蛋白TrxA以融合蛋白形式表达。接种100 μL重组工程菌甘油管菌液至5 mL氨苄抗性的LB液体培养基中,过夜培养,次日将菌液以2%的量接种至氨苄抗性的LB液体培养基中振荡培养,当培养至OD630值在0.6~1.0时加入IPTG(终浓度为1 mmol/L)进行诱导表达,5 h后收集菌体。同时设未诱导的工程菌做阴性对照。收集菌液后超声裂解菌体,离心收集上清并用镍柱亲和层析纯化。
1.2.3间接免疫荧光法检测重组vlp蛋白的黏附功能PK15细胞以2×105个/mL接种于96孔细胞培养板,100 μL/孔,37 ℃、5% CO2条件下培养24 h,PBS(pH 7.4)洗涤1次,每次5 min(以下简称洗涤);用DMEM细胞培养液将vlp蛋白稀释至0.5 mg/mL,100 μL/孔,37 ℃孵育6 h后洗涤3次;每孔加入100 μL冰乙醇4 ℃固定30 min,洗涤3次;每孔加入200 μL 1% BSA于4 ℃封闭过夜,洗涤4次;加入1∶200倍稀释的兔抗硫氧还蛋白多抗,100 μL/孔,于37 ℃孵育1.5 h,洗涤4次;加入1∶50倍稀释的FITC-羊抗兔IgG二抗,50 μL/孔,于37 ℃避光孵育1 h,洗涤5次,于荧光显微镜下观察结果。
1.2.4微孔板黏附试验定量检测重组vlp蛋白的黏附能力用细胞裂解液裂解PK细胞,制备PK细胞全蛋白;利用碧云天细胞膜蛋白与细胞浆蛋白抽提试剂盒制备PK细胞膜蛋白。用BCA法测定蛋白浓度,分别用细胞全蛋白及膜蛋白包被微孔板进行检测。
用碳酸盐缓冲液(0.05 mol;pH9.6)将PK细胞蛋白稀释至10 μg/mL,100 μL/孔包被酶标板,4 ℃孵育过夜,次日用PBST(pH 7.4)洗4次,每次5 min(以下简称洗涤);每孔加入200 μL 5%的BSA于37 ℃封闭1.5 h,洗涤;将vlp蛋白稀释至100 μg/mL,每孔加入100 μL于37 ℃黏附1 h,洗涤;加入1∶2 000倍稀释的兔抗硫氧还蛋白多抗,100 μL/孔,于37 ℃孵育1 h,洗涤;加入1∶15 000倍稀释的辣根过氧化物标记的羊抗兔IgG二抗,100 μL/孔,于37 ℃孵育1 h,洗涤;每孔加入TMB显色液100 μL,避光孵育5 min;每孔加入50 μL 2 mol H2SO4终止液终止,于450~630 nm波长测定OD值。
1.2.5统计学分析利用SPSS 16.0版本软件对各组数据进行One-Way ANOVA分析,P<0.05判定为差异具有统计学差异。
2结果
2.1重组表达质粒的构建PCR扩增vlp目的基因序列,插入到pET-32a(+)空载体中,构建得到pET-32a(+)/vlp重组质粒,用以T7启动子和终止子引物PCR筛选阳性克隆,见图1。挑选阳性克隆,单克隆后DNA测序,测序结果正确。制备甘油管保存菌种。
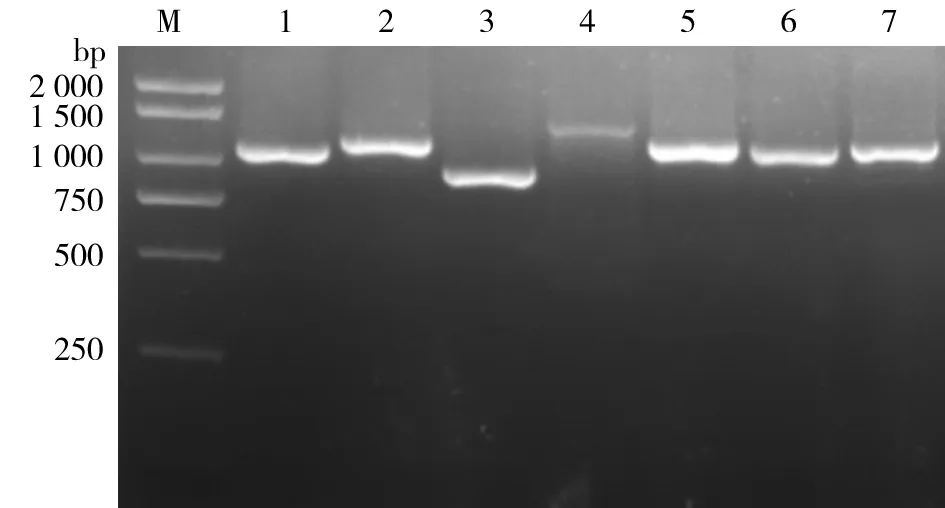
M.DNA分子量标准;1-7.vlp基因(A-G)扩增产物M: DNA molecular weight markers; 1-7: Vlp (A-G) PCR products amplified with T7 promoter and T7 terminator primers.图1 重组表达质粒pET-32a(+)/vlp的鉴定Fig.1 Identification of the recombinant plasmid expressing vlp recombinant proteins
2.2重组蛋白的表达纯化IPTG诱导后重组质粒可以在大肠杆菌中有效地表达,收集菌体后,采用镍柱亲和层析纯化重组vlp蛋白,结果见图2。蒸馏水透析后冻干保存于-20 ℃。

图2 重组vlp蛋白的纯化Fig.2 Purification of the recombinant vlp proteins
2.3间接免疫荧光法检测重组vlp蛋白的黏附功能利用所有重组vlp蛋白共有的融合伙伴TrxA的抗体进行间接免疫荧光检测,显微镜观察,如图3所示,结果发现:vlpA、vlpB、vlpC蛋白对PK细胞的黏附较为明显;vlpE和vlpG蛋白孵育孔可观察到散在的荧光点,但密度与vlpA、vlpB、vlpC小;vlpD及vlpF蛋白孵育孔与阴性对照及空白载体对照蛋白孔相比,无明显差异。
2.4微孔板黏附试验定量检测重组vlp蛋白的黏附能力结果见图4。以PK细胞的全蛋白为包被物时,与不加蛋白的阴性对照组相比,重组蛋白vlpA、vlpB、vlpC、vlpE、vlpG均能明显黏附细胞全蛋白(P<0.01);而重组蛋白vlpD及vlpF不能有效的黏附PK细胞全蛋白(P>0.05)。未插入外源片段的空白pET-32a(+)载体对照蛋白也不黏附细胞全蛋白(P>0.05)。与载体对照蛋白相比, 重组蛋白vlpA、vlpB、vlpC、vlpE、vlpG黏附差异有统计白组相比较,# 表示差异有统计学意义(P<0.05),## 表示差异有统计学意义(P<0.01)。
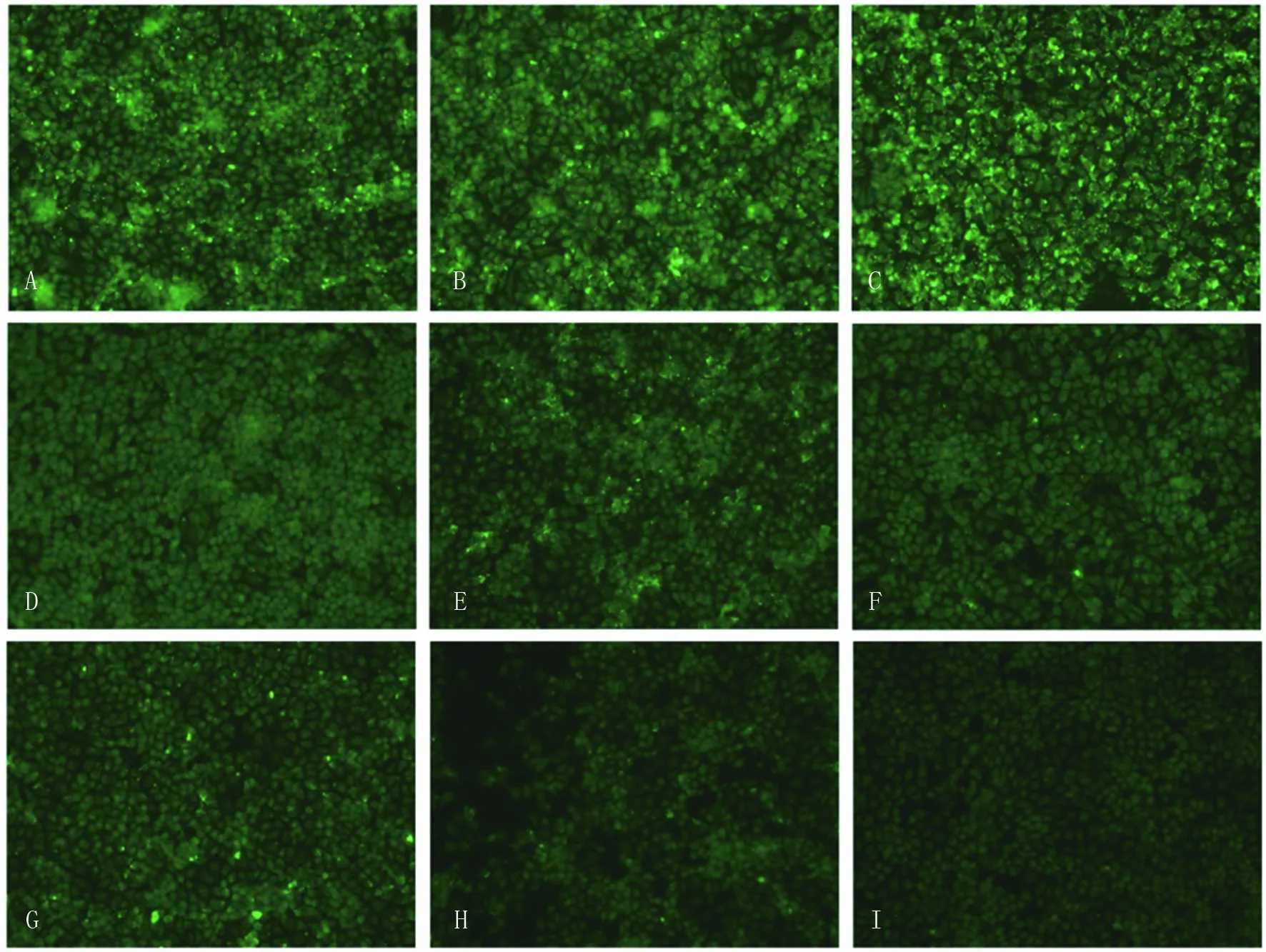
A-G.vlpA-vlpG;H.空载体对照蛋白;I.阴性对照A-G: vlpA- vlpG; H: blank vector protein; I: negative control.图3 蛋白直接黏附法检测结果Fig.3 Adherence of vlp to cells surfaces

注:与阴性对照组相比较, * 表示差异有统计学意义(P<0.05),** 表示差异有统计学意义(P<0.01);与空载体对照蛋
Compared with the group of negative control, * indicates statistical significance atP<0.05 level, ** indicates statistical significance atP<0.01 level;Compared with the group of blank vector protein control, # indicates statistical significance atP<0.05 level, ## indicates statistical significance atP<0.01 level.
图4微孔板黏附试验测定重组vlp蛋白的黏附功能
Fig.4Identification of adhesion function of vlp protein by the microtiter plate adhesion test
学意义(P<0.01);而vlpD及vlpF差异无统计学意义(P>0.05)。以细胞膜蛋白为包被物时,检测结果与全蛋白类似。由此可见,7种重组vlp蛋白中,除vlpD及vlpF无明显黏附功能外,其余vlp成员黏附PK细胞能力明显。
3讨论
支原体是能够自我复制的最小的细菌,通常引发宿主持续性的感染,但这种感染通常不引起致命性的损伤,从而实现其在宿主体内的长期寄生。目前研究者大多数认为支原体一般不通过直接的毒力因子致病,而是通过长期持续性感染引发机体慢性炎症应答而导致病变的发生。几乎所有的人和动物支原体都是通过最初的黏附宿主细胞从而实现后续的体内增殖和感染。因此黏附因子在支原体感染致病的过程中起着极为重要的作用,但到目前为止猪鼻支原体的黏附因子尚不清楚,这严重阻碍了其致病机制的深入研究。
Vlp家族是猪鼻支原体重要的表面蛋白,除介导支原体免疫原性的高频相变外,可能还具有其他功能。在一些其他支原体中表面可变蛋白被报道可以介导支原体黏附细胞,如牛支原体的Vsps[19], 鸡毒支原体的pMGA[14], 滑液囊支原体的VlhA[20], 人型支原体的vaa[21]等。本研究从猪鼻支原体中扩增了7种vlp成员的基因,构建重组蛋白,尝试检测重组vlp蛋白体外黏附猪PK细胞的能力。结果发现其中5种重组vlp蛋白(vlpA、vlpB、vlpC、vlpE、vlpG)可黏附细胞。
在本研究中采用了2种试验来检测黏附功能,一是细胞铺细胞板后加入蛋白孵育,然后用间接免疫荧光方法检测;二是提取细胞蛋白包被微孔板,随后用ELISA方法检测。从检测结果上看定性结论一致,即除vlpD及vlpF外,其余5种重组vlp蛋白具有一定的黏附PK细胞能力。但从黏附能力强弱上看,间接免疫荧光检测结果显示vlpA、vlpB、vlpC蛋白黏附能力较强,vlpE和vlpG蛋白较弱;而微孔板检测结果显示vlpA和vlpG蛋白黏附孔OD值稍高,vlpB、vlpC、vlpE蛋白黏附孔OD值稍低。从检测方法本身分析,间接免疫荧光法定量效果较差,荧光强度受较多因素影响,而微孔板法可以准确量化,重现性也相对较好。但间接免疫荧光法中利用的是生长在细胞板中的完整细胞,与自然感染黏附情况较接近,而微孔板法利用的是提取的蛋白包被ELISA板,两者细胞表面结合受体的呈现状态可能存在差异,导致结合力上产生一定差异。
在试验过程中我们发现表达出来的重组vlp蛋白分子量大于理论分子量,如重组vlpA理论分子量为29 833.92 Da,而在电泳图上的条带分子量在35~50 kDa之间。其分子量比理论值偏大的现象在支原体脂蛋白上有多次报道[22-25],其中包括猪鼻支原体vlp蛋白[11,26]。该现象已被认为是支原体脂蛋白的特征之一,其原因不明,可能与特殊的氨基酸残基组成有关[26]。
本研究中结果发现重组vlpD和vlpF蛋白不能有效粘附PK细胞,但此结果可能不能涵盖全部的情况。vlp家族蛋白在结构上由3个部分组成,Ⅰ区为保守的信号肽;Ⅱ区为相对保守的过渡区;Ⅲ区为重复片段区,由12~13个氨基酸的短肽片段重复串联而成,符合可变数目串联重复序列(variable number of tandem repeats,VNTRs)的特征。在不同的猪鼻支原体菌种及同一菌株的不同代次之间vlpⅢ区的重复次数存在差异。通常VNTRs重复次数的变化会影响到分子的相应功能[23,27]。本研究中所构建的重组vlp蛋白为特定重复次数的vlp,无法涵盖所有变化的可能性,因此当Ⅲ区重复次数发生变化时vlpD和vlpF的黏附细胞能力也存在变化的可能性。关于各种vlp成员的黏附能力强弱、具体黏附表位、以及Ⅲ区重复次数对黏附能力的影响还需更多的试验来深入研究。
本研究通过基因工程技术构建了猪鼻支原体vlp家族全部7个成员的重组蛋白,利用间接免疫荧光及微孔板黏附定量试验检测了vlp各成员对PK细胞的黏附能力,首次证明了vlp为猪鼻支原体的黏附因子,为猪鼻支原体致病机制的深入研究提供了关键数据。
参考文献:
[1] Lin JH, Chen SP, Yeh KS, et al.Mycoplasmahyorhinisin Taiwan: diagnosis and isolation of swine pneumonia pathogen[J]. Vet Microbiol, 2006, 115: 111-116. DOI: 10.1016/j.vetmic.2006.02.004
[2] Morita T, Fukuda H, Awakura T, et al. Demonstration ofMycoplasmahyorhinisas a possible primary pathogen for porcine otitis media[J]. Vet Pathol, 1995, 32(2): 107-111. DOI: 10.1177/030098589503200202
[3] Kim B, Lee K, Han K, et al. Development of in situ hybridization for the detection ofMycoplasmahyorhinisinformalin-fixed paraffin-embedded tissues from naturally infected pigs with polyserositis[J]. J Vet Med Sci, 2010, 72(9): 1225-1227. DOI: 10.1292/jvms.10-0062
[4] Jayagopala Reddy NR, Wilkie BN, Borgs P, et al. Cytokines inMycoplasmahyorhinis-induced arthritis in pigs bred selectively for high and low immune responses[J]. Infect Immun, 2000, 68(3): 1150-1155. DOI: 10.1128/IAI.68.3.1150-1155.2000
[5] Zinocker S, Wang MY, Gaustad P, et al.Mycoplasmacontamination revisited: mesenchymal stromal cells harboringMycoplasmyhyorhinispotently inhibit lymphocyte proliferationinvitro[J]. PLoS One, 2011, 6(1): el6005. DOI: 10.1371/journal.pone.0016005
[6] Yang H, Qu L, Ma H, et al.Mycoplasmahyorhinisinfection in gastric carcinoma and its effects on the malignant phenotypes of gastric cancer cells[J]. BMC Gastroenterol, 2010, 10: 132. DOI: 10.1186/1471-230X-10-132
[7] Namiki K, Goodison S, Porvasnik S, et al. Persistent exposure toMycoplasmainduces malignant transformation of human prostate cells[J]. PLoS One, 2009, 4(9): e6872. DOI: 10.1371/journal.pone.0006872
[8] Urbane KC, Goodison S, Chang M, et al. Detection of antibodies directed atM.hyorhinisp37 in the serum of men with newly diagnosed prostate cancer[J]. BMC Cancer, 2011, 11: 233. DOI: 10.1186/1471-2407-11-233
[9] Mariotti E, Gemei M, Mirabelli P, et al. The percentage of CD133+cells in human colorectal cancer cell lines is influenced byMycoplasmahyorhinisinfection[J]. BMC Cancer, 2010, 10: 120. DOI: 10.1186/1471-2407-10-120
[10] Razin S, Yogev D, Naot Y. Molecular biology and pathogenicity ofMcoplasma[J]. Microbiol Mol Biol Rev, 1998, 62(4): 1094-1156. DOI: 10.1007/b113360
[11]TuLman ER, Liao X, Szczepanek SM, et al. Extensive variation in surface lipoprotein gene content and genomic changes associated with viruLence during evolution of a novel North American house finch epizootic strain ofMcoplasmagallisepticum[J]. Microbiology, 2012, 158(Pt 8): 2073-2088. DOI: 10.1099/mic.0.058560-0
[12] Sachsa K, Helbig JH, Lysnyansky I, et al. Epitope mapping of immunogenic and adhesive structures in repetitive domains ofMcoplasmabovisvariable surface lipoproteins[J]. Infect Immun, 2000, 68(2): 680-687. DOI: 10.1128/IAI.68.2.680-687.2000
[13] Thmas A, Leprince P, Dizier I, et al. Identification by two-dimensional electrophoresis of a new adhesion expressed by alow-passaged strain ofMcoplasmabovis[J]. Res Microbiol, 2005, 156(5/6): 713-718. DOI: 10.1016/j.resmic.2005.02.008
[14] Athamna A, Leprince P, Dizier I, et al. Adherence ofMcoplasmagallisepticuminvolves variable surface membrance proteins[J]. Infect Immun, 1997, 65(6): 2468-2471.
[15] May M, Brown DR. Diversity of expressed vlhA adhesion sequences and intermediate hemagglutination phenotypes inMcoplasmasynoviae[J]. J Bacteriol, 2011, 193(9): 2116-2121. DOI: 10.1128/JB.00022-11
[16] Boesen T, Fedosova NU, Kjeldgaard M, et al. Molecular design ofMcoplasmahominisVaa adhesion[J]. Protein Sci, 2001, 10(12): 2577-2586. DOI: 10.1110/ps.ps.31901
[17] Citti C, Kim MF, Wise KS. Elongated versions of vlp surface lipoproteins protectMycoplasmahyorhinisescape variants from growth-inhibiting host antibodies[J]. Infect Immun, 1997, 65(5): 1773-1785.
[18] Cittc C, Watson-McKown R, Droesse M, et al. Gene families encoding phase-and size-varizble surface lipoproteins ofMycoplasmahyorhinis[J]. J Bacteriol, 2000, 182(5): 1356-1363. DOI: 10.1128/JB.182.5.1356-1363.2000
[19] Sachsa K, Helbig JH, Lysnyansky I, et al. Epitope mapping of immunogenic and adhesive structures in repetitive domains ofMcoplasmabovisvariable surface lipoproteins[J]. Infect Immun, 2000, 68(2): 680-687. DOI: 10.1128/IAI.68.2.680-687.2000
[20] May M, Brown DR. Diversity of expressed vlhA adhesion sequences and intermediate hemagglutination phenotypes inMycoplasmasynoviae[J]. J Bacteriol, 2011, 193(9): 2116-2121. DOI: 10.1128/JB.00022-11
[21] Boesen T, Fedosova NU, Kjeldgaard M, et al. Molecular design ofMcoplasmahominisVaa adhesion[J]. Protein Sci, 2001, 10(12): 2577-2586. DOI: 10.1110/ps.31901
[22] Lysnyansky I, Sachse K, Rosenbusch R, et al. The vsp Locus ofMycoplasmabovis: gene organization and structural features[J]. J Bacteriol, 1999, 181(18): 5734-5741.
[23] Minion FC, Adams C, Hsu T. R1 region of P97 mediates adherence ofMycoplasmahyopneumoniaeto swine cilia[J]. Infect Immun, 2000, 68(5): 3056-3060. DOI: 10.1128/IAI.68.5.3056-3060.2000
[24] Cleavinger CM, Kim MF, Wise KS. Processing and surface presentation of theMycoplasmahyorhinisvariant lipoprotein VlpC[J]. J Bacteriol, 1994, 176(8): 2463-2467.
[25] Jenkins C, Wilton JL, Minion FC, et al. Two domains within theMycoplasmahyopneumoniaecilium adhesin bind heparin[J]. Infect Immun, 2006, 74(1): 481-487. DOI: 10.1128/IAI.74.1.481-487.2006
[26] Yogev D, Watson-McKown R, Rosengarten R, et al. Increased structural and combinatorial diversity in an extended family of genes encoding Vlp surface proteins ofMycoplasmahyorhinis[J]. J Bacteriol, 1995, 177(19): 5636-5643.
[27] Macintosh RL, Brittan JL, Bhattacharya R, et al. The terminal A domain of the fibrillar accumulation-associated protein (Aap) ofStaphylococcusepidermidismediates adhesion to human corneocytes[J]. J Bacteriol, 2009, 191(22): 7007-7016. DOI: 10.1128/JB.00764-09.
DOI:10.3969/j.issn.1002-2694.2016.04.005
通讯作者:熊祺琰,Email:qiyanxiongnj@163.com
中图分类号:R375
文献标识码:A
文章编号:1002-2694(2016)04-0338-06
Corresponding authors: Xiong Qi-yan, Email: qiyanxiongnj@163.com
收稿日期:2015-09-28修回日期:2015-12-14
Construction and expression of variable lipoprotein family ofMycoplasmahyorhinisand its function in the adherence to the cell
JI Yan1,2, XIONG Qi-yan1, WANG Jia1, ZHANG Bi-xiong1, NI Bo1, MA Qing-hong1,FENG Zhi-xin1, LIU Mao-jun1, SHAO Guo-qing1
(1.InstituteofVeterinaryMedicine,JiangsuAcademyofAgriculturalSciences/KeyLaboratoryofVeterinaryBiologicalEngineeringandTechnology,MinistryofAgriculture/NationalCenterforEngineeringResearchofVeterinaryBio-products,Nanjing210014,China;2.TheSpiritJinYuBiologicalPharmaceuticalCo.,Ltd,Hohhot010030,China)
Abstract:Mycoplasma hyorhinis (M. hyorhinis) is a zoonotic pathogen, which is highly prevalent in pig farms, causing a variety of chronic inflammations, and is also related to various human cancers. However, the adhesion molecules and pathogenic mechanism of M.hyorhinis are not clear yet. In this study, we performed several experiments to identify the function of the variable lipoprotein (Vlp) family in the adherence to the host cell. According to the gene sequences of the vlp family, seven genes of Vlp had been cloned into the prokaryotic expression vector pET-32a(+). The recombinant Vlp (rVlp) proteins were induced by IPTG, expressed in E.coli, and purified by affinity chromatography. The adhesion of Vlp to host cell was identified by indirect immunofluorescence assay and the microtiter plate adherence assay. Result showed that seven kinds of recombinant expression plasmid pET-32a (+) /vlp were constructed successfully, and the purified rVlp proteins were obtained. The results of adherence assays showed that the purified vlpA, vlpB, vlpC, vlpE and vlpG proteins were able to bind to PK cell, while the adhesion ability of the purified vlpD and vlpF proteins were not obvious. This study successfully constructed seven kinds of rVlp proteins, and the data indicated that some of Vlp was the adhesins of M.hyorhinis.
Keywords:Mycoplasma hyorhinis; variable lipoprotein; cell adhesion
国家自然科学基金项目(No.31300155)、江苏省自然科学基金项目(No.BK20130702);江苏省农业科技自主创新资金项目(No.cx(14)5039)联合资助
