反转录环介导等温扩增技术对丙型肝炎病毒可视化分型检测
2016-07-28刘金霞孙殿兴
赵 娜,刘金霞,孙殿兴
反转录环介导等温扩增技术对丙型肝炎病毒可视化分型检测
赵娜1,2,刘金霞2,孙殿兴2
1.承德医学院病原生物学教研室,承德067000;2.中国人民解放军白求恩国际和平医院全军肝病诊治中心,石家庄050082
摘要:目的应用反转录环介导等温扩增技术(RT-LAMP)可视化检测丙型肝炎病毒(HCV)1b和2a基因型,为RT-LAMP技术应用于现场或基层医院提供初步探索经验。方法首先,收集临床阳性样本并用荧光定量PCR分型检测,把样本基本分为1型和非1型。然后分别根据HCV 1b和2a基因型设计RT-LAMP引物并优化反应条件,通过互换模板实验验证这2套引物的特异性,并通过检测稀释的模板以验证引物的灵敏度。同时用钙黄绿素进行产物显色,使HCV分型检测可视化。最后用RT-LAMP方法检测临床样本,并计算阳性率,应用配对卡方检验比较RT-LAMP和荧光定量PCR的统计学差异。结果优化好的RT-LAMP体系的特异性好,对HCV 1b型的检测灵敏度为103 IU/mL,2a型的检测灵敏度为104 IU/mL。另外,利用钙黄绿素进行产物检测的效果和电泳结果相当。通过对临床样本分型检测,HCV 1b型样本的RT-LAMP检测结果和荧光定量PCR差异无统计学意义(P>0.05),HCV 2a型样本的RT-LAMP检测结果和荧光定量PCR差异有统计学意义(P<0.05),但是未检出的样本中有2例为HCV 2b型。结论RT-LAMP对HCV的可视化分型检测具有较好的特异性和灵敏度,操作简便,具有在现场或基层医院的应用前景。
关键词:丙型肝炎病毒(HCV);反转录环介导等温扩增(RT-LAMP);分型检测
Supported by the Medicine and Hygiene Research Foundation of the PLA (No. CBJ14C010)
丙型肝炎病毒(Hepatitis C virus,HCV)是仅次于乙型肝炎病毒引起慢性肝炎的主要病原体,如果不进行正确治疗,将有相当比例的患者会发展为肝硬化甚至肝癌。根据HCV序列之间超过30%的差异,可将HCV主要分为6个基因型,每一型又可细分为不同的亚型。HCV基因分型检测具有重要的临床意义:1)HCV基因型分布具有地区差异。在湖北以1b型为主,其次为2a型[1],在山东则以2a型为主,其次为1b型[2]。我国HCV的流行株几乎全部是1b型和2a型。2)不同基因型患者的临床表现也不同。众多学者认为1b型与肝硬化和肝癌有密切关系[3-5],也有学者提出1b型患者的肝硬化程度还与甘油三酯、脂蛋白等指标有关[6]。3)不同基因型患者使用干扰素的疗效也不同。在干扰素加利巴韦林的治疗中,HCV 1型的治疗效果劣于非1型[7]。
虽然荧光定量PCR技术对HCV进行分型在大型医院已经十分普遍,但是这项技术对实验环境和操作能力有较高的要求,因此无法普及到现场或基层医院。反转录环介导等温扩增(Reverse transcription loop-mediated isothermal amplification,RT-LAMP)技术是一种特异性和灵敏度均较高、操作简单的等温RNA扩增技术,尤其是这项技术对实验环境和人员的操作技能要求不高。虽然已经有学者介绍过RT-LAMP对HCV的检测[8-10],但是RT-LAMP对HCV进行分型检测未见介绍;虽然对HCV分型的方法还有直接测序法、型特异性引物PCR分型法[11]等,但是上述技术操作繁琐,不适合在现场或基层医院应用。本研究针对1b型和2a型HCV的5′UTR区保守序列设计分型引物,并使用钙黄绿素使产物显色,初步实现了HCV的可视化分型检测。
1材料与方法
1.1主要试剂病毒RNA提取试剂盒(Viral RNA Mini Kit)购自QIAamp公司,TIANScript cDNA第一链合成试剂盒购自凯杰公司,逆转录酶(M-MLV Reverse Transcriptase)购自Vazyme公司,Bst DNA聚合酶和10×reaction buffer购自NEB公司,重组核糖核酸酶抑制剂(RNA酶抑制剂)购自Invitrogen公司,钙黄绿素购自Sigma公司,100 bp DNA Marker购自TaKaRa公司。
1.2模板来源收集中国人民解放军白求恩国际和平医院肝病科2015年4月至2015年7月住院患者血清并按照RNA提取试剂盒的操作说明提取RNA,送该院检验科用荧光定量PCR进行分型检测(其灵敏度为1×103IU/mL),选择HCV RNA含量范围为1×104~1×107IU/mL的74例样本,其中1型有38例,非1型有36例。检验科另提供HCV RNA含量为1×107IU/mL的HCV 1b和HCV 2a定值质控品进行条件优化、特异性和灵敏性实验。另收集10例健康人血清提取RNA后做阴性对照。
1.3RT-LAMP型特异性引物根据GenBank公布的HCV 1b型(GenBank登录号:L02836、KC844051、GU451222、AY460204、KC844052、EF638081、EU857431、DQ071885、AB779562、HQ639947、KF676352)和2a型(GenBank登录号:HQ639938、HQ639939、HQ639943、HQ639944、HQ639945、KC844043、KF676351、KF676352、KP721475)参考序列,应用Clustal Omega软件进行序列对比,根据两型的5′非编码区区段(5′UTR)确定HCV 1b和2a的型特异性位点,然后借助引物设计软件Primer Explorer V4(http://primerexplorer.jp/e/)设计型特异性引物。型特异性引物设计要求:在F2/B2或F3/B3的3′端有分型位点,在F1c/B1c的5′端有分型位点(但不要求每条引物末端都要有分型位点)。扩增HCV 1b和2a的型特异性引物由上海生工公司合成,引物序列见表1。表1中F3和B3为外引物,FIP(由F1c和F2组成)和BIP(由B1c和B2组成)为内引物。
1.4RT-LAMP体系的优化RT-LAMP 50 μL反应体系包括:内引物(FIP/BIP)、外引物(F3/B3)、dNTPs、甜菜碱、MgSO4、反应缓冲液、Bst DNA聚合酶、AMV、RNA酶抑制剂和RNA模板。逐步改变对扩增影响较大的因素(甜菜碱、MgSO4)的浓度:甜菜碱以0.4、0.8、1.2、1.6 mol/L的浓度顺序扩增;MgSO4以2、4、6、8 mmol/L的浓度顺序扩增。根据电泳条带的亮度确定最优反应条件。扩增时间约60 min,扩增温度为65 ℃,将反应管置于冰上终止反应。
表1HCV 1b和2a型的RT-LAMP引物
Tab.1RT-LAMP primers of HCV genotypes 1b and 2a
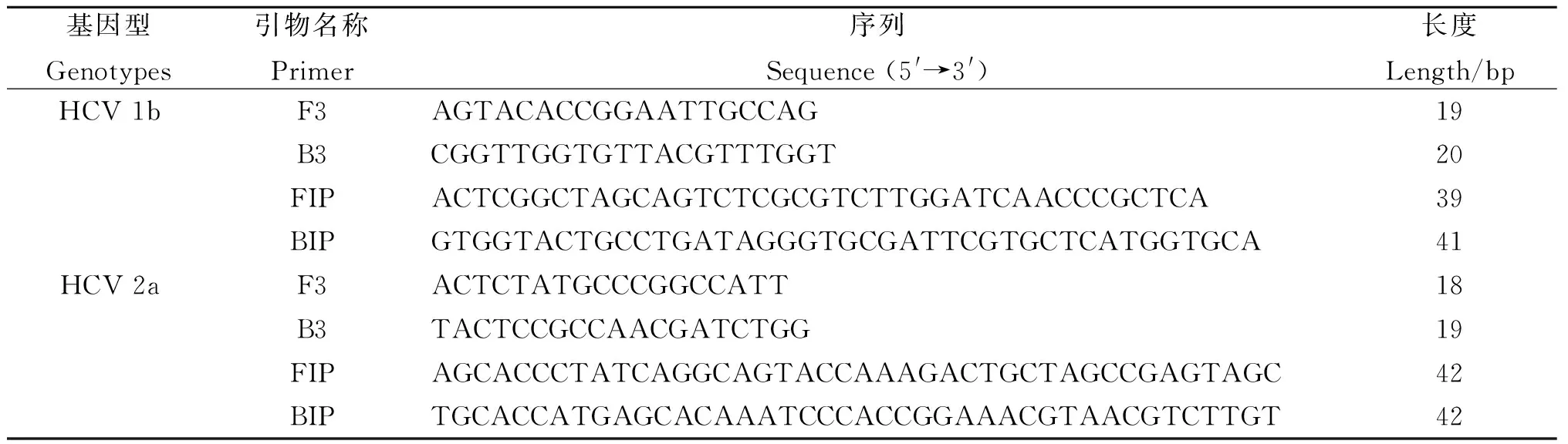
基因型Genotypes引物名称Primer序列Sequence(5'→3')长度Length/bpHCV1bF3AGTACACCGGAATTGCCAG19B3CGGTTGGTGTTACGTTTGGT20FIPACTCGGCTAGCAGTCTCGCGTCTTGGATCAACCCGCTCA39BIPGTGGTACTGCCTGATAGGGTGCGATTCGTGCTCATGGTGCA41HCV2aF3ACTCTATGCCCGGCCATT18B3TACTCCGCCAACGATCTGG19FIPAGCACCCTATCAGGCAGTACCAAAGACTGCTAGCCGAGTAGC42BIPTGCACCATGAGCACAAATCCCACCGGAAACGTAACGTCTTGT42
1.5扩增结果判定本研究用以下2种方法进行判断:1)琼脂糖凝胶电泳:将5 μL扩增产物上样于2%琼脂糖中电泳约40 min,在紫外光下观察扩增条带。阳性扩增可见特征性的梯状条带,阴性结果无此现象。2)钙黄绿素可视化检测:在反应前向体系中加入1 μL配好的钙黄绿素和MnCl2混合液(钙黄绿素和MnCl2的终浓度分别为5 mmol/L和10 mmol/L),反应结束后将反应管置于黑色背景下裸眼观察,呈现绿色为阳性,保持橙色为阴性。
1.6分型特异性和灵敏度特异性实验:分别以HCV RNA质控品、健康人RNA提取物和双蒸水做模板进行RT-LAMP扩增,根据电泳和染色结果判定两套引物的特异性。灵敏度实验:将HCV 1b和2a质控品分别用双蒸水进行一系列10倍稀释至102IU/mL,将稀释后的样本分别进行RT-LAMP扩增,评价RT-LAMP的灵敏度。将特异性和灵敏度实验重复4次。
1.7统计学分析RT-LAMP分别将38例1型、36例非1型和10例阴性样本的RNA进行检测。以荧光定量PCR为标准,计算阳性率,应用SPSS 17.0软件对该结果和荧光定量PCR做McNemar配对卡方检验,双侧检验进行统计学推断,P<0.05为差异有统计学意义。
2结果
2.1RT-LAMP条件优化通过对扩增效率影响较大的甜菜碱和MgSO4进行一系列浓度梯度实验后,优化好的RT-LAMP反应体系为:内引物(FIP和BIP)各1.6 μmol/L,外引物(F3和B3)各0.2 μmol/L,甜菜碱 0.8 mol/L,MgSO46 mmol/L,dNTPs 1.4 mmol/L,模板10 μL(HCV RNA含量为1×107IU/mL),8U Bst DNA聚合酶、5 μL 10×反应缓冲液,100 U AMV,20 U RNA酶抑制剂。

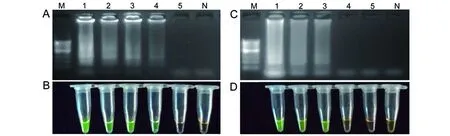
(A)RT-LAMP电泳图:1-4 HCV 1b型的特异性引物对4种模板的检测结果,其中,1表示HCV 1b型为模板;2表示HCV 2a型为模板;3表示健康人RNA提取物为模板;4表示双蒸水为模板;5-8 HCV 2a型的引物对4种模板的检测结果,其中5表示HCV 2a位模板;6表示HCV 1b为模板;7表示健康人RNA提取物为模板;8表示双蒸水为模板。(B)钙黄绿素可视化检测效果,各管的排列顺序同上。M:100 bp DNA marker。(A) Electrophoresis pattern of RT-LAMP. 1-4: 4 templates detection results by HCV genotype 1b specific primers, among which, 1 indicates HCV genotype 1b as template; 2 indicates HCV genotype 2a as template; 3 indicates RNA extract from healthy human as template; 4 indicates ddH2O as template; 5-8 templates detection results by HCV genotype 2a specific primers, among which, 5 indicates HCV genotype 2a as template; 6 indicates HCV genotype 1b as template; 7 indicates RNA extract from healthy human as template;8 indicates ddH2O as template.(B) Visualized detection by calcein, the order of each tube is the same as above. M: 100 bp DNA marker.图1 RT-LAMP分型特异性实验Fig.1 Specificity of genotyping assay by RT-LAMP
2.2分型特异性实验模板互换实验验证HCV 1b型引物特异性:以HCV 1b型质控、2a型质控、健康人RNA 提取物和双蒸水为阴性对照模板进行扩增;模板互换实验验证HCV 2a型引物特异性:以HCV 2a 型质控、1b型质控、健康人RNA 提取物和双蒸水为阴性对照模板进行扩增。电泳结果如图1A所示,HCV 1b型特异性引物只使HCV 1b型模板发生扩增,其他模板均没有被扩增;HCV 2a型特异性引物只使HCV 2a型模板发生扩增,其他模板也均没有被扩增,说明引物未受到其他无关的RNA的影响,特异性较好。另外,由图1B可知,钙黄绿素的可视化效果和电泳结果相当。4次重复实验结果与上述实验结果相当。
2.3分型灵敏度实验RT-LAMP对HCV 1b型质控稀释样本的扩增结果如图2A表示,随着稀释倍数的逐渐增大,模板量从106IU/mL~103IU/mL呈现逐渐减弱的条带,模板量为102IU/mL未见扩增,可知RT-LAMP检测HCV 1b型的灵敏度为103IU/mL,这和荧光定量PCR的灵敏度相当。另外,图2B中钙黄绿素可视化效果同电泳结果相当。RT-LAMP对HCV 2a型稀释样本的扩增结果如图2C所示,随着稀释度的逐渐增大,模板量从106IU/mL~104IU/mL呈现逐渐减弱的条带,模板量为103IU/mL和102IU/mL未见扩增,可知RT-LAMP检测HCV 2a型的灵敏度为104IU/mL,这比荧光定量PCR的灵敏度低1个数量级。图2D中的钙黄绿素可视化效果同电泳结果相当。
对HCV 1b和2a质控分别重复扩增4次,验证检测的重复性。结果如表2所示,和上述实验结果相当,重复性较好。
(A)RT-LAMP检测HCV 1b型的电泳图,其中,1-5表示HCV RNA含量分别为106、105、104、103、102 IU/mL。(B)RT-LAMP检测HCV 1b型的钙黄绿素可视化效果,各管的排列顺序同上图。(C)RT-LAMP检测HCV 2a型的电泳图,其中,1-5表示HCV RNA含量分别为106、105、104、103、102 IU/mL。(D)RT-PCR检测HCV 2a型的钙黄绿素可视化效果,各管的排列顺序同上图。M:100 bp DNA marker;N:双蒸水阴性对照。(A) Electrophoresis pattern for detection of HCV genotype 1b by RT-LAMP.1-5 indicate the electrophoresis results of HCV RNA including 106, 105, 104, 103, and 102 IU/mL.(B) Calcein effect for detection of HCV genotype 1b by RT-LAMP, the order of each tubes is the same as above.(C) Electrophoresis pattern for detection of HCV genotype 2a by RT-LAMP. 1-5 indicate the electrophoresis results of HCV RNA including 106,105,104,103,102 IU/mL.(D) Calcein effect for detection of HCV genotype 2a by RT-LAMP, the order of each tube is the same as above.M:100 bp DNA Marker. N: negative control using ddH2O.图2 RT-LAMP的分型灵敏度实验Fig.2 Genotyping sensitivity assay of RT-LAMP
表2RT-LAMP的重复性实验Tab.2Repeatability assay of RT-LAMP
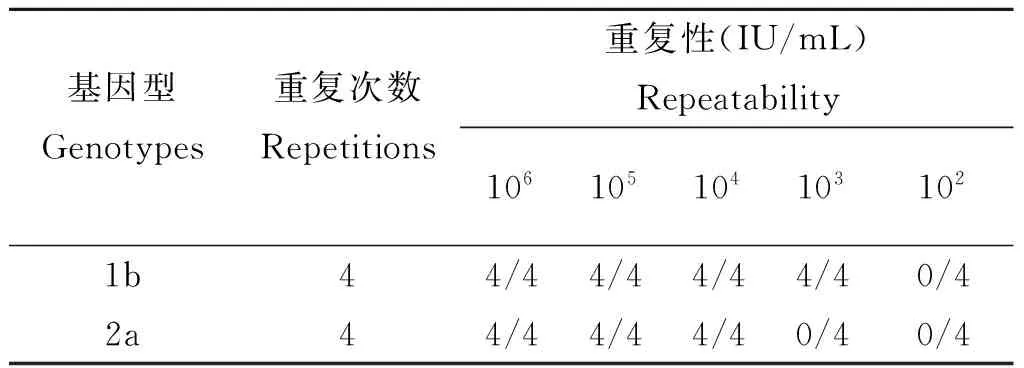
基因型Genotypes重复次数Repetitions重复性(IU/mL)Repeatability1061051041031021b44/44/44/44/40/42a44/44/44/40/40/4
2.4临床样本的分型检测RT-LAMP分别扩增经荧光定量PCR检测的38例HCV 1型、36例HCV非1型和10例阴性对照。计算阳性率,应用SPSS17.0软件,配对卡方检验对扩增结果进行统计学分析,结果如表3所示。
对HCV 1b型样本的检测结果:RT-LAMP法检出34例,阳性率为89.47%,和荧光定量PCR的差异没有统计学意义(P>0.05);对HCV 2a型样本检测结果:RT-LAMP法检出30例,阳性率为83.33%,经配对卡方检验,和荧光定量PCR的差异有统计学意义(P<0.05)。对RT-LAMP未检出的样本凝胶电泳后的产物送测序,结果未检出的4例1型样本为HCV 1a型;未检出的6例非1型样本中有两例为HCV 2b型,另4例其HCV RNA含量约为103IU/mL,低于RT-LAMP对HCV 2a型的检测灵敏度(104IU/mL)。
表3RT-LAMP的临床分型结果
Tab.3Clinical genotyping results of RT-LAMP
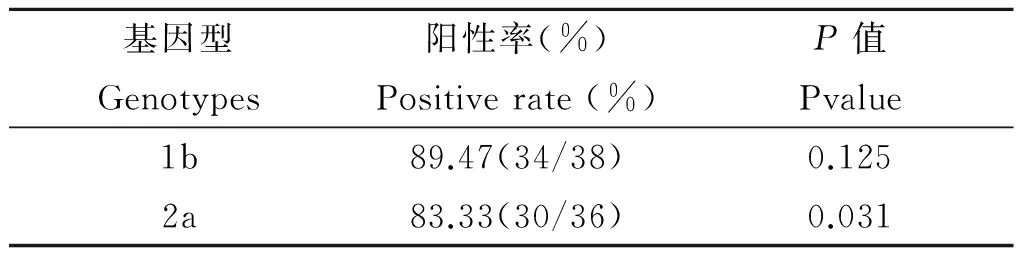
基因型Genotypes阳性率(%)Positiverate(%)P值Pvalue1b89.47(34/38)0.1252a83.33(30/36)0.031
3讨论
本研究应用RT-LAMP对HCV进行可视化分型检测,为HCV 1b和2a这两类基因型不同的患者的临床治疗提供一定的科学依据,有利于在现场或基层医院的丙肝患者的个体化治疗。
使用RT-LAMP对HCV分型检测有如下优势:第一,操作的优势。本研究操作简单、设备廉价,仅需一台保证恒温的普通水浴箱即可,不用如荧光定量PCR昂贵的仪器,也不用设定退火延伸的温度值、循环次数等参数。第二,引物的优势。只有所有引物同时识别靶序列才启动扩增,靶序列上的任何区域与引物不匹配均不能完成扩增,从而保证其特异性和灵敏度。第三,结果判定的优势。本研究选用染料钙黄绿素进行显色,这种染料不抑制扩增反应,所以可以在扩增前加入反应管,扩增后用裸眼观察反应管的颜色变化即可,不但避免了反应后开盖带来的气溶胶污染问题,而且具有和电泳检测相当的效果,直观性好。
本研究建立的RT-LAMP技术为HCV的分型检测提供了初步探索经验。如果对该技术做进一步的完善,如检测不常见的HCV基因型或研制一体化、自动化的检测装置,将更有利于该技术在现场或基层医院的推广,有利于丙肝患者个体化治疗的发展。
参考文献:
[1] Peng J, Lu Y, Liu W, et al. Genotype distribution and molecular epidemiology of hepatitis C virus in Hubei, Central China[J]. PLoS One, 2015, 10(9): e0137059. DOI: 10.1371/journal.pone.0137059
[2] Zhang LX, Wang L, Xu WS, et al.Study of the distribution of HCV genotypes and serotypes in Shandong province[J]. J Clin Hepatol, 2005, 21(4): 215-216. (in Chinese)
张立新, 王磊, 徐皖苏, 等.山东地区丙型肝炎病毒的基因型及血清学分型的研究[J]. 临床肝胆病杂志, 2005,21(4):215-216.
[3] Bruno S, Crosignani A, Maisonneuve P, et al. Hepatitis C virus genotype 1b as a major risk factor associated with hepatocellular carcinoma in patients with cirrhosis: a seventeen-year prospective cohort study[J]. Hepatol (Baltimore, Md), 2007, 46(5): 1350-1356. DOI: 10.1002/hep.21826
[4] Raimondi S, Bruno S, Mondelli MU, et al. Hepatitis C virus genotype 1b as a risk factor for hepatocellular carcinoma development: a meta-analysis[J]. J Hepatol, 2009, 50(6): 1142-1154. DOI: 10.1016/j.jhep.2009.01.019
[5] Sangiovanni A, Iavarone M. Hepatitis C virus genotype 1b, cirrhosis, and risk of hepatocellular carcinoma[J]. Hepatol (Baltimore, Md), 2008, 47(1): 357; author reply -8. DOI: 10.1002/hep.22060
[6] Nagano T, Seki N, Tomita Y, et al. Impact of chronic hepatitis C virus genotype 1b infection on triglyceride concentration in serum lipoprotein fractions[J]. Intl J Mol Sci, 2015, 16(9): 20576-20594. DOI: 10.3390/ijms160920576
[7] Xie ZB, Zhou JL, Li YZ, et al. The characteristics and clinical significance of HCV genotypes in huaihua area of Hunan province[J]. China J Mond Med, 2013, 23(31): 43-46. (in Chinese)
谢知兵, 周建亮, 李勇忠, 等. 怀化地区丙肝基因分型分布及临床意义[J]. 中国现代医学杂志, 2013,23(31):43-46.
[8] Kargar M, Askari A, Doosti A, et al. Loop-mediated isothermal amplification assay for rapid detection of hepatitis C virus[J]. Indian J Virol, 2012, 23(1): 18-23. DOI: 10.1007/s13337-012-0067-2
[9] Wang QQ, Zhang J, Hu JS, et al. Rapid detection of hepatitis C virus RNA by a reverse transcription loop-mediated isothermal amplification assay[J]. FEMS Immunol Medical Microbiol, 2011, 63(1): 144-147. DOI: 10.1111/j.1574-695X.2011.00828.x
[10] Yang J, Fang MX, Li J, et al. Detection of hepatitis C virus by an improved loop-mediated isothermal amplification assay[J]. Arch Virol, 2011, 156(8): 1387-1396. DOI: 10.1007/s00705-011-1001-4
[11] Margall N, March F, Espanol M, et al. Two unusual hepatitis C virus subtypes, 2j and 2q, in Spain: Identification by nested-PCR and sequencing of a NS5B region[J]. J Virologi Methods, 2015, 223: 105-108. DOI: 10.1016/j.jviromet.2015.07.022
DOI:10.3969/j.issn.1002-2694.2016.04.013
通讯作者:刘金霞,Email:1158210524@qq.com
中图分类号:R373
文献标识码:A
文章编号:1002-2694(2016)04-0383-05
Corresponding author:Liu Jin-xia, Email: 1158210524@qq.com
收稿日期:2015-10-26修回日期:2015-12-20
Visual genotyping detection of HCV by reverse transcription loop-mediated isothermal amplification technique
ZHAO Na1,2, LIU Jin-xia1, SUN Dian-xing2
(1.ChengdeMedicalUniversity,Chengde067000,China;2.BethuneInternationalPeaceHospital,Shijiazhuang050082,China)
Abstract:Reverse transcription loop-mediated isothermal amplification (RT-LAMP) method was applied to detect hepatitis C virus(HCV) genotypes 1b and 2a visually, and provided prelimary exploration experience for its promotion at field or in primary care hospitals. First, clinical samples were collected and genotyped by fluorescent quantitative PCR, which could genotype these samples into HCV 1 genotype and non-1 genotype in general. After that, RT-LAMP primers were designed according to HCV genotypes 1b and 2a, the reaction condition was tested for optimization. The specificity of the 2 sets of primers was validated by interchange of templates. The sensitivity of the 2 sets of primers was validated through detection of dilute templates. In the meantime, products strain was realized by calcein for visual HCV genotyping detection. At last, clinical samples were detected by RT-LAMP, and positive rate of RT-LAMP was calculated, the chi-square test was applied to compare the RT-LAMP with fluorescent quantitative PCR. Results showed that optimized RT-LAMP had good specificity,which the sensitivity for detection of HCV genotype 1b was 103 IU/mL and for HCV genotype 2a was 104 IU/mL, respectively. In addition, calcein showed the same effect with electrophoresis in products detection. After detection of clinical samples, RT-LAMP had no statistics difference with fluorescent quantitative PCR (P>0.05)for detection of HCV genotype 1b. RT-LAMP had statistics difference with fluorescent quantitative PCR (P<0.05) for detection of HCV genotype 2a, but we found that there were two HCV 2b samples in the undetected samples. In conclusion, the RT-LAMP method performs well for visualized genotyping detection of HCV. It is easy to operate, with good specificity and sensitivity, and has the application prospect at field or in primary care hospitals.
Keywords:hepatitis C virus (HCV); reverse transcription loop-mediated isothermal amplification (RT-LAMP); genotyping detection
全军医药卫生科研基金项目(No.CBJ14C010)资助
