致病性嗜水气单胞菌的分离鉴定及耐药性分析
2016-07-28高智玲郭学军祝令伟冯书章
高智玲,纪 雪,陈 萍,郭学军,刘 军,祝令伟,周 伟,冯书章,孙 洋
致病性嗜水气单胞菌的分离鉴定及耐药性分析
高智玲1,2,纪雪2,3,陈萍1,郭学军2,3,刘军2,3,祝令伟2,3,周伟2,3,冯书章2,3,孙洋2,3
1.吉林农业大学食品科学与工程学院,长春130118;2.军事医学科学院军事兽医研究所,长春130122;3.吉林省人兽共患病预防与控制重点实验室,长春130122
摘要:目的了解长春地区水产品中致病性嗜水气单胞菌流行菌株的分布及其耐药情况。方法采用国标方法初步分离嗜水气单胞菌,结合生化及分子生物学方法进行种属鉴定并检测毒力基因,测定致病株毒力及耐药谱。结果319份样品中共分离到279株嗜水气单胞菌,分离率87.46%。毒力基因阳性株为24株,阳性率为8.60%,毒力基因阳性株全部为β-溶血并具有较强的细胞毒性。致病性分离株至少耐受4类抗生素,均为多重耐药株。结论研究获得了长春地区嗜水气单胞菌的基本流行病学数据,探讨了其毒力谱和多重耐药模式,为嗜水气单胞菌病防控措施提供了依据。
关键词:嗜水气单胞菌;毒力;耐药性
Supported by the National 863 Project of China (No.2012AA022006), the National Science and Technology Major Project of China (No.2013ZX10004-217-002) and the Scientific and Technological Development Project of Jilin Province (Nos. 20140101032JC & 20150101110 JC)
Corresponding: Sun Yang, Email: sunyang10@hotmail.com
嗜水气单胞菌(Aeromonashydrophila)属于弧菌科、气单胞菌属,属嗜温、有动力的气单胞菌群[1],是气单胞菌的模式种[2]。在自然界中广泛分布,普遍存在于淡水、污水、淤泥、土壤和人类粪便中,根据其毒力差异,可分为致病性菌株和非致病性菌株。致病性菌株可感染鱼类、两栖类、爬行类、鸟类和哺乳类等动物。临床上,人类感染主要以急性出血性败血症为主要特征,慢性感染则主要表现为皮肤溃疡或肠炎[3],是一种典型人—兽—鱼共患病病原[4]。该病原菌可对淡水养殖业造成严重的经济损失,同时给人类的健康带来严重的威胁,其公共卫生学意义已引起国内外广泛关注和高度重视。近年来,随着水产养殖业抗生素的滥用,该菌的耐药性也在不断增强并呈现较严重的多重耐药性,其耐药问题已成为影响水产养殖业发展和威胁人类健康的重要因素[5-7]。本研究针对长春地区淡水养殖鱼类及市售淡水鱼类采样、分离嗜水气单胞菌,并对其毒力及耐药性进行研究,以期掌握致病性嗜水气单胞菌的流行情况及耐药谱变化,为淡水养殖业嗜水气单胞菌病的防控提供理论依据。
1材料与方法
1.1材料
1.1.1样品来源2014年采集长春市水产市场、超市、周边养殖场及水库鱼的鳃拭子、肠道内容物、肝脏及鱼养殖区水样,共计319份。其中水产市场样品188份,超市样品65份,周边养殖场样品40份,水库样品26份。
1.1.2参考菌株及细胞株 嗜水气单胞菌质控菌株ATCC 7966及Vero (CCL-81)细胞株由本室保存。
1.1.3培养基及试剂 RS培养基、RYAN培养基及生化反应管购自青岛海博生物技术有限公司;MHA鉴定培养基购自法国梅里埃公司;DMEM培养液购自美国Thermo公司;药敏纸片购自Oxoid公司;PCR Master Mix 缓冲液、DNA Maker为日本TaKaRa公司产品;引物和测序由invitrogen公司完成;新生胎牛血清购自四季青公司;胰酶为Gibco公司产品。
1.2方法
1.2.1样品处理无菌操作剪取鱼的肝、肠等样品于试管中,加入2 mL无菌生理盐水;水样品取2 mL于试管中;鳃拭子于拭子管中加入2 mL无菌生理盐水。以上样品室温振荡10 min,使细菌充分洗脱,震荡后静置2~3 min。
1.2.2菌株分离培养参考GB/T 18652-2002方法[3],吸取上清10 μL,20 μL生理盐水稀释后在RS琼脂平板上半涂布,半划线,28 ℃恒温培养18~24 h,观察菌落生长情况,若菌落光滑、微凸、圆整、黄色或淡黄色,并有特殊芳香气味,则为疑似菌落。挑取单菌落划线于RYAN气单胞菌选择培养基上进行二次纯化,将菌落形态光滑、中间凸起有核、圆形、颜色绿色或深绿色的单菌落进行革兰氏染色镜检。每样品仅分离一株(所有分离株为非克隆株)。
1.2.3分离株PCR鉴定疑似菌落接种于LB液体培养基中,28 ℃振荡培养过夜;吸取200 μL菌液于1.5 mL离心管中,12 000 r/min离心1 min,弃上清,加入200 μL ddH2O,混匀后100 ℃水浴10 min。冷却后,12 000 r/min离心1 min,上清作为模板待检。参考文献[8-9],针对气单胞菌属16S rDNA基因特异性片段,嗜水气单胞菌16S rDNA基因特异性片段、溶血素基因、气溶素基因合成了4对引物(表1)。PCR 反应体系:PCR Master Mix 12.5 μL,DNA模板1 μL,引物各1 μL,ddH2O补至25 μL。气单胞菌属、气溶素及溶血素检测PCR反应条件:95℃预变性3 min;95℃变性30 s,59℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸7 min;嗜水气单胞菌的特异性16S rDNA检测PCR反应
表1PCR鉴定引物
Tab.1Primers used in this study

引物名称Name引物序列(5'-3')Sequence(5'-3')基因位置Locationwithingene产物大小/bpSizeofproducts/bp参考文献或登入号Referenceandno.ofGenBankAHH1FGCCGAGCGCCCAGAAGGTGAGTT961-983130[9]AHH1RGAGCGGCTGGATGCGGTTGT1090-1071AH-aerAFCAAGAACAAGTTCAAGTGGCCA1323-1344309M16495AH-aerARACGAAGGTGTGGTTCCAGT1631-1613A16SFGGGAGTGCCTTCGGGAATCAGA1020-1041356X74677A16SRTCACCGCAACATTCTGATTTG1375-1355AH-16SFGAAAGGTTGATGCCTAATACGTA445-467685KP091884AH-16SRCGTGCTGGCAACAAAGGACAG1130-1110
注:AHH1,溶血素引物;AH-aerA,气溶素引物;A16S,气单胞菌16S rDNA属特异性引物;AH-16S,嗜水气单胞菌16S rDNA特异性引物。
Note: AHH1, Primers for gene of hemolysin; AH-aerA, Primers for gene of aerolysin; A16S, Primers forAeromonasspp.; AH-16S, Primers forAeromonashydrophila.
条件:95 ℃预变性5 min;95 ℃变性30 s ,56 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。1.5%的琼脂糖进行凝胶电泳,凝胶成像系统观察分析。
1.2.4生化鉴定及溶血试验以细菌鉴定仪(BD PhoenixTM-100)对24株毒力基因阳性的气单胞菌分离株进行鉴定。以微量发酵管进行生化鉴定,包括葡萄糖、蔗糖、阿拉伯糖、七叶苷、水杨苷,同时进行氧化酶试验、AHM鉴定培养、运动性、吲哚试验、蛋白酶试验。并将分离株接种于含5%绵羊血琼脂培养基上,以质控菌株为阳性对照,28 ℃恒温培养24~28 h,观察有无溶血现象。
1.2.5细胞毒性试验24株携带毒力基因的分离株及10株毒力基因阴性分离株分别接种于5 mL脑心浸液肉汤,28 ℃培养箱中孵育16 h。将菌液于4 ℃ 8 000 r/min离心5 min,上清过滤除菌。以细胞培养液将细菌培养上清做2倍梯度稀释,备用。将处于对数生长期的Vero细胞消化并计数,调细胞密度为104m/L,吸取细胞悬液加到96孔细胞培养板中,每孔100 μL,5% CO2,37 ℃,恒温孵育24~48 h,待细胞长至80%后,向每孔中添加100 μL不同稀释度培养上清。每株菌毒素上清设7个梯度,每个梯度设3个重复,于5% CO2,37 ℃恒温孵育24~72 h,倒置显微镜(×40)观察细胞病变状况。同时设置空白对照、阴性对照(脑心浸液肉汤)及阳性对照(ATCC 7966培养上清)。
1.2.6药物敏感性试验以细菌鉴定仪(BD PhoenixTM-100)测定分离株耐药谱。仪器不能测定的抗生素采用Kirby-Bauer纸片扩散法,依据CLSI标准[10]判定耐药水平。
2结果
2.1初步分离鉴定经RS培养基初步分离、RYAN培养基二次纯化后得到279株疑似嗜水气单胞菌分离株。均为革兰氏阴性、两端钝圆的短杆菌。气单胞菌属特异性16S rDNA引物PCR鉴定均为阳性。嗜水气单胞菌特异性16S rDNA引物PCR鉴定205株为阳性,74株为阴性。
2.2毒力基因检测结果实验获得的扩增片段大小与预期结果一致。297株分离菌毒力基因PCR检测有24株携带溶血素和/或气溶素基因(大多数分离株同时携带气溶素与溶血素2种基因,3株菌只携带一种毒素基因)。其中22株嗜水气单胞菌特异性16S rDNA检测阳性(表2)。

表2 毒力基因阳性株鉴定结果
注:“+”阳性;“-”阴性;“—”无鉴定结果。
Note: “+” Positive; “-” Negative; “—” No result.
2.3毒力基因阳性菌株鉴定结果 细菌鉴定仪对这24株菌鉴定结果显示,13株为嗜水气单胞菌,10株为温和气单胞菌,1株为豚鼠气单胞菌。根据《伯杰细菌鉴定手册》对24株菌进行鉴定,氧化酶试验、葡萄糖发酵均阳性,4株水杨苷阴性,AHM鉴定培养及阿拉伯糖发酵试验中分别有2株为阴性,蔗糖和七叶苷发酵试验中分别有1株为阴性,据此结果判定,24株毒力基因阳性分离株中15株为嗜水气单胞菌。此外,蛋白酶试验、运动性及溶血试验均为阳性,且均为β-溶血(表2)。
2.4细胞毒性试验结果24株携带毒力基因的气单胞菌培养上清作用于Vero细胞,均观察到细胞皱缩、脱落及形态变圆等细胞毒性反应。最短在培养上清液作用6 h后,细胞发生空泡效应;72 h后细胞脱落、破碎,死亡;对照组细胞正常。24株毒力基因阳性分离株培养上清致细胞病变的最大稀释倍数在29~218之间,10株毒力基因阴性分离株培养上清致细胞病变的稀释倍数均为2倍,阳性质控菌株细胞毒性反应的最大稀释倍数为218。有6株菌的细胞毒性较高,在215倍稀释度及以上,菌株AH-10毒力最强,细胞毒性反应的稀释倍数为218。只携带1种毒力基因的分离株AH-8、 AH-11及 AH-22的细胞毒性反应的稀释倍数分别为217、216和213。不同分离菌株的上清液对细胞毒性存在差异,结果统计如图1。

注:稀释梯度值为X,log2X-1为横坐标,即9代表1∶29;稀释梯度10代表1∶210;稀释梯度11代表1∶211;以此类推。X as the value of dilution gradient, log2X-1 as the absciss, 9 representatives dilutions of 1∶29; 10 representatives dilutions of 1∶210; 11 representatives dilutions of 1∶211; and so on.图1 细胞毒性试验结果Fig.1 Result of cytotoxic assay
2.5药物敏感性试验结果测试的26种抗生素包括β-内酰胺类与β-内酰胺酶抑制剂、氨基糖苷类、大环内酯类、磺胺类、喹诺酮类、氯霉素类、林可霉素类和四环素类抗生素。24株携带毒力基因的气单胞菌对其中8种抗生素全部敏感,对7种抗生素完全耐药(表3)。对青霉素类的氨苄西林、青霉素完全耐药,对哌啦西林耐药1株;对头孢菌素类的头孢噻吩、头孢唑林全部耐药,对头孢西丁耐药率达到41.70%(10株),对头孢曲松、头孢噻肟及头孢噻肟克拉维酸敏感;对于氨基糖苷类药物中的链霉素耐药,对庆大霉素、阿米卡星敏感;对喹诺酮类药物环丙沙星耐药性较左氧氟沙星严重,耐药率为16.67%(4株);对大环内酯类的红霉素耐药性达到了87.50%(21株),对阿奇霉素的耐药率为37.50%(9株);对克林霉素完全耐药;对四环素、复方新诺明耐药率分别为20.83%(5株)和25.00%(6株);对氨曲南、氯霉素的较为敏感;对碳青霉烯类抗生素全部敏感。总体分析,受试菌株对4类及以上抗生素具有耐药性,均为多重耐药菌,其中耐5类抗生素的菌株数最多,耐药谱最广的菌株能够耐受8类抗生素(图2)。
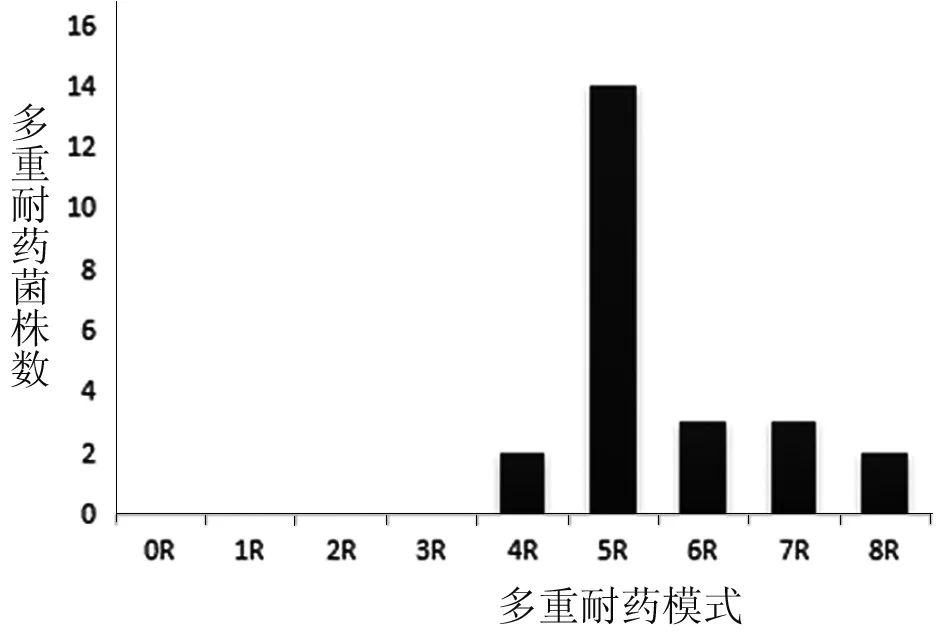
图2 不同耐药类型的菌株统计结果Fig.2 Statistical results of different resistant strains
3讨论
嗜水气单胞菌对鱼等冷血动物和温血动物均有致病性,是典型的人和水生动物的共患病原菌。该菌本身及其产生的毒素对食品安全提出了严峻的挑战。很多国外学者利用PCR方法以16S rDNA为目的基因对嗜水气单胞菌进行鉴定,但该方法亦有其局限性[11]。本研究根据Wang[8]等人的方法分离出的24株携带毒力基因的气单胞菌中,利用Dorsch[9]等的方法嗜水气单胞菌的检出率为91.67%(22株),微生物鉴定系统阳性结果为54.17%(13株),传统生化鉴定16株(66.7%)为嗜水气单胞菌。因此,若要更准确地检出嗜水气单胞菌,还应结合嗜水气单胞菌的生长特性及生化指标进行鉴定。
嗜水气单胞菌的致病性与其毒力因子密切相关,目前发现的嗜水气单胞菌毒力因子很多,但多数报道认为外毒素为嗜水气单胞菌的主要致病因子[12]。PCR方法作为敏感特异的检测手段得到广泛应用[13]。本研究以嗜水气单胞菌的溶血素和气溶素作为毒力标志物进行了PCR检测,并以细胞试验测定其毒力。试验结果全部毒力基因阳性株培养上清均具有很强的细胞毒性作用,而随机抽取的10株毒力基因阴性株培养上清对vero细胞毒性较弱,证明可以利用气溶素和溶血素为毒力标志物判定分离株毒力,或用于建立致病性嗜水气单胞菌的检测方法。本研究对长春地区淡水养殖鱼类嗜水气单胞菌的携带情况进行了初步调查,结果显示该菌广泛存在于市售淡水鱼及水产养殖环境中,且致病性嗜水气单胞菌占有比例较高,提示人类有通过接触或食用受污染的生鲜水产品而感染致病性嗜水气单胞菌的风险,应引起重视。
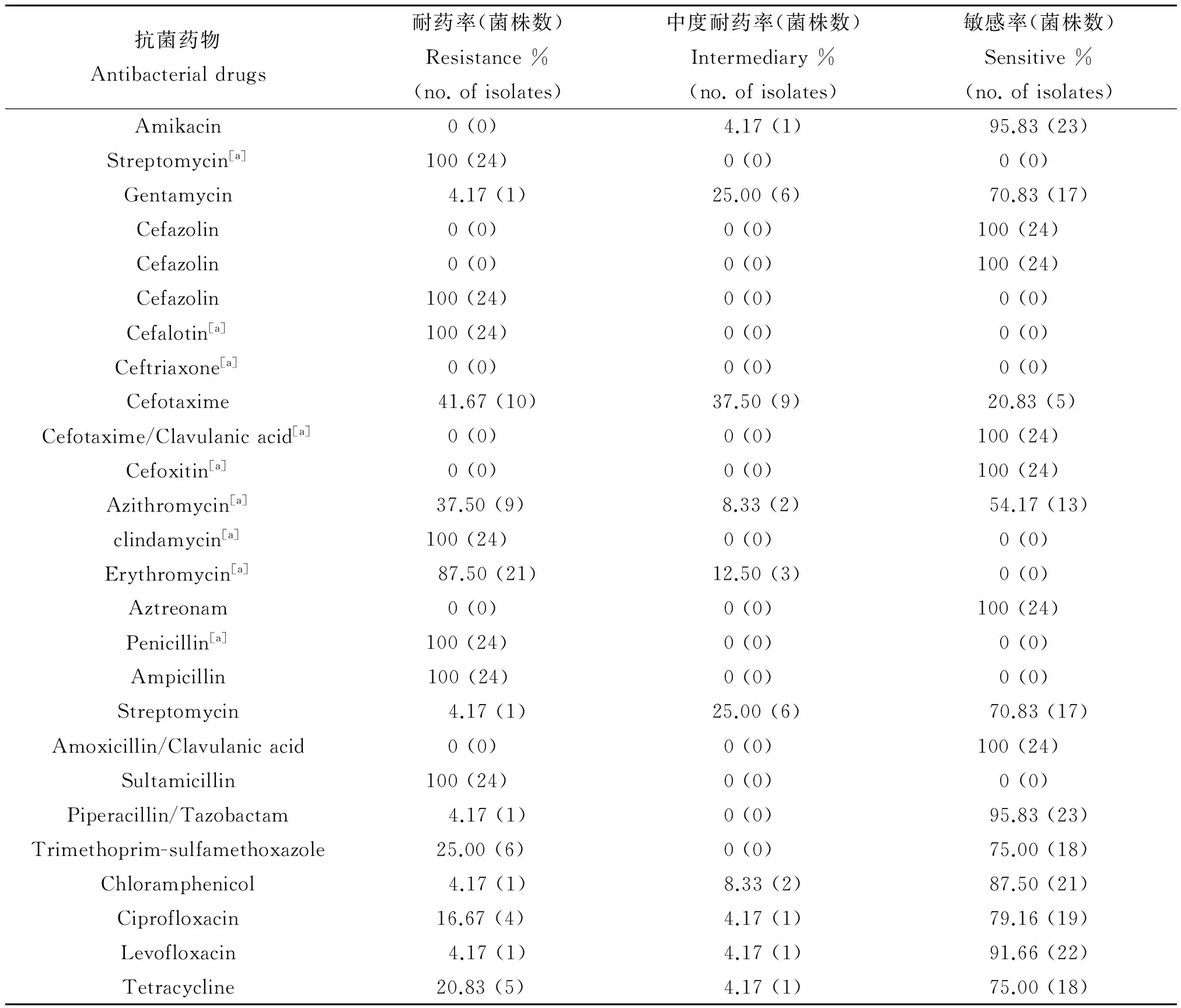
表3 致病性嗜水气单胞菌对26种抗菌药物的敏感性
注:[a]为KB纸片扩散法测得结果。
Note:[a]Results from Kirby-Bauer Test.
本研究分离的致病性嗜水气单胞菌对一代头孢的耐药率较高,对三代头孢比较敏感,这与蔡丽娟[6]和Ko[14]等报道一致,头孢唑林耐药水平较曲芬[15]等报道的48%的耐药率差距较大;对青霉素,氨苄西林完全耐药,耐药水平与朱秀芝[16]等其他学者报道的研究结果相近[17-20],其耐药情况甚为严重(96%~100%),本研究中克林霉素耐药率为100% ,这可能与嗜水气单胞菌固有耐药性有关[21]。相较于王静波[22]报道的北京地区嗜水气单胞菌的耐药情况,本研究结果对磺胺类、氨基糖苷类及喹诺酮类抗生素耐药率偏低,而与王友娟[23]报道的辽宁地区耐药水平相比,各种抗生素耐药水平均呈上升趋势,特别是链霉素、红霉素等抗生素,耐药率分别从8.4%及42.7%上升到了100%与87.5%。且分离到的毒力基因携带株至少耐受4类抗生素,58.3%(14株)的菌株耐受5类抗生素。这与淡水养殖场普遍、高频度使用这几种抗菌素有关,不同养殖区域、养殖品种、用药方法及用量也导致了耐药性的差异。
总之,无论是水产养殖,还是临床治疗,合理使用抗生素已成为当务之急。临床上应尽量根据药敏试验结果确定使用抗生素的种类和剂量,同时应加强水产养殖中抗生素的合理使用,控制多重耐药菌株的产生和流行。
参考文献:
[1]Shen JY. Research progress onAeromonashydrophila[J]. J Zhejiang Ocean Univ, 2008, 27(1): 78-86. DOI: 10.3969/j.issn.1008-830X.2008.01.017 (in Chinese)
沈锦玉. 嗜水气单胞菌的研究进展[J]. 浙江海洋学院学报, 2008, 27(1): 78-86.
[2]Coelwll RR, Macdonell MT, Deley J. Proposal to recognize the family Aeromonadaceae fam. Nov[J]. Intl J Systemic Evolutionary Microbiol, 1986, 36: 473-477. DOI: 10.1099/00207713-36-3-473
[3]GB/T 18652-2002,State Standard of the People's Republic of China[S].Beijing,Standards Press of China,2002.
GB/T 18652-2002, 中华人民共和国国家标准[S].北京:中国标准出版社,2002.
[4]Janda JM, Duffey PS. Mesophilic aeronaonadsin human disease: current taxonomy laboratory identification and infectious disease spectrum[J]. Rev Infect Dis, 1998 (100): 980-997. DOI: 10.1093/clinids/10.5.980
[5]Chen MJ, Wang H. Continuous surveillance of antimicrobial resistance among nosocomial gram-negative bacilli from intensive care units in China[J]. Natl Med J China, 2003, 83(5): 375-381. DOI: 10.3760/j:issn:0376-2491.2003.05.007 (in Chinese)
陈民钧, 王辉. 中国重症监护病房革兰阴性菌耐药性连续7年监测研究[J]. 中华医学杂志, 2003, 83(5): 375-381.
[6]Cai LJ, Xu BQ, Lin QC. Comparison and analysis of drug resistance to morbific bacteriumaeromonashydrophilaisolated from aquatic animals[J]. Fisheriers Sci, 2011, 30(1): 42-45. DOI: 10.3969/j.issn.1003-1111.2011.01.009 (in Chinese)
蔡丽娟, 许宝青, 林启存. 水产致病性嗜水气单胞菌耐药性比较与分析[J]. 水产科学, 2011, 30(1): 42-45.
[7]Vivekanandhan G, Savithamani K, Mohamed HA. et a1. Antibiotic resistance ofAeromonashydrophilaisolated form marketed fish and prawn of South India[J]. Intl J Food Mierobiol, 2002, 76(1/2): 165-168. DOI: 10.1016/S0168-1605(02)00009-0
[8]Wang GH, Clark CG, Liu CY, et al. Detection and characterization of the hemolysin genes inAeromonashydrophilaandAeromonassobriaby multiplex PCR[J]. J Clin Microbiol, 2003, 41(3): 1048-1054. DOI: 10.1128/JCM.41.3.1048-1054.2003
[9]Dorsch M, Ashbolt NJ, Cox PT, et al. Rapid identification ofAeromonasspecies using 16S rDNA targeted oligonucleotide primers: a molecular approach based screening of environmental isolates[J]. Appl Bacteriol, 1994, 7: 722-726. DOI: 10.1111/j.1365-2672.1994.tb02825.x
[10]Alperi A, Figueras MJ, Inza I, et al. Analysis of 16S rRNA gene mutations in a subset ofAeromonasstrains and their impact in species delineation[J]. Intl Microbiol, 2008, 11(3): 185-194. DOI: 10.2436/20.1501.01.59
[11]Clinical and Laboratory Standard Institute. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria: M45A-A2[M]. Wayne: Clinical and Laboratory Standards Institute, 2010: 12-13.
[12]Wu LZ, Zhou HL, Pan MY, et al. Analysis of diarrhea caused byAeromonashydrophila[J]. Chin J Nosocomiol, 2000, 10(4): 256-258. DOI: 10.3321/j.issn:1005-4529.2000.04.039 (in Chinese)
吴龙章, 周辉林, 潘美玉, 等. 嗜水气单胞菌致腹泻分析[J].中华医院感染学杂志. 2000, 10(4): 256-258.
[13]Meng S, Ye CY. Novel triplex real-time TaqMan PCR assay for the detection ofAeromonashydrophila[J]. Chin J Zoonoses, 2012, 28(3): 217-222. DOI: 10.3969/j.issn.1002-2694.2012.03.006 (in Chinese)
孟双, 叶长芸. 嗜水气单胞菌实时荧光三重TaqMan PCR快速检测体系的建立[J]. 中国人兽共患病学报, 2012, 28(3): 217-222.
[14]Ko WC, Yu KW, Liu CY, et al. Increasing antibiotic resistance in clinical isolates ofAeromonasstrains in Taiwan[J]. Antimicrob Agents Chemother, 1996, 40(5): 1260-1262.
[15]Qu F, Bao CM, Cui EB, et al. Prevalence and antimicrobial resistance of differentAeromonasspecies[J]. Chin J Infect Chemother, 2004, 4(5); 302-305. DOI: 10.3321/j.issn:1009-7708.2004.05.014 (in Chinese)
曲芬, 鲍春梅, 催恩博, 等. 气单胞菌不同种的流行及耐药性[J]. 中国抗感染化疗杂志, 2004, 4(5); 302-305.
[16]Zhu XZ, He HJ, Deng SZ, et al. An analysis of the antibiotic resistance and plasmid profileAeromonashydrophilaisolated from Jiangxi Province[J]. Acta Agriculturae Universitatis Jiangxiensis, 2012, 34(6): 1262-1268. DOI: 10.3969/j.issn.1000-2286.2012.06.031 (in Chinese)
朱秀芝, 何后军, 邓舜洲, 等. 嗜水气单胞菌江西地区分离株耐药性及耐药质粒分析[J]. 江西农业大学学报, 2012, 34(6): 1262-1268.
[17]Fang YF, Pan XY, Lin LY, et al. Molecular mechanisms of quinolone resistance inAeromonashydrophilia[J]. Acta Microbiologica Sinica, 2014, 54(2): 174-182. DOI: 10.13343/j.cnki.wsxb.2014.02.006 (in Chinese)
方一风, 潘晓艺, 蔺凌云, 等. 嗜水气单胞菌对喹诺酮类药物耐药的分子机制[J]. 微生物学报, 2014, 54(2): 174-182.
[18]Hong J, Pan LD. Analysing plasmid fingerprinting and relationship between plasmids and resistance inAeromonashydrophilafrom fish[J]. J Fisheries China, 2010, 34(12): 1908-1916. DOI: 10.3724/SP.J.1231.2010.06908 (in Chinese)
洪经, 潘连德. 鱼源嗜水气单胞菌质粒的指纹图谱及其与耐药性的关系[J]. 水产学报, 2010, 34(12): 1908-1916.
[19] Saavedra MJ, Guedes NS, Alves A, et al. Resistance to β-lactam antibiotics inAeromonashydrophilaisolated from rainbow trout (Oncorhynchus mykiss)[J]. Intl Microbiol, 2004, (7): 207-211.
[20]Si LN, Li SW, Wang D, et al. Drug sensitivity test on fifteen strains of pathogenicAeromonashydrophilafrom Northeast China[J]. Acta Agriculturae Universitatis Jiangxiensis, 2011, 33(4): 786-790. DOI: 10.3969/j.issn.1000-2286.2011.04.029 (in Chinese)
司力娜, 李邵戊, 王荻, 等. 东北三省15株致病性嗜水气单胞菌分离株的药敏实验分析[J]. 江西农业大学学报, 2011, 33(4): 786-790.
[21]Li AH, Cai TZ, Wu YS, et al. Inverstigation on drugresistance of fish bacterial pathogen-Aeromonashydrophilain China[J]. Microbiol, ogy2001, 28(1): 58-63. DOI: 10.3969/j.issn.1000-2286.2011.04.029 (in Chinese)
李爱华, 蔡桃珍, 吴玉深, 等. 我国鱼类病原-嗜水气单胞菌的耐药性研究[J]. 微生物学通报, 2001, 28(1): 58-63.
[22]Wang JB, Xu LP, Wang XL, et al. Study on the antibiotic resistance inAeromonashydrophilaisolated from diseased fish in Beijing[J]. Beijing Agr, 2012(30): 77-80. (in Chinese)
王静波, 徐立浦, 王小亮,等. 北京地区养殖鱼类来源嗜水气单胞菌耐药性研究[J]. 北京农业, 2012 (30): 77-80.
[23]Wang YJ, Li RF, Li H, et al. Molecular epidemiology studies onAeromonashydrophilastrains isolated from fresh water fish in Liaoning Province[J]. J Agr Sci Technol, 2012, 14(4): 128-134. DOI: 10.3969/j.issn.1008-0864.2012.04.19 (in Chinese)
王友娟, 李荣峰, 李华, 等. 辽宁地区养殖淡水鱼感染嗜水气单胞菌的流行病学调查[J]. 中国农业科技导报, 2012, 14(4): 128-134.
DOI:10.3969/j.issn.1002-2694.2016.04.016
通讯作者:孙洋,Email: sunyang10@hotmail.com
中图分类号:R378
文献标识码:B
文章编号:1002-2694(2016)04-0400-06
收稿日期:2015-07-09修回日期:2015-12-10
Identification and antimicrobial resistance of pathogenic Aeromonas hydrophila
GAO Zhi-ling1,2, JI Xue2,3,CHEN Ping1,GUO Xue-jun2,3,LIU Jun2,3,ZHU Ling-wei2,3,ZHOU Wei2,3,FENG Shu-zhang2,3,SUN Yang2,3
(1.CollegeofFoodScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China;2.InstituteofMilitaryVeterinary,AMMS,Changchun130122,China;3.KeyLaboratoryofJilinProvinceforZoonosisPreventionandControl,Changchun130122,China)
Abstract:The occurrence of antimicrobial resistance and prevalent distribution of pathogenic Aeromonas hydrophila from aquatic products was investigated in this study. A total of 279 strains were isolated from 319 samples from commercially available freshwater fish and aquaculture farms in Changchun area, in which virulence genes were detected by PCR assays. Among them, 24 strains were positive (8.06%). Most of them carry both genes of hemolysin (hly) and genes of aerolysin (aerA). Biological characteristics and drug resistance spectrum of the pathogenic Aeromonas hydrophila isolates were characterized and identified. The 24 strains could cause β-hemolytic with positive protease test. To evaluate cytotoxicity by vero cell lines, the culture supernatant of the 24 strains resulted in severe cytopathogenic effect. All of pathogenic Aeromonas hydrophila isolates were resistant to at least 4 kinds of antibiotics. The results showed that all of the pathogenic strains had multiple resistance patterns. The investigation provided basic data for preventing and controlling the transmission of Aeromonas hydrophila with the multi-drug resistant.
Keywords:Aeromonas hydrophila; virulence; drug resisitance
863项目(No.2012AA022006);国家科技部传染病重大专项(No.2013ZX10004-217-002)和吉林省科技计划项目(No.20140101032JC,20150101110JC)联合资助
