肝细粒棘球蚴外囊壁钙化相关受体
2016-07-28张旭勇王思博印双红陈雪玲吴向未
张旭勇,杨 涛,王思博,夏 杰,郭 军,印双红,陈雪玲,吴向未
肝细粒棘球蚴外囊壁钙化相关受体
张旭勇1,杨涛1,王思博1,夏杰1,郭军1,印双红2,陈雪玲3,吴向未1
1.石河子大学医学院第一附属医院普外科,石河子832000;2.铜仁学院护理学院,铜仁554300;3.石河子大学医学院免疫学教研室,石河子832002
摘要:目的比较肝细粒棘球蚴病患者钙化外囊壁及非钙化外囊壁上的钙化相关受体BMPRⅡ(骨形态发生蛋白Ⅱ型受体)、IGF1R(胰岛素样生长因子1受体)和ERα(雌激素受体α)的表达差异。方法钙化外囊壁和非钙化外囊壁茜素红染色,Envision免疫组化法和qRT-PCR分别检测同一细粒棘球蚴病患者钙化外囊壁及非钙化外囊壁上钙化相关受体BMPRⅡ、IGF1R和ERα的表达水平和钙化相关受体的mRNA表达量。结果与细粒棘球蚴非钙化外囊壁相比较,同一患者钙化外囊壁茜素红染色钙化显著,且差异有统计学意义(χ2=20.369,P<0.01);钙化外囊壁相关受体的表达明显增加,且差异有统计学意义(P<0.05),mRNA表达量明显增高且差异具有统计学意义(P<0.05)。结论肝细粒棘球蚴病患者钙化外囊壁钙化相关受体表达量较高,钙化相关因子通过与受体BMPRⅡ、IGF1R和ERα等结合,引起细粒棘球蚴外囊壁钙化,外囊壁的钙化可以有效地抑制细粒棘球蚴的生长,在细粒棘球蚴病患者临床治疗过程中发挥着重要作用。
关键词:肝细粒棘球蚴病;钙化外囊;骨形态发生蛋白Ⅱ型受体;胰岛素样生长因子1受体;雌激素受体α
Supported by the National Natural Science Foundation of China (Nos. 81260412 and 81360453)
细粒棘球蚴病(包虫病)是一种危害严重的人兽共患寄生虫病[1-2],多发于肝脏,呈世界性分布,新疆是高发区,肝囊型包虫病(Hepatic cystic echinococcosis)是包虫病的常见类型。在肝细粒棘球蚴病内层纤维囊壁膨胀性形成过程中,囊周Glisson系统和肝静脉系统受挤压并不断纤维化,形成另一层纤维囊壁(外囊壁)[3],肝细粒棘球蚴外囊壁中的主要细胞组成为成纤维样细胞,由胚胎时期的间充质干细胞分化而来,和成骨细胞相似,存在着类似的骨诱导表现,骨诱导的定义最初由Urist[4]提出:在一种可弥散的特定的因子作用下,间充质细胞聚集并向软骨以及骨细胞转化的过程即称为骨诱导,具备诱导活性的因子有许多,比如BMPs(骨形态发生蛋白)、IGF1(胰岛素样生长因子1)和雌激素,能够诱导间充质细胞向软骨细胞和骨细胞方向分化。鉴定肝细粒棘球蚴外囊壁细胞钙化相关受体BMPRⅡ、IGF1R和ERα,进一步研究外囊壁细胞的钙化体外模型,进行抗虫药物的筛选,诱导肝包虫外囊壁钙化,可能成为现有治疗学上的重要补充,为包虫病的治疗提供新的策略。故钙化相关受体的表达鉴定分析具有一定的价值。本课题研究小组通过茜素红染色、免疫组织化学方法和qRT-PCR对BMPRⅡIGF1R和ERα的表达情况进行了检测。
1材料与方法
1.1材料
1.1.1研究对象及临床标本的选择以石河子大学医学院第一附属医院普外科临床手术取出的肝细粒棘球蚴病患者的钙化外囊壁为研究对象,同一患者的非钙化外囊壁为对照组。肝细粒棘球蚴病患者术前经B超和CT检查,外囊壁存在部分钙化,密度增强。本研究通过院伦理委员会批准(批准号LL20111223001),取材前经得患者同意并均已签署知情同意书。
1.1.2临床资料收集肝胆外科住院手术病人2012年2月~2015年5月肝细粒棘球蚴病手术患者45例,男27例,女18例,年龄在32~63岁,平均46.8±11.4岁,病程3~12年。
1.1.3主要试剂茜素红染料(Cyagen Biosciences美国),兔抗人BMPRⅡ(abcam英国)、兔抗人IGF1R(abcam英国)、兔抗人ERα抗体(abcam英国),二抗(Dako丹麦)及DAB试剂盒(Dako丹麦)。RNA提取试剂盒(QIAGEN德国)、逆转录试剂盒(Thermo美国)、OneStep RT-PCR Kit(QIAGEN德国)。BMPRⅡ、IGF1R、ERα及内参引物,根据Gen Bank中人BMPRⅡ、IGF1R、ERα及内参β-Actin的基因序列,应用Primer premier 5.0软件进行比较分析,选择合适的区域合成引物,有上海生工公司合成,见表1。
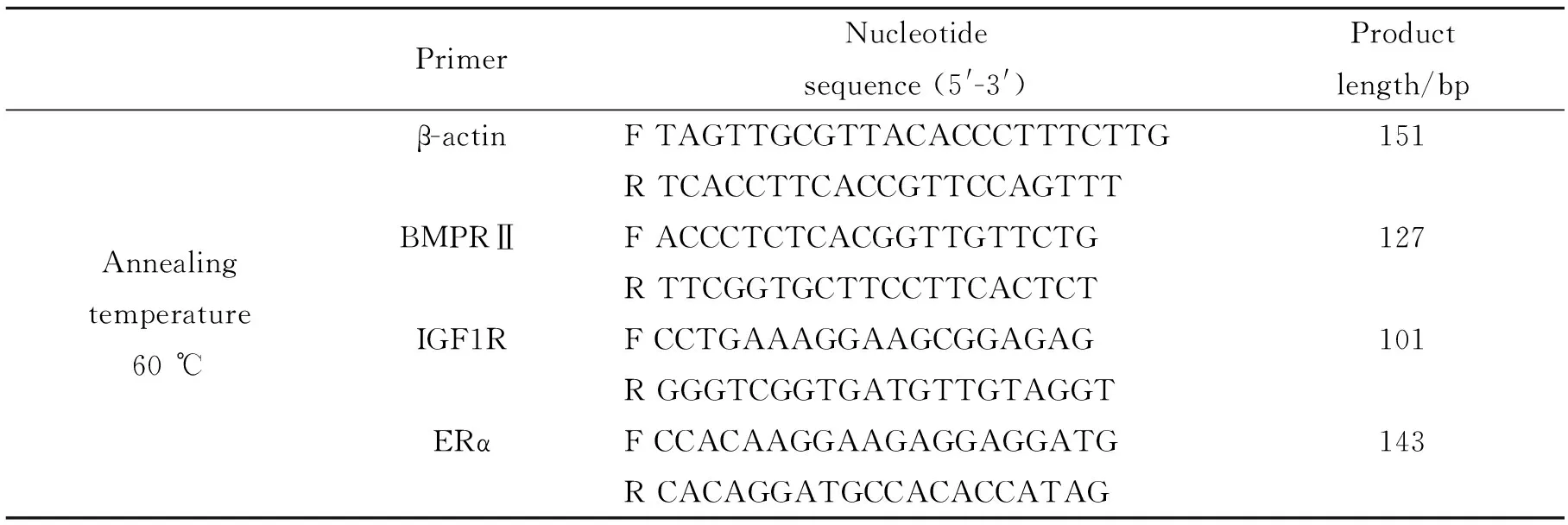
表1 RT-PCR引物序列表
1.2方法
1.2.1组织病理学检查取材于液氮罐中和术中标本,取材后置于10%中性福尔马林溶液中,48 h后常规脱水、包埋、切片4 μm,茜素红染色和免疫组化染色,诊断。qRT-PCR取材后用试剂盒提取RNA,逆转录,定量 PCR检测分析。
1.2.2茜素红染色4 μm切片经过二甲苯及梯度酒精脱蜡脱水,茜素红染色10 min,PBS冲洗掉染料,脱水封片,观察结果,统计分析数据。Envision二步法检测对照组和实验组中BMPRⅡ、IGF1R和ERα的表达。4 μm切片经过二甲苯及梯度酒精脱蜡脱水,pH6.0枸橼酸盐缓冲液中高温修复8 min,自然冷却到室温(25 ℃)后3%过氧化氢室温孵育10 min阻断内源性过氧化物酶活性(无血清阻断),滴加一抗(BMPRⅡ、IGF1R和ERα浓度均是1∶100)后4 ℃冰箱过夜,PBS 3×5 min浸洗后滴加二抗,37 ℃恒温箱放置30 min后PBS 3×5 min浸洗,DAB染色2~5 min(根据显微镜下观察显色结果适时终止染色),苏木素复染、酸化、脱水、封片。显微镜下观察结果,统计分析数据。实时荧光定量PCR检测BMPRⅡ、IGF1R和ERα mRNA的表达量。按照Trizol说明提取外囊壁总RNA,取5 μL提取的RNA,采用逆转录试剂盒逆转录生成20 μL的cDNA,在进行实时荧光定量PCR。反应体系:cDNA 3 μL,SYBR GreenⅠ12.5 μL,上游引物0.5 μL,下游引物0.5 μL,无酶水8.5 μL。反应条件:95 ℃预变性5 min,95 ℃变性10 s, BMPRⅡ、IGF1R、ERα和β-Actin 60 ℃退火30 s,72 ℃延伸30 s,共40个循环。
1.2.3阳性结果判定及标准茜素红染色:染色强度分为:未见钙盐沉积(-)0分、点状钙盐沉积(+)1分、弥漫钙盐沉积(2+)2分;染色阳性范围分为:≤50%为0分、50%~75%为1分、≥75%为2分;两项得分相乘≥2分为阳性。免疫组织化学染色:着色强度分为:无色(-)0分、浅黄色(+)1分、黄色及更深颜色(2+)2分;阳性细胞数分级为:≤50%为0分、50%~75%为1分、≥75%为2分;两项得分相乘≥2分为阳性。
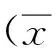
2结果
2.1茜素红染色结果茜素红与钙离子以螯合的方式形成复合物,用来识别组织细胞的钙盐成分,通过茜素红染色,产生红色沉积(即钙结节),细粒棘球蚴病患者钙化外囊壁和非钙化外囊壁中茜素红染色钙盐沉积情况(表2)。两者的差异具有统计学意义(χ2=20.369,P<0.01),提示钙盐在肝细粒棘球蚴病钙化外囊壁中的沉积水平显著升高:其中钙化外囊壁组阳性率为77.78%(35/45),非钙化外囊壁组阳性率为31.11%(14/45),两组经四格表检验,χ2=20.369,P<0.01,差异有统计学意义。
表2 钙化外囊壁和非钙化外囊壁茜素红染色情况
2.2肝细粒棘球蚴病患者钙化外囊壁和非钙化外囊壁中BMPRⅡ、IGF1R和ERα的表达情况(见表3,图1-3)肝细粒棘球蚴病患者钙化外囊壁细胞中这些钙化相关受体的表达水平显著升高,比较实验组与对照组两者差异具有统计学意义(P<0.05)。其中受体BMPRⅡ在实验组阳性率为67.44%(29/43 注:脱片2张),对照组阳性率为27.50%(11/40),两组经卡方检验,χ2=14.960,P<0.05,差异有统计学意义。

表3 钙化外囊壁和非钙化外囊壁中BMPRⅡ、IGF1R和ERα的表达情况
2.3实时荧光定量PCR检测肝细粒棘球蚴患者钙化外囊壁细胞和非钙化外囊壁细胞BMPRⅡ、IGF1R和ERαmRNA的表达量PCR检测结果如图4显示:这些钙化相关受体的mRNA的表达量升高,实验组与对照组两者差异具有统计学意义(P<0.05)。
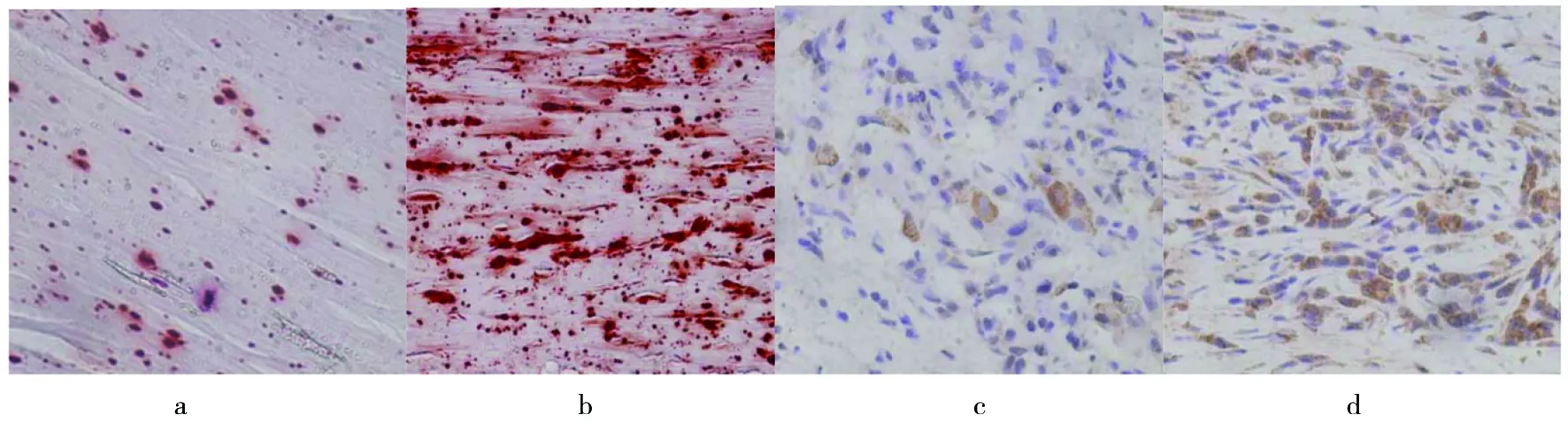
a.非钙化外囊壁茜素红染色;b.钙化外囊壁茜素红染色;c.非钙化外囊壁BMPRⅡ表达较弱;d. 钙化外囊壁BMPRⅡ表达较强。a. Alizarin Red staining in non-calcified hydatid pericyst wall; b. Alizarin Red staining in calcified hydatid pericyst wall; c. BMPRⅡin non-calcified hydatid pericyst wall; d. BMPRⅡexpressed higher in calcified hydatid pericyst wall.图1 非钙化外囊壁和钙化外囊壁中茜素红染色、BMPRⅡ的表达Fig.1 Alizarin Red staining and the expression of BMPRⅡin non-calcified hydatid pericyst wall and calcified hydatid pericyst wall(200×)

a.非钙化外囊壁茜素红染色;b.钙化外囊壁茜素红染色;c.非钙化外囊壁IGF1R表达较弱;d. 钙化外囊壁IGF1R表达较强。a.Alizarin Red staining in non-calcified hydatid pericyst wall; b. Alizarin Red staining in calcified hydatid pericyst wall; c. IGF1R in non-calcified hydatid pericyst wall; d. IGF1R expressed higher in calcified hydatid pericyst wall.图2 非钙化外囊壁和钙化外囊壁中茜素红染色、IGF1R的表达Fig.2 Alizarin Red staining and the expression of IGF1R in non-calcified hydatid pericyst wall and calcified hydatid pericyst wall(200×)
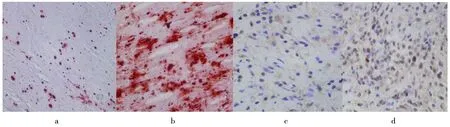
a.非钙化外囊壁茜素红染色;b.钙化外囊壁茜素红染色;c.非钙化外囊壁ERα表达较弱;d. 钙化外囊壁ERα表达较强。a. Alizarin Red staining in non-calcified hydatid pericyst wall; b. Alizarin Red staining in calcified hydatid pericyst wall; c.ERα in non-calcified hydatid pericyst wall. d. ERα expressed higher in calcified hydatid pericyst wall.图3 非钙化外囊壁和钙化外囊壁中茜素红染色、ERα的表达Fig.3 Alizarin Red staining and the expression of ERα in non-calcified hydatid pericyst wall and calcified hydatid pericyst wall(200×)
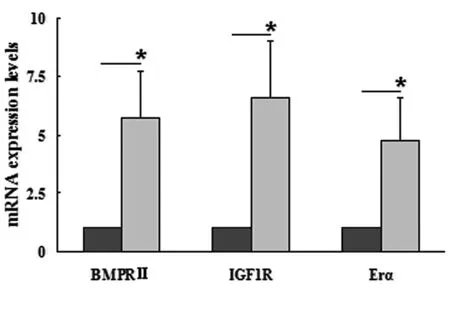
*P<0.05图4 非钙化外囊壁和钙化外囊壁钙化相关受体mRNA的表达水平Fig.4 Percent of calcium related receptor mRNA of non-calcified hydatid pericyst wall and calcified hydatid pericyst wall vs. control group
3讨论
作为肝细粒棘球蚴宿主的免疫防御反应的结果,外囊壁的形成,借以局限细粒棘球蚴囊肿的病程进展[5]。虽然外囊壁钙化不能完全等同于虫体死亡,但其往往提示着细粒棘球蚴生物学上失去活性,临床上处于静止期,理由是外囊壁钙化可以有效地控制寄生虫的营养摄取[6]。国内彭新宇、吴向未等[7-8]与其他实验室研究人员发现:在肝细粒棘球蚴病周围纤维囊壁钙化处富含骨蛋白如,包括骨桥蛋白(OPN)、骨钙素、骨形态发生蛋白2(BMP-2)、 基质小泡及成骨/软骨样细胞等[9],成纤维细胞像成骨细胞一样产生基质小泡并引起小泡内的钙盐沉积,提示骨形成机制可能在肝包虫周围纤维囊壁钙化的形成中起重要作用[10-11]。本实验利用BMPRⅡ、IGF1R和ERα在调控组织细胞钙化上的重要作用,研究钙化外囊壁与非钙化外囊壁上的BMPRⅡ、IGF1R和ERα受体的差异情况,加强细胞因子与这些受体的结合,有望诱发、加强肝细粒棘球蚴外囊壁细胞的钙化,成为肝细粒棘球蚴病治疗学的新靶点。
外囊壁钙化相关受体BMPRⅡ、IGF1R和ERα等在肝细粒棘球蚴外囊钙化过程中有着重要的作用,BMPs是一组具有很强骨诱导活性的生长因子,可能是诱导骨髓基质干细胞向成骨细胞系转化的基本信号因子,其中BMP2是目前已知的具有最强异位成骨能力的细胞因子,能够使未分化的间充质干细胞定向分化为成骨细胞,并诱导形成骨组织[12]。BMPs与细胞膜上的BMPRⅡ结合,通过 Smads 蛋白传递分化信号,促进间充质干细胞向成骨细胞分化[13]。近期相关研究显示,IGF1对BMP2之间可能存在协同成骨作用[14-15],IGF1可增强BMP2介导的间充质干细胞成骨分化。Schmidmaier等[16]将胰岛素样生长因子Ⅰ和 BMP-2 联合用于大鼠的股骨骨折愈合实验,发现两者联合应用对于骨折愈合,在生物力学和组织学上效果都更为明显,同时并发症也降低。BMPRⅡ、IGF1R受体和mRNA表达量在钙化外囊壁中的表达明显高于非钙化外囊壁中的表达,说明在外囊壁成骨诱导钙化上二者成骨作用显著,协同诱导、加强了外囊壁钙化。雌激素受体α在成骨因子基因表达水平具有重要的作用,促进骨髓间充质干细胞的成骨分化,引起钙盐沉积[17],形成钙化结节。茜素红与钙离子以螯合的方式形成复合物,用来识别组织细胞的钙盐成分,通过茜素红染色,产生红色沉积(即钙结节),所以实验首先通过茜素红染色求证所选钙化外囊壁和非钙化外囊壁之间的钙化差异情况,结果显示与非钙化外囊壁相比较,钙化外囊壁钙盐红色弥漫沉积更多,钙化作用更强。接着实验运用免疫组织化学和qRT-PCR方法检测BMPRⅡ、IGF1R和ERα,统计结果显示与非钙化外囊壁相比,钙化的外囊壁组织棕黄色着色更强,说明钙化外囊壁表达的BMPRⅡ、IGF1R和ERα等受体较高,钙化外囊壁组织中表达BMPRⅡ、IGF1R和ERα的mRNA的量更高,这也说明在钙化的肝细粒棘球蚴外囊壁组织中这些受体的表达水平更高。
外囊壁成纤维细胞能向成骨细胞方向分化,同时钙化相关调节因子与受体BMPRⅡ、IGF1R和ERα结合参与诱导成骨潜能,调节外囊壁细胞的成骨作用、调节细胞的矿化能力,相互影响外囊壁的钙化。外囊壁钙化在一定程度上限制了细粒棘球蚴的营养供应,抑制了细粒棘球蚴的生长。通过增加这些钙化因子的量,促进囊周纤维囊壁的钙化,可能达到抑制寄生虫的目的,转变传统杀死细粒棘球蚴本身的药物治疗靶点,为细粒棘球蚴病患者提供一个新的治疗手段。
但机体钙化调控机制是极为复杂的,包括细胞、体液、激素等不同水平的调控机制,这些钙化因子调控外囊壁细胞成骨作用可能只是冰山一角,整体的非特异性的阻断和增强细胞因子可能导致严重的不良后果。目前尚有许多问题需进一步研究,生物学中新技术及新思路的发展将有助于从复杂的信号转导通路中确定出在外囊壁钙化中敏感的关键的步骤,以此而促进疗效高、特异性强、副作用少的药物的研发及新治疗措施的发展。
参考文献:
[1] Carmena D, Sanchez-Serrano LP, Barbero-martinez I.Echinococcusgranulosusinfection in Spain[J]. Zoonoses Public Health, 2008, 55(3): 156-165. DOI: 10.1111/j.1863-2378.2007.01100.x
[2] Chen XL, Yin SH, Wu XW, et al. Protoscoleces and hydatid fluid promote expression of TGF-β from mouse spleen cellsinvitro[J]. J Pathog Biol, 2013, 8(6): 523-526.DOI:10.13350/j.cjpb.2013.06.013 (in Chinese)
陈小林,印双红,吴向未,等.原头蚴及囊液促体外培养小鼠脾细胞TGF-β表达的研究[J].中国病原生物学杂志,2013,8(6):523-526.
[3] Coque TM, Willems R, Canton R, et al. High occurrence of esp among ampicillin-resistant and vancomycin-susceptibleEnterococcusfaeciumclonesfrom hospitalized patients[J]. J Antimicrob Chemother, 2002, 50(6): 1035-1038. DOI: 10.1093/jac/dkf229
[4] Urist MR, Silverman BF, During K, et al. The bone induction principle[J]. Clin Orthopaedics Related Res, 1967, 53: 243-283.
[5] Vuitton DA. The ambiguous role of immunity in echinococcosis: protection of the host or of the parasite?[J]. Acta Trop, 2003, 85: 119-132. DOI: 10.1016/S0001-706X(02)00230-9
[6] Czermak BV, Akhan O, Hiemetzberger R, et al. Echinococcosis of the liver[J]. Abdom Imaging, 2008, 33: 133-143. DOI: 10.1007/s00261-007-9331-0
[7] Wu X, Chen X, Zhang S, et al. Pericyst may be a new pharmacological and therapeutic target for hydatid disease[J]. Chin Med J, 2011, 124: 2857-2862.
[8] Janssens K, Ten Dijke P, Janssens S, et al. Transforming growth factor-beta 1 to the bone[J]. Endocrine Rev, 2005, 26: 743-774. DOI: 10.1210/er.2004-0001
[9] Cao DP, Fan HN, Wu DF, et al. Preliminary proteomics analysis on protoscoleces and cyst wall of human hydatid cyst[J]. Chin J Zoonoses, 2014, 30(6): 575-582.DOI:10.3969/j.issn.1002-2694.2014.06.006 (in Chinese)
曹得萍,樊海宁,毋德芳,等.细粒棘球绦虫在人体内棘球蚴原头节、囊壁蛋白质表达谱分析[J]. 中国人兽共患病学报,2014,30(6):575-582.
[10] Peng X, Li J, Wu X, et al. Detection of osteopontin in the pericyst of human hepaticEchinococcusgranulosus[J]. Acta Trop, 2006, 100(3): 163-171. DOI:10.1016/j.actatropica.2006.08.013
[11] Zhang SJ, LYU Y, Peng XY, et al. Observation on the ultrastructure of liver cells around hydatid cyst[J]. Chin J Parasitol Parasit Dis, 2007, 25(5): 434-435.DOI:10.1016/j.actatropica.2006.08.13 (in Chinese)
张示杰,吕游,彭心宇,等. 肝囊型棘球蚴囊周肝细胞超微结构观察[J]. 中国寄生虫学与寄生虫病杂志,2007,25(5):434-435.
[12] Seeherman HJ, Azari K, Bidic S, et al. RhBMP-2 delivered in a calcium phosphate cement accelerates bridging of critical-sized defects in rabbit radii[J]. J Bone Joint Surg Am, 2006, 88(7): 1553-1565. DOI: 10.2106/JBJS.E.01006
[13] Takashi S, Masafumi O, Yoshiaki H, et al. Acceleration effect of human recombinant bone morphogenetic protein-2 on differentiation of human pulp cells into odontoblasts[J]. Endodontics,2004,30(4): 205-208. DOI: 10.1097/00004770-2004 04000-00005
[14] Mukherjee A, Wilson EM, Rotwein P. Selective signaling by Akt2 promotes bone morphogenetic protein 2-mediated osteoblast differentiation[J]. Mol Cell Biol, 2010, 30(4): 1018-1027. DOI: 10.1128/MCB.01401-09
[15] Miyazono K, Kamiya Y, Morikawa M. Bone morphogenetic protein receptors and signal transduction[J]. J Biochem, 2010, 147(1): 35-51. DOI: 10.1093/jb/mvp148
[16] Schmidmaier G, Lucke M, Schwabe P, et al. Collective review: bioactive implants coated with poly(D,L-lactide) and growth factors IGF-I, TGF-beta1, or BMP-2 for stimulation of fracture healing[J]. J Long Term Eff Med Implants, 2006, 16(1): 61-69. DOI: 10.1615/JLongTermEffMedImplants.v16.i1.70
[17] Zaman G, Jessop HL, Muzylak M, et al. Osteocytes use estrogen receptor alpha to respond to strain but their ERalpha content is regulated by estrogen[J]. J Bone Mineral Res, 2006, 21(8): 1297-1306. DOI: 10.1359/jbmr.060504
DOI:10.3969/j.issn.1002-2694.2016.04.004
通讯作者:吴向未,Email:wxwshz@126.com
中图分类号:R383
文献标识码:A
文章编号:1002-2694(2016)04-0332-06
Corresponding author:Wu Xiang-wei, Email: wxwshz@126.com
收稿日期:2015-08-24修回日期:2015-12-16
Calcium related receptors of the pericyst of hepatic cystic echinococcosis
ZHANG Xu-yong1, YANG Tao1, WANG Si-bo1, XIA Jie1, GUO Jun1, YIN Shuang-hong2,CHEN Xue-ling3, WU Xiang-wei1
(1.DepartmentofGeneralSurgery,theFirstAffiliatedHospital,MedicalCollegeofShiheziUniversity,Shihezi832008,China;2.CollegeofNursing,TongrenUniversity,Tongren554300,China;3.DepartmentofImmunology,CollegeofMedicine,ShiheziUniversity,Shihezi832002,China)
Abstract:To compare the differential expression of BMPRⅡIGF1R and ERα between calcified hydatid pericyst wall and non-calcified hydatid pericyst wall, we detected the expression of BMPRⅡIGF1R and ERα in calcified pericyst wall and non-calcified pericyst wall of hepatic cystic echinococcosis respectively with Alizarin Red stainingenvision immuno-histochemical method and qRT-PCR. In comparison with non-calcified hydatid pericyst wall, the red calcified nodes of Alizarin Red staining on the calcified hydatid pericyst wall were obviously increased, and differences were statistically significant (χ2=20.369, P<0.01). The expression levels of BMPRⅡIGF1R and ERα were much higher in calcified hydatid pericyst wall than those in non-calcified hydatid pericyst wall with statistical significance (P<0.05). Compared with control groups, the mRNA relative expression levels of BMPRⅡIGF1R and ERα were statistically higher in calcified pericyst wall group (P<0.05). The expression levels of these calcium related receptor were higher in calcified hydatid pericyst wall than those in non-calcified hydatid pericyst wall. Cytokines binding with these calcium related receptors may contribute to the response; calcified hydatid pericyst wall may inhibit Echinococcus granulosus and plays an important role on treatment of hepatic cystic echinococcosis.
Keywords:hepatic cystic echinococcosis; calcified hydatid pericyst wall;BMPRⅡ; IGF1R; ERα
国家自然科学基金(No.81260412,81360453)资助
