中国莱姆病螺旋体菌株bmpA基因中人B细胞表位多态性分析
2016-07-28刘慧鑫侯学霞万康林
刘慧鑫,郝 琴,刘 炜,侯学霞,张 琳,万康林
中国莱姆病螺旋体菌株bmpA基因中人B细胞表位多态性分析
刘慧鑫1,郝琴2,刘炜2,侯学霞2,张琳2,万康林2
1.温州医科大学检验医学院生命科学学院,温州325035;2.中国疾病预防控制中心传染病预防控制所,传染病预防控制国家重点实验室,北京102206
摘要:目的研究我国伯氏疏螺旋体(Borrelia burgdorferi sensu lato),即莱姆病螺旋体菌株中bmpA基因及其人B细胞表位区的序列多态性。方法选取61株莱姆病螺旋体分离株,PCR扩增其bmpA基因并测序后,结合4种基因型参考菌株序列,与从免疫表位数据库(Immune Epitope Database,IEDB)中查询到的B细胞表位序列进行比对分析。结果中国B.garinii基因型菌株的cluster2、cluster3以及B.afzelii和B.valaisiana基因型所有菌株与参考序列比对后发现分别有3、9、5和18个异义突变。B细胞表位改变主要发生在B.afzelii基因型全部分离株和B.garinii基因型的cluster3及5株非成簇菌株。B.afzelii基因型菌株在B细胞表位区的异义突变A125S影响了2个B细胞表位;B.garinii基因型的cluster3和5株非成簇菌株B细胞表位区的3个异义突变导致5个B细胞表位均发生改变。结论中国莱姆病螺旋体bmpA基因在4种基因型间和B.garinii基因型内存在较大多态性。
关键词:莱姆病螺旋体;bmpA;B细胞表位;多态性
Supported by the National Science and Technology Major Project for Infectious Diseases (No.2013ZX10004-001)
莱姆病(Lyme disease,LD)是美国Steere AC博士在1977年首次报告,由伯氏疏螺旋体(Borreliaburgdorferisensulato),即莱姆病螺旋体引起的一种蜱传感染性人兽共患病[1-2]。现已有世界五大洲70多个国家报告发现有莱姆病的存在,我国20个省、市、自治区的病人、蜱、野鼠和野兔中已分离到莱姆病螺旋体[3]。莱姆病的临床表现多种多样,典型症状为游走性红斑(erythema migrans,EM),感染后期可引起关节、心脏和神经系统症状,严重者可致残甚至死亡[4-6]。随着免疫学和分子生物学的发展,莱姆病的早期诊断已成为研究热点。一些研究证实OspC、VlsE、flagellin(FlaB)、BmpA、P66、DbpA和DbpB可用于莱姆病的诊断[7-9]。
Bmp家族蛋白由染色体编码,包括BmpA、BmpB、BmpC和BmpD[10]。4种蛋白氨基酸序列相似度在36%~64%[11]。BmpB、BmpC和BmpD的研究较少,而大量研究证实BmpA是莱姆病螺旋体的早期表达蛋白,分子量约39 KiloDalton,即P39。P39是一种层粘连蛋白结合蛋白,与莱姆病中关节炎的致病有关[10]。
本研究中,我们选取了61株国内莱姆病螺旋体的分离株,扩增其BmpA基因,测序后分析了该基因的人B细胞表位序列的多态性,为莱姆病的早期诊断和亚单位疫苗研究提供基础。
1材料与方法
1.1菌株来源从菌株库中选取61株莱姆病螺旋体分离株作为本次研究的样本,根据我国各基因型菌株比例[12],选取Borreliaburgdorferisensustricto(B.b.s.s) 1株,Borreliagarinii(B.garinii) 41株,Borreliaafzelii(B.afzelii) 15株,Borreliavalaisiana(B.valaisiana) 4株。各菌株省份来源见表1。
表161株分离株的地理分布和基因型信息
Tab. 1Geographic distribution and genotype data of 61 B.burgdorferi sensu lato strains

地区Area菌株数No.ofstrains基因型GenotypeJilin12B.gariniiGuangdong1B.gariniiInnerMongolia8B.gariniiShandong1B.afzeliiLiaoning1B.afzeliiGuizhou73B.afzelii,4B.valaisianaSichuan6B.afzeliiHeilongjiang86B.garinii,2B.afzeliiXinjiang13B.gariniiBeijing2B.afzeliiHebei1B.gariniiHunan1B.bssTotal61-
同时,我们从美国国立生物技术信息中心(National Center of Biotechnology Information, NCBI)网站中下载了1株B.b.s.s(B31, AE000783),3株B.garinii(PBi, CP000013.1; BgVir, NC_017717.1; NMJW1, CP003866.1),3株B.afzelii(PKo,CP002933.1; K78, CP009058.1; Tom3107, CP009212.1)和2株B.valaisiana(VS116, ABCY02000001.1; Tom4006, CP009117.1)菌株的bmpA等位基因序列。
1.2bmpA基因扩增和序列测定根据B.b.s.s菌株B31中的bmpA基因,使用Primer5设计PCR引物,正、反向引物分别为5′-CCATGGTATCTTGTAGTGGTAA-3′和5′-TTAAATAAATTCTTTAAGAAAC-3′。PCR扩增的总反应体系为25 μL,其中2xPCR缓冲液12.5 μL,正、反向引物各100 nmol/L,4种dNTP各200 μmol/L和0.5 U的DNA聚合酶。PCR反应条件为94 ℃预变性10 min,然后94 ℃变性45 s,45 ℃复性45 s,72 ℃延伸1 min重复35个循环,最后72 ℃延伸10 min终止反应。PCR产物送测序公司双向测序并拼接。
1.3bmpA基因中B细胞表位区的确定检索免疫表位数据库(Immune Epitope Database, IEDB)[13],获得Borreliaburgdorferi中存在的人B细胞表位序列,与B31菌株的bmpA基因序列进行比对,完全匹配的表位序列用于多态性分析。
1.4数据分析所有菌株bmpA基因的测序拼接结果用MEGA5.1软件[14]进行alignment操作,根据测序结果最长可信序列比对分析bmpA基因的109~966 bp(37~322氨基酸)。所用参考菌株为B.b.s.s-B31、B.garinii-NMJW1、B.afzelii-Tom3107和B.valaisiana-Tom4006。
2结果
2.1bmpA基因中人B细胞表位的信息经检索IEDB及与B31菌株bmpA基因序列比对后,在B31菌株的bmpA基因中发现了5个B细胞表位,以及各基因型菌株中B细胞表位序列,见表2。
2.2菌株聚类分析结果基于BmpA蛋白的氨基酸序列,用MEGA5.1软件采用neighbor-jioning方法对所有菌株进行聚类分析。结果显示B.garinii基因型菌株主要聚类为cluster1、cluster2和cluster3,B.b.s.s、B.afzelii、B.valaisiana基因型菌株的聚类结果与郝琴MLSA[12]结果一致。JC1-7菌株在郝琴MLSA研究和其他蛋白抗原人B细胞表位多态性研究(数据未显示)中聚类结果均为B.garinii,而在BmpA氨基酸序列聚类结果中为B.afzelii,见图1。
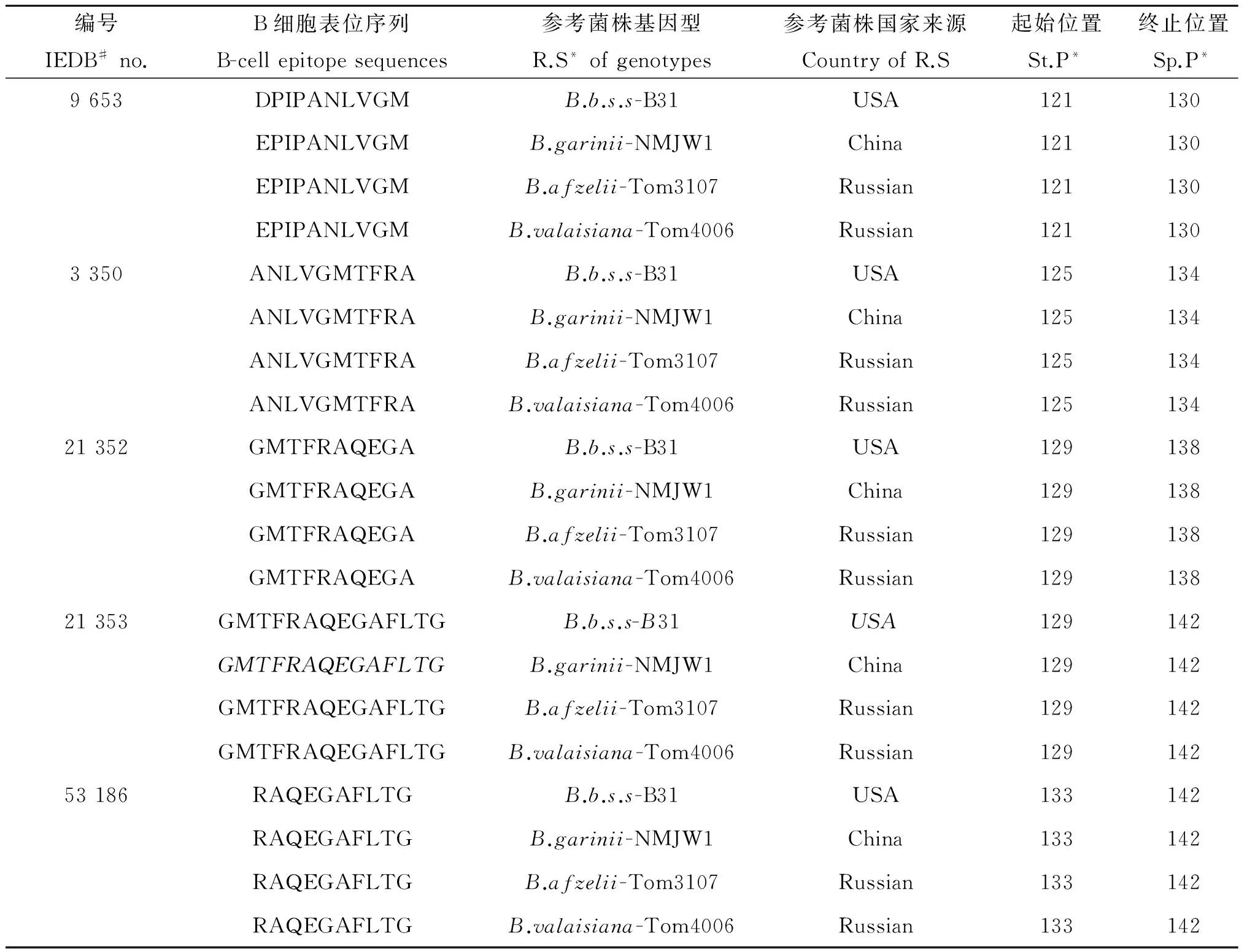
表2 各基因型菌株bmpA基因序列中B细胞表位的分布信息
#IEDB为免疫表位数据库(Immune Epitope Database);起始位置和终止位置均为氨基酸位置。
Note:#IEDB, Immune Epitope Database; Start position and stop position are all means of the position of amino acid.
2.3bmpA基因中的异义突变经序列比对分析发现,莱姆病螺旋体4个基因型参考菌株BmpA蛋白氨基酸序列的相似度为83.9%,见图2;我国B.b.s.s菌株CS4和B.gariniicluster1菌株的BmpA氨基酸序列与相应基因型参考序列完全相同。国内B.garinii的cluster2、cluster3以及B.afzelii和B.valaisiana所有菌株与参考序列比对后发现分别有3、9、5和18个异义突变,详细突变位置和突变类型见表3。
2.4bmpA基因中B细胞表位区的变异61株中国莱姆病螺旋体分离株中,B.b.s.s、B.valaisiana基因型分离株及B.garinii基因型的cluster1和cluster2分离株的B细胞表位区与相应基因型参考序列完全相同,在B细胞表位区未发生异义突变。B细胞表位改变主要发生在B.afzelii基因型全部分离株和B.garinii基因型的cluster3及5株非成簇菌株。B.afzelii基因型菌株在B细胞表位区的异义突变A125S影响了2个B细胞表位;B.garinii基因型的cluster3和5株非成簇菌株B细胞表位区的3个异义突变导致5个B细胞表位均发生改变。见表4。
3讨论
本研究中,根据MLSA分型中国莱姆病螺旋体菌株各基因型的比例,我们选取了61株中国莱姆病螺旋体的分离株,这些分离株的来源地区几乎完全覆盖了我国莱姆病的发病疫区,采用PCR和测序的方法,对其bmpA基因和B细胞表位进行多态性分析。菌株的代表性较好,分析结果可信度较高。
莱姆病螺旋体的BmpA蛋白表达于莱姆病早期免疫反应中,其结构暴露于莱姆病螺旋体的外膜,是一种表面暴露的外膜脂蛋白[15-16]。BmpA蛋白作为莱姆病螺旋体的外膜组成成分,通过与宿主的层粘连蛋白结合在侵袭宿主时发挥作用[10]。此外,该蛋白还是莱姆病关节炎的主要致病因子,U.Pal和P.Wang的研究[17]证实莱姆病螺旋体bmpA突变株不能侵犯鼠关节组织,进一步证实了BmpA蛋白的作用。BmpA作为一种早期表达蛋白,已用于莱姆病的血清学诊断。

图1 61株莱姆病螺旋体分离株基于BmpA氨基酸序列聚类分析图Fig.1 Phylogenetic tree for the sequence of BmpA amino acid of 61 B.bsl strains
表3莱姆病螺旋体菌株bmpA基因中的异义突变
Tab.3Nonsynonymous mutations founded in bmpA gene of B.bsl strains
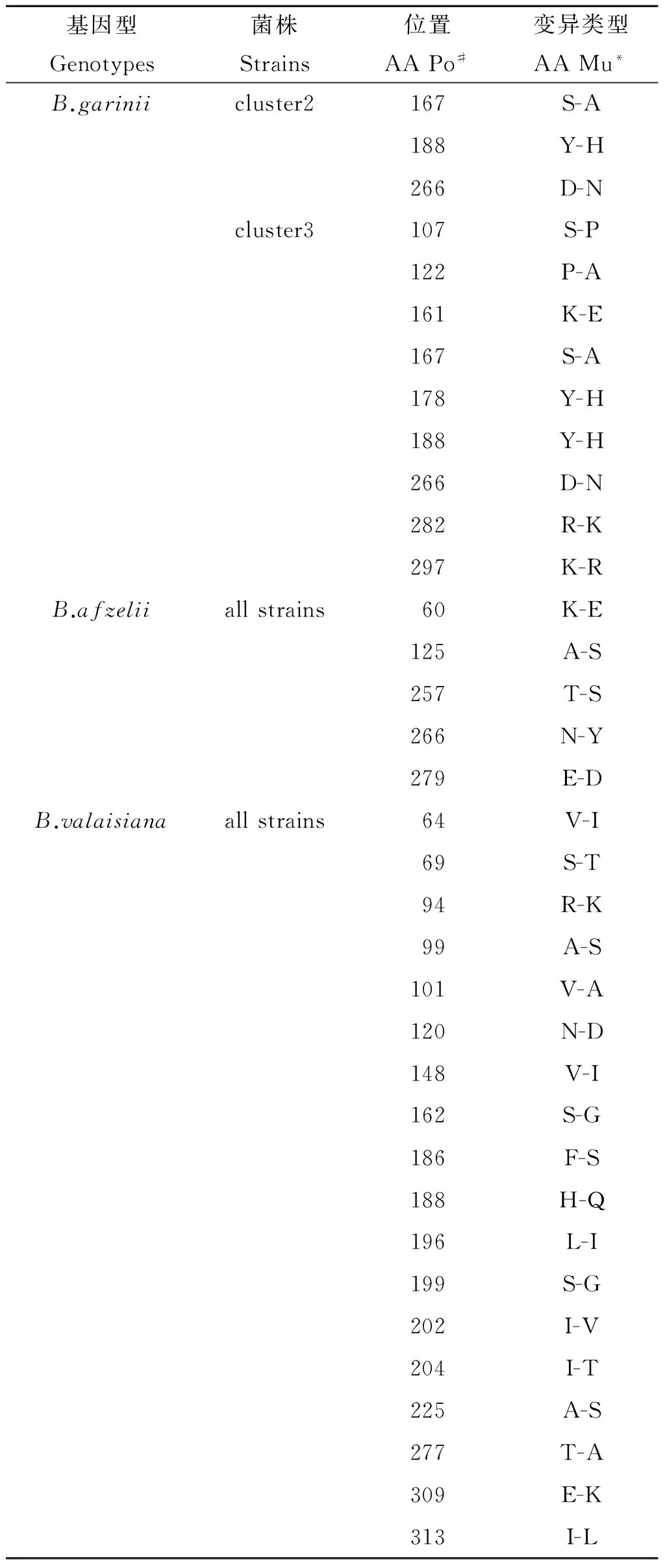
基因型Genotypes菌株Strains位置AAPo#变异类型AAMu*B.gariniicluster2167S-A188Y-p66D-Ncluster3107S-P122P-A161K-E167S-A178Y-H188Y-p66D-N282R-K297K-RB.afzeliiallstrains60K-E125A-S257T-S266N-Y279E-DB.valaisianaallstrains64V-I69S-T94R-K99A-S101V-A120N-D148V-I162S-G186F-S188H-Q196L-I199S-G202I-V204I-T225A-S277T-A309E-K313I-L
#AA Po代表氨基酸位置;*AA Mu代表氨基端突变类型。
Note: AA Po, amino acid position; AA Mu, amino acid mutation.

注:该基因B细胞表位区在图中框出;相同序列和变异序列分别用省略号和阴影标注。Note: The B epitope region was boxed in BmpA of B31; the same region and variable region were separately labeled by dots and shadows.图2 各基因型参考菌株BmpA氨基酸序列异质性Fig.2 Heterogeneity of BmpA amino acid sequence in four genotypes
表4莱姆病螺旋体菌株bmpA基因中的变异对B表位区的影响
Tab.4Effects to the B epitope regions of the mutations in bmpA
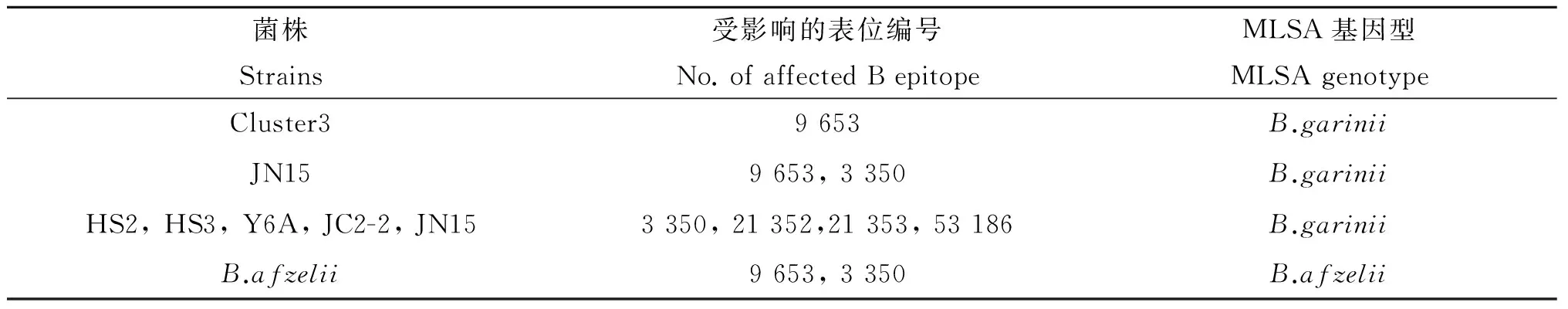
菌株Strains受影响的表位编号No.ofaffectedBepitopeMLSA基因型MLSAgenotypeCluster39653B.gariniiJN159653,3350B.gariniiHS2,HS3,Y6A,JC2-2,JN153350,21352,21353,53186B.gariniiB.afzelii9653,3350B.afzelii
在本研究中,基于BmpA蛋白氨基酸序列的聚类结果中,JC1-7菌株与B.afzelii基因型菌株聚为一簇,而在郝琴研究[12]中该菌株与B.garinii基因型菌株聚为一簇,这可能是bmpA基因发生基因交换所致。许多研究证实,基因交换现象常发生在莱姆病螺旋体ospC基因中[18-20]。
B.afzelii(含JC1-7)和B.valaisiana基因型菌株与俄罗斯参考菌株Tom3107和Tom4006比对,发现分别有5和18个异义突变。B.afzelii基因型菌株的125位突变位于B细胞表位区,导致2个B细胞表位受影响;B.valaisiana基因型的异义突变均位于非表位区,B细胞表位未受影响。但是两个基因型内的中国菌株BmpA氨基酸序列完全相同,这说明我国B.afzelii和B.valaisiana菌株基因型内高度保守。我国B.afzelii和B.valaisiana基因型菌株与参考菌株之间的异义突变可能是受地域差异的影响。由于B.valaisiana基因型菌株较少,需要进一步扩大菌株量进行验证。
B.b.s.s基因型CS4菌株的BmpA氨基酸序列与所选参考菌株序列相同,因B.b.s.s基因型菌株主要在美国致病而欧洲和亚洲少见[4],本课题组仅有一株,故只有一株用于分析。我国B.garinii基因型菌株聚类分析分为cluster1、cluster2、cluster3和5株非成簇菌株。cluster1与所选中国参考菌株的BmpA氨基酸序列相同且为菌株数量最多的一簇;我国B.garinii的cluster2、cluster3与参考序列比对后发现分别有3和9个异义突变。cluster2和cluster3菌株与菌株NMJW1的BmpA的序列比对分别有3和9个异义突变,cluster2菌株的突变均位于非表位区而cluster3菌株的122位突变导致一个B细胞表位受影响;5株非成簇菌株在B细胞表位的3个异义突变使5个B细胞表位均受影响。说明B.garinii基因型内菌株存在较大的异质性。
4结论
在我国莱姆病螺旋体菌株的bmpA基因可能存在基因交换现象;BmpA蛋白在4种基因型间和B.garinii基因型内存在较大异质性,该蛋白用于莱姆病早期血清学诊断时应考虑这种异质性以提高检测的灵敏度。
参考文献:
[1]Steere AC, Malawista SE, Hardin JA, et al.Erythemachronicummigrans andLymearthritis. The enlarging clinical spectrum [J]. Ann Intern Med, 1977, 86(6): 685-698. DOI: 10.7326/0003-4819-86-6-685
[2]Burgdorfer W, Barbour AG, Hayes SF, et al. Lyme disease-a tick-borne spirochetosis?[J]. Science, 1982, 216(4552): 1317-1319. DOI: 10.1126/science. 7043737
[3]Wan KL, Zhang ZF, Dou GL. Investigation on primary vector ofBorreliaburgdorferiin China[J]. Chin J Epidemiology, 1998, 19(5): 263-266.(in Chinese).
万康林, 张哲夫, 窦桂兰. 中国莱姆病螺旋体主要生物媒介的调查研究[J]. 中华流行病学杂志, 1998, 19(5): 263-266.
[4]Stanek G, Wormser GP, Gray J, et al. Lyme borreliosis[J]. Lancet, 2012, 379(9814): 461-473. DOI: 10.1016/S0140-6736(11)60103-7
[5]Stanek G, Strle F. Lyme borreliosis[J]. Lancet, 2003, 362(9396): 1639-1647. DOI: 10.1016/S0140-6736(03)14798-8
[6]Steere AC, Coburn J, Glickstein L. The emergence of Lyme disease[J]. J Clin Invest, 2004, 113(8): 1093-1101. DOI: 10.1172/JCI200421681
[7]Tong YP, Feng FB, Bi SL, et al. Molecular cloning and expression inBorreliaburgdorferiP39 geneE.coli[J]. Chin J Zoonoses, 2000, 16(4): 9-11.(in Chinese)
佟玉品, 冯方波, 毕胜利, 等. 莱姆病螺旋体P39蛋白的基因克隆及在大肠杆菌中的高效表达[J]. 中国人兽共患病杂志, 2000, 16(4): 9-11.
[8]Salo J, Jaatinen A, Soderstrom M, et al. Decorin binding proteins ofBorreliaburgdorferipromote arthritis development and joint specific post-treatment DNA persistence in mice[J]. PLoS One, 2015, 10(3): e0121512. DOI: 10.1371/journal.pone.0121512
[9]Arnaboldi PM, Seedarnee R, Sambir M, et al. Outer surface protein C peptide derived fromBorreliaburgdorferisensu stricto as a target for serodiagnosis of early lyme disease[J]. Clin Vaccine Immunol, 2013, 20(4): 474-481. DOI: 10.1128/CVI.00608-12
[10]Verma A, Brissette CA, Bowman A, et al.BorreliaburgdorferiBmpA is a laminin-binding protein[J]. Infect Immun, 2009, 77(11): 4940-4946. DOI: 10.1128/IAI.01420-08
[11]Ramamoorthy R, Povinelli L, Philipp MT. Molecular characterization, genomic arrangement and expression of bmpD, a new member of the bmp class of genes encoding membrane proteins ofBorreliaburgdorferi[J]. Infect Immun, 1996, 64(4): 1259-1264.
[12]Hao Q, Hou X, Geng Z, et al. Distribution ofBorreliaburgdorferisensulatoin China[J]. J Clin Microbiol, 2011, 49(2): 647-650. DOI: 10.1128/JCM.00725-10
[13]Vita R, Zarebski L, Greenbaum JA, et al. The immune epitope database 2.0[J]. Nucleic Acids Res, 2010, 38(Database issue): 11. DOI: 10.1093/nar/gkp1004
[14]Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Mol Biol Evol, 2011, 28(10): 2731-2739. DOI: 10.1093/molbev/msr121
[15]Shin JJ, Bryksin AV, Godfrey HP, et al. Localization of BmpA on the exposed outer membrane ofBorreliaburgdorferiby monospecific anti-recombinant BmpA rabbit antibodies[J]. Infect Immun, 2004, 72(4): 2280-2287. DOI: 10.1128/IAI.72.4.2280-2287.2004
[16]Bryksin AV, Tomova A, Godfrey HP, et al. BmpA is a surface-exposed outer-membrane protein ofBorreliaburgdorferi[J]. FEMS Microbiol Lett, 2010, 309(1): 77-83. DOI: 10.1111/j.1574-6968.2010.02020.x
[17]Pal U, Wang P, Bao F, et al.Borreliaburgdorferibasic membrane proteins A and B participate in the genesis ofLymearthritis[J]. J Exp Med, 2008, 205(1): 133-141. DOI: 10.1084/jem.20070962
[18]Jauris-Heipke S, Liegl G, Preac-Mursic V, et al. Molecular analysis of genes encoding outer surface protein C (OspC) ofBorreliaburgdorferisensulato: relationship to ospA genotype and evidence of lateral gene exchange of ospC[J]. J Clin Microbiol, 1995, 33(7): 1860-1866.
[19]Qiu WG, Bruno J F, McCaig WD, et al. Wide distribution of a high-virulenceBorreliaburgdorfericlone in Europe and North America[J]. Emerg Infect Dis, 2008, 14(7): 1097-1104. DOI: 10.3201/eid1407.070880
[20]Qiu WG, Schutzer SE, Bruno JF, et al. Genetic exchange and plasmid transfers inBorreliaburgdorferisensu stricto revealed by three-way genome comparisons and multilocus sequence typing[J]. Proc Natl Acad Sci U S A, 2004, 101(39): 14150-14155. DOI: 10.1073/pnas.0402745101
DOI:10.3969/j.issn.1002-2694.2016.04.002
通讯作者:万康林,Email: wankanglin@icdc.cn
中图分类号:R377
文献标识码:A
文章编号:1002-2694-(2016)04-0321-06
Corresponding author:Wan kang-lin, Email: wankanglin@icdc.cn
收稿日期:2016-01-06;修回日期:2016-03-17
Polymorphisms of human B cell epitopes in bmpA of Borrelia burgdorferi sensu lato in China
LIU Hui-xin1, HAO Qin2, LIU Wei2, HOU Xue-xia2, ZHANG Lin2, WAN Kang-lin1
(1.SchoolofLaboratoryMedicineandLifeScience,WenzhouMedicalUniversity,Wenzhou325035,China;2.StateKeyLaboratoryofInfectiousDiseasesPreventionandControl,NationalInstituteforCommunicableDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China)
Abstract:To study the polymorphism in bmpA and its human B cell epitopes of Borrelia burgdorferi strains in China, the bmpA sequences of 61 B.burgdorferi strains were obtained by PCR and sequencing. They were compared with the human B cell epitope sequences from Immune Epitope Database (IEDB) based on the reference strain of each genotype. The 3, 9, 5 and 18 nonsynonymous mutations were seperately found in cluster2 and cluster3 of B.garinii, B.afzelii and B.valaisiana strains in China. The changed B cell epitopes were mainly found in cluster3 and five non-clustered strains of B.garinii and B.afzelii strains. The nonsynonymous mutation of A125S in B.afzelii strains affected two B cell epitopes. Three nonsynonymous mutations in cluster3 and five non-clustered strains in B.garinii affected all of five B cell epitopes. The polymorphysims were widely existed in bmpA and its B cell epitopes in B.garinii and between four genotypes of B.burgdorferi strains selected in China.
Keywords:Borrelia burgdoferi; bmpA; B cell epitope; polymorphism
国家科技重大专项课题(No.2013ZX10004-001)资助
