人IL-37b基因真核表达载体的构建与表达
2016-07-27姚静程江2裴雪枫3王静宇4袁明4
姚静,程江2*,裴雪枫3,王静宇4,袁明4*
(1.石河子大学医学院,新疆石河子 832000;2.石河子大学第一附属医院检验科,新疆石河子 832000;3.辽宁医学院,辽宁锦州 121001;4.中国航天员科研训练中心,航天医学基础与应用国家重点实验室,北京 100094)
人IL-37b基因真核表达载体的构建与表达
姚静1,程江2*,裴雪枫3,王静宇4,袁明4*
(1.石河子大学医学院,新疆石河子 832000;2.石河子大学第一附属医院检验科,新疆石河子 832000;3.辽宁医学院,辽宁锦州 121001;4.中国航天员科研训练中心,航天医学基础与应用国家重点实验室,北京 100094)
【摘要】目的 构建pEGFP-N1/IL-37b真核表达载体,并检测其在THP-1细胞中的表达情况。方法 从人PBMCs中提取总RNA,利用RT-qPCR技术扩增出IL-37b基因编码区序列,克隆至pEGFP-N1真核表达载体,将构建的重组质粒pEGFP-N1/IL-37b转染到THP-1细胞中,通过RT-qPCR和Western blot检测IL-37的表达。结果 双酶切及基因测序结果显示IL-37b基因正确插入真核表达载体pEGFP-N1中;RT-qPCR和Western blot结果显示转染THP-1细胞后,IL-37表达水平明显升高(P<0.01)。结论 成功构建了新型抗炎因子IL-37真核表达载体pEGFP-N1/IL-37b,为进一步研究IL-37功能及与相关疾病的关系奠定基础。
【关键词】白细胞介素-37;基因克隆;真核表达载体;THP-1细胞
IL-37作为IL-1家族11个成员之一,最初是由Kumar等[1]于2000年利用计算机进行生物信息学分析时发现的,并命名为IL-1H4。后由Dunn等[2]于2001年命名为IL-1F7。2010年,Nold等[3]正式将IL-1F7更名为IL-37。IL-37基因位于人类第二号染色体上,共有五种不同的剪切亚型,即IL-37a~e,其中 IL-37b是五种亚型中分子量最大的一个[4,5]。IL-37具有广泛的炎症抑制作用,可抑制外周血单个核细胞、树突状细胞、巨噬细胞及上皮细胞等细胞炎症因子的产生[3,6],另外在感染性休克、系统性红斑狼疮、炎症性肠病、肝损伤、肝癌等疾病中发挥重要作用[3,7-10]。本实验利用基因工程相关技术,从人外周血单个核细胞中成功克隆出IL-37b全长编码区序列,并构建了其真核表达载体,且成功在THP-1细胞中实现了过表达,为进一步研究IL-37的生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 血液标本
5 mL人外周血由本实验室课题组成员提供。
1.1.2 质粒、菌株及细胞
pEGFP-N1质粒、THP-1细胞由本实验室保存;转化态E.coli DH5α购自康为世纪。
1.1.3 主要试剂
淋巴细胞分离液、LPS购自Sigma;Pfu DNA聚合酶、质粒抽提试剂盒、胶回收及DNA产物纯化试剂盒购自康为世纪;限制性内切酶BamHI及EcoRI、T4 DNA连接酶购自NEB;反转录试剂盒、SYBRⓇ Green荧光定量试剂盒购自TaKaRa;TRIzol试剂购自Invitrogen;IL-37单克隆抗体购自 Abcam(ab57187);GAPDH单克隆抗体购自CST(D16H11);胎牛血清、RPMI1640及 Opti-MEM培养基购自 Gibco;EntransterTM-D4000转染试剂购自Engreen。
1.2 实验方法
1.2.1 总RNA提取和cDNA合成
分离健康人新鲜外周血单个核细胞于含10% FBS的RPMI1640培养基中,加入1 μg/mL刺激浓度的LPS,置于37℃、5%CO2培养箱中培养24 h,收集细胞。用TRIzol法对所收集的细胞进行总RNA提取,用反转录试剂盒进行RT-PCR合成cDNA。
1.2.2 目的基因的扩增
根据GenBank中IL-37b(NM_014439.3)的序列分别设计用于扩增CDs全长(660 bp)的上下游引物,上游:5′-TCGAATTCTTGAAAATGTCCTTTGTGGGG G-3′,下游:5′-AAGGATCCATATCGCTGACCTCACTGGGGCT-3′(下划线分别为EcoRI和BamHI酶切位点)。以合成的cDNA为模板,用上述引物及Pfu DNA聚合酶进行PCR扩增,反应条件如下[11]:94℃预变性2 min、94℃变性30 s、60℃退火30 s、72℃延伸60 s,共35个循环,最后72℃终延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳分析回收纯化。
1.2.3 真核表达载体pEGFP-N1/IL-37b的构建
用限制性内切酶EcoRI和BamHI分别对回收的PCR产物和pEGFP-N1空载体进行37℃双酶切过夜,酶切产物经琼脂糖凝胶电泳分析回收纯化后,在T4 DNA连接酶作用下16℃连接过夜。将连接产物转化至大肠杆菌DH5α感受态细胞,转化液涂布于含卡那霉素的LB平板上,37℃培养过夜,次日随机挑取8个平板上单克隆菌落进行菌落PCR,筛选阳性单克隆菌落扩增提取质粒,进一步对质粒进行双酶切及测序鉴定。
1.2.4 THP-1细胞的培养及转染
复苏THP-1细胞于含10%FBS的RPMI1640培养基中,置于37℃、5%CO2培养箱中培养24 h,次日换液,之后每隔3~4 d进行传代培养,待细胞密度至70%左右时,按照EntransterTM-D4000转染说明书操作,培养72 h后,给予1 μg/mL的LPS刺激细胞,继续培养8 h,离心收集细胞。
1.2.5 重组质粒在THP-1细胞中的表达及检测
分别提取THP-1细胞总RNA和总蛋白,采用RT-qPCR和Western blot方法检测转染前后THP-1细胞中IL-37 mRNA和蛋白水平的变化。相关引物序列见表1。
1.2.6 统计分析
2 结果
2.1 IL-37b基因扩增产物的鉴定
IL-37b基因PCR产物经1%琼脂糖凝胶电泳后,可见两条略小于700 bp且大小相近的一明一暗条带(见图1),大小与预期相符。
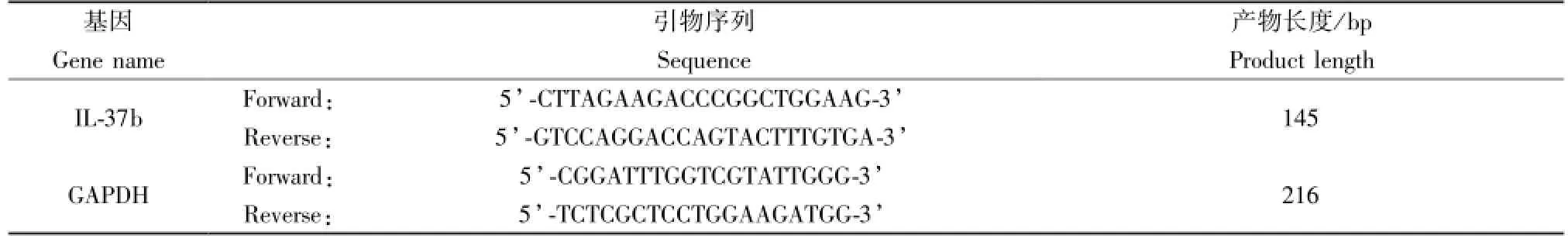
表1 实时荧光定量PCR扩增引物Tab.1 Primer pairs for the real-time PCR

注:M:Marker;1:PCR产物。图1 IL-37b基因PCR产物琼脂糖凝胶电泳Note.M:Marker;1:PCR products.Fig.1 Agarose gel electrophoresis of IL-37b PCR products.
2.2 重组质粒的鉴定
重组质粒单克隆菌落PCR产物琼脂糖凝胶电泳显示,8号菌落在略小于750 bp处有一明亮的特异性条带(见图2),对其进行增菌提取质粒,进一步双酶切(EcoRI/BamHI),产物琼脂糖凝胶电泳显示,可见约4700 bp的载体片段和660 bp左右的目的基因片段(见图3),大小与预期相符。DNA测序结果显示,构建的重组质粒pEGFP-N1/ IL-37b中含有IL-37b的全长序列(660 bp),Blast同源性分析显示,与 GenBank中登录的 IL-37b (NM_014439.3)序列相比,发现有两处碱基存在差异,即G/T和A/G(见图4),经查证是单核苷酸多态性(SNP)。
2.3 IL-37b在THP-1细胞中的表达
重组质粒pEGFP-N1/IL-37b转染THP-1细胞后,RT-qPCR检测结果显示(见图5),IL-37b表达较对照组明显升高(P<0.01),且给予LPS刺激后,差异有显著性(P<0.001)。Western blot检测结果显示(见图6),在50×103左右处可见特异性条带,与预期结果相符;对条带进行光密度量化分析结果显示,IL-37表达转染组较对照组明显升高(P<0.01)。

注:M:Marker;a~b:阴性克隆菌落PCR产物;1~8:阳性克隆菌落PCR产物。图2 菌落PCR琼脂糖凝胶电泳Note.M:Marker;a~b:Negative control;1~8:Positive colony PCR products.Fig.2 PCR agarose gel electrophoresis of the bacterial colonies

注:M:Marker;1:阴性对照;2:pEGFP-N1/IL-37b双酶切产物。图3 pEGFP-N1/IL-37b双酶切产物琼脂糖凝胶电泳Note.M:Marker;1:Negative control;2:Restriction enzyme digestion products of pEGFP-N1/IL-37b.Fig.3 Agarose gel electrophoresis of restriction enzyme digestion products of pEGFP-N1/IL-37b.
3 讨论
IL-1超家族共有11个成员,绝大多数是促炎性细胞因子,其中7个为激动剂(IL-1α、1L-1β、IL-18、IL-33、IL-36α、IL-36β、IL-36γ),2个为天然的受体拮抗剂(IL-1Ra、IL-36Ra)。IL-37作为第7个成员,是一种天然的免疫抑制物,IL-37作为一种天然的免疫抑制物,可由TLRs配体以及一些促炎性细胞因子(IL-1β、TNF-α、IFN-γ等)刺激的人外周血单个核细胞(PBMCs)、树突状细胞(DCs)诱导产生,能够抑制多种炎症因子的表达。IL-37基因共有6个外显子,通过不同的剪切,形成5个剪切亚型(IL-37a-e),但是不同的剪切亚型具有组织特异性,如IL-37a、b、c主要表达于淋巴结、胸腺、骨髓、肺、睾丸、胎盘、子宫、皮肤、结肠、NK细胞、单核细胞、角蛋白细胞和受刺激的B细胞中,而IL-37d、e只表达与骨髓和睾丸中;大脑中仅表达IL-37a,肾脏中仅表达IL-37b,心脏中仅表达IL-37c[4]。值得一提的是,IL-37是目前鼠科同系物中唯一没有发现的IL-1家族成员[12]。

图4 DNA序列比对分析部分结果Fig.4 Analysis of DNA sequence alignment.

注:转染组与空转组相比较,*P<0.05,**P<0.01,***P<0.001。图5 THP-1细胞中IL-37b基因mRNA水平的表达Note.*P<0.05,**P<0.01,***P<0.001 for IL-37b expression vs. mock-transfected.Fig.5 IL-37b mRNA expression level in the THP-1 cells

注:转染组与空转组相比较,*P<0.05,**P<0.01,***P<0.001。图6 THP-1细胞中IL-37蛋白水平的表达Note.Electrophoresis(left)and quantification(right)representation of Western blot.*P<0.05,**P<0.01,***P<0.001 for IL-37b expression vs.mock-transfected.Fig.6 IL-37 protein expression levels in the THP-1 cells
IL-37b是五种亚型中分子量最大的一个,包含除3号外显子以外的其他5个外显子[4,5],且1号外显子可编码caspase-1酶切位点,IL-37b前体经caspase-1切割活化后进入细胞核内参与转录调控,实验结果也证实在caspase-1催化活性缺失后,IL-37b的入核能力丧失,同时其炎症抑制作用下降[13]。然而,入核参与转录调控并不是IL-37发挥负向调节作用的唯一方式。研究者发现重组IL-37能够有效抑制脂多糖(LPS)引起的IL-6和IL-1α的产生,以及胞内蛋白激酶JNK、MAPK(p38)、ERK的磷酸化,从而实现抑制炎症信号的传导,由此证明分泌到胞外的IL-37也具有抑制炎症的作用[14]。此外IL-37还可通过与 IL-18Rα结合,进一步募集 IL-1R8,形成一个三聚体装配在细胞表面,抑制LPS与其受体TLR4的结合,从而抑制炎症反应[15]。在免疫调节方面,IL-37可抑制树突状细胞的成熟,使其维持在半成熟状态,从而不能有效地发挥其在免疫应答中捕获、处理和呈递抗原的作用,抑制免疫系统识别并且靶标新抗原的能力[6]。
一些动物实验已经证实,IL-37在疾病的进展中,起到保护作用,如在脂多糖(LPS)诱导的感染性休克、葡聚糖硫酸钠(DSS)诱导的结肠炎、刀豆素A (ConA)诱导的肝炎、烟曲霉菌诱导的肺部真菌感染中,发现IL-37转基因小鼠的全身炎症反应、局部器官组织的损伤程度较野生对照小鼠减轻、炎症因子的产生减少[3,8,9,16]。另外一些来源于临床样本的研究结果分析显示[17],不同的炎症性疾病及自身免疫性疾病中,IL-37的表达有不同程度的上调或下调。
基于IL-37潜在的临床应用价值,本实验室从LPS刺激的PBMCs中成功克隆出大IL-37b全长序列,通过琼脂糖凝胶电泳,发现在略小于700 bp处有上下两条大小相近的一明一暗条带,根据文献报道[4],PBMCs中可表达IL-37b和IL-37c两种剪切亚型,因此我们考虑明亮且分子量稍大的条带为IL-37b,而另一条灰暗且分子量略小的为IL-37c。对IL-37b进行胶回收及后续实验,将IL-37b编码区全长序列克隆入真核表达载体pEGFP-N1,该载体含有SV40和CMV启动子及绿色荧光蛋白GFP,具有稳定表达、利于检测基因转染效率等优点。经酶切及测序鉴定,发现与GenBank中登录的IL-37b(NM _014439.3)序列有两处碱基存在差异,即 GGA/ GTA(甘氨酸/缬氨酸)和ACC/GCC(苏氨酸/丙氨酸),经查证均为该基因的两处单核苷酸多态性(SNP:rs3811046和rs3811047)。进一步转染THP-1细胞,检测到无论是否给与LPS刺激,IL-37表达均显著升高,成功地实现了其在THP-1细胞中的过表达,为后续研究IL-37与其他免疫调节细胞因子相互作用的分子机制及与相关疾病的关系奠定基础。
参考文献
[1] Kumar S,McDonnell PC,Lehr R,et al.Identification and initial characterization of four novel members of the interleukin-1 family [J].J Biol Chem,2000.275(14):10308-10314.
[2] Dunn E,Sims JE,Nicklin MJ,et al.Annotating genes with potential roles in the immune system:six new members of the IL-1 family[J].Trends Immunol,2001.22(10):533-536.
[3] Nold MF,Nold-Petry CA,Zepp JA,et al.IL-37 is a fundamental inhibitor of innate immunity[J].Nat Immunol,2010.11 (11):1014-1022.
[4] Boraschi D,Lucchesi D,Hainzl S,et al.IL-37:A new anti-inflammatory cytokine of the IL-1 family[J].Eur Cytokine Netw,2011.22(3):127-147.
[5] Banchereau J,Pascual V,O’Garra A.From IL-2 to IL-37:The expanding spectrum of anti-inflammatory cytokines[J].Nat Immunol,2012.13(10):925-931.
[6] Luo Y,Cai X,Liu S,et al.Suppression of antigen-specific adaptive immunity by IL-37 via induction of tolerogenic dendritic cells[J]. Proc Natl Acad Sci U S A,2014.111(42):15178-15183.
[7] Ye L,Ji L,Wen Z,et al.IL-37 Inhibits the production of inflammatory cytokines in peripheral blood mononuclear cells of patients with systemic lupus erythematosus:its correlation with disease activity[J].J Transl Med,2014.12:69.
[8] McNamee EN,Masterson JC,Jedlicka P,et al.Interleukin-37 expression protects mice from colitis[J].Proc Natl Acad Sci U S A,2011.108(40):16711-16716.
[9] Bulau AM,Fink M,Maucksch C,et al.In vivo expression of interleukin-37 reduces local and systemic inflammation in concanavalin ainduced hepatitis[J].Scient World J,2011.11:2480-2490.
[10] Zhao JJ,Pan QZ,Pan K,et al.Interleukin-37 mediates the antitumor activity in hepatocellular carcinoma:role for CD57+NK cells[J].Sci Rep,2014.4:5177.
[11] 严磊,李晶,赵婷婷,等.大鼠CB1基因真核表达载体的构建及其对CaSki细胞凋亡的影响[J].中国实验动物学报,2015,23(02):153-158.
[12] Bufler P,Azam T,Gamboni-Robertson F,et al.A complex of the IL-1 homologue IL-1F7b and IL-18-binding protein reduces IL-18 activity[J].Proc Natl Acad Sci U S A,2002.99(21):13723-13728.
[13] Bulau AM,Nold MF,Li S,et al.Role of caspase-1 in nuclear translocation of IL-37,release of the cytokine,and IL-37 inhibition of innate immune responses[J].Proc Natl Acad Sci U S A,2014.111(7):2650-2655.
[14] Li S,Neff CP,Barber K,et al.Extracellular forms of IL-37 inhibit innate inflammation in vitro and in vivo but require the IL-1 family decoy receptor IL-1R8[J].Proc Natl Acad Sci U S A,2015.112(8):2497-2502.
[15] Nold-Petry CA,Lo CY,Rudloff I,et al.IL-37 Requires the receptors IL-18Ra lpha and IL-1R8(SIGIRR)to carry out its multifaceted anti-inflammatory program upon innate signal transduction[J].Nat Immunol,2015.16(4):354-365.
[16] Moretti S,Bozza S,Oikonomou V,et al.IL-37 inhibits inflammasome activation and disease severity in murine aspergillosis [J].PLoS Pathog,2014.10(11):e1004462.
[17] Chen HM,Fujita M.IL-37:a new player in immune tolerance [J].Cytokine,2015.72(1):113-114.
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)03-0268-05
Doi:10.3969/j.issn.1005-4847.2016.03.010
Corresponding author:YUAN Ming,E-mail:yuanming7711@aliyun.com;CHENG Jiang,E-mail:chengjiang1980 @sina.com
[基金项目]国家重点基础研究发展计划(973计划)(2014CB744404)。
[作者简介]姚静(1988-),女,硕士,研究方向:临床分子生物学诊断,E-mail:yaojing_hnzz@163.com。
[通讯作者]袁明(1977-),男,副研究员,博士,研究方向:空间生物学,E-mail:yuanming7711@aliyun.com;程江(1963-),男,教授,硕士,研究方向:实验室管理及分子生物学,E-mail:chengjiang1980@sina.com。
[收稿日期]2016-01-06
Construction and expression of eukaryotic expression vector of human IL-37b gene
YAO Jing1,CHENG Jiang2*,PEI Xue-feng3,WANG Jing-yu4,YUAN Ming4*
(1.Medical College of Shihezi University,Shihezi 832000,China;2.Department of Clinical Laboratory,the First Affiliated Hospital of Shihezi Medical University,Shihezi 832000;3.Liaoning Medical College,Jinzhou 121001;4.Key Laboratory of Space Medicine Fundamentals and Application,China Astronaut Research and Training Center,Beijing 100094)
【Abstract】Objective To construct the eukaryotic expression vector pEGFP-N1/IL-37b and analyze the expression of IL-37 gene in THP-1 cells.Methods Total RNA was extracted from human peripheral blood mononuclear cells(PBMCs)and the coding region of IL-37b gene was amplified by RT-qPCR.Then,the gene was cloned into pEGFP-N1 eukaryotic expression vector.After transfected the recombinant plasmid into THP-1 cells,the expression of IL-37 was detected by RT-qPCR and Western blot.Results Double restriction enzyme digestion and gene sequencing showed that IL-37b gene was correctly inserted into the eukaryotic expression vector pEGFP-N1.RT-qPCR and Western blot showed that the IL-37 expression level was increased significantly(P<0.01)after transfection in THP-1 cells.Conclusions We successfully constructed a novel anti-inflammatory cytokine IL-37 eukaryotic expression vector pEGFP-N1/IL-37b,which lays a foundation for further study on IL-37 functions and its association with related diseases.
【Key words】Interlukin-37;Gene cloning;Eukaryotic expression vector;THP-1 cells
