孕前炔雌醇暴露对大鼠子代糖代谢变化和肝脏糖代谢相关基因表达的影响
2016-07-27徐凯旋李宁宁管磊剑夏彦恺吴笛
徐凯旋,李宁宁,管磊剑,夏彦恺,吴笛
(南京医科大学公共卫生学院卫生毒理学系,江苏南京 211166)
研究报告
孕前炔雌醇暴露对大鼠子代糖代谢变化和肝脏糖代谢相关基因表达的影响
徐凯旋,李宁宁,管磊剑,夏彦恺,吴笛*
(南京医科大学公共卫生学院卫生毒理学系,江苏南京 211166)
【摘要】目的 以SD大鼠为模型,观察孕前炔雌醇(ethinyl estradiol,EE)暴露对子代糖代谢变化和肝脏内与糖代谢相关基因表达的影响。方法 52只雌性大鼠随机分为4组:对照组(芝麻油)、50、200、800 μg/kg EE组,每天1次,连续灌胃暴露15 d后受孕。在子代出生后第23天(postnatal day,P23)和P25分别进行口服葡萄糖耐量(OGTT)和胰岛素耐量(ITT)实验,并用RT-PCR检测肝脏中糖代谢相关基因表达水平。结果 子代雌鼠OGTT:200 μg/kg EE组空腹血糖值显著低于对照组(P<0.05);800 μg/kg EE组第15min血糖值显著高于对照组、50、200 μg/kg EE组(P<0.01,P<0.01,P<0.01),50、800 μg/kg EE组2 h血糖值显著低于对照组(P<0.05,P<0.01)。子代雄鼠OGTT:在第15 min,800 μg/kg EE组血糖值显著高于对照组(P<0.01);第30 min时,200 μg/kg EE组血糖值显著低于对照组(P<0.05)。子代雌鼠ITT:第15 min时,50、200 μg/kg EE组血糖值显著高于对照组(P<0.001,P<0.01)。子代雄鼠ITT:第30 min时50、200 μg/kg EE组血糖值显著高于对照组(P<0.01,P<0.01)。子代雌鼠RT-PCR:50,200 μg/kg EE和800 μg/kg EE组Glut2和Lpk mRNA表达水平显著低于对照组(P <0.01,P<0.05,P<0.05);50、200 μg/kg EE组Gys2 mRNA表达水平显著低于对照组(P<0.01,P<0.01)。子代雄鼠RT-PCR:200 μg/kg EE组G6pase和Pepck mRNA表达水平显著高于对照组(P<0.01,P<0.01),50 μg/kg EE组Glut2 mRNA表达水平相对于对照组显著降低(P<0.01),800 μg/kg EE组Gys2 mRNA表达水平显著高于对照组(P<0.01)。结论 孕前炔雌醇暴露会导致子代雌鼠葡萄糖耐量受损、子代出现胰岛素抵抗及肝脏内糖代谢相关基因表达异常。而且这些效应具有性别差异,子代雌鼠对孕前EE暴露更敏感。
【关键词】孕前;炔雌醇;糖代谢失衡;肝脏
炔雌醇(ethinyl estradiol,EE)是一种人工合成雌激素,被广泛使用在药物制剂中,是目前短效口服避孕药中的高效雌激素。在我国偏远乡村,有1%的已婚妇女选择服用短效避孕药[1],但是在人口密集的沿海发达地区,由于婚前对短期有效且可逆的避孕方法需求的增加,服用含有EE避孕药的人群相对比较庞大。在我国,EE更多地被用于调节女性正常生理周期、恢复流产后生理周期、辅助受孕、治疗痤疮和妇科疾病[2,3],EE非避孕性应用是避孕性应用的21倍[4]。值得注意的是,服用EE的女性人群相对年轻,往往在短期内会有怀孕计划。那么,最令人关心的是女性在孕前服用EE是否会给子代健康发育带来不良影响。
EE高效而且相对不易降解,消除半衰期比较长(36±13)h,长期定量服用很容易在体内积累,也较容易引起妊娠早期暴露,从而具有潜在的生殖发育毒性。所以,EE作为雌激素内分泌干扰物代表,被美国国家毒理学项目重点研究[5]。但目前关于EE生殖发育毒性的报道很少。根据2003年国际上正式认可的 DOHaD理论(Developmental Origins of Health and Disease),慢性代谢疾病如糖代谢稳态失衡和糖尿病的病因,往往可以追溯到人类在早期发育过程中经历的不利因素[6],这些不利因素可引起子代出生后表型的改变,如糖代谢失衡[7],很多动物和人群研究已经发现孕期母体内环境对子代出生后的生长发育有影响[8],但是关于围孕期特别是孕前母体环境对后代出生后生长发育影响的研究刚刚开展。肝脏是糖代谢和脂代谢调节的重要器官[9],在稳定血糖、清除血氨和解毒方面有重要作用。因此我们建立了孕前EE暴露SD大鼠模型,研究孕前EE暴露是否会影响子代健康发育,尤其是糖代谢以及从肝脏角度探索子代糖代谢失衡的可能机制。
1 材料和方法
1.1 材料
1.1.1 实验动物
SPF级雌鼠SD大鼠52只,体重230~250 g,7 ~9周龄,购自上海斯莱克实验动物有限责任公司【SCXK(沪)2012-0002】,SPF级雄鼠SD大鼠52只,体重430~450 g,12~14周龄,购自上海斯莱克实验动物有限责任公司【SCXK(沪)2013-0018】,均饲养于南京医科大学江宁校区动物中心屏障实验室【SYXK(苏)2014-0009】,环境温度:20±2℃,相对湿度:50% ~60%,光照:150~200 lx,12 h/12 h明暗交替,噪音<50 db,每个IVC笼内饲养2只大鼠,自由饮食,并按实验动物使用的3R原则给予人道的关怀。
1.1.2 实验试剂
Ethinylestradiol,购自德国Dr.Ehrenstorfer标准品公司;罗氏血糖试纸,购自南京迈迪特生物化学有限公司;中性胰岛素注射液,购自江苏万邦生化医药股份有限公司;Trizol,购自Invitrogen(Carlsbad,CA,USA)公司;逆转录试剂盒、RNA酶抑制剂(RNasin)和SYBR Green PCR Master Mix reagent kits,均购自Takara公司(大连宝生物有限公司)。
1.1.3 实验仪器
罗氏卓越型血糖仪,购自南京迈迪特生物化学有限公司;台式低温高速离心机(GS215R,美国Backman),7900型荧光定量 PCR仪(美国ABI公司)。
1.2 炔雌醇染毒
将52只雌鼠按照体重随机分为4组,每组13只,采取灌胃方法对4组大鼠分别给予芝麻油及50、200 μg/kg和800 μg/kg EE暴露,每日一次,连续暴露15 d,给药前禁食不禁水。
1.3 大鼠交配及子代体重测定
大鼠连续EE暴露15 d后给予15 d的洗脱期,之后雌雄按1∶1的比例进行合笼交配,每天上午9:00-11:00检查雌鼠阴栓脱落情况,记观察到阴栓为怀孕第1天,怀孕的母鼠单独饲养与鼠笼内,给予不含雌激素的食物,且每5 d记录1次体重。大鼠的妊娠期为21 d,在19 d左右密切观察大鼠分娩情况,观察到子代出生记为出生后第1天(postnatal day,P1),对新生子代采取剪趾标记,并在同组间交换不同窝别的子代以减少子代个体差异,子代在出生后第22天断奶,第25天进行雌雄分笼。子代从P4-P14,每2 d称1次体重。
1.4 子代葡萄糖耐量和胰岛素耐量测定
1.4.1 葡萄糖耐量实验
在子代P23前1 d晚上对子代(n=8)禁食12 ~14 h,并在第2天早上8点按2 g/kg剂量给子代灌胃50%葡萄糖,尾尖采集0、15、30、60、120 min时间点的血糖并利用罗氏卓越型血糖仪记录数值,绘制OGTT曲线。
1.4.2 胰岛素耐量实验
在子代P25前1 d晚上对子代(n=8)禁食12 ~14 h,并在第2天早上8点按0.75 IU/kg剂量对子代腹腔注射胰岛素,尾尖采集0、15、30、60、120 min时间点的血糖并记录血糖数值,绘制ITT曲线。
1.5 RT-PCR
1.5.1 子代肝脏总RNA提取
在抽提RNA之前,所有需使用的器材、离心管及枪头等均需在0.1%DEPC水中浸泡24 h,烘干,高压消毒去除RNase以后待用。称取各组子代肝脏0.1 g并超声,接下来用TRizol试剂盒按产品说明书提取总RNA。
1.5.2 引物设计
根据GenBank上提供的基因序列,应用Primer Premier 5.0软件设计基因特异性引物。引物设计完成后,通过NCBI对其特异性进行鉴定,结果表明均具有良好的特异性(表1)。引物由上海捷瑞生物工程有限公司合成。

表1 肝脏内与糖代谢相关基因引物序列及反应条件Tab.1 Primer sequences and reaction conditions of glucose-related genes in the liver of rats
1.6 统计分析
用统计学分析软件SPSS 19.0结合Origin对各项指标进行数据整理及分析,所有数据均行正态性、方差齐性检验,所有实验结果用均数±标准误表示,采用单因素方差分析(One-way ANOVA)比较各组间的差异后用LSD多重比较的方法进行两两比较,来判断是否有统计学显著差异。
2 结果
2.1 子代体重
母鼠孕前EE暴露后,观察子代出生后P4-P14体重变化,结果显示子代雌鼠在P4和P10组间体重差异有显著性(P<0.05,图1A)。经LSD法比较发现在P4,800 μg/kg EE组子代体重显著低于对照组(P<0.01,图 1A);在P10,200 μg/kg EE和800 μg/kg EE组子代体重显著高于对照组(P<0.01)。而对于子代雄鼠,在P6,50 μg/kg EE组子代体重显著低于对照组(P<0.01,图1B)。
2.2 子代葡萄糖耐量实验
子代雌鼠OGTT实验结果发现P23空腹血糖值组间存在差异(P<0.05,图2A)。使用LSD法比较发现200 μg/kg EE组子代空腹血糖值显著低于对照组(P<0.05,图2A),说明200 μg/kg EE暴露有可能导致子代代谢失衡。在第15 min,800 μg/kg EE组血糖值显著高于对照组、50μg/kg EE和200 μg/kg EE组(P<0.01,P<0.01,P<0.01,图2A);但在2 h,50 μg/kg EE和800 μg/kg EE组血糖值却显著低于对照组(P<0.05,P<0.01,图2A),说明孕前EE暴露可使子代雌鼠糖耐量受损。
在子代雄鼠OGTT中,第15 min、30 min血糖水平组间差异有显著性(P<0.05,图2B)。LSD法两两比较发现,在第15 min,800 μg/kg EE组血糖值显著高于对照组(P<0.01,图2B);在第30 min,200 μg/kg EE组血糖值显著低于对照组(P<0.05,图2B)。然而在2 h,EE暴露组的血糖值和对照组相比差异无显著性(P>0.05,图2B),说明较雌鼠而言,子代雄鼠的糖耐量可能未受损。
2.3 子代胰岛素耐量实验
在P25,ITT实验结果显示子代雌鼠和雄鼠对胰岛素的敏感性具有类似趋势。在雌鼠中,腹腔注射胰岛素后第15 min,50 μg/kg EE、200 μg/kg EE组血糖值显著高于对照组(P<0.001,P<0.01,图3A)。在子代雄鼠中,第30 min组间血糖水平差异有显著性(P<0.05,图3B),LSD法发现,50 μg/kg EE和200 μg/kg EE组血糖值显著高于对照组(P<0.01,P<0.01,图3B),综上可说明50 μg/kg EE和200 μg/kg EE组子代经孕前EE暴露后有可能出现胰岛素抵抗现象。
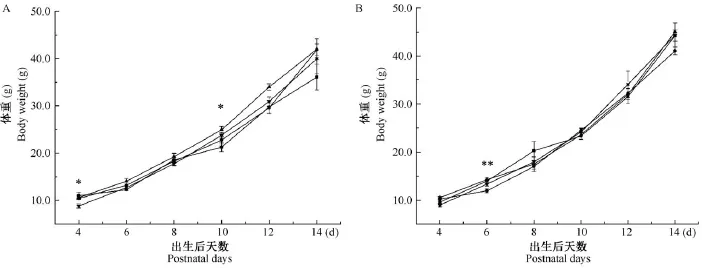
注:—■—对照组;—·—50 μg/kg EE组;—▲—200 μg/kg EE组;—▼—800 μg/kg EE组;*P<0.05,**P<0.01。图1 子代雌鼠(A)和雄鼠(B)P4-P14体重Note.—■—Control group;—·—50 μg/kg EE group;—▲—200 μg/kg EE group;—▼—800 μg/kg EE group;*P<0.05,**P<0.01.Fig.1 Body weight of the female(A)and male(B)offsprings from P4 to P14
2.4 RT-PCR
用RT-PCR的方法检测了肝脏内糖代谢相关基因Glut2、Gck、Lpk、G6pase、Pepck、Gys2和Pygl mRNA的相对表达水平。在子代雌鼠中,50、200 μg/kg EE和800 μg/kg EE组Glut2和Lpk的表达水平相对于对照组显著降低(P<0.01,P<0.05,P<0.05,图4A);糖原合成相关酶Gys2基因表达水平在50 μg/ kg EE和200 μg/kg EE组也显著低于对照组(P<0.01,P<0.01,图4A);糖异生关键基因G6pase和Pepck、Gck和Pygl基因表达水平在对照组和剂量组中差异无显著性(P>0.05,图4A)。
在子代雄鼠中,糖异生基因G6pase和Pepck表达水平在200 μg/kg EE组中相对于对照组显著增高(P<0.01,P<0.01,图 4B);50 μg/kg EE组Glut2表达水平相对于对照组显著降低(P<0.01,图4B);糖原合成相关酶Pygl表达水平在800 μg/ kg EE显著高于对照组(P<0.01,图4B)。
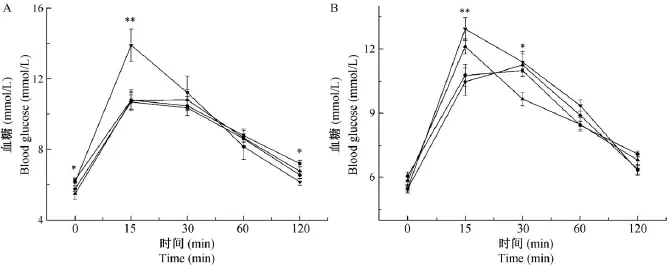
注:—■—对照组;—·—50 μg/kg EE组;—▲—200 μg/kg EE组;—▼—800 μg/kg EE组;*P<0.05,**P<0.01。图2 子代雌鼠(A)和雄鼠(B)P23葡萄糖耐量实验Note.—■—Control group;—·—50 μg/kg EE group;—▲—200 μg/kg EE group;—▼—800 μg/kg EE group;*P<0.05,**P<0.01.Fig.2 Results of glucose tolerance test in the female(A)and male(B)offsprings at P23

注:—■—对照组;—·—50 μg/kg EE组;—▲—200 μg/kg EE组;—▼—800 μg/kg EE组;*P<0.05,**P<0.01。图3 子代雌鼠(A)和雄鼠(B)P25胰岛素耐量实验Note.A:Female offspring;B: Male offspring.—■—Control group.—·—50 μg/kg EE group.—▲—200 μg/kg EE group.—▼—800 μg/kg EE group.*P<0.05,**P<0.01.Fig.3 Results of insulin tolerance test in the female(A)and male(B)offsprings at P25
3 讨论
炔雌醇(EE)属于环境内分泌干扰物(environmental endocrine disrupting chemicals,EDCs),长期以来一直是口服避孕药中的重要激素,由于EE在育龄妇女中的广泛运用,其对于女性本身是具有安全性的[2.3],但对后代是否具有毒性作用应该引起足够的重视。既往的动物实验主要着重于孕期以及哺乳期暴露EE对子代的影响,而关于孕前暴露EE的研究还较少,本实验选择SD大鼠孕前EE暴露模型,研究其对子代糖代谢的影响和肝脏内糖代谢相关基因mRNA的转录水平,进而探索子代糖代谢失衡的可能机制。
Ferguson等[10]研究发现SD大鼠在孕期第6~21天连续暴露5 μg/kg和10 μg/kg EE,子代雌鼠和雄鼠体重较对照组均随年龄增加显著增高,与本实验子代雌鼠体重变化趋势类似(图1A),却不同于子代雄鼠体重变化,推测可能与不同性别子代对EE的敏感性有关;Mandrup等[11]却发现Wister大鼠在孕期第7~10天暴露0、5、15和50 μg/kg EE导致50 μg/kg子代雄鼠P6体重下降,与我们的结果完全一致;在鲫鱼暴露EE模型中,亦发现体重下降现象[12]。这些结果意味着孕前同孕期暴露EE在一定程度上都可导致子代体重变化,原因推测有可能与摄食量及代谢变化有关[13]。
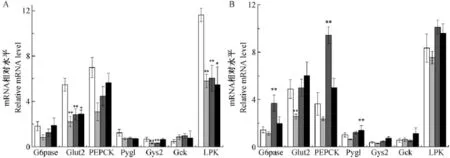
注:对照组;50 μg/kg EE组;200 μg/kg EE组;800 μg/kg EE组;*P<0.05,**P<0.01。图4 子代雌鼠(A)和雄鼠(B)肝脏内与糖代谢相关基因mRNA表达水平Note:Control group;50 μg/kg EE group;200 μg/kg EE group;800 μg/kg EE group;*P<0.05,**P<0.01.Fig.4 The mRNA expression level of glucose metabolic-related genes of liver in the female(A)and male(B)offsprings
Lawrence等[14]研究的甲基炔诺酮(norgestrel/ ethinyl estradiol;NEE)和Kendig[15]给CD1小鼠喂食含有炔雌醇的饲料,均发现子代糖耐量受损现象,说明EE在不同的种属中且与其他具有雌激素效应的短效避孕药一样,都可使子代糖耐量受损。本实验研究结果发现不同剂量的孕前EE暴露都可使子代糖耐量发生变化,但是糖耐量发生异常的时间点不一样,这可能与不同性别子代体内的代谢功能和脂肪分布有关,因为雄鼠更倾向于改变皮下脂肪分布而非腹部脂肪[15]。此种效应的差异与同样作为EDCs的双酚A(bisphenol A,BPA)有共同点,刘景丽等[13]在C57BL6小鼠孕期及哺乳期不同阶段暴露BPA,因给药的剂量、时间和对胰岛素具有的不同敏感性等[16]原因均可使不同性别子代的葡萄糖耐量存在差异。
肝脏是调节糖代谢的主要器官,Gck和Lpk均是肝脏糖酵解的关键酶,它们的表达或活性降低,将直接影响胰岛素在肝脏的利用以及葡萄糖在肝脏的吸收,导致葡萄糖耐量下降及胰岛素抵抗[17]。Lpk是肝脏糖酵解三个关键的限速酶之一,且处于糖酵解过程的最后一步,Lpk活性高,葡萄糖分解加快[18],Glut2可促进体内葡萄糖摄取且与葡萄糖敏感基因表达的调节密切相关[19],Glut2表达升高可促进葡萄糖转运,为肝糖原含量增加提供条件,Glut2敲除的小鼠出现明显的高糖血症[20]。本实验孕前EE暴露组子代雌鼠肝脏内Lpk和Glut2表达下调,可间接解释50 μg/kg EE和800 μg/kg EE组子代雌鼠2 h的血糖水平低于对照组的现象。而在子代雄鼠中,Glut2在只50 μg/kg EE组中表达下调,与糖耐量结果不一致。在哺乳动物中,肝糖原生成对去除体内过量血糖起到关键的作用[21],在子代雌鼠中,Gys2作为肝糖原合成酶在50 μg/kg EE和200 μg/kg EE组中表达降低,说明在高剂量组中Gys2合成较少,葡萄糖转化为肝糖原的量较少,体内血糖水平继而升高,同子代雌鼠胰岛素耐量实验结果一致。Pepck和G6pase是糖异生的关键酶,Pepck和G6pase表达上调可使血糖水平升高[22],我们的ITT结果显示200 μg/kg EE组血糖水平显著增高,符合Pepck和G6pase表达上调的结果,说明200 μg/kg EE孕前暴露确实会导致使子代产生胰岛素抵抗。
综述所述,孕前炔雌醇长期暴露会导致子代代谢失衡,如葡萄糖耐量受损、出现胰岛素抵抗现象等,结合肝脏内与糖代谢相关基因的表达,可在一定程度上解释子代幼年期糖代谢失衡的现象,继而为幼年期糖代谢失衡的发生发展提供新的理论依据,最终为预防和控制EE引起的儿童高血糖提供直接依据。
参考文献
[1] He D,Zhang Y,Ji N,et al.A cross-sectional study of contraceptive use among.married women living in rural China[J].Int J Gynaecol Obstet,2012,118(2):129132.
[2] 张春燕.复方短效口服避孕药的非避孕作用临床应用及体会.临床合理用药杂志[J].2012,5(5A):107-108.
[3] 付建红,郭尚云.人工流产术后及时服用短效避孕药的临床观察[J].中国妇幼保健.2013,28(17):2744-2746.
[4] 庞艳玉,杨振宇,曾涛.我院门诊复方口服避孕药的非避孕性应用情况分析[J].中国药学杂志.2012,47(11):878-879.
[5] National Toxicology Program.Multigenerational reproductive toxicology study of ethinyl estradiol(CAS No.57-63-6)in Sprague-Dawley rats[J].Natl Toxicol Program Tech Rep Ser,2010,(547):1-312.
[6] Gluckman PD,Hanson MA,Low FM.The role of developmental plasticity and epigenetics in human heath[J].Birth Defects Res C Embryo Today,2011,93(1):12-18.
[7] Zheng S,Rollet M,Pan YX.Protein restriction during gestation alters histone modifications at the glucose transporter 4(GLUT4)promoter region and induces GLUT4 expression in skeletal muscle of female rat offspring[J].J Nutr Biochem,2012,23(9):1064-1071.
[8] Galjaard S,Devlieger R,Van Assche FA.Fetal growth and developmental programming[J].J Perinat Med,2013,41(1):101-105.
[9] Sesti G.Pathophysiology of insulin resistance[J].Best Pract Res Clin Endocrinol Metab,2006,20(4):665-679.
[10] Ferguson SA,Law CD,Kissling GE.Developmental treatment with ethinyl estradiol,but not bisphenol A,causes alterations in sexually dimorphic behaviors in male and female Sprague Dawley rats[J].Toxicol Sci,2014,140(2):374-392.
[11] Mandrup KR,Jacobsen PR,Isling LK,et al.Effects of perinatal ethinyl estradiol exposure in male and female Wistar rats[J]. Reprod Toxicol,2013,42:180-191.
[12] Huang B,Sun W,Li X,et al.Effects and bioaccumulation of 17beta-estradiol and 17 alpha-ethynylestradiol following long-term exposure in crucian carp[J].Ecotoxicol Environm Safety,2015,112:169-176.
[13] Liu J,Yu P,Qian W,et al.Perinatal bisphenol A exposure and adult glucose homeostasis:identifying critical windows of exposure[J].PloS One,2013,8(5):e64143.
[14] Olatunji LA,Oyeyipo IP,Usman TO.Effect of a high-fructose diet on glucose tolerance,plasma lipid and hemorheological parameters during oral contraceptive administration in female rats [J].Clin Hemorheol Microcirc,2013,54(1):23-31.
[15] Kendig EL,Buesing DR,Christie SM,et al.Estrogen-like disruptive effects of dietary exposure to bisphenol A or 17alpha-ethinylestradiol in CD1 mice[J].Int Toxicol,2012,31(6):537 -550.
[16] Lin Y,Wei J,Li YY,et al.Developmental exposure to di(2-ethylhexyl)phthalate impairs endocrine pancreas and leads to long-term adverse effects on glucose homeostasis in the rat[J]. Am J Physiol Endocrinol Metab,2011,301(3):527-538.
[17] Yarushkin AA,Kachaylo EM,Pustylnyak VO.The constitutive androstane receptor activator 4-[(4R,6R)-4,6-diphenyl-1,3-dioxan-2-yl]-N,N-dimethylaniline inhibits the gluconeogenic genes PEPCK and G6Pase through the suppression of HNF4alpha and FOXO1 transcriptional activity[J].Br J Pharmacol,2013,168(8):1923-1932.
[18] Krivoruchko A,Storey KB.Activation of the carbohydrate response element binding protein(ChREBP)in response to anoxia in the turtle Trachemys scripta elegans[J].Biochim Biophys Acta,2014,1840(10):3000-3005.
[19] Thorens B.GLUT2,glucose sensing and glucose homeostasis [J].Diabetologia,2015,58(2):221-232.
[20] Guillam MT,Hümmler E,Schaerer E,et al.Early diabetes and abnormal postnatal pancreatic islet development in mice lacking GLUT2[J].Nat Genet,1997,17:327-330.
[21] Brunner Y,Schvartz D,Priego-Capote F,et al.Glucotoxicity and pancreatic proteomics[J].J Proteomic,2009,71:576-591.
[22] Li X,Xu M,Wang F,et al.Interaction of ApoA-IV with NR4A1 and NR1D1 represses G6Pase and PEPCK transcription:nuclear receptor-mediated downregulation of hepatic gluconeogenesis in mice and a human hepatocyte cell line[J].PloS One,2015,10(11):e0142098.
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)03-0221-07
Doi:10.3969/j.issn.1005-4847.2016.03.001
[基金项目]国家自然科学基金资助项目(81470150);江苏省高校自然科学研究计划项目(12KJB330001);留学回国人员科研启动基金。
[作者简介]徐凯旋(1988-),女,硕士研究生,主要研究方向:生殖发育与内分泌毒理学。E-mail:xkx516@163.com。
[通讯作者]吴笛(1977-),女,副教授,博士,主要研究方向:生殖毒理学与神经内分泌毒理学。E-mail:diwu@njmu.edu.cn。blood glucose level than that in the control group(P<0.05).At 15 min after glucose administration,the blood glucose level in the 800 μg/kg EE group was much higher than that in the control group,50 μg/kg and 200 μg/kg EE groups(P <0.01,P<0.01,P<0.01).At the time point of 2 h,the blood glucose level of the 50 μg/kg and 800 μg/kg EE groups were both significantly lower than that in the control group(P<0.05,P<0.01).The female offsprings in the 50 μg/kg and 200 μg/kg EE groups had significantly higher glucose level after insulin administration than that in the control group(P<0.001,P<0.01).In the male offsprings,the 800 μg/kg EE group had a significantly higher blood glucose level than the control group at 15 min after glucose administration(P<0.01),and the 200 μg/kg EE group had a lower blood glucose level than the control at 30 min after glucose administration.In the male offsprings,the blood glucose level of 50 μg/kg and 200 μg/kg EE groups were much higher than that of the control group(P<0.01,P<0.01).In the female offsprings,Glut2 and Lpk mRNA expressions in the 50 μg/kg,200 μg/kg and 800 μg/kg EE groups were much lower than that in the control group(P<0.01,P<0.05,P<0.05).Gys2 mRNA expressions in the 50 μg/kg and 200 μg/kg EE groups were much lower than that in the control group(P<0.01,P<0.01).In the male offsprings,the 200 μg/kg EE group had much higher G6pase and Pepck mRNA expression than in the control group(P<0.01,P<0.01).The Glut2 mRNA expression in the 50 μg/kg EE group was much lower than that in the control group(P<0.01).The Gys2 mRNA expression in the 800 μg/kg EE group was significantly higher than that in the control group(P<0.01).Conclusions Pregestational EE exposure can lead to impaired glucose tolerance and insulin resistance in female offspring and alterations of key hepatic glucose-metabolism-related gene expression,and these effects are sex-specific,and female offspring is more sensitive to pregestational EE exposure.
Corresponding author:WU Di,.E-mail:diwu@njmu.edu.cn
[收稿日期]2016-04-08
Pregestational ethinyl estradiol exposure leads to glucose homeostasis disruption and changes of expressions of glucose-metabolism-related genes in rat offsprings
XU Kai-xuan,LI Ning-ning,GUAN Lei-jian,XIA Yan-kai,WU Di*
(Department of Toxicology,School of Public Health,Nanjing Medical University,Nanjing 211166,China)
【Abstract】Objective The aim of this study was to observe pregestational ethinyl estradiol(EE)-exposure-induced glucose metabolism alterations and hepatic glucose-metabolism-related gene expression changes in the offsprings of SD rats.Methods Fifty-two female and 52 male SD rats were used in this study.The female rats were gavaged with sesame oil,50 μg/kg,200 μg/kg and 800 μg/kg EE for 15 consecutive days.After the end of exposure period,the female rats were mated with male rats and gave birth to next generation.The blood glucose and insulin tolerance in the offsprings were measured on postnatal days 23(P23)and 25(P25).The expressions of hepatic glucose-metabolism-related genes were measured by RT-PCR.Results In the female offsprings,the 200 μg/kg EE group had significantly lower fasting
【Key words】Pregestational;Ethinyl estradiol;Glucose metabolism imbalance;Liver
