羟基磷灰石除氟的实验地球化学研究
2016-07-26王洪涛季峻峰伟表生地球化学教育部重点实验室南京大学地球科学与工程学院南京210023
任 超,王洪涛,季峻峰,李 伟表生地球化学教育部重点实验室,南京大学地球科学与工程学院 南京210023
羟基磷灰石除氟的实验地球化学研究
任 超,王洪涛*,季峻峰,李 伟*
表生地球化学教育部重点实验室,南京大学地球科学与工程学院 南京210023
摘要:中国和世界上许多国家(地区)都面临着饮用水氟含量超标的问题,因此研究氟的环境地球化学行为以及探索除氟技术和原理至关重要。本实验采用廉价的非金属矿物羟基磷灰石作为吸附材料,研究羟基磷灰石吸附溶解态F-的地球化学行为和机制,考察反应时间、pH、初始F-浓度等环境参数对吸附反应的影响。实验结果发现羟基磷灰石对F-的吸附反应需进行到48 h以上时才接近反应平衡。在实验条件下(pH≥4),F-的吸附量随pH升高而降低,羟基磷灰石对F-的吸附受pH调控。同时还发现羟基磷灰石在pH=6条件下对F-的吸附等温线既满足Langmuir等温模式(R2=0.89)同时也满足Freundlich等温模式(R2=0.99),并推导出该条件的理论最大吸附量为21.6×10-3。本研究还进一步采用了先进的XRD、SEM、HR-TEM、19F NMR手段,系统地表征了反应前后吸附产物的形态和成分变化,发现在高F-浓度条件下,F-在羟基磷灰石表面的吸附机制不再是单层的表面配位。核磁共振的结果表明F-可部分取代羟基磷灰石结构中的隧道羟基而形成含氟羟基磷灰石。研究结果表明羟基磷灰石是一种相当具有潜力的除氟材料,值得进一步开发。
关键词:羟基磷灰石;氟;吸附;核磁共振;透射电子显微镜
饮用水中的氟污染物被认为是目前威胁人类健康的主要问题之一(Amini et al.,2008)。摄入适量的氟有助于人体健康,对于预防龋齿、氟斑牙、氟骨病等地方性疾病的防治有重要意义,但是摄入的氟含量不足或者过多,会导致氟中毒(Dorozhkin and Epple,2002)。实验表明,地方性氟中毒与环境饮用水中的氟含量呈正相关关系(Smith et al.,1931)。根据世界卫生组织(WHO)规定,安全饮用水中的氟含量不能超过1.5 mg·L-1(WHO,2006)。全世界有超过30个国家和地区,超过2亿人口正面临饮水型氟中毒的威胁(Ayoob et al.,2008),这些国家和地区大多集中在发展中国家(Singh et al.,2013)。地方性氟中毒在中国已经成为危害最严重的地方病之一,病区分布范围遍及全国29个省市,受威胁人口接近5千万(陈男,2012)。例如,江苏省是受污染较严重的地区之一,江苏省徐州市所处的地貌为古黄河形成的泛滥平原,沉积有大量的黄泛冲积物,对氟起到了富集的作用(张景荣等,1998),局部地下水氟浓度可达13.0 mg·L-1,远超中国的安全饮用水标准(1.0 mg·L-1)(邱世保等,1993)。
自然因素是造成饮用水氟污染的主要因素。氟是亲石元素,自然界中含氟的矿物有很多,最主要的是萤石 (CaF2),其次还有氟镁石(MgF2)、 氟 铝 石 (AlF3·H2O)、 冰 晶 石(Na3AlF6)、氟磷灰石(Ca10(PO4)6F2)等(刘金华,2013)。这些矿物所组成的岩石在风化以后,氟被岩石、土壤中的循环水溶解,一部分直接被动植物利用,一部分通过淋滤作用等进入地下水造成污染(刘英俊等,1984)。
目前环境除氟可被大致分为以下几种方法,包括絮凝沉淀法、吸附法、离子交换法、电化学方法和膜方法(Ayoob et al.,2008)。其中,吸附法因为成本低廉,设计简单,便于操作的优势被广泛应用于降氟。大量的吸附剂已经被成功应用于除氟实验,包括活性氧化铝(Rubel et al.,1979),沸石,骨粉(Bhargava and Killedar,1992),活性炭(Srimurali et al.,1998),方解石(Yang et al.,1999),粘土,漂白粘土(Mahramanlioglu et al.,2002)和红泥(Cengeloglu et al.,2002)等等,选用何种吸附剂长期以来备受关注(表1)
近年来,磷灰石作为一种除氟的天然矿物材料受到广泛的关注。磷灰石是火成岩和变质岩中最常见的一种副矿物,因为性质稳定也常常产出于陆源碎屑岩中(王德滋和谢磊,2012)。羟基磷灰石(Hydroxyapatite,简称HAP)是磷灰石的一种,作为磷酸盐的衍生物在自然界中广泛分布(Bouyarmane et al.,2014),同时也是动物牙齿和骨骼的重要组成部分(Suchanek et al.,1998)。羟基磷灰石相比于其他吸附剂具有吸附量大,吸附效果好,环境友好等特点,但是已报道的大多数研究停留在宏观吸附行为和除氟效果研究,关于羟基磷灰石除氟的微观地球化学反应机制尚不十分明确(Jiménez-Reyes et al.,2010)。本研究通过控制反应时间、pH、初始F-浓度探讨羟基磷灰石对氟的吸附行为,计算理论最佳吸附条件;还探索了运用扫描电镜(SEM),高分辨率透射电镜(HR-TEM)以及氟的固体核磁共振技术(19F NMR)等先进的微观表征手段,来研究羟基磷灰石对F-的吸附机制。
1 材料与方法
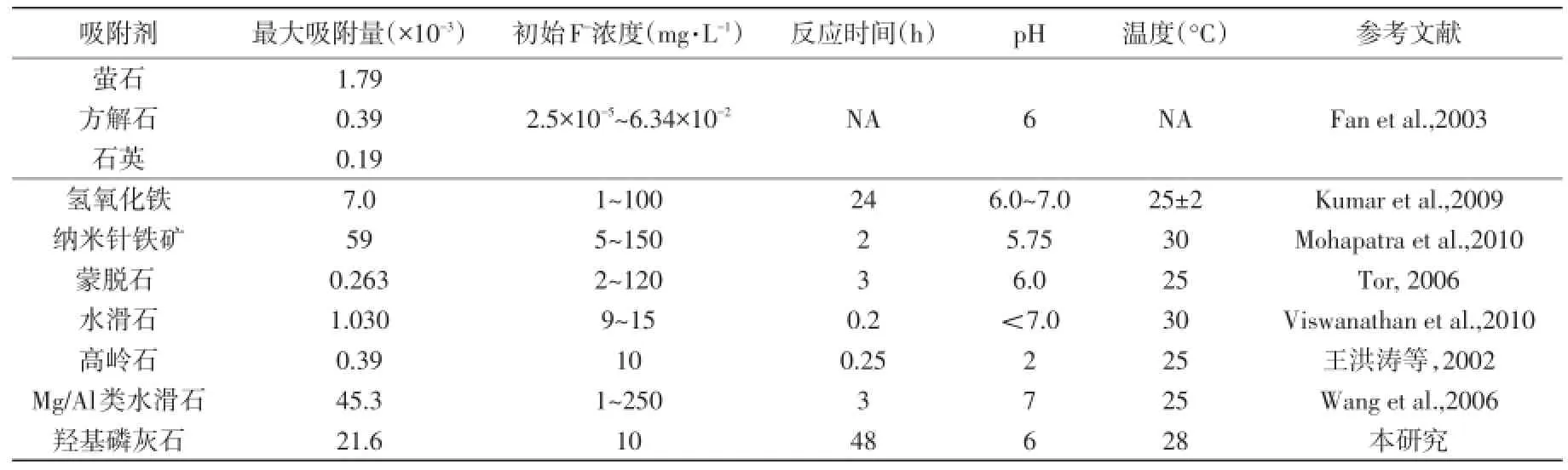
表1 不同材料的氟吸附性能Table 1 Summary of fluoride sorption capacity for several materials
1.1 吸附剂表征
本次实验选用的羟基磷灰石(BR)为白色粉末,晶体结构分析在南京大学现代分析中心,由瑞士ARL公司生产的X’TRA型X射线衍射仪上完成,扫描角度为3°~70°,扫描步长0.02°,其XRD图谱 (图1) 与文献(Kanno et al.,2014) 和JCPDS-09-0423标准比较发现本实验所选用的为一类质地纯净的羟基磷灰石矿物。
羟基磷灰石的比表面积和孔容测试在南京大学表生地球化学教育部重点实验室型号为Micromeritics ASAP2020M全自动气体吸附系统上完成,BET法测得的比表面积为15.2 m2·g-1,孔容积0.0557 cm3·g-1,孔径14.7 nm。
1.2 吸附实验
本次实验运用batch法考查了pH、初始F-浓度等对F-在羟基磷灰石/溶液体系中吸附行为的影响。准确称取0.100 g羟基磷灰石粉末至50 mL离心管中,加入40 mL一定初始F-浓度(0.05、0.1、0.25、0.5、1、2、5、10 mmol·L-1等)的NaF溶液(背景电解质NaCl的浓度为0.01 mol·L-1),实验中用到的水均为二次去离子水。用0.01 mol·L-1HCl或NaOH溶液调节pH,经常重复以上操作,使反应过程中pH误差在±0.2以内,将调节好pH的样品放入恒温振荡器反应。加入完毕开始计时,反应温度设置为28℃(以下实验均在该温度条件下进行),每个样品均设置两个平行对照样本。反应结束后离心,转速设置为5000 r·min-1,离心时
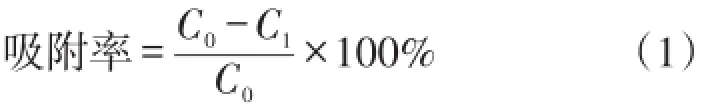
其中,C0为初始F-浓度,C1为反应后的F-浓度,mmol·L-1。
1.3 吸附样品的微观表征
吸附样品通过离心进行固液分离并室温风干后,进行固体表征。样品的扫描电镜照片在中国科学院南京地质古生物研究所完成,仪器的型号为日立(HITACHI SU3500)扫描电子显微镜,二次电子成像分辨率3.0 nm/30 kV,7.0 nm/50 kV,加速电压0.3~30 kV,放大倍数7~800 000倍。
透射电镜照片及EDAX主成分分析在南京大学纳米技术研究中心的高分辨率透射电子显微镜上完成,仪器的型号为JEM-2100,200 kV高分辨率透射电子显微镜。仪器点分辨率为0.23 nm,束斑尺寸为1.0~25 nm,放大倍数为2000~1 500 000倍。
固体样品的氟的固体核磁测试在600 MHz的傅里叶变换固体核磁共振谱仪器(布鲁克公司)完成,设置π/2单脉冲长度为5.57 ms,每一个旋回间隔时间为30 s(Mohammed et al.,2013),转子转速频率为14 kHz。氟核磁的化学位移用CFCl3(0×10-6)矫正。每个样品采样约500~1000次。间为5 min。待离心结束后,吸取10 mL左右上清液经0.22 μm滤头过滤后注入10 mL离心管中待测,倾倒上清液,收集剩余残留固体,室温风干,待固体表征。
本实验中溶液F-浓度的测量采用氟离子选择电极法(Wang et al.,2006)。吸附实验中的羟基磷灰石对氟的吸附率通过公式1计算得到。
2 结果与讨论
2.1 时间对吸附效果的影响
实验把羟基磷灰石按2.5 g·L-1的固液比投入NaF的NaCl溶液(初始F-浓度[F-]=0.25 mmol·L-1)中,通过0.01 mol·L-1HCl和0.01 mol·L-1NaOH溶液调节pH=7±0.2,得到羟基磷灰石对F-的吸附效果随着时间的变化(图2a)。由图2a可以看出,在pH=7,初始F-浓度[F-]=0.25 mmol·L-1条件下,羟基磷灰石对F-的吸附率随着时间的变化而变化。在反应前2 h内,反应激烈,且吸附率已达到较高水平;在2~24 h里,吸附率逐渐变缓;在反应24 h以后,吸附率平缓并趋于平衡。这可能是由于F-与羟基磷灰石的反应由表面开始逐渐向晶体内部扩散,这一过程进行得比较缓慢。
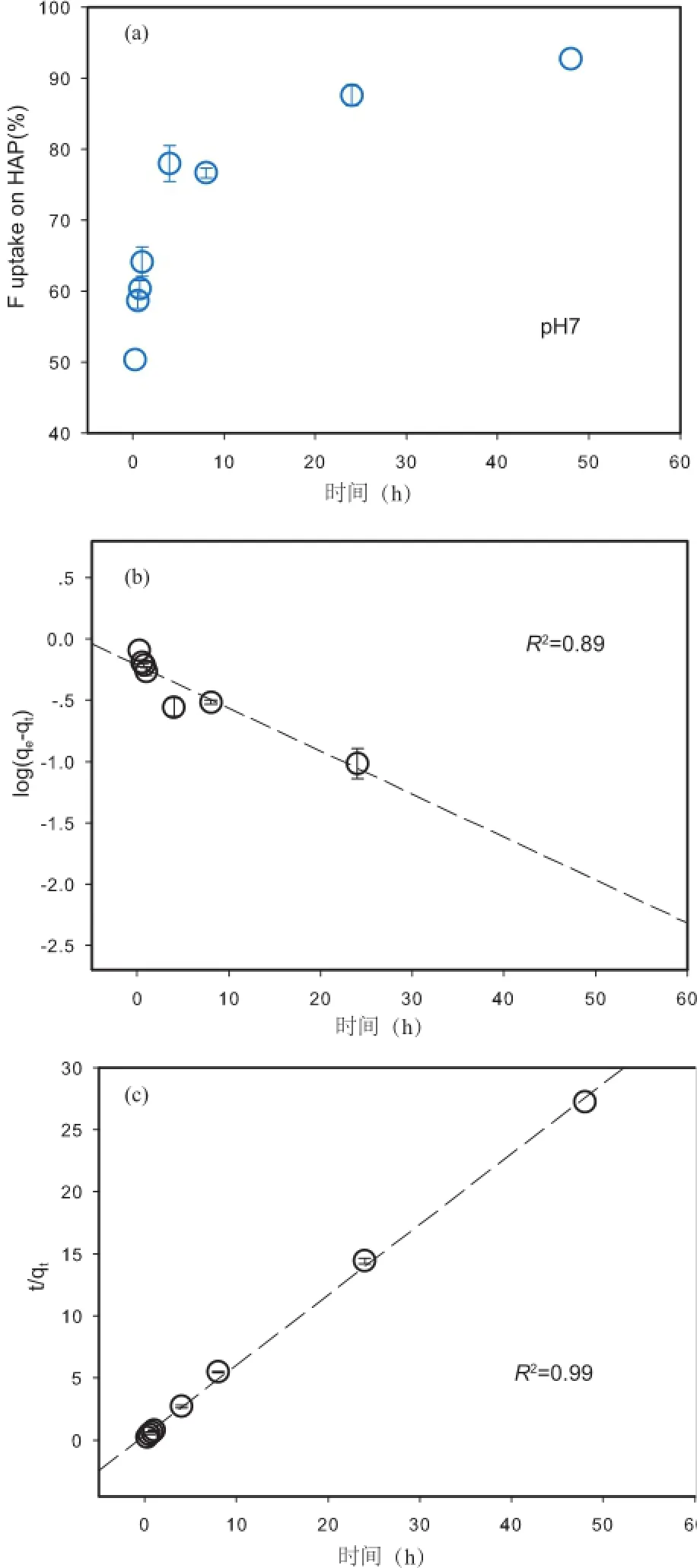
图2 (a)羟基磷灰石对F-的吸附率随反应时间的变化(初始F-浓度为0.25 mmol·L-1);(b)Largergren拟一级动力学模型拟合曲线;(c)Largergren拟二级动力学模型拟合曲线Fig.2 (a)Kinetics of fluoride sorption on hydroxylapatite([F-]initial=0.25 mmol·L-1);(b)Pseudo-1st-order regression curve for the adsorption of fluoride on the HAP;(c)Pseudo-2nd-order regression curve for the adsorption of fluoride on the HAP
采用Lagergren拟一级动力学模型对本次实验中羟基磷灰石吸附F-的吸附动力学进行拟合从而得出反应速率常数。
拟一级动力学模型方程(Fan et al.,2003):

式中,t为吸附时间,h;qe和qt分别为平衡时的吸附量和反应时间t时的吸附量,g·mg-1;K1为吸附速率常数,h-1。
图2(b)所示的是log(qe-qt)-t的关系,所得到的速率方程是log(qe-qt)=-0.2147-0.0351 t,由拟一级动力学模型方程拟合的相关系数R2=0.8985,计算可得一级速率常数K1=8.08×10-2h-1。
在很多情况下,Lagergren拟二级动力学方程能够更好地描述吸附动力学过程(李玲等,2010),其方程表示如下:

式中,K2为拟二级吸附速率常数,h-1;其余参数含义同拟一级动力学模型方程。图2(c)所示的是-t的线性关系,速率方程可以表达为= 0.3831+0.5663t,线性相关系数R2=0.9988,速率常数K2=0.8371g·(mg·h)-1。
2.2 pH对除氟效果的影响
溶液的pH值是影响吸附过程的重要参数(Jiménez-Reyes et al.,2010)。如果把反应48h近似看作反应平衡,实验得到不同pH条件下反应到达平衡时,羟基磷灰石对F-的吸附率(图3)。由图3可以看出,当pH=4和pH=5时,吸附率均能达到99%以上;但是随着pH值的升高,平衡吸附率不断降低,到pH=10时,吸附率只有50%左右。前人的研究中报道羟基磷灰石的pHpzc=7.2(Poinern et al.,2011),也有研究得出羟基磷灰石的pHpzc在4.35到7.6范围内(Bell et al.,1971)。pHpzc是矿物与水溶液处于零电势时的pH值(Brown et al.,1999)。当pH<pHpzc时,矿物表面表现为带正电荷,而F-作为阴离子带负电,因此当pH降低时,吸附率升高。
本实验还发现在pH=3时,羟基磷灰石的吸附率略低于pH=4,这可能是因为羟基磷灰石在酸性条件下表面会部分溶解,从而影响了对F-的吸附。这一现象Jiménez-Reyes等(2010)和Poinern等(2010)在相关文献中也曾有报道。由此可总结出在磷灰石表面稳定的前提下(pH=4~10),F-的吸附率随pH的升高而降低。

图3 不同pH条件下羟基磷灰石对F-的平衡吸附率(初始F-浓度为0.5 mmol·L-1)Fig.3 Effect of pH on the removal of F by HAP at[F-]initialof 0.5 mmol·L-1
2.3 吸附等温线
图4表示的是羟基磷灰石在pH=7,不同初始F-浓度条件下,反应平衡时的吸附率。由图可以看出,平衡吸附率随着F-浓度的增加而减小,当初始F-浓度≤0.5mmol·L-1时,吸附率≥80%,当初始F-浓度≤0.1 mmol·L-1时,羟基磷灰石对F-的吸附接近100%。

图4 不同初始浓度下羟基磷灰石对F-的吸附率(pH 7)Fig.4 F sorption by hydroxyapatite as a function of F-initial concentration at pH 7
为了考察羟基磷灰石对F-的吸附热力学,在控制pH=7,不同初始F-浓度条件下,羟基磷灰石对F-的吸附量与剩余F-浓度之间的关系如图5a所示。可以看出,随着平衡浓度的增加,吸附量增大,羟基磷灰石对F-的吸附能力增强。Langmuir(公式4)和Freundlich(公式5)等温吸附模型是常用的等温吸附模型。

图5 (a)氟离子在pH7条件下的吸附等温线;(b)运用Langmuir等温模式进行线性回归得到的等温线;(c)运用Freundich等温模式进行线性回归得到的等温线Fig.5 (a)Sorption isotherm of fluoride sorption on hydroxyapatite at pH 7;Fit of isotherm using Langmuir model (b)and Freundlich Model(c)

公式中的各个字母表示的意义:qe为平衡吸附量,mg·g-1;qmax为最大吸附量,mg·g-1;Ce为平衡浓度,mmol·L-1;b、n、K分别为常数:化简上述公式,可知Langmuir等温式是与的线性函数(公式6),Freundlich可以通过log(Ce)与log(qe)进行线性拟合(公式7):

通过Langmuir和Freundlich等温吸附模型进行拟合,可以得到相应的吸附等温线和相关系数(图5b、c)。羟基磷灰石对F-的等温吸附特征表明,羟基磷灰石对F-的吸附等温线满足Langmuir等温吸附模型,通过线性回归计算出的理论最大吸附量为21.6×10-3,这一最大吸附量与李玲等报道的羟基磷灰石对F-的最大静态吸附容量相当(26.11×10-3)(李玲等,2010)。前人的文献中提出了很多具有很高吸附率的材料(郭亚祺等2014,刘昊等2015),但是大多是经过表面改性的材料,这样就提高了吸附剂的环境治理成本,本实验中采用的羟基磷灰石作为天然的廉价矿物在经济成本和吸附表现上具有突出的优势。
同时本研究发现,与Langmuir吸附模型相比,Freundlich等温吸附模型能更好地拟合F-在羟基磷灰石表面的吸附等温线。由于Langmuir模型假设在均一表面进行的单分子层吸附,并且被吸附的粒子和粒子之间没有相互作用(Bitton,1998),而Freundlich模型是基于均质界面的非理想吸附模型,描述的是多分子层吸附(Liang et al.,2007)。根据两种模式计算出来的相关系数可以判断,羟基磷灰石对F-的吸附并非简单的单层吸附,而较大可能是均质表面的非理想吸附模型,即多层吸附(Jiménez-Reyes et al.,2010)。这一推论在下面的电子显微镜和固体核磁共振等微观表征研究中得到了进一步验证。
2.4 吸附机制探讨
一般认为,羟基磷灰石除氟的机制主要包括表面吸附(Surface Adsorption)、离子交换(Ion Exchange)和溶解沉淀(Dissolution-Precipitation)三种模式。表面吸附模式中,F-主要与羟基磷灰石的表面活性位点结合,如≡CaOH(Sternitzke et al.,2012)等,从而形成络合物;提出离子交换是主要机制的学者则认为F-(0.133 nm)相比于OH-(0.137 nm)有着相近的离子半径,因此吸附在羟基磷灰石表面的F-能够取代OH-进入晶格形成更难溶解的含氟羟基磷灰石(Ca10(PO4)6(F,OH)或氟磷灰石Ca10(PO4)6F2,从而降低了溶液中F-的浓度,Mueller等(2010)和de Leeuw等(2004)分别通过实验观察和模拟证实了羟基磷灰石表面可以生成氟磷灰石或含氟磷灰石的薄层;也有学者(Christoffersen et al.,1995和Spinelli et al.,1971)提出羟基磷灰石在酸性条件下会溶解产生钙离子(Ca2+),和磷酸根离子(PO),而F-与Ca2+达到一定浓度产生饱和氟化钙溶液而沉淀,从而达到了除氟的效果。
如果把吸附剂表面看作一个单层吸附的模型,通过比表面积和吸附量的换算,实验得出,当初始F-浓度≥5 mmol·L-1时,羟基磷灰石对F-的吸附已经达到15~40 F-·(nm)-2,这已经接近甚至超过了单位表面积可容纳的最大理论吸附量(~14.8 F-·nm-2),由此判断吸附机制以产生沉淀为主。然而当初始F-浓度≤2 mmol·L-1时,单位面积的离子个数所指示的吸附机制是吸附还是表面沉淀尚不清楚,这与羟基磷灰石表面的吸附位点有关。Nelson等(1969)通过数学建模提出羟基磷灰石在含氟溶液中形成CaF2沉淀在物理化学的反应平衡中是可行的。此外,Christoffersen等(1995)从吸附实验的角度说明了牙釉质和水溶液中F-反应的机制以生成CaF2沉淀为主,实验控制的条件为酸性环境,初始F-浓度为2~50 mmol·L-1,与本实验相似。但是由于本实验主要是在中性pH条件下进行,尚不能推测本实验中也产生了CaF2沉淀。但是可以确定的是,在高F-浓度(≥5 mmol·L-1),单层的表面吸附不再是主要的吸附机制。
通过控制反应体系pH和初始F-浓度分离出来的固体在扫描电子显微镜(SEM)下进行形态观察(6e、h是未反应过的羟基磷灰石)。观察发现,反应前后的羟基磷灰石宏观上没有发生太大的变化(图6a、b、c、d),当放大倍数达到50k×时,可见原始葡萄状羟基磷灰石,表面较平滑,而反应后的羟基磷灰石表面不平整,毛糙。尤其在图6g中较为明显,图6g中的固体是在初始F-浓度10 mmol·L-1,pH=6条件下反应得到的,推测固体表面有一层不规则沉淀物生成。

图6 不同pH和初始F-浓度反应前后样品的SEM形态(表2):(a)F-pH6-0.5;(b)F-pH7-0.5;(c)F-pH6-10;(d)HAP;(e)F-pH6-0.5;(f)F-pH7-0.5;(g)F-pH6-10;(h)HAPFig.6 SEM images of selected samples:(a)F-pH6-0.5;(b)F-pH7-0.5;(c)F-pH6-10;(d)HAP;(e)F-pH6-0.5;(f)F-pH7-0.5;(g)F-pH6-10;(h)HAP.Sample information are provided in Table 2
图7指示的是通过控制反应pH、初始F-浓度在反应48h后分离出来的固体样品在透射电子显微镜(TEM)下的形貌。可以看出反应前后颗粒表面由光滑变得粗糙有棱角,羟基磷灰石的边缘形貌发生改变,可能是由羟基磷灰石的溶解和重结晶造成的,也可能是在外围形成一层新矿物。通过透射电子显微镜(TEM)观察到羟基磷灰石在反应后形态发生变化的现象在多篇文章中均有报道(Vanessa et al.,2012)。实验又在微观结构的基础上进行了EDAX主成分分析,得到沉淀态氟的直接证据。实验选取了一小块区域进行透射电镜联用的能谱分析,发现在O峰的附近出现了明显的氟元素的峰形(图7d),说明这一部分样品含有沉淀态的氟,推测为一种新产生的含氟固体沉淀相。

图7 不同pH和初始F-浓度处理前后样品的TEM形态以及能谱分析结果:(a)F-pH7-0.5;(b)F-pH6-10;(c)HAP;(d)F-pH6-10.(表2)Fig.7 TEM images and EDX analysis of samples:(a)F-pH7-0.5;(b)F-pH6-10;(c)HAP;(d)F-pH6-10 (Sample information are provided in Table 2)

表2 固体微观表征的样品信息列表Table 2 Experimental conditions for samples with microscopic characterization
为了进一步从分子水平查明新生成的含氟矿物种类,本次实验对固体粉末样品进行了固体核磁共振(19F NMR)测试(图8)。固体核磁技术克服了固体样品分子运动受限的缺点,从而实现对不溶样品的表征以及防止了样品溶解后对结构的破坏实现原位表征,且19F NMR对环境因素很敏感,可反映出化合物结构的细微差别(李临生等,2007)。由图8可以看出,在pH=6条件下的吸附样品观测到化学位移为-103×10-6的主峰,它与萤石(CaF2)的化学位移(-108×10-6)不一致,说明该含氟固体沉淀并非CaF2。Braun和Jana(1995)研究了含氟磷灰石的化学位移,指出含氟磷灰石Cal0(PO4)6F2x(OH)2-2x(此处x指取代羟基磷灰石结构羟基的百分数)的化学位移在-104.0×10-6到-101.4×10-6之间且化学位移与磷灰石含氟量之间存在一定的线性关系,由此关系可知本研究中观测到-103×10-6的核磁峰可归属为含氟羟基磷灰石,从而说明该条件下羟基磷灰石吸附F的机制主要为生成沉淀态的含氟羟基磷灰石。在pH=7,初始F-浓度为0.5mmol·L-1条件下的19F NMR谱图中,不仅可以观察到化学位移为-103× 10-6的主峰,同时还观察到-94×10-6处有较小的肩峰,它对应的可能是表面吸附态的氟。但是在此条件下,吸附机制仍以生成沉淀态含氟羟基磷灰石为主(Mohammed et al.,2013)。

图8 吸附样品的19F固体核磁共振表征,星号代表自旋边带Fig.819F solid-state NMR analysis on two selected fluoride sorption samples.The19F chemical shift was referenced to FCCl3,and asterisks denote spinning sidebands
2.5 羟基磷灰石除氟效果评价
一般而言,除氟材料可以划分为钙基材料、铝基材料、铁基材料等。钙基材料的代表是天然碳酸钙矿物,F-吸附量可达0.39×10-3(Fan et al.,2003)。它的优势在于自然界中广泛分布着大量灰岩,因此原材料廉价易得,但是吸附量较小,吸附效果不理想。铝基材料以活性氧化铝为代表,F-吸附量可达16.3×10-3(Young and Chiou,2001),因为有着较好的吸附效果早期广泛应用于生产和生活。但是铝基材料在吸附污染物的同时形成大量污泥,并向环境中释放Al3+等污染离子造成安全隐患。铁基材料的代表是氢氧化铁,其F-吸附量可达7.0×10-3。此外,一些学者还研究了自然界中广泛存在的廉价矿物,如粘土矿物(王洪涛和刘连文,2002;孙承辕等,1997;郭华明等,2000),沸石(韩成,1986)及其他材料(王焰新等,1999;陆铮等,1990;付格娟等,2010)等。LDH(Layered-Doubled-Hydroxides)作为一种新材料,区别于其他材料的是它通过改变层间的结构和成分吸附环境中的不同阴离子,而不产生化学污泥,最大的F-吸附量可以达到213.22×10-3(Bhatnagar et al.,2011)。本次实验中的羟基磷灰石属于钙基材料,但是吸附量是传统钙剂材料的50倍。在所有材料里面,只略逊色于LDH。考虑到羟基磷灰石为天然材料,廉价且易获取,在降低大规模饮用水除氟中具有明显的成本优势,值得进一步开发。
3 结论
本实验中羟基磷灰石作为一种成本低廉,环境友好的吸附饮用水中F-的原材料,表现出了非常出色的吸附能力,理论最大F-吸附量可达到21.6×10-3。反应后的羟基磷灰石表面有含氟新矿物生成。在F-浓度较高条件(>10×10-3)下,F-在羟基磷灰石表面会形成沉淀态含氟羟基磷灰石,但是在较高pH条件下也发现有少量表面吸附态氟。
参考文献(References):
陈男.2012.天然及合成多孔性粘土材料对地下水氟化物的吸附性能研究[D].北京:中国地质大学.
付格娟,李剑超,张晓伟,等.2010.高氟水处理材料的研究进展[J].江西农业学报,22(1):156-159.
郭华明,王焰新,李永敏,等.2000.用于降氟的亚粘土改性方法与吸附作用机理研究[J].环境化学,19(3):427-430.
郭亚祺,杨洋,伍新花,等.2014.煅烧的水滑石同时去除水体中的砷和氟[J].环境工程学报,8(6):2485-2491.
韩成.1986.天然沸石降氟作用的初步探讨[J].地质科学,3:268-275.
李临生,李燕,兰云军,等.2007.19F NMR的特点[J].波谱学杂志,24(3): 353-364.
李玲,朱志良,仇雁翎,等.2010.缺钙型羟基磷灰石对溶液中氟离子的吸附作用研究[J].环境科学,31(6):1554-1559.
刘昊,卢思名,刘屹,等.2015.改性氧化铝对氟的吸附性能研究[J].资源节约与保护,5:27-29.
刘金华.2013.苏打盐碱土氟分布及铝氟互作效应研究[D].长春:吉林农业大学.
刘英俊,曹励明,李兆麟,等.1984.元素地球化学[M].北京:科学出版社:481-490.
陆铮,田树奎,孙林祉,等.1990.石灰、粘土、贝壳砂改水降氟的实验研究[J].中国地方病防治杂志,5(6):339-340.
邱世保,郭兆麟,沈慧君.1993.徐州市的地方性氟中毒及其防治对策[J].地方病通报,8(2):78-82.
孙承辕,季俊峰,赵梅芳.1997.凹凸棒粘土的除氟作用研究[J].高校地质学报,3(4):400-404.
王德滋,谢磊.2012.光性矿物学[M].北京:科学出版社:60-62.
王洪涛,刘连文.2002.高岭石胶体的降氟作用机理[J].南京大学学报,38(6):855-859.
王洪涛,季峻峰,刘连文.2002.蒙脱石降氟作用的实验研究[J].岩石矿物学杂志,22(1):71-77.
王焰新,郭华明,袁曦明.1999.利用某些天然岩土材料降氟的实验研究[J].水处理技术,25(5):281-285.
张景荣,朱法华,陈汝秀,等.1998.江苏丰、沛、铜地区高氟地下水成因探讨[J].高校地质学报,4(2):140-146.
Amini M,Muelle K,Abbaspour K C,et al.2008.Statistical modeling ofglobal geogenic fluoride contamination in groundwaters [J].Environmental Science&Technology,42(10):3662-3668.
Ayoob S,Gupta A K,Bhat,et al.2008.A conceptual overview on sustainable technologies for the defluoridation of drinking water[J].Critical Reviews in Environmental Science and Technology,38(6):401-470.
Bell L C,Posner A M and Quirk J P.1971.The point of zero charge of hydroxyapatite and fluorapatite in aqueous solutions[J].Journal of Colloid and Interface Science,42(2):250-261.
Bhargava D S and Killedar D J.1992.Fluoride adsorption on fishbone charcoal through a moving media adsorber[J].Water Research,26(6): 781-788.
Bhatnagar A,Kumar E and Sillanpää M.2011.Fluoride removal from water by adsorption-A review[J].Chemical Engineering Journal,171(3): 811-840.
Bitton G.1998.Formula Handbook for Environmental Engineers and Scientist[M].John Wiley&Sons,New York.
Bouyarmane H,Saoiabi S,Laghzizil A,et al.2014.Natural phosphate and its derivative porous hydroxyapatite for the removal of toxic organic chemicals [J].Desalination and Water Treatment,52(37-39): 7265-7269.
Braun M and Jana C.1995.F-19 NMR spectroscopy of fluoridated apatites [J].Chemical Physics Letters,245:19-22.
Brown G E,Foster A L and Ostergren J D.1999.Mineral surfaces and bioavailability of heavy metals:A molecular-scale perspective[J].Proceedings of the National Academy of Sciences,96(7):3388-3395.
Cengeloglu Y,Kir E and Ersor M.2002.Removal of fluoride from aqueous solution by using red mud[J].Separation and Purification Technology,28:81-86.
Christoffersen J,Christoffersen M R,Arends J,et al.1995.Formation of phosphate-containing calcium fluoride at the expense of enamel,hydroxyapatite and fluorapatite[J].Caries Research,29:223-230.
De leeuw N H.2004.Resisting the onset of hydroxyapatite dissolution through the incorporation of fluoride[J].Journal of Physical Chemistry B,108(6):1809-1811.
Dorozhkin S V and Epple M.2002.Biological and Medical Significance of Calcium Phosphates[M].Angewandte Chemie International Edition,41 (17):3130-3146.
Fan X,Parker D J and Smith M D.2003.Adsorption kinetics of fluoride on low cost materials[J].Water Research,37:4929-4937.
Jiménez-Reyes M and Solache-Ríos M.2010.Sorption behavior of fluoride ions from aqueous solutions by hydroxyapatite[J].Journal of Hazardous Materials,180(1-3):297-302.
Kanno C M,Sanders R L,Flynn S M,et al.2014.Novel apatite-based sorbent for defluoridation:Synthesis and sorption characteristics of Nano-micro-vrystallinehydroxyapatite-coated-limestone[J].Environmental Science&Technology,48(10):5798-5807.
Kumar E,Bhatnagar A,Ji M,et al.2009.De fl uoridation from aqueous solutions by granular ferric hydroxide(GFH)[J].Water Research,43: 490-498.
Liang L,He J,Wei M,et al.2007.Treatment of high fluoride concentration water by Mg Al-CO3layered double hydroxides:kinetic and equilibrium studies[J].Water Research,41:1534-1542.
Mahramanlioglu M,Kizalcikli I and Bicer I O,2002.Adsorption of fluoride from aqueous solution by acid treated spent bleaching earth[J].Journal of Fluorine Chemistry,115:41-47.
Mohapatra M,Rout K,Gupta S,et al.2010.Facile synthesis of additiveassisted Nano-goethite powder and its application forfluoride remediation[J].Journal of Nanoparticle Research,12:681-686.
Mohammed N R,Kent N W,Lynch R J M,et al.2013.Effects of fluoride on in vitro enamel demineralization analyzed by 19 F MAS-NMR [J].Caries Research,47:421-428.
Mueller F,Zeitz C,Mantz H,et al.2010.Elemental depth profiling of fluoridated hydroxyapatite:saving your dentition by the skin of your teeth?[J].Langmuir,26(24):18750-18759.
Nelson K G and Higuchi W I.1969.Mechanism of fluoride uptake by hydroxyapatite from acidic fluoride solutions: I. theoretical considerations[R].The 46th annual Meeting of the IADR,San Francisco,California,USA.
Poinern,Gérrard E J,Ghosh,et al.2011.Defluoridation behavior of nanostructured hydroxyapatite synthesized through an ultrasonic and microwave combined technique[J].Journal of Hazardous Materials,185 (1):29-37.
Rubel J R and Dale W R.1979.The removal of excess fluoride from drinking water by activated alumina[J].American Water Works Association,71 (1):45-49.
Singh K,Lataye D H,Wasewar K L,et al.2013.Removal of Fluoride from aqueous solution:status and techniques[J].Desalination and Water Treatment,51(16-18):3233-6247.
Smith M C,Lanze E M and Smith H V.1931.The cause of mottled enamel [J].Science,74(1914):244-244.
Spinelli M A,Brudevold F and Moreno E.1971.Mechanism of fluoride uptake by hydroxyapatite[J].Archives of Oral Biology,18(3):187-203.
Srimurali M,Pragathi A and Karthikeyan J.1998.A study on removal of fluoride from drinking water by adsorption on low cost materials[J].Environment Pollution,99(2):285-289.
Sternitzke V,Kaegi R,et al.2012.Uptake of fluoride from aqueous solution on Nano-sized hydroxyapatite:examination of a fluoridated surface layer [J].Environmental Science&Technology,46(2):802-809.
Sunchanek,Wojciech,Yoshimura,et al.1998.Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants[J].Journal of Materials Research,13(1):94-117.
Tor A.2006.Removal of fluoride from an aqueous solution by using montmorillonite[J].Desalination,201:67-276.
Viswanathan N and Meenakshi S.2010.Selective fluoride adsorption by a hydrotalcite/chitosan composite[J].Applied Clay Science,48:607-611.
Wang H T,Chen J,Cai Y F,et al.2006.Defluoridation of drinkingwater by Mg/Al hydrotalcite-like compounds and their calcined products[J].Applied Clay Science,35(1-2):59-66.
WHO(World Health Organization).2006.Guideline for Drinking Water Quality[R].First Addendum to third Edition,1:375-377.
Yang M,Hashimoto T,Hoshi N,et al.1999.Fluoride Removal in a Fixed Bed Packed with Granular Calcite[J].Water Research,33(16): 3395-3402.
Young K U and Chiou H W.2001.The Adsorption of Fluoride Ion from Aqueous Solution by Activated Alumina[J].Water,Air,& Soil Pollution,133(1-4):349-361.
中图分类号:P599
文献标识码:A
文章编号:1006-7493(2016)02-0289-10
DOI:10.16108/j.issn1006-7493.2016007
Corresponding author:WANG Hongtao,Associate Professor;E-mail:htwang@nju.edu.cn LI Wei,Professor;E-mail:Liwei_isg@nju.edu.cn
收稿日期:2016-01-22;修回日期:2016-03-12
基金项目:江苏省杰出青年基金(SBK2015010225)资助
作者简介:任超,男,1993年生,博士研究生,环境地球化学方向;E-mail:dz1529015@smail.nju.edu.cn;
*通讯作者:王洪涛,副教授;E-mail:htwang@nju.edu.cn;李伟,教授;E-mail:Liwei_isg@nju.edu.cn
Macroscopic and Spectroscopic Study on Fluoride Sorption by HAP
REN Chao,WANG Hongtao*,JI Junfeng,LI Wei*
1.Key Laboratory of Surficial Geochemistry Ministry Education,School of Earth Sciences and Engineering,Nanjing University,Nanjing 210023,China
Abstract:Geologic fluoride pollution is a worldwide environmental problem,as numerous countries and regions are facing problems that drinking water contains excess F concentration.In this research,we adopted low-cost non-metal mineral hydroxyapatite(HAP)as adsorbent to study the geochemical behavior and mechanism of F adsorption as a function of reaction time,pH,and initial F concentration.After 48 hours,the reaction reached equilibrium and yielded a maximum adsorption amount of 21.6 mg/g at pH 6 through regression analysis using Langmuir equation.To further understand the mechanisms of F adsorption on HAP,we employed advanced geochemical approaches,such as XRD,SEM,HR-TEM,and19F solid state NMR,to characterize the sorption products before and after reaction.It can be concluded that formation of F-Hap(s)solid-solution is the dominant mechanism at high F initial concentration(>10 ppm).This study demonstrates that hydroxyapatite is a good candidate material for fluoride removal.
Key words:hydroxyapatite;fluoride;adsorption;NMR;TEM
