小动物实验用镁锰合金颈椎植入物制备及其可行性研究*
2016-07-25耿芳姜明威夏天
耿芳 姜明威 夏天*
论著·实验研究
小动物实验用镁锰合金颈椎植入物制备及其可行性研究*
耿芳1姜明威2夏天2*
目的应用镁锰合金材料制备用于小动物实验的颈椎植入物,验证表面处理对合金抗腐蚀能力的改进,并分析其用于小动物实验的可行性。方法根据新西兰兔颈椎解剖设计镁锰合金(Mg-1.3Mn)颈椎植入物,应用微弧氧化方法在镁合金表面制备含硅生物活性涂层。体外使用人工组织液浸泡,观察降解情况。体内实验将经表面处理的镁锰合金植入物及同尺寸未经表面处理的镁锰合金植入物、钛合金植入物植入兔颈椎椎体,观察不同时间植入物的体内降解情况。结果镁锰合金颈椎植入物制备成功,表面改性后其抗腐蚀性能明显提高,经手术成功固定于兔颈椎椎体上,与未经表面改性的镁锰合金植入物相比,体内、体外的降解速度均显著降低,扫描电镜及能谱分析等结果表明表面改性的镁锰合金抗腐蚀性有较大改善。结论镁锰合金颈椎植入物可用于小动物颈椎部位实验,适当的表面处理能够有效改进合金的抗腐蚀性能。
镁锰合金;微弧氧化;颈椎;动物实验
骨科内植物是现代骨外科不可或缺的一部分,为减少内植物体内存留或无需二次手术取出给病人带来的痛苦和心理负担,研究者们一直以来都在探寻可降解的替代材料[1,2]。由于表面改性工艺的不断改进,镁及镁基合金作为一种重要的候选材料受到重视[3,4]。近年来,基于纯镁及镁锌、镁钙合金的骨科植入物的安全性已得到初步的证实[5],并已有少数新型的镁合金植入物准备或已开始应用于临床[6-8]。
目前研究或临床使用的镁合金骨科内植物主要应用于四肢关节,而脊柱外科领域并未有相关的研究。颈椎前路融合手术中常用的钛合金接骨板存在应力遮挡,并有导致食管并发症的风险,而此类材料由于二次手术的风险,一般终身存留于患者体内,也给部分病人带来较多的心理负担[9]。因此,临床上确实需要具有合适强度的可降解的镁合金颈椎接骨板[10,11]。由于颈椎周围存在有气管食管、椎间盘以及神经等重要组织,镁合金降解过程中形成高镁环境及氢气对邻近组织脏器的影响需要进一步的研究[12,13],因此有必要设计能用于小动物(如实验动物兔)的颈椎植入物供前期研究,为包括镁锰合金在内的镁合金颈椎接骨板的研制提供可行的实验方法和理论基础。
本研究根据新西兰兔解剖特点,设计并制备适用于小动物实验的镁锰合金颈椎植入物,经表面改性后植入实验动物体内,分析该植入物用于小动物实验的可行性,并观察表面改性对其体内、体外抗腐蚀性能的改进作用。
1 材料与方法
1.1 医用镁锰合金颈椎内植物设计与加工
选用镁锰合金(Mg-1.3Mn)及钛合金(Ti6Al4V)材料,使用雕刻机(Carver_S600A RT)加工成所需的颈椎植入物,经表面去油等超声清洗干净后,在含硅溶液中使用专用的微弧氧化设备在500V电压下进行表面处理5分钟,制备含硅生物活性涂层,经过纯净水清洗后,进行环氧乙烷的灭菌处理,动物实验备用。使用未灭菌的样品在OUTLAB电化学工作站上测试获得镁锰合金的循环动电位极化曲线以测试表面改性是否带来合金抗腐蚀能力的改进。另外,应用不锈钢制备相应的开口和把持工具用于手术。
1.2 体外降解实验方法
将镁锰合金和钛合金植入物分别放置于培养皿中,以PBS液浸没。浸泡环境恒定为气温11.3℃,湿度21.2%,气压1.02×105Pa;降解的反应方程式为:Mg+2H2O=Mg(OH)逐日观察降解情况,并收集产生的气体,记录气体量。
1.3 动物实验方法
动物实验过程符合ISO10993-2标准,由上海交通大学附属第一人民医院伦理委员会批准。实验动物选取18月龄雄性清洁级新西兰兔,体重2.2~2.7kg,共40只,分为4组:假手术组1组,共4只;手术组3组,每组12只,分别植入经表面处理的镁锰合金植入物、未经表面处理的镁锰合金植入物和钛合金植入物。采用1%戊巴比妥钠静脉麻醉,剂量为3mL/kg。麻醉成功后取仰卧位固定于手术台,颈部后仰。颈前部皮肤剃毛,安尔碘消毒,铺手术巾。于甲状软骨下缘水平作正中切口,长约3.5cm,逐层切开皮肤及皮下组织,分离浅层肌肉暴露气管。将气管食管鞘牵向一侧,暴露颈长肌,注意避免损伤颈内血管并避免刺激迷走神经。于颈长肌间钝性分离至颈椎椎体,并用骨膜剥离子暴露椎体骨质。假手术组用缝线标记。手术组用专用钻头于椎体上开孔,拧入植入物。缝合手术切口。术后1~3天青霉素钠40万单位肌肉注射抗感染。兔在无其他支持措施的情况下允许在笼中自由活动。术后1、3、6、12周应用X线摄片和计算机断层扫描(CT)观察植入物降解情况。
1.4 植入物表面的扫描电镜观察及成分分析
制成样品经体外、体内实验应用后的样品经超声清洗30分钟清除表面组织,于空气中干燥后于扫描电镜下观察。应用能谱分析(EDAX Genesis;加速电压:15KV)了解合金表面元素构成及比例。
1.5 统计方法
计量数据以“均值±标准误”表示。组间比较采用单因素方差分析(one-wayANOVA)。采用SPSS17.0软件进行统计学分析,以认为差异有统计学意义。
2 结果
2.1 兔颈椎植入物设计及制备
根据成年新西兰兔解剖尺寸及实验需要设计旋入式颈椎植入物(图1,C、D彩图见插页),由板体和螺钉两部分组成:板体为椭圆形,长径8.0mm,短径5.5mm,厚1.5mm,设有两孔作把持用,孔径1.5mm;螺钉部分长4.0mm,直径3.0mm,螺纹深度1.1mm,螺距1.0mm。植入物形状如图1所示。扫描电镜观察可见经表面改性的镁锰合金表面为带有微孔的涂层完全覆盖,孔径1~8 m,大小不一。能谱分析显示表面涂层主要由O、Mg、Si、Na等元素构成。循环动电位极化曲线的对比表明,经表面处理的镁锰合金的动电位提高显著,提示表面改性可以显著提高合金的抗腐蚀性能。
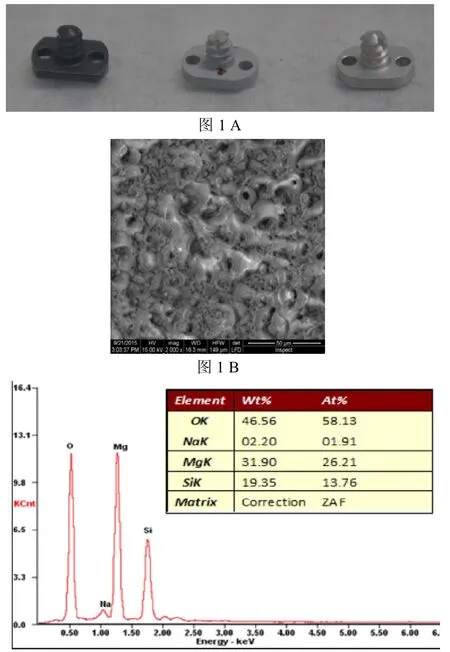
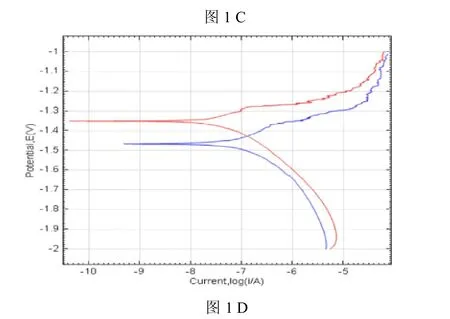
图1 植入物设计制造及表面改性检测。A内植物实物图,由左向右依次为钛合金,经表面改性的镁锰合金,镁锰合金;B扫描电镜观察经改性的镁锰合金表面(×2000);C能谱分析显示镁锰合金表面主要由O、Mg、Si、Na元素构成;D表面改性前后镁锰合金表面循环动电位极化曲线比较,蓝色为未表面改性样品、红色为经表面改性样品
2.2 体外降解实验结果
经6周浸泡,未经表面改性的镁锰合金植入物产生大量气体,达(9.07±0.06)mL,植入物表面腐蚀明显,覆盖大量松散的氧化沉积物(图2A);经表面改性的植入物产生气体较少,为(1.47±0.15)mL,每个观测时点的气体析出量均较未经表面改性者少(图2 B),植入物降解速度明显慢于未表面改性者,植入物外形完整,仅小部分降解,表面未见明显的点状腐蚀区;钛合金植入物经浸泡无气体产生,表面亦无明显变化。根据最终产生氢气量、反应化学方程式及合金材料的初始质量计算,表面处理组平均质量减少约(1.29±0.13)%,显著少于表面未处理组(8.03±0.02)经过表面处理的镁锰合金在体外实验中抗腐蚀性能显著优于未经表面改性者。

图2 不同材质颈椎植入物体外降解情况(浸泡环境:恒定气温11.3℃,湿度21.2%,气压1.02×105Pa;反应方程式为:Mg+2H2O=Mg(OH)2↓+H2↑)。A从左至右依次为浸泡实验完成后的钛合金植入物、表面未处理镁合金植入物、表面处理镁合金植入物;B不同材质植入物产生气体量的比较
2.3 动物实验结果
应用专门的开孔器械和把持器,可以将颈椎植入物固定于兔颈椎椎体上。手术后兔可正常存活,进食及运动功能正常。手术后1、6、12周行X线摄片见植入物无明显移位;未表面改性的镁锰合金植入物密度逐渐降低,至12周时完全降解,经表面改性者及钛铝合金植入物影始终存在(图3);处死动物后,分离植入物周围组织,见镁锰合金植入物未发生明显移位或松动,经表面改性的镁锰合金植入物表面被新生钙化组织覆盖。
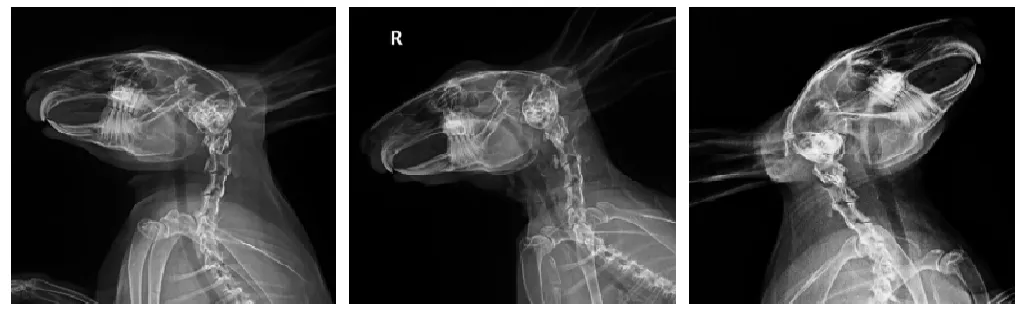
图3 经表面处理的镁合金植入物手术部位术后1、6、12周的X线平片
2.4 经腐蚀的镁锰合金表面扫描电镜观察结果
未经表面改性的镁锰合金在体外降解6周后,表面开始出现大片的腐蚀区,并有大量的氧化物沉积,经表面改性者则无明显腐蚀,SEM观察到其表面多孔层依然清晰可辨。植入体内的镁锰合金植入物降解速率均慢于体外,未经表面处理者表面无明显沉积物,但表面腐蚀明显;经表面改性者尽管微孔结构消失,但总体腐蚀不明显(图4)。

图4 镁锰合金颈椎植入物表面扫描电镜观察(×500)。体外降解8周后,经表面处理的镁锰合金植入物(A)表层微孔结构保持完好,未经表面处理者(B)则出现显著的腐蚀,并有大量氧化物晶体形成。植入动物体内12周后,经表面处理的镁锰合金植入物(C)腐蚀程度亦远小于未经表面处理者(D)
3 讨论
能够适用于临床的理想的镁合金材料应当不含有对人体有害的元素,并应具有良好的加工性能以及合适的刚度和强度。值得注意的是,目前研究较多的纯镁及镁钙合金在强度上不能完全符合加工和临床的需要。而镁锌合金中多数含有铝元素,对人体存在潜在的危害,另有一些镁基合金材料为改善其加工性能,添加了一些稀土族元素,后者在人及动物体内并非常规存在且成本较高[7]。本研究应用的镁锰合金仅含有镁、锰及其他少量人体内存在的元素,并具有良好加工性能和强度,抗拉强度≥330MPa,屈服强度≥300MPa,延伸率≥6%,是一种较为合适的候选材料,因此有必要对其进行进一步的研究。
微弧氧化法是镁合金常用的表面改性方法,可以在植入物表面形成致密氧化层,使之陶瓷化,其他常见的表面改性方法包括纳米磷灰石包裹及转化膜等,这些表面改性的目的均是为了达到延缓并控制材料腐蚀的性能[14]。在本研究中,应用微弧氧化法对镁锰合金材料进行表面改性,同样达到了此目的。扫描电镜可以清楚的观察到覆盖于植入物表面的多孔氧化层,其中主要含有O、Na、Si等元素;电化学测试结果显示表面改性层大大降低了镁锰合金的降解速度;无论是经过6周的体外浸泡,还是最长3个月的体内降解,这种表面改性层仍较为完整的存在。
溶液的pH值对镁及镁合金材料的腐蚀行为影响很大[15],观察镁合金材料体外的腐蚀行为,需将其浸泡于缓冲液中以模拟体内相对恒定的pH值[16,17],但由于降解过程中其表面会形成氧化物及钙盐沉积,直接测定质量损耗是较为困难和不准确的。根据化学反应方程式,其析出气体的成分则单纯为氢气,因此本研究选择观察析出氢气量间接反映出镁合金材料的腐蚀程度。
本研究试制的颈椎内植物根据实验动物兔的颈椎骨骼尺寸设计,可以通过手术顺利的植于兔的颈椎椎体,固定可靠,在不限制兔正常活动的情况下,未出现松动、移位等情况。该植入物为一体成型,无需多个组件安装,简单方便,并避免了植入件间相互摩擦可能对植入物表面造成的损坏。小动物的实验成本较低,作为前期实验,此种植入物可以用于研究其安全性并观察表面改性的可靠性。但实验动物兔无论在尺寸、解剖,还是姿势上与人相差较大,并且因工艺所限,制造适用于生物力学研究的微小植入物具有较大的困难。因此,在初步证明其安全性的基础上,需要设计适用于人或大型实验动物的植入材料进行进一步研究。
本研究设计的颈椎植入物用于兔的动物实验是可行的,可作为今后类似植入物制造的参考;无论在体内还是体外,表面改性可以显著延缓镁锰合金的降解速度,可用于未来适合临床应用的镁锰合金骨科内植物的研发。而镁合金本身具有一定的成骨诱导和抗菌性能,本研究亦发现体外浸泡后镁锰合金表面出现钙沉积。未来可以利用此性质进一步开发具有特殊功能的骨科假体材料。
[1]Ratna Sunil B,Sampath Kumar TS,Chakkingal U,et al.In vitro and in vivo studies of biodegradable fine grained AZ31 magnesium alloy produced by equal channel angular pressing[J].Mater Sci Eng C Mater Biol Appl,2016,1,59:356-367.
[2]井永斌,庄金鹏,闫景龙,等.生物可降解镁合金在心血管和骨科的研究进展[J].生物骨科材料与临床研究,2013,10(2):28-30.
[3]Razavi M,Fathi M,Savabi O,et al.In vivo assessments of bioabsorbable AZ91 magnesium implants coated with nanostructured fluoridated hydroxyapatite by MAO/EPD technique for biomedical applications[J].Mater Sci Eng C Mater Biol Appl,2015,48: 21-27.
[4]Jang Y,Tan Z,Jurey C,et al.Understanding corrosion behavior of Mg-Zn-Caalloys fromsubcutaneous mousemodel:effect ofZnelement concentration and plasma electrolytic oxidation[J].Mater Sci Eng C Mater Biol Appl,2015,48:28-40.
[5]Qu Y,Kang M,Dong R,Liu J,Liu J,Zhao J.Evaluation of a new Mg-Zn-Ca-Y alloy for biomedical application[J].Journal of materials science Materials in medicine,2015,26(1):5342.
[6]Zhou P,Gong HR.Phase stability,mechanical property,and electronic structure of an Mg-Ca system[J].J Mech Behav Biomed Mater,2012,8:154-164.
[7]Seitz JM,Durisin M,Goldman J,et al.Recent advances in biodegradable metals for medical sutures:a critical review[J].Adv Healthc Mater,2015,16,4(13):1915-1936.
[8]张芳.生物医用镁合金专利技术发展综述[J].生物骨科材料与临床研究,2015,12(1):72-75.
[9]Yeung KW,Wong KH.Biodegradable metallic materials for orthopaedicimplantations:Areview[J].TechnolHealthCare,2012.[Epub ahead of print]
[10]Brooks EK,Der S,Ehrensberger MT.Corrosion and mechanical performance of AZ91 exposed to simulated inflammatory conditions[J].Mater Sci Eng C Mater Biol Appl,2016,60:427-436.
[11]Gong H,Wang K,Strich R,et al.In vitro biodegradation behavior, mechanical properties,and cytotoxicity of biodegradable Zn-Mg alloy[J].J Biomed Mater Res B Appl Biomater,2015,103(8): 1632-1640.
[12]Ma J,Zhao N,Zhu D.Biphasic responses of human vascular smooth muscle cells to magnesium ion[J].J Biomed Mater Res A, 2016,104(2):347-356.
[13]Guan RG,Cipriano AF,Zhao ZY,et al.Development and evaluation of a magnesium-zinc-strontium alloy for biomedical applications--alloy processing,microstructure,mechanical properties, and biodegradation[J].Mater Sci Eng C Mater Biol Appl,2013,33(7):3661-3669.
[14]Ma WH,Liu YJ,Wang W,et al.Improved biological performance of magnesium by micro-arc oxidation[J].Braz J Med Biol Res, 2015,48(3):214-225.
[15]Inoue H,Sugahara K,Yamamoto A,et al.Corrosion rate of magnesium and its alloys in buffered chloride solutions[J].Corros Sci,2002,44(3):603.
[16]Witecka A,Bogucka A,Yamamoto A,et al.In vitro degradation of ZM21magnesium alloyinsimulated bodyfluids[J].Mater SciEng C Mater Biol Appl,2016,65:59-69.
[17]Zeng RC,Qi WC,Zhang F,et al.In vitro corrosion of pure magnesium and AZ91 alloy-the influence of thin electrolyte layer thickness[J].Regen Biomater,2016,3(1):49-56.
Development and feasibility of Mg-Mn alloy cervical implant for small animal experiments
Geng Fang1,JiangMingwei2,XiaTian2.1 ShanghaiMicroPortOrthopedicsCo.,Ltd,Shanghai,201203;2 Department of Orthopedics,Shanghai General Hospital,Shanghai,201620,China
Objectives Toverifytheimprovement of corrosionresistantabilityafter surface modificationanditsfeasibility for small animal experiment of a newly developed magnesium-manganese(Mg-Mn)alloy cervical implants.Methods A new kind of Mg-Mn alloy(Mg-1.3Mn)cervical implants were designed according to the anatomy features of New Zealand rabbit.Micro arc oxidation(MaO)was used for the implants’surface modification,in order to prepare the silicious bioactive coating.The corrosion in vitro was observed by immersing implants into artificial tissue fluid.Then the implants with and without surface modification were implanted in the cervical vertebrae of the New Zealand rabbit by surgery.The corrosion of the implants at different time was observed by scanning electron microscope(SEM).Results The Mg-Mn alloy implants were successfully developed and their electrochemical properties were notably improved after surface modification.Implants were fixed to the rabbit’s vertebral bodies.The corrosion rate of the implants with surface modification,compared with those without,was significantly slowed down both in vivo and in vitro,and the corrosion resistant ability was obviously improved,proved by SEM and EDX,etc.Conclusion Mg-Mn alloy cervical implants can be used in small animal experiments and proper surface modification can improve the alloy’s corrosion resistant ability effectively.
Magnesium-Manganese Alloy;Micro-Arc Oxidation;Cervical Vertebrae;Animal Experiment
R318
A
10.3969/j.issn.1672-5972.2016.05.002
swgk2016-05-00098
耿芳(1977-)女,博士,高级工程师。研究方向:生物医用材料及医疗器械研发。
*[通信作者]夏天(1981-)男,硕士,主治医师。研究方向:脊柱外科临床与基础研究。
2016-05-08)
消息·会讯
上海市自然科学基金青年项目(13ZR1459800)
1上海微创骨科医疗科技有限公司,上海201203;2上海市第一人民医院,上海201620
