艾塞那肽对高糖诱导的心肌细胞损伤的保护作用机制探讨*
2016-07-25骆晓艳鲍翠玉
骆晓艳,周 宇,鲍翠玉
(1.湖北科技学院药学院,湖北 咸宁 437100;2.湖北科技学院护理学院)
艾塞那肽对高糖诱导的心肌细胞损伤的保护作用机制探讨*
骆晓艳1,周宇1,鲍翠玉2*
(1.湖北科技学院药学院,湖北 咸宁 437100;2.湖北科技学院护理学院)
摘要:目的 探讨艾塞那肽对高糖诱导的心肌细胞损伤的保护作用及其可能的作用机制。方法 将培养48h的原代心肌细胞分为5个组:正常组、模型组、小剂量组(10nmol/L)、大剂量组(20nmol/L)、甘露醇组,培养24h后,用western blot检测Sirt1、p-p38蛋白的表达、ELISA测肿瘤坏死因子-a,白介素-6等炎症因子。结果 模型组Sirt1的表达量低于正常组,p-p38的表达量高于正常组,给予艾塞那肽处理后,Sirt1蛋白的表达明显高于模型组,p-p38的表达量低于模型组,但仍然高于正常组。甘露醇组的蛋白表达量与正常组相比无统计学差异。结论 艾塞那肽对高糖诱导的心肌细胞的炎性损伤有保护作用,其保护作用可能是通过调节Sirt1、p-p38蛋白的表达量来发挥作用的。
关键词:艾塞那肽;高糖;Sirt1;p-p38;心肌细胞
糖尿病心肌病是一种独立于其他的心脏疾病,发生于糖尿病患者特异性的疾病,它以心脏的收缩、舒张功能障碍为主要特征,最终导致心力衰竭。糖尿病心肌病的发病机制还未完全阐明,研究发现炎症反应在糖尿病心肌病的发生发展中扮演着重要的角色。艾塞那肽是一种与天然的GLP-1有高度同源性的GLP-1受体激动剂,是一种新型的糖尿病治疗药物。近几年越来越多的研究发现艾塞那肽不仅具有降血糖作用,而且对糖尿病心血管疾病的并发症也有作用:艾塞那肽可以通过抑制炎症反应来发挥抗糖尿病心肌病的作用,但其具体的作用机制还需要进一步探讨。我们通过实验,观察艾塞那肽对Sirt1、p-p38蛋白表达,IL-6、TNF-a的含量的影响,来探究其抗炎的作用及作用机制。
1材料与方法
1.1实验动物出生0~3d的新生SD乳鼠(购自于武汉大学实验动物中心)30只。主要试剂:艾塞那肽(exendin-4)购于sigma公司,Sirt1一抗购自于CST公司,Gibcol胎牛血清,ELISA试剂盒,DMEM培养基。
1.2方法
1.2.1心肌细胞的培养用75%的酒精给乳鼠身体表面消毒,用手术弯剪取乳鼠的心尖部分置于预冷的D-hank′s液中,洗去污血。用眼科剪剪去心脏周围的血管和组织,将心脏组织剪成1mm3大小,用胰酶和二型胶原酶混合消化多次,收集上清液于10%的培养液中终止消化,1000rpm,离心5min,弃去上清液,获得细胞沉淀,采用差速贴壁的方法纯化心肌细胞,将纯化的心肌细胞用20%的培养液培养48h。
1.2.2模型的建立及分组将分离的乳鼠原代心肌细胞培养48h后首度换液,在倒置显微镜下观察细胞的长势,待细胞融合至90%时,将细胞分成六组分别给予以下处理:正常组(DMEM培养基),模型组(DMEM培养基+24.5mmol/L的葡萄糖溶液),小剂量组(模型组+exendin-4,10nmol/L),高剂量组(模型组+exendin-4,20nmol/L),对照组(DMEM培养基+24.5mmol/L的甘露醇),以上细胞均继续培养24h,进行以下指标的测定。
1.2.3炎症因子IL-6和TNF-a含量的测定用ELISA试剂盒测收集到的细胞培养液,严格按照说明书操作,用酶标仪在450nm波长测量各孔的吸光度,根据标准曲线,计算出IL-6和TNF-a含量,用来判断高糖诱导下的心肌细胞内炎症因子水平的变化。
1.2.4乳鼠心肌细胞内Sirt1、p-p38蛋白水平的测定采用western blot测定细胞内Sirt1、p-p38蛋白的表达水平,用Sirt1与b-actin的蛋白条带的灰度值比值,p-p38 和p38蛋白条带的灰度值比值来比较Sirt1、p-p38蛋白的表达水平。
1.3统计学分析以上指标的测定均重复三次,数据用SPSS 17.0 统计软件处理,计量资料以均数±标准差表示,组间差异用两样本均数的t检验进行比较,两组以上比较采用单因素方差分析作统计学处理。P<0.05为差异有显著性,P<0.01为差异有极显著性。
2结果
2.1炎症因子含量的变化
2.1.1IL-6含量的变化与正常组比较,模型组心肌细胞内IL-6的含量明显升高(159.89±10.01,P<0.01),给予艾塞那肽大剂量组和小剂量组后,心肌细胞内的炎症因子水平下降(P<0.05),分别为131.90±10.35,122.58±11.23,见图1。
2.1.2TNF-a的含量变化与正常组相比较,模型组心肌细胞内TNF-a的含量明显升高(64.45±6.07,P<0.01),给予艾塞那肽大剂量组和小剂量组(P<0.05)后,心肌细胞内的炎症因子水平下降,分别为(46.42±7.03,P<0.05),(40.52±4.94,P<0.05),如图1。

图1 IL-6及TNF-a的含量
2.2p-p38蛋白表达量的变化图2显示,与正常组相比较,模型组心肌细胞内p-p38的含量明显升高(5.15±0.23,P<0.01),给予艾塞那肽大剂量组和小剂量组后,心肌细胞内的p-p38蛋白的表达量下降,分别为4.17±0.27,4.19±0.24(P<0.05)。
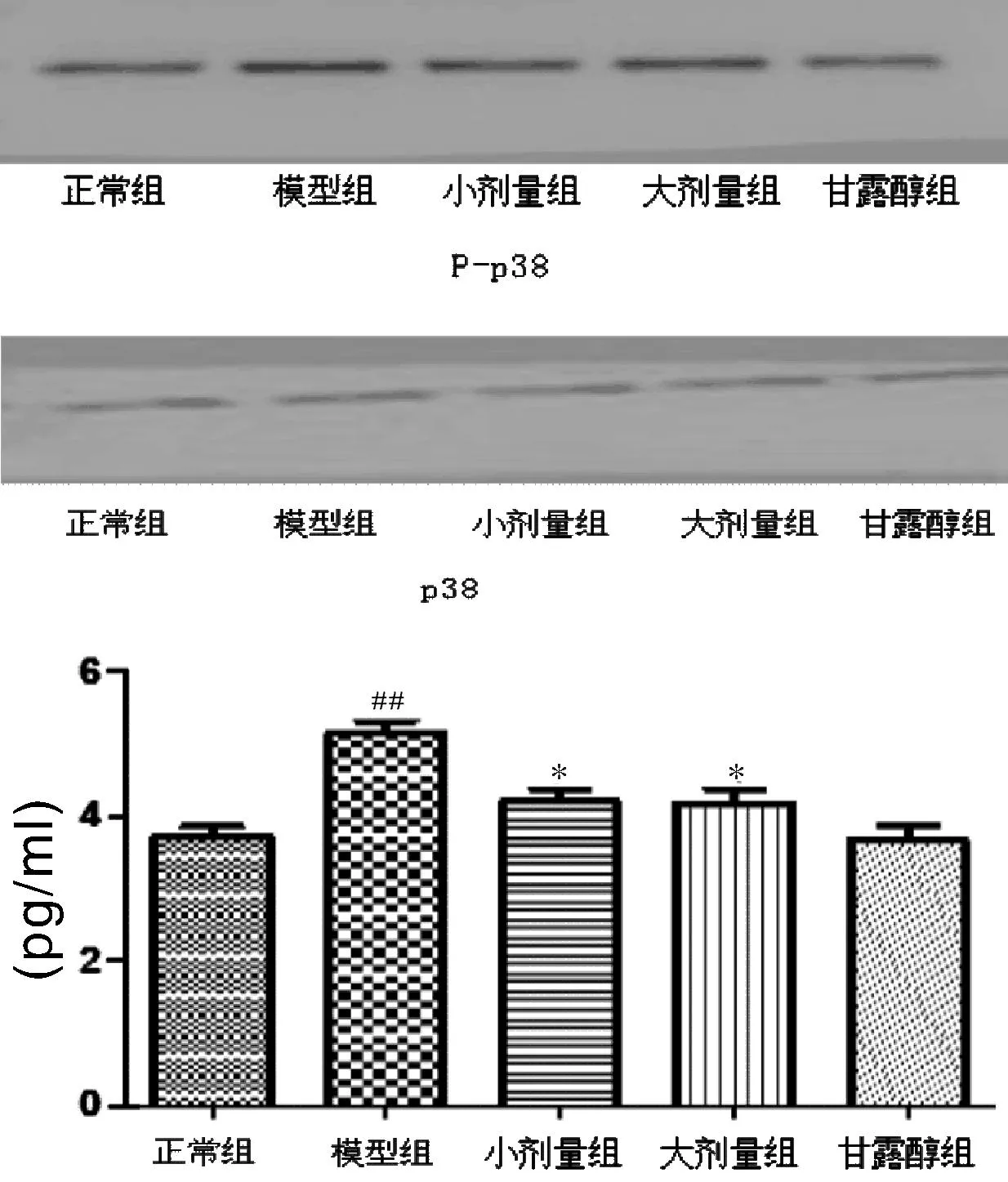
图2 p-p38蛋白表达量的变化
2.3Sirt1蛋白表达量的变化与正常组相比较,高糖能使Sirt1蛋白的表达量减少(0.45±0.09,P<0.01),给予小剂量(0.66±0.07)和大剂量(0.73±0.04)艾塞那肽后,Sirt1蛋白的表达量明显增加(P<0.05,P<0.01),但仍低于正常组,结果如图3。
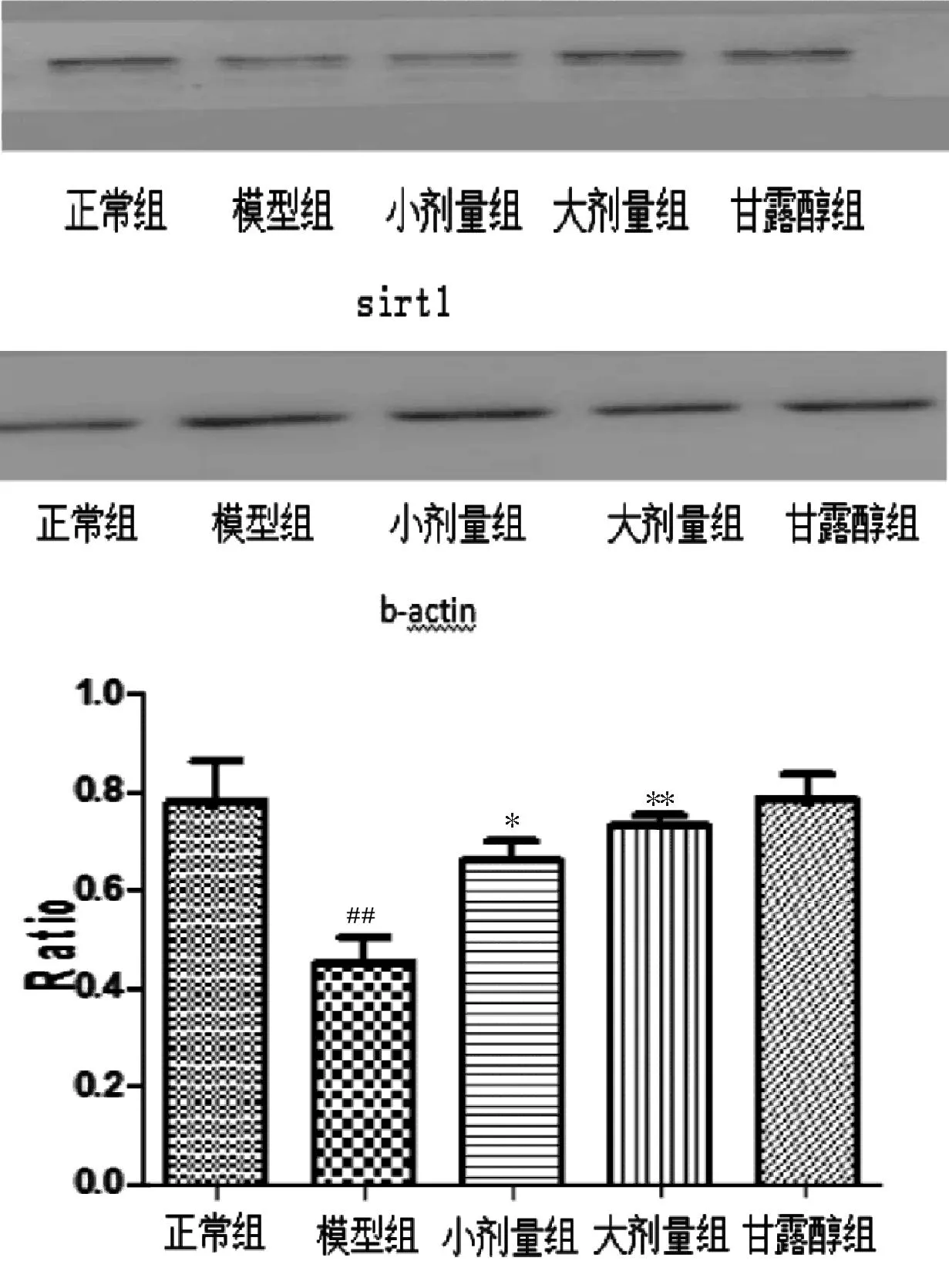
图3 Sirt1蛋白表达量的变化
3讨论
糖尿病心肌病是糖尿病主要的并发症之一,也是导致糖尿病患者死亡的主要原因。糖尿病心肌的发病机制目前还未完全阐明,但是大量的研究[1]均证明炎症反应在糖尿病心肌病的发生发展过程中起着重要的作用,糖尿病时,心肌组织中炎症细胞大量浸润,炎症因子异常表达,本实验也观察到高糖环境下,心肌细胞内的炎症因子与其他组相比其含量增加,说明高糖对心肌细胞有损伤作用。
沉默信息调节因子相关酶1(Sirt1)是酵母沉默信息调节因子2(Sir2)的哺乳动物同源体,是一种高度保守的NAD+依赖的组蛋白去乙酰化酶,属于Ⅲ类组蛋白去乙酰化酶,它可以与多种底物结合发挥抗氧化应激、促进糖、脂代谢以及抑制炎症反应等生理作用[2,3]。Sirt1在调控炎症反应中起着重要的作用,让小鼠的巨噬细胞过表达Sirt1基因,可以控制急性炎症的发生,敲除Sirt1会使炎症因子过高表达[4]。Sirt1受体的激动剂白黎芦醇可以通过增加Sirt1的表达,抑制NF-κB,从而抑制血管的炎症反应[5],这说明Sirt1的异常低表达会引发炎症反应。本实验结果表明高糖可以诱导心肌细胞内的Sirt1蛋白表达降低,同时模型组的炎症因子水平也比其他组明显升高,验证了这一论述。
P38MAPK信号通路是体内一条重要的信号传导通路,它不仅与细胞的增殖凋亡有关,也与细胞内的炎症反应有关。因此在我们的实验中,高糖环境可以使心肌细胞内的炎症因子表达增加,于此同时p-p38的表达也增加。
GLP-1是由肠L细胞分泌的一种肠促胰岛素,临床上被广泛用于治疗糖尿病;GLP-1受体不仅仅存在于胰腺组织中,而且也存在于其他的组织器官中。近年来发现GLP-1还有抗炎作用[6],能增加Sirt1的表达。通过给予艾塞那肽后我们发现:不论是大剂量组,还是小剂量组,均能明显的改善高糖所引起的炎症因子水平的高表达和Sirt1蛋白的低表达的情况,说明艾塞那肽对高糖导致的心肌细胞的炎性损伤有保护作用,可能与增加Sirt1蛋白的表达有关。
综上所述,高糖可以诱导乳鼠心肌细胞的炎性损伤,艾塞那肽可以通过下调Sirt1蛋白,上调p-p38蛋白,抑制炎症反应来减轻高糖环境下心肌细胞的损伤。
参考文献:
[1]Yuli Cai,Xiaorong Hu,Bo Yi,et al.Glucagon-like peptide-1 receptor agonist protects against hyperglycemia-induced cardiocytes injury by inhibiting high mobility group box 1 expression[J].Mol Bio Rep,2012,39(12):10705
[2]Thakur BK,Chandra A,Dittrich T,et al.Inhibition of SIRT1 by HIV-1 viral protein Tat results in activation of p53 pathway[J].Biochem Biophys Res Commun,2012,424(2):245
[3]Kuno,Hori YS,Hosoda R,et al.Resveratrol improves cardiomyopathy in dystrophin-deficient mice through SIRT1 protein-mediated modulation of p300 protein[J].J Biol Chem,2013,288(8):5963
[4]Liu TF,McCall CE.Deacetylation by SIRTl reprograms inflammation and cancer[J].Genes Cancer,2013,4(34):135
[5]Rong Guo,Baoxin Liu,Ke Wang et al.Resveratrol ameliorates diabetic vascular inflammation and macrophage infiltration in db/db mice by inhibiting the NF-κB pathway[J].Diabetes & Vascular Disease Research,2014,11(2) 92
[6]Krasner NM,Ido Y,Ruderman NB,et al.Glucagon-like peptide-1 (GLP-1) analog liraglutide inhibits endothelial cell inflammation through a calcium and AMPK dependent mechanism[J].PLoS One,2014,9(5):e97554
Protective Effect of Exenatide on High Glucose-induced Myocardial Cell Injury and its Mechanism
LUO Xiao-yan,ZHOU Yu,BAO Cui-yu
(SchoolofPharmacy,HubeiUniversityofScienceandTechnology,XianningHubei437100,China)
ABSTRACT:Objective To investigate the effect of exenatide on the myocardial cell damage induced by high glucose and explore the possible mechanism. Methods The primary cultured myocardial cells were divided into five groups: normal group,high glucose group,low-dose group(10nmol/L),high-dose group(20nmol/L) andmannitol group.Western blot was used to detect the expression of sirt1 and p-p38 after culturing for 24 hours,the levels of tumor necrosis factor-α,interleukin-6 and other inflammatory cytokines were assayed by ELISA.Results Compared with normal group,sirt1 expression level was lowered in high glucose group and p-p38 expression was increased.Compared with high glucose group,exenatide could significantly elevate sirt1 expression and decrease p-p38 protein.No significant difference was observed in protein expression beween mannitol group and normal group.Conclusion Exenatide can protect high glucose-induced myocardial cell injury in rats by up-regulation of sirt1 expression and down-regulation p-p38 expression.
KEY WORDS:Exenatide;High glucose;Sirt1;p-p38;Myocardial cell
*通讯作者,E-mail:bcy_tiaopi@126.com
中图分类号:R961
文献标识码:A
文章编号:2095-4646(2016)03-0188-03
DOI:10.16751/j.cnki.2095-4646.2016.03.0188
(收稿日期:2016-02-04)
