转化生长因子β1的关键序列筛选及鉴定
2016-07-25宗宪磊李国菊靳小雷姜笃银
宗宪磊 李国菊 靳小雷 姜笃银
·论著·
转化生长因子β1的关键序列筛选及鉴定
宗宪磊李国菊靳小雷姜笃银
【摘要】目的应用噬菌体随机12肽库,筛选转化生长因子β1(Transforming growth factor-beta1,TGF-β1)的关键序列,进行TGF-β1活性短肽的合成,并检测其与成纤维细胞的亲和力。方法以TGF-β1单克隆抗体为靶,筛选噬菌体随机12肽库,获得TGF-β1的特异性序列。进行序列比对分析,选择TGF-β1的关键序列。进行TGF-β1活性短肽的合成、纯化、修饰及免疫荧光标记。应用免疫荧光法检测TGF-β1活性短肽的成纤维细胞亲和力。结果筛选噬菌体随机12肽库,获得10个与TGF-β1相似的特异性序列。分析获得7个TGF-β1的关键序列。合成获得7个TGF-β1活性短肽,并纯化至98%,短肽的C端进行氨基化封闭,N端进行罗丹明激光染料标记。免疫荧光检测结果显示,1个TGF-β1活性短肽能够与成纤维细胞相结合。结论从噬菌体随机12肽库中筛选到TGF-β1的关键序列,1个TGF-β1活性短肽能够与成纤维细胞相结合,有望应用于促进创面愈合的相关研究。
【关键词】噬菌体随机12肽库转化生长因子β1活性短肽成纤维细胞
转化生长因子β1(Transforming growth factorbeta 1,TGF-β1)是一种多功能的生长因子,与创面愈合、胚胎发育和免疫调节密切相关,能够促进创面愈合,增加组织的抗张强度[1]。局部应用生长因子有助于促进创面愈合,但是现有的生长因子产品存在很多缺点,限制了生长因子的广泛应用。目前,寡肽和多肽的研究及应用备受瞩目,具有重要的理论意义和应用价值[2]。噬菌体随机肽库是呈现特定长度的各种不同外源性多肽的噬菌体集合物。噬菌体随机肽库涵盖性好,已广泛应用于抗原表位的模拟和蛋白质工程的改造等方面,特别是小分子活性肽的展示,可用于研制新型创面药物和受体激动剂[3]。我们在前期工作中,已从噬菌体随机12肽库中筛选获得TGF-β1的特异性序列[4-5]。本研究拟进行TGF-β1关键片段的分析和选取,进行TGF-β1活性短肽的合成,并检测其与成纤维细胞的亲和力,为TGF-β1的结构调整和生产方法开拓新的思路。
1 材料和方法
1.1主要试剂和仪器
噬菌体随机12肽库试剂盒(NEB公司,美国),TGF-β1(Peprotech公司,美国),TGF-β1单克隆抗体(R&D公司,美国),TGF-β1 ELISA试剂盒(上海Sunbio公司),D-PBS、PBS、DMEM、FBS、胰蛋白酶(Hycolone公司,美国),DMSO(Sigma公司,美国),免疫荧光检测试剂盒 (武汉博士德公司),酶标仪(Bio-Rad公司,美国),超净工作台(苏州安泰空气技术有限公司),细胞培养箱(HERAEUS公司,德国)。
1.2实验方法
1.2.1TGF-β1特异性序列筛选
以人TGF-β1单克隆抗体包被96孔板,添加噬菌体随机12肽库孵育,TBST洗板10次,洗脱缓冲液(0.2 mol/L Glycine-HCl,pH 2.2,0.1%BSA),洗脱结合的噬菌体,中和缓冲液 (1 mol/L Tris-HCl,pH 9.1),快速中和洗脱物。应用E.coli ER2738宿主菌对洗脱物进行扩增,用于下一轮筛选。同样方法对每轮的洗脱物再进行三轮筛选。对第四轮的洗脱物进行滴度测定,随机挑选噬菌体蓝斑,进行扩增,调整至2.0×1013pfu/mL。应用ELISA方法和人TGF-β1免疫测定试剂盒检测单克隆噬菌体的结合力。挑选结合力好的噬菌体,应用碘化物缓冲液法提取噬菌体DNA,送北京华大基因有限公司进行染料示踪的双脱氧法自动测序。应用核酸Blast系统检测模拟肽DNA的相似性[4-5]。 1.2.2TGF-β1关键片段分析与选取
将筛选获得的10个特异性氨基酸序列逐一与TGF-β1的氨基酸序列相对比,特异性氨基酸序列在TGF-β1蛋白中集中出现于多个部位,选取这些相对集中的氨基酸序列片段。
1.2.3TGF-β1活性短肽合成
送武汉明皓生物科技有限公司进行TGF-β1活性短肽的合成,纯化至98%,然后对短肽的C端进行氨基化封闭,对短肽的N端进行罗丹明激光染料标记。制备成冻干粉,-20℃保存。
1.2.4细胞系和培养方法
采用组织块培养法获得第3~5代正常皮肤成纤维细胞,用于实验。培养方法:应用DMEM和10% 的FBS于37℃、5%CO2条件下进行培养,所有培养基添加100 U/mL的青霉素和100 μg/mL的链霉素。1.2.5细胞结合性检测
实验共设7组:TGF-β1活性短肽组 (No.1-No. 7)。将成纤维细胞种植于24孔板,每孔1×105个细胞,应用DMEM+10%FBS的培养基培养。培养24 h后换液,应用DMEM+0.5%FBS的培养基培养,于7组中分别添加TGF-β1活性短肽(No.1-No.7,浓度为0.5 ng/mL),继续培养48 h,应用D-PBS洗涤3次,4%多聚甲醛固定0.5 h。严格按照免疫荧光检测试剂盒的操作说明进行操作。
2 结果
2.1TGF-β1特异性序列筛选
通过对噬菌体随机12肽库筛选,获得TGF-β1特异性的噬菌体模拟肽,对噬菌体DNA样本进行测序,获得10个特异性的碱基序列和氨基酸序列[4-5](表1)。
2.2TGF-β1序列分析及关键片段选取
将筛选获得的氨基酸序列与TGF-β1的氨基酸序列相对比,共发现7个相对集中的氨基酸序列片段。选取这7个氨基酸序列,进行活性短肽的合成,进一步鉴定和筛选TGF-β1的关键片段(表2)。
2.3TGF-β1活性短肽合成
完成7个TGF-β1活性短肽的合成,并纯化至98%,对TGF-β1活性短肽的C端进行氨基化封闭,增强短肽的稳定性,对短肽的N端进行罗丹明激光染料标记,用于鉴定活性短肽能否与成纤维细胞上的特异性受体相结合。制成冻干粉,-20℃保存备用。
2.4细胞结合性检测
应用7种TGF-β1活性短肽对培养的成纤维细胞进行干预,因TGF-β1活性短肽应用罗丹明激光染料进行了标记,免疫荧光检测的结果显示1种 TGF-β1活性短肽(No.2)干预的成纤维细胞能够染色,表明该段氨基酸序列为TGF-β1的关键片段(图1)。

表1 DNA测序结果Table 1 The results of DNA sequencing
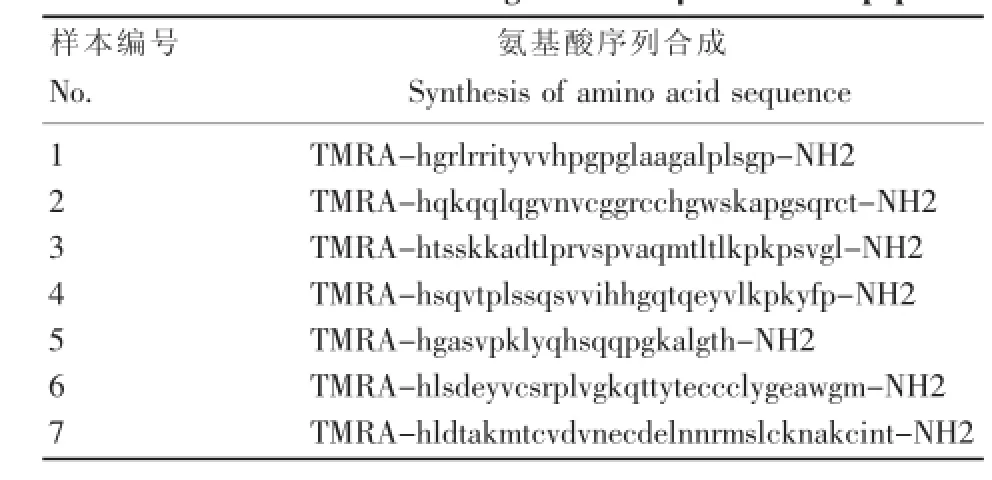
表2 TGF-β1活性短肽的序列选取和设计Table 2 The selection and design of TGF-β1 bioactive peptides

图1 TGF-β1活性短肽的免疫荧光测定(200×)Fig.1 The immunofluorescence assay of TGF-β1 bioactive peptides(200×)
3 讨论
创面愈合过程包括细胞、细胞外基质和可溶性分子之间复杂的相互作用,生长因子是其中不可或缺的因素。TGF-β1是一种促进创口缩合的重要因子,可促进成纤维细胞增殖,胶原形成和沉积,细胞外基质平衡,成纤维细胞转分化为肌纤维母细胞[6]。高压脉冲电流刺激能够增强TGF-β1的表达,促进Ⅰ胶原蛋白的合成,使创面明显缩合,从而促进创面愈合[7]。STZ诱导的糖尿病大鼠表达TGF-β1降低,局部应用TGF-β1能够促进血管再生和创面愈合[8]。创伤早期应用TGF-β1能够诱导早期上皮化,促进胶原沉积,使炎症细胞浸润减少,促进创面血管化,创面更早重塑。TGF-β1处理后的脂肪干细胞能够上调Ⅰ型胶原蛋白和MMP-1的表达,促进皮肤成纤维细胞迁移,从而促进创面愈合[9]。应用电穿孔法导入TGF-β1质粒,能够增强糖尿病模型创面的再上皮化、胶原合成和血管化,从而提高了治愈率。广谱的MMP抑制剂BB-94能够抑制TGF-β1的活性,抑制TGF-β1诱导肌纤维母细胞形成的作用,从而延缓创口缩合[10]。
局部应用生长因子有助于促进创面愈合,但是现有的生长因子产品存在很多缺点,包括:①需要应用动物载体进行生产,存在伦理学和疾病传播等问题,且产量较低,生产成本较高,导致价格昂贵;②分子量大,结构复杂,作用多样化,难以控制,至今生长因子的体内应用未获国家批准通过;③稳定性差,易受到创面局部微环境的影响,易降解失活,生物半衰期短,作用时间短,需大剂量反复应用才能达到预期的治疗效果,加重了创面损伤和患者的经济负担。这些因素限制了生长因子的广泛应用。目前,寡肽和多肽的研究及应用备受瞩目,合成的肽相对于天然蛋白,具有很多优点,包括:①分子量小,作用单一,并可进行结构调整,增强短肽的稳定性和性能;②可直接大量合成制备,生产成本较低;③不需要借助动物载体进行生产,避免了伦理学问题和疾病传播。因此,这类产品具有重要的理论意义和实际应用价值[2]。
基于上述原因,我们在前期研究工作中已应用TGF-β1单克隆抗体,从噬菌体随机12肽库中筛选获得特异性序列[4-5]。将筛选获得的氨基酸序列与TGF-β1的蛋白对比分析,发现7个相对集中的氨基酸序列,这些氨基酸序列中可能存在TGF-β1的关键片段,形成TGF-β1的空间构象,发挥其生物学作用。为了从这7个氨基酸序列中进一步筛选鉴定TGF-β1的关键片段,我们进行了活性短肽的合成。为了增强活性短肽的稳定性,对短肽的C端进行氨基化封闭。为了鉴定活性短肽能否与成纤维细胞上的特异性受体相结合,对短肽的N端进行了罗丹明激光染料标记。免疫荧光检测结果显示,第2组的成纤维细胞能够显色,表明选取的第2个氨基酸序列是TGF-β1的关键片段,形成了TGF-β1的空间构象,能够与成纤维细胞上的特异性受体相结合。在后期的实验中,需要对短肽的N端进行乙酰化封闭,进一步增强短肽的稳定性。本研究还需要进行离体细胞实验和在体动物实验,以进一步检测TGF-β1的生物学性能。
4 结论
①筛选获得了TGF-β1的关键片段,有助于了解TGF-β1的结构;②如果TGF-β1活性短肽能够产生类似于TGF-β1的生物学作用,有望用于促进创面愈合,为生长因子的结构调整和生产方法开拓新的思路,具有科学研究价值和临床应用前景。
参考文献
[1]Vaz ER,Fujimura PT,Araujo GR,et al.A short peptide that mimics the binding domain of TGF-β1 presents potent anti-
inflammatory activity[J].PLoS One,2015,10(8):e0136116.
[2]Ahmadvand D,Rasaee MJ,Rahbarizadeh F,et al.Production and characterization of a high-affinity nanobody against human endoglin[J].Hybridoma(Larchmt),2008,27(5):353-360.
[3]宗宪磊,姜景龙,姜笃银,等.应用噬菌体随机12肽库筛选TβRⅡ特异性序列[J].组织工程与重建外科,2010,6(6):323-326.
[4]刘振中,姜笃银,蔡景龙,等.转化细胞生长因子β1噬菌体模拟肽抑制瘢痕疙瘩成纤维细胞增殖的实验研究[J].中华医学杂志, 2011,91(38):2714-2718.
[5]刘振中,姜笃银,蔡景龙,等.应用噬菌体随机十二肽库筛选TGF-β1相关模拟肽的实验研究[J].山东大学报(医学版),2011,49(8): 70-73.
[6]Gutiérrez J,Droppelmann CA,Contreras O,et al.RECK-mediated β1-integrin regulation by TGF-β1 is critical for wound contraction in mice[J].PLoS One,2015,10(8):e0135005.
[7]Jeon JK,Park SK,Lee JH.Effects of high voltage pulsed current stimulation with a visible contraction intensity on expression of TGF-β1 and synthesis of typeⅠ collagen in wound-induced white rats[J].J Phys Ther Sci,2015,27(5):1485-1490.
[8]Okizaki S,Ito Y,Hosono K,et al.Suppressed recruitment of alternatively activated macrophages reduces TGF-β1 and impairs wound healing in streptozotocin-induced diabetic mice[J]. Biomed Pharmacother,2015,70:317-325.
[9]Cho JW,Kang MC,Lee KS.TGF-β1-treated ADSCs-CM promotes expression of type I collagen and MMP-1,migration of human skin fibroblasts,and wound healing in vitro and in vivo [J].Int J Mol Med,2010,26(6):901-906.
[10]Mirastschijski U,Schnabel R,Claes J,et al.Matrix metalloproteinase inhibition delays wound healing and blocks the latent transforming growth factor-beta1-promoted myofibroblast formation and function[J].Wound Repair Regen,2010,18(2):223-234.
【中图分类号】Q813.1+1
【文献标识码】A
【文章编号】1673-0364(2016)03-0156-04
doi:10.3969/j.issn.1673-0364.2016.03.003
基金项目:国家自然科学基金资助项目(30772258,81201467);山东省自然科学基金项目(ZR2011HM027)。
作者单位:100144北京市中国医学科学院北京协和医学院整形外科医院(宗宪磊,靳小雷);250014山东省济南市山东大学口腔医学院放射科 (李国菊);250033山东省济南市山东大学第二医院美容整形烧伤外科、急诊科,山东大学组织工程研究所(姜笃银)。
通讯作者:靳小雷(E-mail:jinyuyizxyy@126.com);姜笃银(E-mail:jdybs2@vip.163.com)。
收稿日期:(2016年3月6日;修回日期:2016年4月28日)
The Biopanning and Appraisal of Key Sequence of Transforming Growth Factor-beta 1
ZONG Xianlei1,LI Guojv2, JIN Xiaolei1,JIANG Duyin3.1 Plastic Surgery Hospital,Chinese Academy Medical Sciences,Beijing 100144,China;2 Department of Radiology,School of stomatology,Shandong University,Jinan 250012,China;3 Department of Plastic and Burn Surgery,and Emergency,The Second Hospital of Shandong University,Institute of Tissue Engineering of Shandong University,Jinan 250033,China.Corresponding author:JIN Xiaolei(E-mail:jinyuyizxyy@126.com);JIANG Duyin(E-mail: jdybs2@vip.163.com).
【Abstract】ObjectiveTo isolate key sequences from a phage display 12-mer peptide library,synthesize transforming growth factor-beta1(TGF-β1)bioactive peptides and evaluate the fibroblasts affinity of TGF-β1 bioactive peptides. MethodsUsing monoclonal anti-human TGF-β1 antibody as the target,a phage display 12-mer peptide library was screened and target sequences were isolated.The key sequences of TGF-β1 were chosen.The key sequences were then modified to generate TGF-β1 bioactive peptides.Immunofluorescence assay was performed to evaluate the fibroblasts affinity of TGF-β1 bioactive peptides.ResultsTen peptides similar to TGF-β1 were isolated from a phage display 12-mer peptide library.Seven key sequences of TGF-β1 were chosen and then modified to generate TGF-β1 bioactive peptides.TGF-β1 bioactive peptides were then purified to reach a purity of 98%.The C terminal of TGF-β1 bioactive peptides was closed,and the N terminal was labeled with rhodamine dye laser.Immunofluorescence assay showed one TGF-β1 bioactive peptides was able to combine with the fibroblasts.ConclusionThe key sequences of TGF-β1 can be screened from a phage display 12-mer peptide library.One TGF-β1 bioactive peptides can combine with the fibroblasts.The results are expected to help promoting wound healing.
【Key words】Phage display 12-mer peptide library;Transforming growth factor-beta 1;Bioactive peptide;Fibroblast
