告达庭联合吉非替尼逆转HGF诱导的非小细胞肺癌对EGFR-TKI的获得性耐药研究
2016-07-24范方田卞庆亚吴红雁
范方田,卞庆亚,吴红雁Δ
(1.南京中医药大学 翰林学院,江苏 泰州 225300;2.盐城卫生职业技术学院 药学院,江苏 盐城 224005)
告达庭联合吉非替尼逆转HGF诱导的非小细胞肺癌对EGFR-TKI的获得性耐药研究
范方田1,卞庆亚2,吴红雁2Δ
(1.南京中医药大学 翰林学院,江苏 泰州 225300;2.盐城卫生职业技术学院 药学院,江苏 盐城 224005)
目的 探讨告达庭联合吉非替尼对肝细胞生长因子(hepatocyte growth factor ,HGF)诱导的非小细胞肺癌PC-9细胞对吉非替尼耐药的效应及可能机制。方法 利用外源性HGF及与MRC-5共培养诱导PC-9细胞对EGFR-TKIs耐药模型;MTT法考察告达庭对HGF诱导的PC-9细胞耐吉非替尼的逆转作用; Western blot检测告达庭联合吉非替尼逆转HGF诱导PC-9细胞耐药的机制。结果 外源性HGF和MRC-5均可诱导PC-9对吉非替尼的耐药作用,降低相对抑制率(P<0.05);在HGF存在的情况下,单用告达庭(0~32 μM)和吉非替尼(1 μM)均不能显著抑制PC-9的增殖,而告达庭联合吉非替尼能剂量依赖性抑制PC-9增殖(P<0.05)。告达庭联合吉非替尼下调Met及PI3K/AKT磷酸化水平(P<0.05)。结论 告达庭能逆转HGF诱导的PC-9细胞对吉非替尼的耐药,其机制可能与其抑制Met/PI3K/AKT通路有关。
非小细胞肺癌;细胞增殖;吉非替尼:告达庭
表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)如吉非替尼和厄洛替尼,明显改善了非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的生存率,尤其对于含有EGFR基因突变的肿瘤患者,可以从EGFR-TKIs治疗中明显获益[1]。然而,几乎所有对EGFR-TKIs初始治疗敏感的EGFR基因突变的患者,经过1年的治疗后都不可避免地出现病情恶化,临床上定义为EGFR-TKIs获得性耐药[2]。因此,迫切需要寻找新的治疗策略来克服EGFR-TKIs获得性耐药。
告达庭(Gaudatin)是从传统补益中药白首乌(耳叶牛皮消)中提取的一种C21甾体苷元,研究发现其具有较强的抗肿瘤活性;它能抑制肺癌A549细胞增殖并可诱导肺癌细胞发生凋亡[3];告达庭具有抑制SGC-7901胃癌细胞增殖的活性并且可以诱导胃癌细胞凋亡[4-5]。告达庭可增强TRAIL诱导的HepG2细胞凋亡[6]。本研究通过探讨吉非替尼联合告达庭对体外诱导吉非替尼获得性耐药的NSCLC细胞PC-9的抗肿瘤效应及其可能的机制,以期从天然产物中寻找能克服EGFR-TKIs获得性耐药的活性成分,为NSCLC的临床联合用药治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞:人肺癌PC-9细胞株及人胚肺成纤维细胞MRC-5购自中国科学院上海细胞生物学研究所。
1.1.2 主要药物:告达庭购自南京森贝伽生物科技有限公司,吉非替尼由美国路易斯安那州立大学黄世乐实验室惠赠,人重组肝细胞生长因子(hepatocyte growth factor,HGF)购自Peprotech公司,药物用DMSO溶解配制成浓度为10 mmol/L的浓缩液,-20 ℃冰箱保存,临用前用细胞培养液配成所需浓度用于所有的实验中。
1.1.3 试剂:胎牛血清、DMEM和RPMI-1640培养液购自美国Invitrogen公司,DMSO、MTT和碘化丙啶购自美国 Sigma公司,磷酸酶抑制剂、蛋白酶抑制剂和 BCA蛋白质浓度测定试剂盒购自碧云天公司,兔抗人磷酸化EGFR和EGFR、磷酸化MET和MET、磷酸化AKT和AKT、磷酸化PI3Kp85和PI3K p85多克隆抗体购自美国Cell Signal Technology公司,辣根过氧化物酶标记的山羊抗小鼠或兔IgG二抗购自北京中杉金桥生物技术有限公司,蛋白质印迹法检测用的化学发光剂购自美国 Millipore 公司。
1.1.4 仪器:超净工作台(苏净集团安泰公司,型号:SW-CJ-ZFD);CO2培养箱(美国Thermo,型号:03793-6738);倒置荧光显微镜(德国Zeiss,型号:Discovery.V20);超低温冰箱(美国Nuaire,型号:Nu-6511);酶标仪(美国MD,型号:SPECTRA MAX 190);电泳仪(美国Bio-Rad,型号:Mini Protean 3 Cell);凝胶成像仪(美国Bio-Rad,型号:GelDoc 2000) 0.22 μm滤膜(迈博瑞生物膜技术有限公司);
1.2 方法
1.2.1 细胞培养:实验所用细胞用含10%胎牛血清、100 U/mL青霉素和终质量浓度为100 μg/mL链霉素的DMEM培养液或RPMI-1640培养液,置于37 ℃、CO2体积分数为5%的培养箱中培养,每2~3 d传代1次,取处于对数生长期的细胞进行实验。PC-9细胞(包括药物处理组)与MRC-5成纤维细胞共培养在直径8 mm的Transwell小室(Corning)进行,PC-9细胞(104个/孔)置于小室底部,MRC-5细胞置于小室上部,培养72 h后,小室上部细胞移去,小室底部的PC-9细胞用MTT检测增殖情况。
1.2.2 MTT检测药物对细胞增殖的影响
① 外源性加入HGF:有报道外源性加入HGF可以诱导PC-9细胞对吉非替尼耐药[7-8],本实验取对数生长期的PC9细胞,调整细胞密度为4×104个/mL,100 μL/孔接种于96孔板中,培养24 h后,按组别分别给予药物干预。分组如下:Caudatin;HGF+Caudatin;Caudatin+Gefitinib;HGF+Caudatin+Gefitinib;各组分别加入不同浓度的告达庭(0.125、0.25、0.5、1、2、4、8、16、32 μM),吉非替尼(1 μM)和HGF(20 ng/mL)的浓度固定,各组设6个复孔。细胞继续培养48 h后,加入MTT溶液10 μL/孔(终质量浓度为5 mg/mL),继续培养4h后,加入DMSO(150 μL/孔),振荡10 min,使紫色结晶完全溶解,在酶联免疫检测仪上检测490 nm波长处各孔的吸光度(A)值,计算相对细胞存活率(%)=(A给药孔/A对照孔)×100%,抑制率(%)=100%-相对存活率(%)。
② PC-9细胞与成纤维细胞MRC-5共培养:有报道成纤维细胞能产生HGF也可诱导PC-9细胞对吉非替尼耐药[8],本实验考察告达庭对PC-9细胞与MRC-5共培养后增殖的影响,共培养方法请见1.2.1细胞培养部分,MTT方法同①。分组如下:Control、Gefitinib、Caudatin、Caudatin+Gefitinib。浓度:告达庭32 μM、吉非替尼1 μM。
1.2.3 Western blot检测药物处理后 PC9细胞中蛋白及磷酸化水平的表达 Met及其下游的PI3K/AKT信号通路在HGF诱导的NSCLC细胞对EGFR-TKIs的耐药中发挥重要作用[7,9-10]。本实验采用Western blot检测药物作用后对EGFR及Met相关信号通路蛋白的影响。取对数生长期的PC-9细胞,接种于100 mm2的培养皿中,1×106个细胞/培养皿;细胞培养24 h后进行实验分组和药物处理。分组如下:Control、Caudatin、Gefitinib、Caudatin+Gefitinib;HGF、HGF+Caudatin、HGF+Gefitinib、HGF+Caudatin+ Gefitinib。浓度:告达庭32 μM、吉非替尼1 μM和HGF 20 ng/mL。收集药物处理48 h后的PC-9细胞,PBS洗涤细胞3次,以含磷酸酶抑制剂和蛋白酶抑制剂的细胞裂解液提取细胞总蛋白,BCA法测定蛋白浓度。取40 μg/孔蛋白在7.5%~12%SDS-PAGE电泳分离,然后转至PVDF膜上,以5%脱脂奶粉溶液于室温下封闭反应2 h,加入1:1000稀释的一抗抗体及1:1000稀释的GAPDH(内参)抗体,4 ℃反应过夜; TBST洗膜后,加入1:10000稀释的辣根过氧化物酶标记的山羊抗小鼠或兔IgG二抗,室温反应2h;TBST洗膜3次后,置于Bio-Rad凝胶成像仪中,加入化学发光剂进行化学显色,分析蛋白条带的位置及表达的情况,采用Photoshop 5.0软件对蛋白条带的灰度扫描后进行半定量分析,结果采用与对应内参的相对比值。

2 结果
2.1 告达庭逆转HGF诱导的PC-9细胞对EGFR-TKIs的耐药 单独加入告达庭(Control)在32 μM浓度范围内,对PC-9细胞增殖变化无显著影响,在加入吉非替尼(1 μM)后,细胞增殖明显受到抑制(Control组vs.吉非替尼组,P<0.05);在加入HGF (20 ng/mL)后,不加告达庭(0 μM)时,可见PC-9细胞对吉非替尼(1 μM)产生耐药,随着告达庭浓度逐渐增加到32 μM时,细胞增殖抑制越来越明显,在32 μM时的抑制率与不加HGF的Gefitinib组的相当[Caudatin+Gefitinib组相对抑制率(67.13±0.72)%vs.Caudatin+Gefitinib+HGF组相对抑制率(69.24±1.95)%]。见图1。

图1 吉非替尼和告达庭对PC-9细胞的增殖抑制作用±s)Fig.1 Effect of Caudatin and Gefitinib on proliferation of ±s)
2.2 告达庭逆转与MRC-5共培养的PC-9细胞对EGFR-TKIs的耐药 PC-9细胞与MRC-5细胞共培养后,对吉非替尼产生耐药[与Medium相比,共培养体系中Gefitinib组对细胞的相对抑制率(7.03±0.81)%,远低于Medium对照体系中的相对抑制率(57.24±2.69)%,P<0.01],但是Caudatin+Gefitinib组能明显抑制细胞增殖[共培养体系中,Caudatin+Gefitinib组对细胞的相对抑制率(53.63±2.47)%vs.Gefitinib组的相对抑制率(7.03±0.81)%,P<0.01],逆转了MRC-5共培养后PC-9细胞对吉非替尼的耐药。见图2。
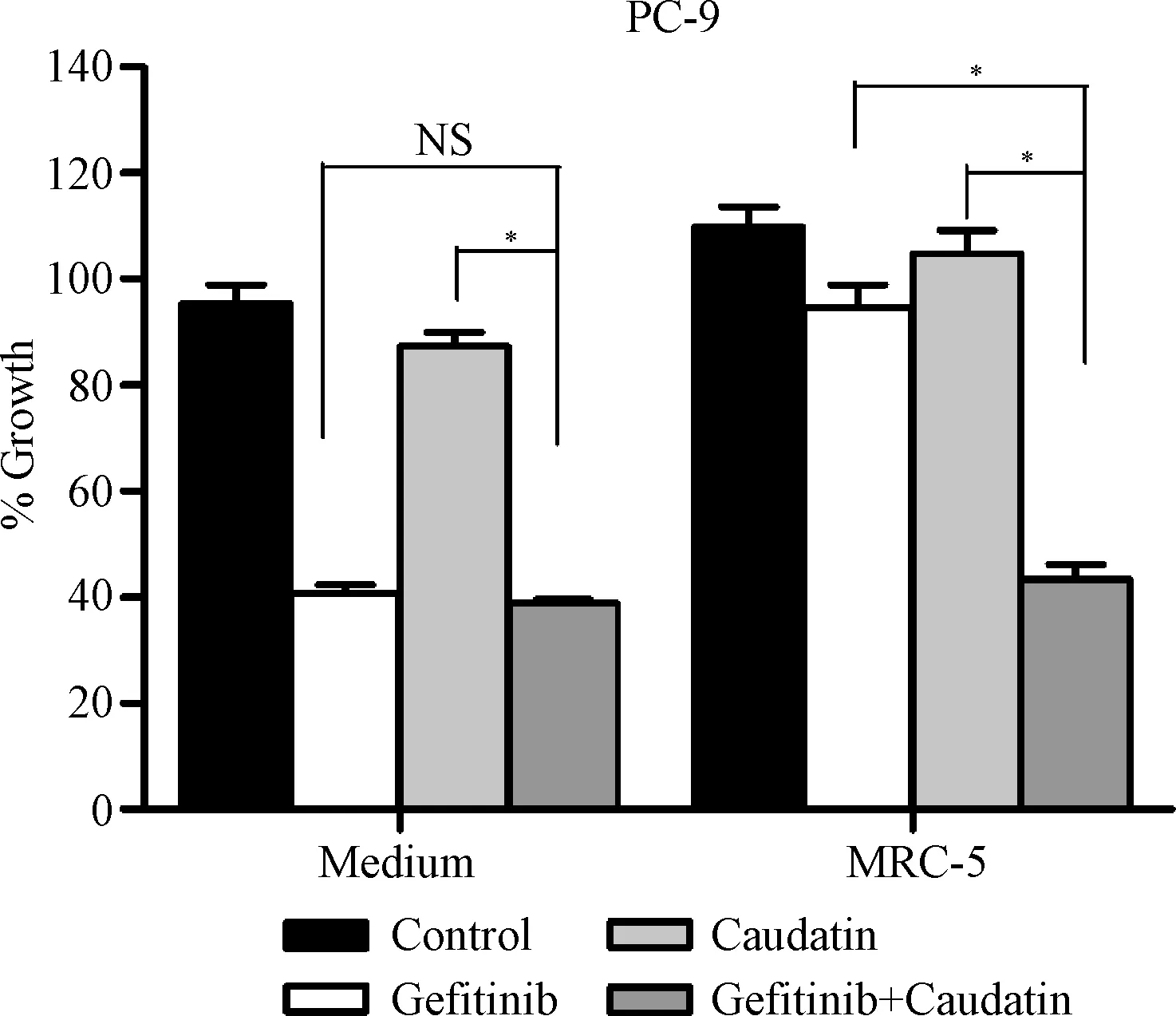
图2 吉非替尼和告达庭与MRC-5共培养后的PC-9细胞的增殖抑制作用NS: P>0.05,*P<0.05Fig.2 Effect of Caudatin and Gefitinib on proliferation ofNS: P>0.05,*P<0.05
2.3 告达庭联合吉非替尼用药对PC-9 细胞Met/PI3K/Akt通路的影响 本实验检测了各组药物作用后对EGFR及Met相关信号通路关键蛋白表达水平的影响。见图3、表1。

图3 吉非替尼和告达庭对PC-9细胞中PI3K/Akt通路相关蛋白表达的影响Fig.3 Effect of Caudatin and Gefitinib on expression of PI3K/Akt pathway in PC-9
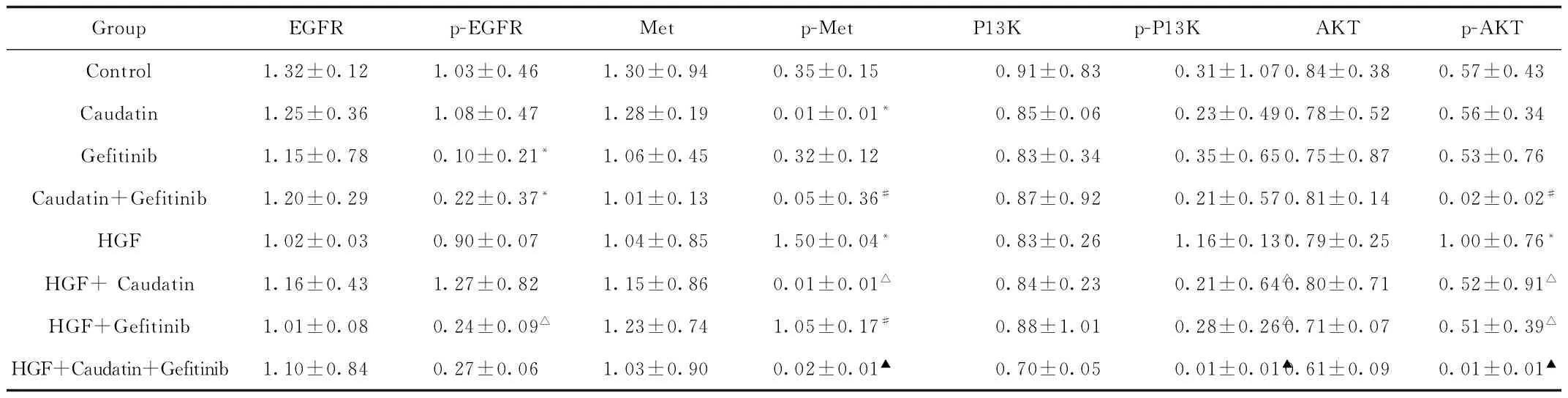
GroupEGFRp-EGFRMetp-MetP13Kp-P13KAKTp-AKTControl1.32±0.121.03±0.461.30±0.940.35±0.150.91±0.830.31±1.070.84±0.380.57±0.43Caudatin1.25±0.361.08±0.471.28±0.190.01±0.01*0.85±0.060.23±0.490.78±0.520.56±0.34Gefitinib1.15±0.780.10±0.21*1.06±0.450.32±0.120.83±0.340.35±0.650.75±0.870.53±0.76Caudatin+Gefitinib1.20±0.290.22±0.37*1.01±0.130.05±0.36#0.87±0.920.21±0.570.81±0.140.02±0.02#HGF1.02±0.030.90±0.071.04±0.851.50±0.04*0.83±0.261.16±0.13*0.79±0.251.00±0.76*HGF+Caudatin1.16±0.431.27±0.821.15±0.860.01±0.01△0.84±0.230.21±0.64△0.80±0.710.52±0.91△HGF+Gefitinib1.01±0.080.24±0.09△1.23±0.741.05±0.17#0.88±1.010.28±0.26△0.71±0.070.51±0.39△HGF+Caudatin+Gefitinib1.10±0.840.27±0.061.03±0.900.02±0.01▲0.70±0.050.01±0.01▲0.61±0.090.01±0.01▲
*P<0.05,与Control组比较,compared with Control group;#P<0.05,与Gefitinib组比较,compared with Gefitinib group;△P<0.05,与HGF组比较,compared with HGF group;▲P<0.05,与HGF+Gefitinib组比较,compared with HGF+Gefitinib group
HGF诱导PC-9耐Gefitinib机制验证:与Control组比较,HGF组激活Met, P13K及AKT磷酸化(P<0.05),与Gefitinib组比较,HGF+Gefitinib激活Met磷酸化(P<0.05),这说明HGF能够激活Met/PI3K/AKT信号通路,诱导Gefitinib耐药。
Caudatin对Met/PI3K/AKT信号通路的影响:基础水平下,与Control组比较,Caudatin组显著降低Met磷酸化(P<0.05);与Gefitinib组比较,Caudatin+Gefitinib显著降低p-Met和p-Akt的表达水平(P<0.05)。在HGF诱导的情况下,与HGF组比较,HGF+Caudatin组显著降低p-Met、p-PI3K和p-Akt的表达水平(P<0.05)。这说明Caudatin 能抑制Met/PI3K/AKT信号通路。
Caudatin+Gefitinib对EGFR及Met相关信号通的影响:与HGF+Gefitinib组比较,HGF+Caudatin+ Gefitinib组显著降低p-Met、p-PI3K和p-Akt的表达水平(P<0.05)。这提示Caudatin联合Gefitinib能抑制Met信号通路。
综上,提示告达庭可能通过抑制Met/PI3K/AKT通路发挥逆转耐药效应。
3 讨论
吉非替尼是被批准的治疗肺癌的二线化疗EGFR-TKIs,主要用于己接受过以铂类为基础化疗的进展期NSCLC患者[11-12]。EGFR基因突变NSCLC患者对EGFR-TKIs的敏感性好,显示出较好的疗效[1,13]。然而,随着治疗时间的延长,初期对EGFR-TKIs治疗敏感的EGFR基因突变患者1年后都不可避免地产生获得性耐药。
通过对临床病例的分析发现,对EGFR-TKIs产生获得性耐药的有61%患者都出现HGF高表达、T790M突变和Met扩增,其中HGF是一种多功能的细胞因子,不仅会来自肿瘤细胞,间质细胞如成纤维细胞液也会产生。HGF与其受体Met结合后与EGFR信号通路产生交互作用[14]。研究表明,HGF以剂量依赖性的方式使NSCLC细胞对EGFR-TKIs产生获得性耐药,主要是因为它通过Met途径激活了PI3K/AKT通路[7],因此,要克服HGF诱导的NSCLC细胞对EGFR-TKIs的获得性耐药,就需要同时阻断EGFR 和 HGF-Met信号通路,于是,寻找合适的化合物与EGFR-TKIs联用来克服NSCLC获得性耐药是当前研究的热点。
从天然产物中寻找活性成分联合化疗可以增效减毒,目前已经在实验研究和临床应用中显示出显著的疗效[15],告达庭是中药白首乌(耳叶牛皮消)中的一种C21甾体苷元,研究发现它具有较好的抗肿瘤活性,但目前对于其具体作用机制不是十分明确,本研究结果显示,告达庭联合吉非替尼对外源性HGF诱导的PC-9获得性耐药有较好的逆转效应,联合用药组抗增殖作用明显强于各单药组。通过初步对其机制的研究发现,告达庭能通过抑制Met/PI3K/Akt通路从而恢复NSCLC细胞PC-9对吉非替尼的敏感性。实验结果显示,告达庭对EGFR磷酸化水平无明显影响,但是能抑制Met和 PI3k/Akt磷酸化水平;告达庭与吉非替尼联合用药能同时显著抑制EGFR、HGF-Met 信号通路,提示告达庭可能通过抑制Met/PI3K/AKT通路发挥逆转耐药效应。但告达庭这种逆转耐药的效应还需要体内实验和大量的临床研究进一步予以证实。
总而言之,本研究结果表明,告达庭在体外能逆转HGF诱导的PC-9细胞对吉非替尼的耐药,对Met/PI3K/Akt信号通路有显著抑制,因此告达庭可能会成为有潜力的能克服NSCLC对EGFR-TKIs获得性耐药的一种化合物,也符合从天然产物中寻找活性成分联合现有靶向药物发挥多靶点协同作用的特点。
[1] Lynch TJ, Bell DW, Raffaella S, et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl J Med, 2004, 350(350):2129-2139.
[2] David J, William P, Riely GJ, et al.Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer[J].J Clin Oncol, 2010, 28(2):357-360.
[3] 姚楠, 顾晓洁, 李友宾.白首乌中3个C21甾体皂苷类成分对人肺癌A549细胞生长及周期的影响[J].中国中药杂志, 2009, 34(11):1418-1421.
[4] 费洪荣, 肖婷, 陈庚,等.告达庭对人胃癌细胞株SGC-7901细胞增殖和凋亡的调节作用[J].中国药理学通报, 2010, 26(10):1330-1334.
[5] 朱赴东, 周霞, 陶雪芬,等.告达庭激活Caspase-3诱导人胃癌细胞SGC-7901凋亡[J].中国肿瘤, 2014, 23(6):523-527.
[6] 费洪荣, 王桂玲, 赵莹,等.告达庭增强TRAIL诱导的HepG2细胞凋亡[J].中国病理生理杂志, 2015(2):279-283.
[7] Seiji Y, Wei W, Qi L, et al.Hepatocyte growth factor induces gefitinib resistance of lung adenocarcinoma with epidermal growth factor receptor-activating mutations[J].Cancer Res, 2008, 68(22):9479-9487.
[8] Donev IS, Wei W, Tadaaki Y, et al.Transient PI3K inhibition induces apoptosis and overcomes HGF-mediated resistance to EGFR-TKIs in EGFR mutant lung cancer[J].Clin Cancer Res, 2011, 17(8):2260-2269.
[9] Turke AB, Zejnullahu K, Wu YL, et al.Preexistence and Clonal Selection of MET Amplification in EGFR Mutant NSCLC[J].Cancer Cell, 2010, 17(1):77-88.
[10] Gusenbauer S, Vlaicu P, Ullrich A.HGF induces novel EGFR functions involved in resistance formation to tyrosine kinase inhibitors[J].Oncogene, 2013, 32(33):3846-3856.
[11] Martin R, Nico VZ, Cesare G, et al.Erlotinib in advanced non-small cell lung cancer: efficacy and safety findings of the global phase IV Tarceva Lung Cancer Survival Treatment study[J].J Thorac Oncol, 2010, 5(10):1616-1622.
[12] Sanford M, Scott LJ.Gefitinib: a review of its use in the treatment of locally advanced/metastatic non-small cell lung cancer[J].Drugs,2009, 69(16):2303-2328.
[13] Paez JG, Jänne PA, Lee JC, et al.EGFR mutations in lung cancer : correlation with clinical response to gefitinib therapy[J].Science,2004, 304(5676):1497-1500.
[14] Stabile LP, Rothstein ME, Keohavong P, et al.Targeting of both the c-Met and EGFR pathways results in additive inhibition of lung tumorigenesis in transgenic mice[J].Cancers, 2010, 2(4):2153-2170.
[15] Kang XH, Xu ZY, Gong YB,et al.Bufalin reverses HGF-Induced resistance to EGFR-TKIs in EGFR mutant lung cancer cells via blockage of Met/PI3k/Akt pathway and induction of apoptosis[J].Evid Based Complement Alternat Med, 2012, 2013(1): 243859.
(编校:王俨俨)
Caudatin combined with Gefitinib reversing HGF induced non-small cell lung cancer to EGFR-TKI acquired drug resistance
FAN Fang-tian1, BIAN Qing-ya2, WU Hong-yan2Δ
(1.Department of Pharmacy, Nanjing University of Chinese Medicine Hanlin College, Taizhou 225300, China; 2.Department of Pharmacy,Yancheng Health Vocational and Technical College, Yancheng 224005, China)
ObjectiveTo investigate the effect and underlying mechanism of Caudatin combined with Gefitinib on Gefitinib resistance induced by HGF in PC-9.MethodsModel of EGFR-TKIs resistance in PC-9 cells was induced by exogenous HGF and co-cultured with MRC-5.Caudatin was tested as a drug resistant modulator to reverse the resistance of Gefitinib in PC-9 cells induced by HGF by MTT assay.Western blot was performed to observe the mechanism of Caudatin combined with Gefitinib reversing the resistance of PC-9 induced by HGF.ResultsThe resistance of gefitinib to PC-9 was induced by exogenous HGF and co-cultured with MRC-5 which could reduce relative inhibitory rate (P< 0.05).Neither caudatin (0-32 μM) or Gefitinib (1 μM) alone could significantly inhibit proliferation of PC-9 in the presence of HGF, which could be inhibited in a dose-dependent manner by Caudatin combined with Gefitinib (P<0.05); Caudatin combined with Gefitinib down-regulated the phosphorylation levels of Met and PI3K/Akt simultaneously (P< 0.05).ConclusionCaudatin could reverse the drug resistance of Gefitinib in PC-9 induced by HGF, the mechanism of which may be related to the inhibition of Met/PI3K/AKT pathway.
non-small cell lung cancer; cell proliferation; Gefitinib; Caudatin
10.3969/j.issn.1005-1678.2016.06.14
盐城市医学科技发展计划(YK2014062);江苏高校品牌专业建设工程资助项目
范方田,男,硕士,讲师,研究方向:中药抗肿瘤药理,E-mail:fftian3912@163.com;吴红雁,通信作者,男,硕士,讲师,研究方向:中药抗肿瘤药理,E-mail:why20133055@163.com。
R453.9
A
