艾迪注射液辅助治疗对晚期肺癌患者血清MMP-9、TIMP-1、CRP及VEGF水平的影响
2016-07-24刘志聪周凌燕
刘志聪,周凌燕
(湖州市中心医院 呼吸内科,浙江 湖州 313000)
艾迪注射液辅助治疗对晚期肺癌患者血清MMP-9、TIMP-1、CRP及VEGF水平的影响
刘志聪Δ,周凌燕
(湖州市中心医院 呼吸内科,浙江 湖州 313000)
目的 探讨艾迪注射液辅助治疗对晚期肺癌患者血清基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、组织金属蛋白酶抑制剂-1(tissue inhibifor of metalloproteinase-1,TIMP-1)、C反应蛋白(C-reactionprotein,CRP)及血管内皮生长因子(vascular endothelial growth factor,VEGF)水平的影响。方法 收治晚期非小细胞肺癌患者52例,随机分为对照组和实验组,每组26例。对照组给予多西他赛和顺铂治疗;室验组在对照组基础上加用艾迪注射液。治疗结束后,比较2组患者的血清MMP-9、TIMP-1、VEGF、CRP及SIL-2R水平、免疫功能及生存质量评分。结果 与对照组比较,治疗后实验组患者血清MMP-9、TIMP-1、VEGF、CRP、SIL-2R水平均较低(P<0.05);实验组患者外周血CD4+T细胞、CD4+/ CD8+水平较高,CD8+T细胞水平较低(P<0.05),Karnofsky评分较高(P<0.05)。结论 艾迪注射液辅助治疗能够显著降低晚期肺癌患者血清MMP-9、TIMP-1、VEGF、CRP及SIL-2R水平,改善免疫功能,提高患者的生存质量。
艾迪注射液;晚期肺癌;MMP-9;TIMP-1;CRP;VEGF
肺癌是最常见的恶性肿瘤之一,发病率和死亡率均居于恶性肿瘤的前列。资料显示,2008年全球约有161万例新发肺癌患者,占所有恶性肿瘤的13%,138万死亡病例,占所有恶性肿瘤的18%,我国肺癌发病率呈现逐年上升趋势,年平均增长1.63%,其中男性为1.30%,女性为2.34%[1]。其中,非小细胞肺癌占大多数,发病率约占肺癌发病总数的80%[2]。本病早期的临床表现较轻微,很容易被忽视,一旦发现,70%~80%已处于疾病晚期,失去了手术治疗的时机。对于晚期肺癌,一般采用化疗、放疗、免疫治疗、分子靶向疗法等综合疗法[3],但是,这些药物的副作用较大,对正常组织的损伤较严重,治疗效果不很理想。中医药在我国的应用历史悠久,中药联合化疗治疗晚期非小细胞肺癌能够显著提高患者的生活质量,改善患者的免疫功能及生存率[4]。艾迪注射液是临床广泛应用的一种抗肿瘤中药, 是黄芪、人参、刺五加和斑蝥等药物的提取物,主要含人参皂苷、黄芪皂苷、刺五加多糖和去甲斑蝥素等[5]。本研究通过对患者血清MMP-9、TIMP-1、CRP、VEGF水平、免疫功能及生存质量评分等情况进行分析,探讨艾迪注射液辅助治疗晚期肺癌的疗效。现报道如下。
1 资料与方法
1.1 一般资料 收集湖州市中心医院2014年4月~2015年4月确诊为晚期非小细胞肺癌的患者52例,男性28例,女性24例。其中鳞癌22例,腺癌20例,大细胞癌10例。根据随机数字表分为实验组和对照组,每组各26例,对照组男性15例,女性11例,平均年龄(49.98±9.38)岁,其中鳞癌11例,腺癌9例,大细胞癌6例;实验组男性13例,女性13例,年龄平均(50.35±9.10)岁,其中鳞癌11例,腺癌11例,大细胞癌4例。2组患者的年龄分布、性别组成、病理类型比较差异无统计学意义。纳入标准:非小细胞肺癌的诊断符合2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会国际多学科肺腺癌分类(2011年版)关于非小细胞肺癌的诊断标准[6];经影像学、免疫生化、病理学检查确诊;Karnofsky 评分≥60分;预计生存期在3个月以上。排除标准:①合并肺部感染、大咯血、恶液质等严重并发症;②合并免疫系统或血液系统疾病;③合并其他恶性肿瘤;④合并严重的心、脑血管疾病,肝、肾功能不全;⑤妊娠或哺乳期妇女;⑥对研究中所涉及药物过敏;⑦病历资料不全。
1.2 方法
1.2.1 治疗方法:所有患者治疗前均给予保肝、保护胃黏膜、止吐、营养支持等常规对症治疗。在此基础上,对照组患者给予多西他赛注射液(Aventis Pharma S.A.,H20090494)75 mg/m2,溶于250 mL 0.9%氯化钠溶液中,静脉滴注,每周期第1天静点;给予注射用顺铂(云南个旧生物药业有限公司,国药准字H53021677)20 mg/m2,溶于250 mL 0.9%氯化钠溶液中,静脉滴注,每周期第1至第5天静点。在对照组治疗基础上,实验组患者给予艾迪注射液(贵州益佰制药股份有限公司,国药准字Z52020236)20 mL,溶于0.9%氯化钠溶液250 mL,1次/天静滴。21d为1个疗程,2组患者均治疗1个疗程。
1.2.2 血液指标采集:治疗前后,采集所有研究对象的空腹12 h后静脉血5 mL,采用超速离心机(贝克曼库尔特OptimaTMXPN)分离血清,采用RT-6000全自动酶标仪(Rayto雷杜),严格按照试剂盒(上海诺泰中国生物公司)说明书进行操作,通过酶联免疫吸附试验(ELISA)检测血清基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶抑制因子-1(TIMP-1)、血管内皮生长因子(VEGF)、可溶性白介素2受体(SIL-2R)水平;采用透射免疫比浊法测定血清中C反应蛋白(CRP)水平。
1.2.3 免疫功能评价:治疗前后,抽取所有患者的外周血3 mL,采用贝克曼CytoFLEX流式细胞仪检测各组患者外周血中CD4+T细胞、CD8+T细胞及CD4+/CD8+水平。
1.2.4 生存质量评价:治疗前后采用Karnofsky功能状态评分标准对所有患者的生存质量进行评价。

2 结果
2.1 2组患者治疗前后血清MMP-9、TIMP-1及VEGF水平比较 治疗后2组患者的血清MMP-9、TIMP-1及VEGF水平与治疗前比较均明显降低(P<0.05);与对照组比较,实验组患者的血清MMP-9、TIMP-1及VEGF水平明显降低 (P<0.05)。见表1。
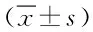
表1 血清MMP-9、TIMP-1及VEGF水平比较Tab.1 Comparison of serum levels of MMP-9、TIMP-1 and VEGF in two groups pre- and post- treatment(±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.2 2组患者血清CRP、SIL-2R水平比较 治疗后2组患者的血清CRP、SIL-2R水平与治疗前比较均明显降低(P<0.05);与对照组治疗后比较,实验组患者的血清CRP、SIL-2R水平明显降低 (P<0.05)。见表2。
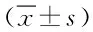
表2 血清CRP、SIL-2R水平比较Tab.2 Comparison of serum levels of CRP,SIL-2R between two groups pre- and post- treatment(±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.3 2组患者外周血CD4+T细胞、CD8+T细胞及CD4+/CD8+水平比较 治疗后2组患者的免疫功能与治疗前比较均明显改善(P<0.05);与对照组治疗后比较,实验组患者的外周血CD4+T细胞、CD4+/CD8+水平明显升高,CD8+T细胞水平明显降低 (P<0.05)。见表3。
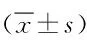
表3 治疗前后2组患者外周血CD4+T细胞、CD8+T细胞及CD4+/CD8+水平比较Tab.3 Comparison of peripheral blood levels of CD4+T cells、CD8+T cells and CD4+/CD8+ in two groups pre-an dpost-treatment(±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.4 治疗前后2组患者Karnofsky评分比较 治疗后2组患者的Karnofsky评分与治疗前比较均明显升高(P<0.05);与对照组治疗后比较,实验组患者的Karnofsky评分明显升高 (P<0.05)。见表4。
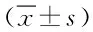
表4 治疗前后2组患者Karnofsky评分比较Tab.4 Comparison of Karnofsky score between two groups pre -and post-treatment(±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
3 讨论
肺癌的发生与吸烟、被动吸烟、居住地污染、社会精神因素、饮食、肺癌家族史等危险因素有关,其中吸烟为最主要的因素,有报道称,90%的肺癌发病与吸烟有关[7]。肺癌早期临床表现不典型,发现时多已经发展到晚期,化疗、放疗、靶向治疗、免疫治疗等综合治疗成为主要的治疗手段,临床上多采用辅助治疗手段来减轻肺癌化疗的不良反应,提高患者生活质量,延长生存期[7],中医药在此方面具有良好的效果。肺癌属中医“咳嗽”“肺积”“息贲”“胸痛”等范畴[9],艾迪注射液由斑蝥、人参、黄芪、刺五加提取而成,人参性平,味甘、微酸,有补中益气,健脾益肺之功;黄芪性甘温,有补气升阳、益卫固表之效;2者相辅相成,共奏益气扶正之效[10]。本研究结果发现,实验组患者血清MMP-9、TIMP-1及VEGF水平与对照组比较明显降低(P<0.05),证实了艾迪注射液辅助治疗能够抑制晚期肺癌的侵袭和转移。MMP-9是基质金属蛋白酶家族的一员,属于蛋白水解酶[11],其活性高低与锌离子及钙离子关系密切,能够通过降解细胞外基质,促进新生血管生成,调节细胞之间、细胞与基质之间的粘附作用,促进肿瘤的浸润、转移。TIMP-1为MMPs的抑制剂,也与恶性肿瘤的发展关系密切,除了能够抑制MMP-9等的活性外,还能促进肿瘤细胞的有丝分裂、促进血管新生,防止肿瘤细胞凋亡,从而推动肿瘤进展。研究报道[12],肺癌患者血清中MMP-9、TIMP-1的含量明显高于健康对照组,且Ⅲ、Ⅳ期患者血清TIMP-1、MMP-9含量明显高于Ⅰ、Ⅱ期,提示血清TIMP-1、MMP-9水平与肺癌患者的发生发展关系密切。VEGF是血管内皮生成因子,具有促进内皮细胞增殖与迁移,增加血管通透性,促进微血管形成的作用,在新生血管形成过程中起重要作用。有研究证明[13],VEGF在肺癌中的过度表达与肺癌恶性程度、晚期淋巴结转移等有关。
CRP是由肝脏分泌的急性时相反应蛋白,对于炎症反应有着较高的敏感性,在正常情况下,CRP合成量较少,血清CRP水平较低,当受到炎症反应、创伤、肿瘤等刺激时,血清CRP水平明显升高。有研究称[14],血清CRP水平随着肺癌的病情进展而升高,提示血清CRP水平可以作为评估肺癌预后及药物治疗效果的指标。SIL-2R是存在于淋巴细胞表面的复合性黏蛋白,能够与白细胞介素-2结合,抑制活化的T细胞,起到免疫抑制作用,亦与肺癌的增殖活性有关。本研究结果显示,实验组患者的血清SIL-2R、CRP水平与对照组比较明显降低(P<0.05),表明艾迪注射液辅助治疗能够抑制肺癌增殖活性,改善晚期肺癌患者的预后。
恶性肿瘤的发生与机体免疫功能下降密切相关,T淋巴细胞水平是免疫功能最直接的体现,CD4+T细胞和CD8+T细胞都是T淋巴细胞的亚型。CD4+T细胞属于辅助性T细胞,能够调节免疫应答,促进抗体的产生;CD8+T细胞则属于抑制性T细胞,具有细胞毒性作用,能够维持T淋巴细胞的平衡。有研究显示[15],肿瘤发生多与T淋巴细胞亚群状态,尤其与CD4+/CD8+比值有关。与对照组比较,实验组患者的外周血CD4+T细胞、CD4+/ CD8+水平明显升高,CD8+T细胞水平明显降低,表明艾迪注射液辅助治疗能够提高晚期肺癌患者的免疫功能,增强机体抗肿瘤能力。Karnofsky评分是评估患者生活质量的评估方法,分数越高,提示患者的生活质量越高。本研究结果显示,实验组患者的Karnofsky评分与对照组比较明显升高,表明艾迪注射液辅助治疗能够明显提高晚期肺癌患者的生活质量,这与艾迪注射液抑制TIMP-1、MMP-9、VEGF表达以降低肿瘤侵袭力和转移,减少CRP合成分泌以改善患者预后,提高免疫功能以增强抗肿瘤能力的作用密切相关。
综上所述,艾迪注射液辅助治疗能够显著降低晚期肺癌患者血清MMP-9、TIMP-1、CRP及VEGF水平,改善免疫功能,提高患者的生存质量。
[1] 姚晓军,刘伦旭.肺癌的流行病学及治疗现状[J].现代肿瘤医学,2014(8):1982-1986.
[2] 樊松,彭丽华,漆兴芝,等.艾迪注射液联合化疗治疗晚期非小细胞肺癌临床观察[J].浙江中西医结合杂志,2011,21(4):232-233.
[3] 于宏杰.中医治疗中晚期非小细胞肺癌临床研究的Meta分析[D].上海:上海中医药大学,2013.
[4] 崔娣,胡晓冬,夏清青,等.中药联合化疗治疗晚期非小细胞肺癌疗效及对患者生存期的影响[J].环球中医药,2014,7(3):219-222.
[5] 席青, 王建清, 常小红. 艾迪注射液在肺癌治疗中的研究进展[J]. 中国医药导报, 2014, 11(4):163-165.
[6] 黄受方.国际肺癌研究协会/美国胸科学会/欧洲呼吸学会国际多学科肺腺癌分类(2011年版)解读[J].中华病理学杂志,2011,40(12):793-796.
[7] 黄萌,陈星,邱月锋,等.肺癌危险因素及交互作用研究[J].中华疾病控制杂志,2011,15(2):91-94.
[8] 路必顺,罗晓春.中西医结合治疗肺癌的疗效观察[J].中西医结合研究,2011,03(4):190,194.
[9] 刘匡飞.中医药参与肺癌治疗研究进展[J].大家健康(中旬版),2014,8(6):339-340.
[10] 朱广媛, 李东华, 张树范,等. 艾迪注射液的临床研究进展[J]. 中医药学报, 2010, 38(1):123-127.
[11] 王小军.bFGF、MMP-9、TIMP-1在肺癌患者血清中的表达及意义[D].银川:宁夏医科大学,2013.
[12] 王小军,火云霞,刘华,等.肺癌患者血清MMP-9和TIMP-1检测的临床意义[J].重庆医学,2013,42(10):1111-1113,1116.
[13] 权修权,朴惠顺,尹学哲,等.VEGF在肺癌中的表达及相关药物靶向治疗中的研究现状[J].中国医院药学杂志,2015,35(8):758-762.
[14] 陈静.探讨C反应蛋白和纤维蛋白原检测在肺癌中的临床意义[D].南昌:南昌大学医学院,2014.
[15] 朱小玉,张祥忠,钟雪云,等.艾迪注射液对血液恶性肿瘤化疗患者造血功能和免疫功能的影响[J].中国中西医结合杂志,2010,30(2):205-207.
(编校:王冬梅)
Effect of adjuvant treatment of Aidi injection on serum levels of MMP-9,TIMP-1,CRP and VEGF in patients with advanced lung cancer
LIU Zhi-congΔ, ZHOU Ling-yan
(Deptment of Respiratory Medicine, HuZhou Central Hospital, Huzhou 313000, China)
ObjectiveTo analysis the effect of adjuvant treatment of Aidi injection on serum levels of MMP-9,TIMP-1,CRP and VEGF in patients with advanced lung cancer.Methods52 patients with advanced non small cell lung cancer were collected. All patients were randomly divided into experimental group and control group,26 cases in each group. Control group were given Docetaxel injection and cisplatin,while experiment group were added Aidi injection on the basis of control group.After the treatment, the serum levels of MMP-9,TIMP-1,VEGF,CRP and SIL-2R immunologic function and quality of life score were compared.ResultsAfter treatment, compared with control group, the serum levels of MMP-9,TIMP-1 and VEGF were lower in experimental group(P<0.05); the serum levels of CRP,SIL-2R were lower in experimental group(P<0.05); the peripheral blood CD4+T cells and CD8+/CD4+levels were higher, CD8+T cells level was lower in experimental group(P<0.05), The Karnofsky score of the experimental group was higher(P<0.05).ConclusionThe adjuvant treatment of Aidiinjection can significantly reduce the serum MMP-9,TIMP-1,VEGF,CRP and SIL-2R levels in patients with advanced lung cancer, improve immune function and improve the quality of life of patients.
Aidi injection; advanced lung cancer; MMP-9;TIMP-1; CRP; VEGF
刘志聪,通信作者,女,硕士,主治医师,研究方向:慢性气道疾病及肺癌诊治,E-mail:liuzhicongcong@163.com。
R734.2
A
10.3969/j.issn.1005-1678.2016.05.51
