锂氧电池复合电解质电化学性能研究
2016-07-23蔡克迪郎笑石张庆国何铁石
蔡克迪,赵 雪,郎笑石,张庆国,何铁石
(渤海大学 辽宁省超级电容器工程技术研究中心,辽宁 锦州 121013)
锂氧电池复合电解质电化学性能研究
蔡克迪,赵 雪,郎笑石,张庆国,何铁石
(渤海大学 辽宁省超级电容器工程技术研究中心,辽宁 锦州 121013)
摘要:将LiPF6溶入EC/EMC/DMC作为锂氧电池电解质主体,并分别加入[Emim]BF4和[DEME]TFSI离子液体制成复合电解质材料,组装成锂氧电池。通过循环伏安、交流阻抗、恒流充放电等方式研究复合电解质的电化学性能。结果表明,LiPF6溶入EC/EMC/DMC-[Emim]BF4体系复合电解质表现出较优的电化学性能,在0.025×10–3A·cm–2电流密度下电池首次放电比容量为2 672×10–3Ah·g–1,能量密度达6.468×10–3Wh·cm–2。
关键词:锂氧电池;复合电解质;离子液体;LiPF6;EC/EMC/DMC;[Emim]BF4
赵雪(1990-),女,辽宁辽阳人,研究生,研究方向为锂氧电池电解质材料,E-mail:xue.zhao.fly@gmail.com 。
网络出版时间:2016-05-31 11:09:34 网络出版地址:http://www.cnki.net/kcms/detail/51.1241.TN.20160531.1109.011.html
锂氧电池是一种用金属锂作负极,以氧气作为正极反应物的金属空气电池,由于其具备较高的理论比能量且环境友好等优势,近年来开始备受关注。非水系锂氧电池在放电时负极锂释放电子后成为锂离子,其穿过电解质材料,在正极与氧气、以及外电路流过来的电子结合生成氧化锂或过氧化锂,并留在阴极;充电时氧化锂或过氧化锂会分解为锂和氧气。与此同时,锂氧电池的研究受到溶剂挥发、电解液分解、锂负极易腐蚀、正极空隙堵塞等等问题的制约。电解液、正极材料及负极保护问题是当前锂氧电池研究的热点,其中如何在提高电池性能的基础上改善电解液的稳定性成为目前研究的难题之一。
锂氧电池工作过程中正极会不断有活性物质氧气或空气进入,因此要求电解液不仅能起到传递锂离子的作用,同时能有效保护锂片不发生副反应被消耗,性能优异的电解液更加能溶解部分放电产物,提高电池的循环工作稳定性以及高倍率放电性能。目前有关锂氧电池电解液的报道主要集中在新型电解质对锂片的保护[1-3]、对电池充放电性能的影响[4-8]、添加剂的应用[9-11]、氧在电解液中的反应机制[12-15]以及电解液在充放电过程中的稳定性等。非水系电解液存在挥发的问题,尤其是对于一个不断通入氧气的半开放体系,溶剂的挥发更加严重。离子液体也被称为低温熔融盐,许多优异的性能集于一体,其良好的热稳定性能够防止溶剂在电池工作时的挥发,进而防止电池容量下降。但其黏度较大,因此使用离子液体的锂氧电池在大电流区放电性能可能比有机系电解液差[16],本文用LiPF6in EC/EMC/DMC作为锂氧电池电解质主体,并分别加入[Emim]BF4(1-乙基-3-甲基咪唑四氟硼酸)和[DEME]TFSI(N-二乙基甲铵基,N-乙基甲醚基双三氟甲磺亚胺)离子液体制成复合电解质材料,组装成锂氧电池通过循环伏安、交流阻抗、恒流充放电等方式研究复合电解质的电化学性能。以期得到性能优异的锂氧电池电解质材料。
1 实验
1.1 复合电解质的制备
将锂盐置于真空干燥箱中在100 ℃下进行24 h恒温干燥处理,同时对非电池级有机溶剂进行干燥处理24 h后放入手套箱中。在手套箱水氧氛围均小于1×10–6的情况下按所需浓度称量锂盐、溶剂以及添加剂,在磁力搅拌器上以500 r/min的转速均匀搅拌混合3 h以上,直至电解液澄清为止。使用锂片对配置好的电解液进行简单的除水处理,降低电解液中水含量。将配置好的电解液转移至试剂瓶中,陈化24 h后方可使用[17-18]。
本文中使用的有机电解液分别有(Ⅰ号)c(Li+) = 2 mol·L–1,LiPF6溶入EC/EMC/DMC(质量比1:1:1);(Ⅱ号)c(Li+) = 2 mol·L–1,LiPF6溶入EC/EMC/DMC+ [Emim]BF4(EC/EMC/DMC与[Emim]BF4体积比1:1);(Ⅲ号)c(Li+)=2 mol·L–1,LiPF6溶入EC /EMC/ DMC+[DEME]TFSI (EC/EMC/ DMC与[DEME]TFSI体积比1:1)。溶剂溶质种类见表1,其中EC为碳酸乙烯酯,EMC为碳酸甲乙酯,DMC为碳酸二甲酯。
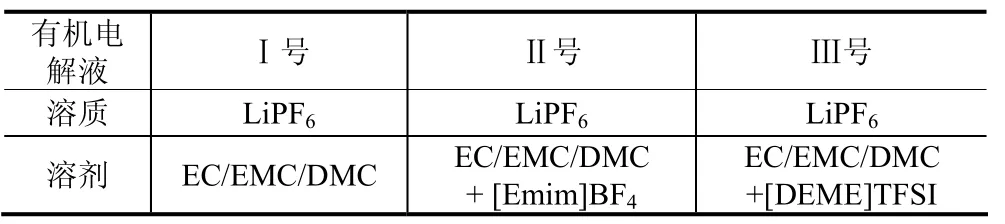
表1 溶质与溶剂种类Tab.1 The kinds of solute and solvent
1.2 空气电极的制备
空气电极的制作分为支撑层、整平层和催化层三部分进行。气体支撑层是将碳纸在质量分数为5% 的PTFE溶液中浸泡30 min,取出自然晾干,然后在350 ℃加热1 h得到。
整平层浆料:按照计算所得碳载量的1.25倍分别称取碳粉置入小烧杯内,加入适量碳粉分散剂聚乙二醇辛基苯基醚(C34H62O11)溶解上述物质,搅拌均匀,随后加入质量分数15%的粘结剂溶液、乙醇和水,超声分散2 h备用(碳基体与粘结剂质量比为4:1)。
催化层浆料:按照计算所得碳载量的1.25倍分别称取碳粉、催化剂(MnO2、Pt/C,质量比2:1),将两者在玛瑙研钵中混合均匀,置入小烧杯内,加入适量碳粉分散剂聚乙二醇辛基苯基醚(C34H62O11)溶解上述混合物,搅拌均匀,随后加入质量分数15%的粘结剂溶液、乙醇和水,超声分散2 h备用(质量比:碳基体/催化剂/粘结剂=75/15/10,如无特殊说明,碳基体/催化剂/黏结剂一般为Super P/ MnO2、Pt(C)/PTFE)。
将作为气体扩散层的碳纸置于80 ℃电热板上,使用喷枪依次将上述制备好的溶液在0.2 MPa的压力下喷涂在碳纸表面,喷涂结束后将得到的电极在60 ℃干燥2 h,然后从中取直径10mm的圆片作为空气电极备用,取下的空气电极置于60 ℃的干燥箱中干燥12 h得空气电极。
1.3 单电池的组装
负极——厚0.2mm、直径16mm的商业锂片作为负极。
正极——取上述制作好的空气电极(直径10mm)作为正极。
电解液——自制复合电解液。
隔膜——使用直径16mm的无纺布和聚丙烯微孔膜Celgard 2400作为隔膜。
单电池的组装采用钮扣电池作为模具。电池的组装在充满氩气的手套箱中进行,模具底部的不锈钢正好作为负极锂片的集流体,正极集流体采用泡沫镍,电池按照锂片/隔膜/正极/泡沫镍的顺序进行组装,组装过程中使用双层隔膜以保证吸收储存足够的电解液,装好的电池在测试之前先静置1 h,保证电解液完全润湿隔膜。
电池组装流程:(1)将负极锂片置于负极壳体中;(2)将无纺布隔膜置于负极锂片之上;(3)取30 μL电解液滴在第一层隔膜上;(4)将聚丙烯隔膜置于第一层隔膜上;(5)取10 μL电解液滴在第二层隔膜上;(6)将已准备好的正极置于第二层隔膜中央位置;(7)使用密封圈密封;(8)在密封圈中间放置集流体,盖正极壳体[19]。
1.4 电池性能测试
电池的充放电测试采用新威充放电测试仪进行,电池的测试在干燥的纯氧条件下完成,测试开始前,让电池在氧气氛围下静置1 h,保证氧气在电解液中的充分溶解。电池的充放电测试在CT3008W电池测试仪上完成,充放电曲线的分析采用Neware TC 5.3软件,电池的交流阻抗测试在CHI 660E电化学工作站上完成,频率范围10–1~105Hz,振幅10 mV,交流阻抗图谱的分析采用CHI 660 legzcy软件。电池的循环伏安测试在LK2005A电化学工作站上完成,循环伏安图谱的分析采用LK2005A软件。
2 结果与讨论
2.1 循环伏安测试
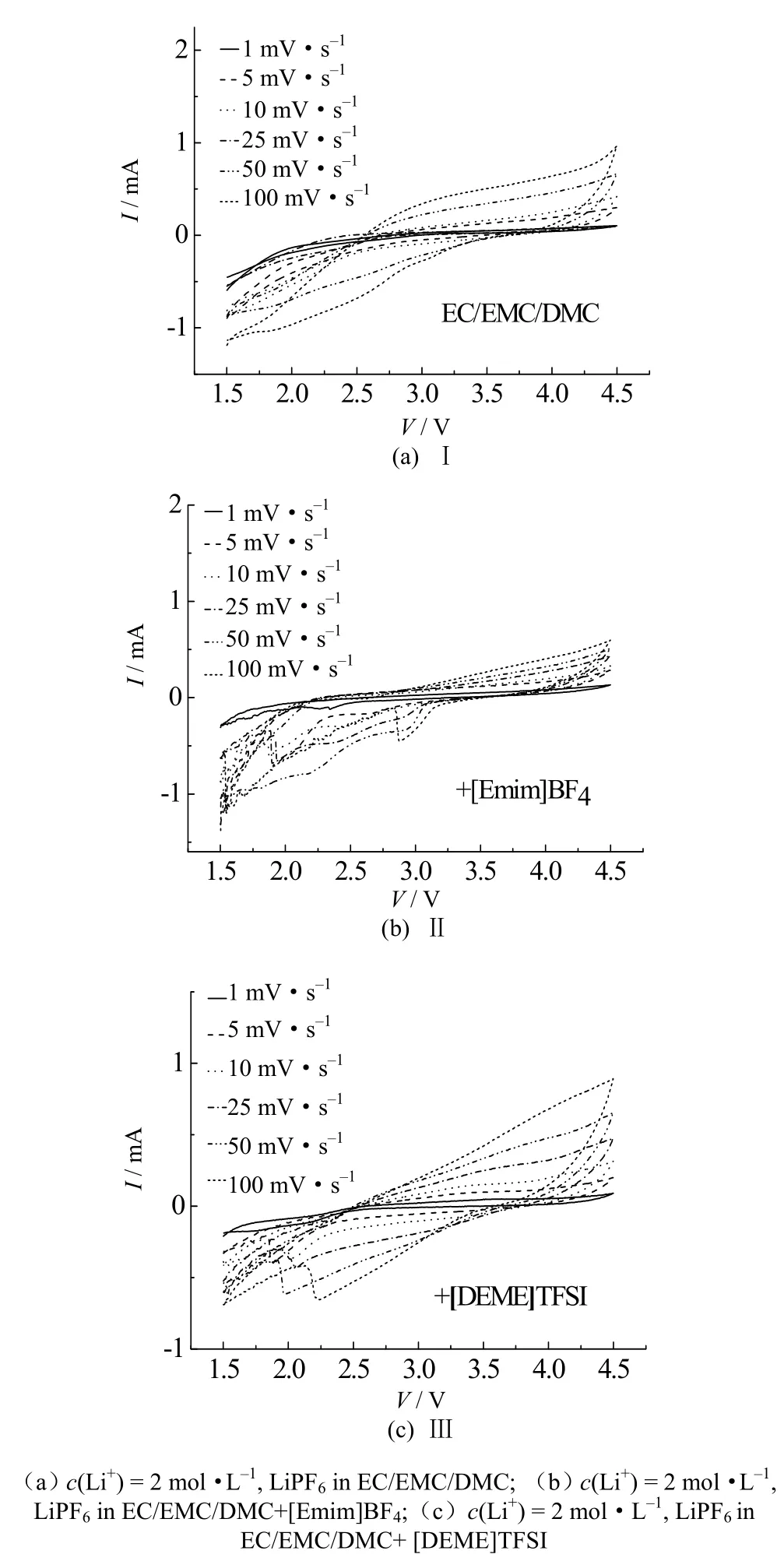
图1 Ⅰ、Ⅱ、Ⅲ电解液的锂氧电池循环伏安曲线Fig.1 The cyclic voltammogram curves of Ⅰ, Ⅱ and Ⅲ electrolyte lithium oxygen batteries
图1给出了三种电解液分别在1,5,10,25,50,100 mV·s–1六个扫描速度下的循环伏安曲线,从图中可以看出随着扫描速度的加快,峰电流强度呈现增大趋势,氧化峰和还原峰分别向正、负两个方向偏移,Ⅰ号、Ⅱ号和Ⅲ号电解液的锂氧电池峰值电位的间距DV依次为0.03,0.05,0.08,0.15,0.40,0.50;0.45,0.60,0.75,0.90,1.10,1.15;1.3,1.45,1.5,1.65,1.75,1.85 V;DV相应增大,这是缘于氧及氧离子在非水电解液中的扩散速率较小,扫描速率增大时电极极化加剧造成的。图2是三种电解液的锂氧电池在50 mV·s–1下的循环伏安曲线比较,可以看出,三者的循环曲线在1.5~4.5 V,表现出较规则的CV特性,其中Ⅱ号和Ⅲ号电解液的曲线中氧还原峰很明显,这是由于离子液体的加入增强了氧还原能力[19]。

图2 Ⅰ、Ⅱ、Ⅲ电解液的锂氧电池在50 mV·s–1下的循环伏安曲线Fig.2 The cyclic voltammetric curves of Ⅰ, Ⅱ and Ⅲ electrolyte lithium oxygen batteries under 50 mV·s–1
图3显示三种电解液的氧还原峰峰值电流与扫描速度平方根的关系曲线。不同电解液中氧还原的电流差别很大,还原电流的差别与电极的极化、氧在电解液中的溶解度以及氧的扩散系数有关。从图中可以看出,三种电解液的氧还原峰值电流均与扫描速度的平方根有较好的线性关系,说明整个氧还原过程受扩散控制,由于氧在非水电解液中的溶解和扩散系数都很小,非水电解液中氧的溶解和随后的扩散以及氧离子的迁移对于其在电解液中的还原影响很大。

图3 不同电解液的氧还原峰值电流与扫描速度平方根的关系Fig.3 The relationship of different electrolyte oxygen reduction peak current and scan speed square root
2.2 交流阻抗测试
图4为三种电解液各自在不同电压下的阻抗图,从图中可以看出三种电解液组装成的锂氧电池的阻抗都随着电压升高呈增大的趋势,且Ⅰ号电解液增大的速率最大,Ⅱ号电解液呈缓慢增大趋势,而Ⅲ号电解液的阻抗基本不随电压的增大而改变,同时,Ⅲ号电解液的阻抗图中基本都为直线,说明其放电过程的控制步骤是扩散。图5为不同电解液在同一电压下的EIS图,从图中可以看出Ⅰ号电解液阻抗在五个电压下阻抗都大于Ⅱ号和Ⅲ号,而Ⅲ号电解液阻抗最小。由此可知,当溶剂中添加了[Emim]BF4或者[DEME]TFSI时,会不同程度地减小电池阻抗。
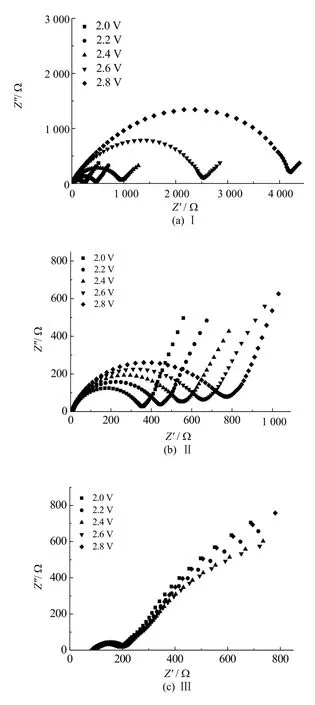
图4 Ⅰ、Ⅱ、Ⅲ电解液的锂氧电池不同电压下的EIS图Fig.4 The EIS figures of Ⅰ, Ⅱ and Ⅲ electrolyte lithium oxygen batteries under different voltages
图5 Ⅰ、Ⅱ、Ⅲ电解液的锂氧电池同一电压下的EIS图Fig.5 The EIS figures of Ⅰ, Ⅱ and Ⅲ electrolyte lithium oxygen batteries under the same voltage
2.3 电池放电性能测试

图6 Ⅰ、Ⅱ、Ⅲ电解液的锂氧电池首次放电曲线Fig.6 The first discharge curves of Ⅰ, Ⅱ and Ⅲ electrolyte lithium oxygen batteries
三种电解液组装的电池在0.01×10–3,0.05×10–3,0.1×10–3A·cm–2电流密度下的首次放电曲线如图6所示,从图中可以看出,当电流密度为0.01×10–3A·cm–2,Ⅰ号电解液首次放电时间为31.3 h,Ⅱ号电解液首次放电时间为215.6 h,Ⅲ号电解液首次放电时间为171.6 h;当电流密度为0.05×10–3A·cm–2时,Ⅰ号电解液首次放电时间为10.6 h,Ⅱ号电解液首次放电时间为42.9 h,Ⅲ号电解液首次放电时间为34.8 h;当电流密度为0.1×10–3A·cm–2时,Ⅰ号电解液首次放电时间为8.6 h,Ⅱ号电解液首次放电时间为13.6 h,Ⅲ号电解液首次放电时间为7.0 h。可知,电流密度在0.01×10–3~0.1×10–3A·cm–2范围内,采用Ⅱ号复合电解液(LiPF6in [Emim]BF4+EC/EMC/DMC)的电池放电时间表现出较优的性能,Ⅲ号(LiPF6in [DEME] TFSI+ EC/ EMC/DMC)次之,采用LiPF6in EC/EMC/DMC的Ⅰ号电解液的放电时间与其他两者相比较小。这表明,由于离子液体具有难挥发、性质稳定、电化学窗口高的优势,在锂氧电池非水系电解液中引入离子液体可以降低电解液的挥发、改善电解液的稳定性,从而提高锂氧电池的放电时间及其电化学性能。其中,[Emim]BF4中BF4离子具有亲水性,而[DEME]TFSI中TFSI则表现出疏水性,亲水性BF4离子与疏水性PF6离子的共同作用,有助于Li离子在电池内部的快速传输,因此采用Ⅱ号复合电解液(LiPF6in [Emim]BF4+EC/EMC/DMC)的锂氧电池表现出较长的首次放电时间和稳定性。
图7为三种电解液组装的锂氧电池循环性能。从图7(a)可以看出,三者的循环性能存在明显差别,电流密度为0.1×10–3A·cm–2时,采用Ⅰ号和Ⅲ号电解液的锂氧电池充电、放电时间都相对较短,五次循环之后,性能衰减严重。而采用Ⅱ号电解液的电池循环性能相对较优,第一次循环时间为5.6 h,第二次为5.5 h,性能保持率为98.2 %。而从图7(b)、(c)、(d)可知,当电流密度为0.01×10–3,0.05×10–3A·cm–2时,Ⅲ号电解液和Ⅱ号电解液的电池循环性能接近,相差不大。这表明,在小电流密度下,两种类型的离子液体传导能力尚能满足扩散传质要求,而在大电流密度下,对扩散传质的要求较高,此时Ⅱ号电解液中亲水、疏水两种离子的协同作用有助于电池改善充放电性能,表现出较优的循环性能。
2.4 容量特性
图8为三种电解液组装的锂氧电池在不同电流密度下首次放电容量曲线,从图中看出,当电流密度小于等于0.1×10–3A·cm–2时,Ⅱ号电解液首次放电比容量均优于Ⅲ号和Ⅰ号,而当电流密度大于0.1×10–3A·cm–2时,采用Ⅰ号电解液的电池比容量较优,Ⅱ号电解液其次,Ⅲ号电解液则较低。从图9可以看出Ⅰ号、Ⅱ号电解液组装的锂氧电池首次放电比容量呈先增大后减小变化趋势,分别在电流密度为0.13×10–3,0.025×10–3A·cm–2时取得最大值,其值分别为1 064,2 672 mAh·g–1。Ⅲ号电解液所组装的电池的首次放电容量随着电流密度的增大,比容量先减小后增大又减小的趋势,电流密度为0.05×10–3A·cm–2时取得最大首次放电比容量1 898×10–3A·cm–2。由此,可看出在0.01×10–3~ 0.5× 10–3A·cm–2范围内,即小电流区,添加离子液体的电解液首次放电比容量表现出较好的电化学性能,而在大电流密度区,离子液体的加入反而降低了离子的传质速率,增加了扩散极化,导致电池性能偏低。而[Emim]BF4中BF4离子具有亲水性,而[DEME] TFSI中TFSI则表现出疏水性,亲水性BF4离子与疏水性PF6离子的共同作用,有助于Li离子在电池内部的快速传输,而同为疏水性的TFSI离子与PF6离子相互作用,并没有改善Li离子的传质。因此,采用Ⅱ号复合电解液(LiPF6in [Emim]BF4+EC/EMC/DMC)的锂氧电池相比Ⅲ号复合电解液(LiPF6in [DEME]TFSI +EC/EMC/DMC)表现出较优的比容量。

图7 不同电解液的锂氧电池循环性能Fig.7 The cycle performance of different electrolyte lithium oxygen batteries

图8 不同电解液的锂氧电池在不同电流密度下首次放电容量曲线Fig.8 The first discharge capacity of different electrolyte lithium oxygen batteries under different current densities

图9 不同电解液锂氧电池在十个电流密度下的首次放电容量关系图Fig.9 The first time discharge capacity diagram of different electrolyte lithium oxygen batteries under ten current densities
2.5 功率及能量特性
图10是三种电解液组装的锂氧电池在不同电流密度下放电电压平台曲线,可见,随着电流密度的增加,电池放电电压平台呈下降趋势,但表现出较好的线性关系。从中可以直观地看出放电电流密度增至0.25×10–3A·cm–2后曲线斜率明显下降。说明放电电流密度小于0.25×10–3A·cm–2时,电池放电电压稳定;放电电流密度大于0.25×10–3A·cm–2时,电池放电电压平台相对较低。且电流密度在0.05×10–3~0.25×10–3A·cm–2范围内Ⅰ号电解液的锂氧电池放电电压平台从2.6 V逐渐降到2.3 V,Ⅱ号电解液的锂氧电池平均放电电压处在2.4~2.2 V,Ⅲ号电解液的锂氧电池放电电压处在2.0~2.3 V,并且电流密度在0.01×10–3~0.25×10–3A·cm–2范围内,添加离子液体复合电解液的锂氧电池电压平台相对较低,而当电流密度高于0.25×10–3A·cm–2时,添加离子液体的锂氧电池电压平台输出稳定且较高。
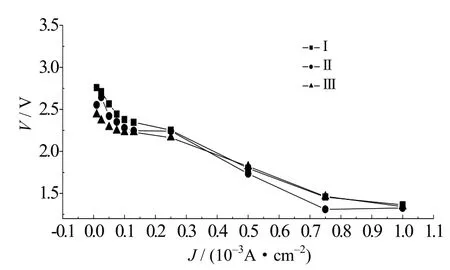
图10 不同电解液的锂氧电池极化曲线Fig.10 The polarization curves of different electrolyte lithium oxygen batteries
图11为不同电解液的锂氧电池在不同电流密度下的功率密度曲线,三者功率密度随着电流密度的增大而递增,呈线性关系,且相差不大,但比功率相对较低。对于锂氧电池而言,比能量是它的优势,图12给出了三种电解液组装锂氧电池能量密度随放电电流的变化规律。从图中可以看出,电流密度小于0.13×10–3A·cm–2时,Ⅱ号电解液的能量密度较Ⅰ号和Ⅲ号都高;电流密度在0.13×10–3~0.5×10–3A·cm–2时,Ⅰ号电解液锂氧电池最大,Ⅱ号次之,Ⅲ号最小;电流密度大于0.5×10–3A·cm–2时,三者较接近。电流密度在0.01×10–3~0.25×10–3A·cm–2范围内时,Ⅰ号电解液锂氧电池在0.13×10–3A·cm–2时得到最大比能量2.287×10–3Wh·cm–2,Ⅱ号电解液锂氧电池在0.025×10–3A·cm–2时得到最大比能量6.468×10–3Wh·cm–2,Ⅲ号电解液锂氧电池在0.01×10–3A·cm–2时得到最大比能量4.118×10–3Wh·cm–2,由此可知,Ⅱ号电解液锂氧电池可以得到最高的比能量,表现出较优的电化学性能。这是由于离子液体的加入不仅改善了复合电解液的稳定性,而且疏水性离子与亲水性离子的协同作用提高了电池能量特性。
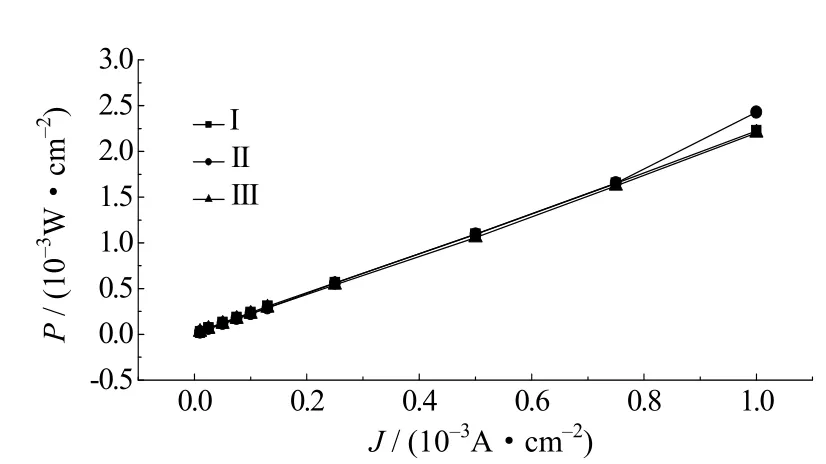
图11 不同电解液的锂氧电池功率密度曲线Fig.11 The power density curves of different electrolyte lithium oxygen batteries
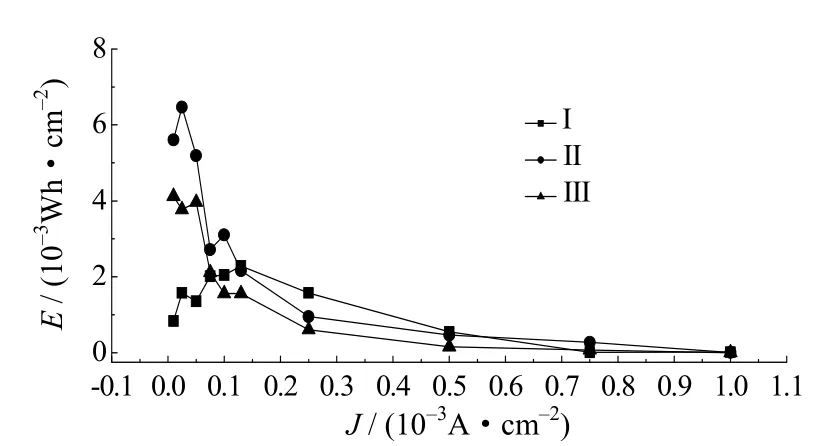
图12 不同电解液的锂氧电池能量密度曲线Fig.12 The energy density curves of different electrolyte lithium oxygen batteries
3 结论
比较研究了采用不同复合电解质的锂氧电池电化学性能,结果表明,采用Ⅱ号复合电解液(LiPF6in [Emim]BF4+EC/EMC/DMC)的电池表现出较优的性能。在电流密度0.01×10–3~0.5×10–3A·cm–2范围内,添加离子液体的电解液首次放电比容量表现出较好的电化学性能,Ⅱ号电解液在电流密度0.025×10–3A·cm–2时取得最大首次放电比容量2 672 mAh·g–1,而在大电流密度区,离子液体的加入反而降低了离子的传质速率,增加了扩散极化,导致电池性能偏低,Ⅱ号复合电解液(LiPF6in [Emim]BF4+EC/EMC/DMC)的锂氧电池适合在小电流区域放电。离子液体的加入不仅改善了复合电解液的稳定性,而且疏水性离子与亲水性离子的协同作用提高了电池能量特性。
致谢:感谢国家自然科学基金项目(21206083)与锦州凯美能源有限公司对本研究的资金支持。
参考文献:
[1] ZHANG J, XU W, LI X H, et al. Air dehydration membranes for nonaqueous lithium-air batteries [J]. J Electrochem Soc, 2010, 157 (8):A940-A946.
[2] ZHANG S S, XU K, READ J. A non-aqueous electrolyte for the operation of Li-air battery in ambient environment [J]. J Power Sources, 2011, 196 (8):3906-3910.
[3] ZHANG J G, WANG D, XU W, et al. Ambient operation of Li-air batteries [J]. J Power Sources, 2010, 195(13):4332-4337.
[4] READ J, MUTOLO K, ERVIN M, et al. Oxygen transport properties of organic electrolytes and performance of lithium-oxygen battery [J]. J Electrochem Soc, 2003, 150(10):A1351-A1356.
[5] XIAO J, HU J, WANG D, et al. Investigation of the rechargeability of Li-O2batteries in non-aqueous electrolyte [J]. J Power Sources, 2011, 196(13):5674-5678.
[6] XU W, VISWANATHAN V V, WANG D, et al. Investigation on the charging process of Li2O2-based air electrodes in Li-O2batteries with organic carbonate electrolytes [J]. J Power Sources, 2011, 196(8):3894-3899.
[7] MIZUNO F, NAKANISHI S, KOTANI Y, et al. Rechargeable Li-air batteries with carbonate-based liquid electrolytes [J]. Electrochemistry, 2010, 78(5):403-405.
[8] HASSOUN J, CROCE F, ARMAND M, et al. Investigation of the O2electrochemistry in a polymer electrolyte solid-state cell [J]. Angewandtechem Int Ed, 2011, 50(13):2999-3002.
[9] WANG Y, ZHENG D, YANG X Q, et al. High rate oxygen reduction in non-aqueous electrolytes with the addition of perfluorinated additives [J]. Energy Environmental Sci, 2011, 4(9):3697-3702.
[10] ZHENG D, YANG X, QU D. High-rate oxygen reduction in mixed nonaqueous electrolyte containing acetonitrile [J]. Chem An Asian J, 2011, 6(12):3306-3311.
[11] FRANCESCA D, FRANCESCA S, MARINA M. Effect of lithium ions on oxygen reduction in ionic liquid-based electrolytes [J]. Electrochem Commun, 2011, 13(10):1090-1093.
[12] LAOIRE C O, MUKERJEE S, ABRAHAM K M. Elucidating the mechanism of oxygen reduction for lithium-air battery applications [J]. J Phys Chem C, 2009, 113(46):20127-20134.
[13] FRANCESCA S A, CHEN Y, PENG Z, et al. Reactions in the rechargeable lithium-O2battery with alkyl carbonate electrolytes [J]. J Am Chem Soc, 2011, 133(20):8040-8047.
[14] LAOIRE C O, MUKERJEE S, ABRAHAM K M. Influence of nonaqueous solvents on the electrochemistry of oxygen in the rechargeable lithium-air battery [J]. J Phys Chem C, 2010, 114(19):9178-9186.
[15] ALLEN C J, MUKERJEE S, PLICHTA E J, et al. Oxygen electrode rechargeability in an ionic liquid for the Li-air battery [J]. J Phys Chem Lett, 2011, 19(2):2420-2424.
[16] HASSOUN J, CROCE F, ARMAND M, et al. Investigation of the O2electrochemistry in a polymer electrolyte solid-state cell [J]. Angewandte Chem Int Ed, 2011, 50(13):2999-3002.
[17] 刘东. 锂空气电池有机电解液的优化及其性能研究 [D]. 深圳:深圳大学, 2015.
[18] 蔡克迪, 赵雪, 仝钰进, 等. 锂氧电池关键技术研究 [J]. 化学进展, 2015, 27(12):1722-1731.
[19] 高勇. 锂-空气电池的研究 [D]. 北京:中国地质大学, 2012.
(编辑:曾革)
Electrochemical performance of composite electrolyte for lithium-oxygen battery
CAI Kedi, ZHAO Xue, LANG Xiaoshi, ZHANG Qingguo, HE Tieshi
(Liaoning Engineering Technology Research Center of Supercapacitor, Bohai University, Jinzhou 121013, Liaoning Province, China)
Abstract:LiPF6in EC/EMC/DMC doped with [Emim]BF4and [DEME]TFSI as a composite electrolyte was designed and fabricated for lithium-oxygen battery, which was studied through the cyclic voltammograms, alternating-current impedance, constant current charge and discharge and so on. While using LiPF6as solute with EC/EMC/DMC, EC/EMC/DMC-[Emim]BF4and EC/EMC/DMC-[DEME]TFSI as organic, the lithium oxygen battery with LiPF6-EC/EMC/DMC-[Emim]BF4composite electrolyte shows the best performance which can get the first discharge specific capacity of 2 672×10–3Ah·g–1at the current density of 0.025×10–3A·cm–2and power density of 6.468×10–3Wh·cm–2.
Key words:lithium-oxygen battery; composite electrolyte; ionic liquids; LiPF6; EC/EMC/DMC; [Emim]BF4
doi:10.14106/j.cnki.1001-2028.2016.06.012
中图分类号:TM912
文献标识码:A
文章编号:1001-2028(2016)06-0056-08
收稿日期:2016-03-21 通讯作者:蔡克迪
基金项目:国家自然科学基金资助项目(No. 21206083);辽宁省高校优秀人才支持计划第一层次项目资助(No. LR2014033)
作者简介:蔡克迪(1982-),男,黑龙江青冈人,副教授,主要从事超级电容器和锂氧电池研究,E-mail:caikedihit@tsinghua.edu.cn ;
