饲料维生素B2水平对团头鲂幼鱼生长性能、体组成、
2016-07-23王菲李向飞李鹏飞
王菲++李向飞++李鹏飞

摘要:研究了团头鲂幼鱼饲料中维生素B2的最适需求量及维生素B2水平对团头鲂幼鱼生长性能、体组成、抗氧化功能和肠道消化酶活性的影响。试验采用单因子浓度梯度法,将鱼随机分为6组,投喂不同水平的维生素B2,分别为166、2.83、4.29、6.15、8.37、11.28 mg/kg的半纯合饲料,每日3次,饱食投喂12周。结果表明,饲料中维生素B2水平对团头鲂幼鱼饵料系数、存活率和形体指标均无显著影响。当饲料中维生素B2水平从1.66 mg/kg升至 6.15 mg/kg 时,团头鲂幼鱼的增质量率和特定生长率均显著增加;当维生素水平进一步升高时,则显著下降。饲料中维生素B2水平对团头鲂幼鱼全鱼的水分、粗蛋白和粗灰分水平均无显著影响。团头鲂幼鱼全鱼粗脂肪水平在饲料中维生素B2水平由1.66 mg/kg升至6.15 mg/kg时则显著升高;当维生素B2水平进一步升高时,则显著下降。当饲料中维生素B2水平从1.66 mg/kg升至4.29 mg/kg时,团头鲂幼鱼肝脏中超氧化物歧化酶、过氧化氢酶活性和还原型谷胱甘肽的含量,以及肠道淀粉酶、蛋白酶和脂肪酶活性均显著升高,当维生素B2水平进一步升高时,则显著下降;丙二醛含量变化趋势则与之相反。根据团头鲂幼鱼增质量率、肝脏维生素B2沉积量和肝脏D-AAO活性进行回归分析结果,团头鲂幼鱼饲料中维生素B2最适添加量分别为5.21、4.65、6.02 mg/kg。
关键词:团头鲂;维生素B2;生长性能;体组成;抗氧化;肠道酶活性
中图分类号: S963.73+1文献标志码: A文章编号:1002-1302(2016)05-0319-05
维生素B2,又称核黄素,是动物必需的水溶性维生素之一,参与机体内氧化还原反应、细胞代谢和呼吸链反应[1]。研究表明,鱼类缺乏维生素B2一般会呈现食欲减退和生长缓慢的症状[2]。鲑属鱼类缺乏维生素B2时,除了生长缓慢,眼睛还会出现畏光、白内障、出血及角膜新生血管等症状[3-5],大鳞大麻哈鱼(Oncorhynchus tshawytscha)、虹鳟(Salmo gairdneri)还会出现体色变深和身体平衡失调等情况[4,6];然而,Woodward在虹鳟幼鱼缺乏维生素B2试验中并未发现以上症状,但缺乏维生素B2的幼鱼却表现出严重的鳍部侵蚀、体色变浅和高死亡率的情况[7]。此外,同种鱼类维生素B2的缺乏亦有不同表症。例如,斑点叉尾(Ietalurus punetaus) 缺乏维生素B2时会出现单侧或2侧的白内障[8],Murai等发现维生素B2的缺乏仅会导致斑点叉尾生长迟缓和体长变短[9]。研究表明,维生素B2缺乏症具有明显的特异性,且与鱼类的种类、生长阶段、环境、食性等有着密切的联系。鱼类饲料原料中的维生素B2水平并不能满足鱼类生长的需要,必须额外添加一定量的维生素B2进行补充[1-2],充分说明维生素B2对鱼类生长的必要性。
Chen等发现,缺乏维生素B2会削弱草鱼(Ctenopharyngodon idella)幼鱼鳃部的抗氧化能力[10];Yates等研究表明,维生素B2可提高大鼠(Rattus norvegicus)的胃肠道功能[11];Li等也在对建鲤(Cyprinus carpio var. Jian)的研究中得出,饲料中添加维生素B2会促进其幼鱼消化能力的增强[12]。前人研究指出,鱼类的生长和其抗氧化功能及肠道酶活性密切相关[10,13],目前,尚未有文献直接指明饲料维生素B2水平与团头鲂(Megalobrama amblycephala)幼鱼抗氧化功能和肠道酶活性的关系,因此本试验开展团头鲂幼鱼营养需求相关方面的研究。
团头鲂是中国重要的草食性淡水经济鱼类[14]。近年来,团头鲂的养殖量迅速增长[15],但针对团头鲂营养需求的研究还很有限。目前,团头鲂的营养需求研究主要集中在三大营养物质、氨基酸和脂溶性维生素等方面[16-20],而水溶性维生素的研究尚较缺乏。本试验着重探讨了团头鲂幼鱼的适宜维生素B2需求量及其对鱼体抗氧化功能和肠道酶活性的影响,以期为团头鲂维生素营养需求资料的完善提供理论基础,并为营养饲料配方提供科学依据。
1材料与方法
1.1试验饲料
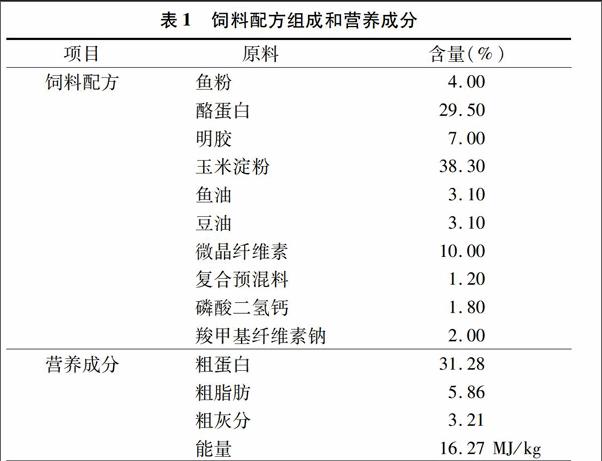
本试验采用单因子设计,配制6组半纯合饲料,分别添加维生素B2水平为0、2、4、6、8、10 mg/kg[12](饲料中维生素B2实际水平为1.66、2.83、4.29、6.15、8.37、11.28 mg/kg)。试验饲料以进口的秘鲁鱼粉、酪蛋白和明胶为蛋白源,以豆油和鱼油为脂肪源(按照1 ∶1的比例添加),以玉米淀粉为糖源,以微晶纤维素作为填充物,以羧甲基纤维素钠为黏结剂[14]。饲料原料先粉碎,按照配方称重后将各原料逐级均匀混合,充分混合后加入一定量的水再混合,然后用小型制粒机加工成粒径为2 mm左右的颗粒饲料,常温风干后置于4 ℃冰箱保存备用[14,16,18]。饲料组成及营养成分见表1。
1.2试验团头鲂及养殖管理
试验鱼养殖于南京农业大学浦口试验基地室内流水系统中,驯化14 d,其间投喂不含维生素B2的基础饲料,驯化后挑选体格健壮、规格整齐、体质量为(41.52±0.15)g的幼鱼288尾,随机分成6组,每组4个重复,每个重复12尾。每日饱食投喂3次(时间分别在07:30、11:30、16:30),养殖期为12周。试验期间,全程微流水循环(1.5 L/min),水温控制在 25~30 ℃,pH值为7.0~7.5,全天24 h充氧。
1.3指标测定方法
1.3.1生产性能统计和样本采集养殖结束后,将鱼饥饿24 h采样。统计每缸的尾数并称总质量,从中随机取出6尾鱼逐尾称质量和测量体长,其中2尾鱼冰冻保存用以测定全鱼体组成,另外4尾鱼置于冰盘上解剖,取出内脏团称质量。然后,分离出肝脏,用预冷的0.85%生理盐水清洗,用滤纸吸干并称质量,将其置于-70 ℃冷冻保存,用于抗氧化功能的测定;取肠道中段,并用生理盐水冲洗肠道内部清除内容物,将其置于-70 ℃冷冻保存,用于肠道酶活性的测定。
生产性能的计算公式如下:
增质量率(WGR)=(mt-m0)/m0×100%;
特定生长率(%/d)=[ln(mt)-ln(m0)]/t×100%;
饵料系数(FCR)=F/(mt-m0);
肥满度(CF)=mt(g)/体长3(cm3)×100%;
肝体比(HSI)=肝脏质量(g)/全鱼质量(g)×100%;
脏体比(VSI)=内脏质量(g)/全鱼质量(g)×100%;
成活率(SR)=试验结束时总尾数/试验开始时总尾数×100%。
式中:m0为鱼体初质量,g;mt为鱼体末质量,g;F为摄食量,g;t为饲养天数,d。
1.3.2样品测定饲料原料和团头鲂幼鱼全鱼概略养分测定参考AOAC的方法[21]。将饲料和全鱼称质量后置于培养皿中,在(105±2) ℃的烘箱中烘至恒质量测定水分水平。粗蛋白(N×6.25)水平采用全自动凯氏定氮仪(FOSS KT260,瑞士)测定;粗脂肪水平采用索氏抽提法测定(2050;FOSS Tector);将样品置于电炉上炭化后,在马福炉中于(550±20) ℃ 下灼烧5 h后测得饲料和全鱼中粗灰分水平;饲料总能采用氧弹测热仪(Parr 1281,美国)测定。
饲料及团头鲂幼鱼肝脏中维生素B2水平参考Callmer等的方法[22]测定。肝脏组织匀浆液的制备及酶活性的测定:将肝脏准确称质量,以1 ∶4(组织 ∶生理盐水)的比例加入预冷的生理盐水后冰浴匀浆,然后于3 000 r/min离心10 min,收集上清液并存放于4 ℃冰箱。待测肝脏D-氨基酸氧化酶(D-amino acid oxidation,D-AAO)活性参考Woodward的方法[23]进行测定。肝脏超氧化物歧化酶(SOD)活性按照Jin等描述的方法[24]测定;还原型谷胱甘肽(GSH)和丙二醛(MDA)水平参照Zhang等的方法测定[25];过氧化氢酶(CAT)活性测定参考Jiang等的方法测定[26]。
肠道组织匀浆液的制备及酶活性的测定:将肠道准确称质量,按1 ∶9(组织 ∶生理盐水)加入预冷生理盐水后冰浴匀浆,制成20%组织匀浆,然后于3 000 r/min离心10 min,收集上清液并存放于4 ℃冰箱。肠道蛋白酶采用福林-酚法[27]测定;淀粉酶和脂肪酶活性参考Furné等的方法[28]测定。
1.4数据统计与分析
试验数据采用SPSS 19.0软件分析,结果以“平均值±标准误”表示。先进行单因素方差分析,采用Tukey氏法做多重比较分析组间差异显著程度,显著水平设定为P<0.05。
2结果与分析
2.1饲料维生素B2水平对团头鲂幼鱼生长性能和形体指标的影响
饲料中维生素B2水平量对团头鲂幼鱼饵料系数、存活率和形体指标均无显著影响(表2)。当饲料中维生素B2水平从1.66 mg/kg升至6.15 mg/kg时,团头鲂幼鱼的增质量率和特定生长率均显著增加;而当维生素水平进一步升高时,又显著下降。以饲料中维生素B2水平为横坐标,团头鲂幼鱼增质量率为纵坐标进行双折线回归分析,得出y=4.032 7x+64.532(r=0.978 0)和y=-0.643 2x+88.905(r=0.943 2) 2个方程式。对其求解,得出当饲料中维生素B2水平为 5.21 mg/kg 时,团头鲂幼鱼有最大增质量率(图1)。
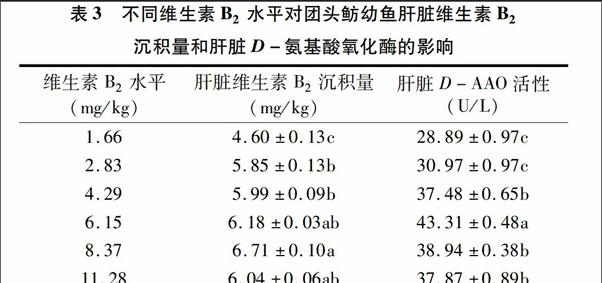
2.2饲料维生素B2水平对团头鲂幼鱼肝脏维生素B2沉积量和D-氨基酸氧化酶活性的影响当饲料中维生素B2水平由1.66 mg/kg升至8.37 mg/kg时,团头鲂幼鱼肝脏中维生素B2沉积量显著增加;当维生素B2水平进一步升高时,则无显著差异。饲料中维生素B2水平由1.66 mg/kg升至6.15 mg/kg时,团头鲂幼鱼肝脏D-AAO 活性显著增加;当维生素B2水平进一步升高时,则显著下降(表3)。
2.3饲料维生素B2水平对团头鲂幼鱼全鱼体组成的影响
饲料中维生素B2水平对团头鲂幼鱼全鱼的水分、粗蛋白和粗灰分均无显著影响(表4)。当饲料中维生素B2水平由1.66 mg/kg升至6.15 mg/kg时,团头鲂幼鱼全鱼粗脂肪含量显著增加;当维生素B2水平进一步增加时,则显著下降。
2.4饲料维生素B2水平对团头鲂幼鱼肝脏抗氧化功能的影响
当饲料中维生素B2水平由1.66 mg/kg升至4.29 mg/kg时,团头鲂幼鱼肝脏中超氧化物歧化酶、还原型谷胱甘肽和过表4不同维生素B2水平对团头鲂幼鱼全鱼组成的影响
维生素B2水平氧化氢酶都显著升高;当维生素B2水平进一步升高时,则显著下降。饲料中维生素B2水平由1.66 mg/kg升至 2.83 mg/kg 时,团头鲂幼鱼肝脏丙二醛含量显著降低;当维生素B2水平进一步升高时,则差异不显著(表5)。
2.5饲料维生素B2水平对团头鲂幼鱼肠道消化酶活性的影响
饲料中维生素B2水平由1.66 mg/kg升至4.29 mg/kg时,团头鲂幼鱼肠道蛋白酶活性显著升高,当维生素B2水平进一步升高时,则差异不显著;饲料中维生素B2水平由1.66 mg/kg 升至6.15 mg/kg时,团头鲂幼鱼肠道淀粉酶和脂肪酶活性显著升高,当维生素B2水平进一步升高时,淀粉酶活性则差异不显著,而脂肪酶活性显著下降(表6)。
3讨论与结论
3.1饲料维生素B2最适需求量
根据前人研究,有些鱼类缺乏维生素B2会出现眼球出血、畏光等情况[3-5]。Deng等饲喂肉食性鱼类杂交鲈(Morone chrysops ♀ × Morone saxatilis ♂) 8周试验中,出现上述缺乏症[1]。而本试验中,团头鲂幼鱼却并未出现此种症状。这可能是由于养殖试验环境、周期、鱼的种类和食性不同所致[1,12]。鱼类缺乏维生素B2最为普遍的症状便是生长减缓[3-6],与本试验结果一致。当饲料中维生素B2水平是1.66 mg/kg 时,团头鲂幼鱼末质量、增质量率和特定生长率均最小,与维生素B2水平较多的处理组相比有显著差异;当维生素B2水平达到6.15 mg/kg时,末质量、增质量率和特定生长率达到最大值,这可能是由于在此条件下,团头鲂幼鱼有较高肠道消化酶活性,从而提高其对饲料的利用率[29]。根据团头鲂幼鱼增质量率和饲料中维生素B2水平进行回归分析,得出团头鲂幼鱼维生素B2最适需求量为5.21 mg/kg,比建鲤维生素B2最适需求量4.22 mg/kg[12]偏大,这可能是因为其试验采用的建鲤幼鱼初质量在23.39 g左右,比本试验所用的团头鲂幼鱼小,而小鱼对于维生素B2的缺乏较为敏感[1]。
肝脏维生素B2的沉积量也是衡量鱼类维生素B2需求量的一个重要指标[30]。通过对团头鲂幼鱼肝脏维生素B2沉积量进行回归分析,饲料中维生素B2最适添加量为 4.65 mg/kg,与Halver在鲑鱼6~8 mg/kg[30]和Amezaga在虹鳟4.4~11.4 mg/kg[31]中所得的结果有所差别,这可能是由于鱼的种类不同导致肝脏维生素B2沉积量的差异,同时也证明了维生素B2并不会在肝脏中累积。除此之外,Woodward在针对虹鳟的试验中表明,D-AAO活性是衡量其维生素B2需求量一个更为敏感稳定的指标[32],该论断也在本试验中得到验证。以肝脏D-AAO活性为考量进行回归分析,得出团头鲂幼鱼饲料中维生素B2最适添加量为6.02 mg/kg,与 Serrini 在斑点叉尾研究中所得最适需求量为6 mg/kg结果[33]基本一致,表明团头鲂幼鱼维持生理需求的维生素B2水平高于正常生长需要水平。
生产实践中一般推荐以增质量率为指标,回归分析所得最适需求量作为考量,但鉴于鱼类对维生素B2的需求量与很多环境因素相关[1,14],且日粮中合理的原料配比可以降低其对维生素B2的需求量[32],所以试验所得数据若要应用于生产,应仔细考虑生产实践与试验条件的差异,并进行合理调整。
3.2饲料维生素B2水平对团头鲂幼鱼全鱼体组成的影响
本试验结果表明,饲料中维生素添加量对团头鲂幼鱼全鱼水分、蛋白质和灰分均无显著影响。根据以往的研究可知该结果是合理的,鱼类全鱼体组成中,粗蛋白和粗灰分水平与日粮组成并无直接联系,而与其年龄与规格有关[34-35]。当饲料中维生素B2水平由1.66 mg/kg升至6.15 mg/kg时,团头鲂幼鱼全鱼粗脂肪水平显著增加,当维生素B2水平进一步增加时,则又呈显著下降趋势,这也与Li等在草鱼中所得结果[12]一致。由前人研究可知,维生素B2确实与机体脂肪代谢相关[2],但其粗脂肪水平的变化是否因为维生素B2水平变化而直接引起的还有待进一步研究。
3.3饲料维生素B2水平对团头鲂幼鱼肝脏抗氧化功能的影响
机体在呼吸和细胞代谢过程中会产生氧自由基,当氧自由基及代谢过程副产物过量时,机体会出现不同程度的氧化损伤[14,36],及时清除过量的自由基可以降低机体氧化损伤的程度。本试验中当维生素B2水平由1.66 mg/kg升至4.29 mg/kg 时,肝脏MDA含量显著下降,当维生素B2水平进一步上升时,则差异不显著。表明维生素B2水平的升高可以在一定范围内减弱鱼体遭受自由基攻击的程度,减轻鱼体的氧化应激损伤[36-38]。当维生素B2水平由1.66 mg/kg升至4.29 mg/kg时,肝脏SOD、CAT活性和GSH含量均呈上升趋势,并与对照组差异显著;而当维生素B2水平进一步升高时,则差异不显著。表明维生素B2水平的升高可以促使CAT活性提高,使之能更好地消除体内过多的过氧化氢,避免多余自由基的产生,从而使细胞免受过氧化损伤;促使SOD和GSH清除自由基的能力增强,减弱自由基对鱼体的胁迫程度[36-38]。因此,在饲料中适当升高维生素B2水平可以降低MDA含量,提高SOD、CAT活性,增加GSH含量,进而提高团头鲂幼鱼的抗氧化功能。
3.4饲料维生素B2水平对团头鲂幼鱼肠道消化功能的影响
肠道是鱼类进行消化吸收的主要场所,尤其对无胃鱼类来说[12,38],肠道消化酶参与细胞腔消化,可在一定程度上反映鱼类的消化能力,对鱼类生长起着重要作用[12,29]。本试验中随着维生素B2水平的升高,团头鲂幼鱼肠道淀粉酶、蛋白酶和脂肪酶活性也显著增加,但当维生素B2水平进一步升高时,淀粉酶和蛋白酶活性无显著差异,表明维生素B2可以在一定范围内提高团头鲂肠道消化酶的活性,从而增强其对营养物质的消化,增加其消化功能,这与Li等对建鲤的研究结果[12]一致。本试验中肠道酶活性较高的组也有较好的增质量率,进一步证明肠道酶活性对鱼类生长起重要作用[29]。
综上所述,分别根据团头鲂幼鱼增质量率、肝脏维生素B2沉积量和肝脏D-AAO活性进行回归分析,饲料中维生素B2最适添加水平分别为5.21、4.65、6.02 mg/kg,并且在一定范围内添加饲料中维生素B2水平可以显著提高团头鲂幼鱼的抗氧化能力,增强肠道消化功能。
参考文献:
[1]Deng D F,Wilson R P. The riboflavin requirement of juvenile sunshine bass(Morone chrysops♀×Morone saxatilis♂)[J]. Aquaculture,2003,218:695-701.
[2]National Research Council. Nutrient requirements of fish and shrimp[M]. Washington D C:the National Academies Press,2011.
[3]McLaren B A,Keller E,O'Donnell D J,et al. The nutrition of rainbow trout. 1. Studies of vitamin requirements[J]. Archives of Biochemistry and Biophysics,1947,15:169-178.
[4]Halver J E. Nutrition of salmonids fishes. 4. Water-soluble vitamin requirements of Chinook salmon[J]. The Journal of Nutrition,1957,62:225-243.
[5]Takeuchi L,Takeuchi T,Ogino C. Riboflavin requirements in carp and rainbow trout[J]. Bullentin of the Japanese Society of Scientific Fisheries,1980,46:733-737.
[6]Kitamura S,Suwa T,Ohara S,et al. Studies on vitamin requirements of rainbow trout. 2. The deficiency symptoms of fourteen kinds of vitamins[J]. Bullentin of the Japanese Society of Scientific Fisheries,1967,33:1120-1125.
[7]Woodward B. Symptoms of severe riboflavin deficiency without ocular opacity in rainbow trout(Salmo gairdneri)[J]. Aquaculture,1984,39:275-281.
[8] Dupree H K. Vitamins essential for growth of channel catfish,Ietalurus punetaus:Technical Paper No. 7 [R]. Washington D C:U. S. Bureau of Sport Fisheries and Wildlife,1966:7.
[9]Murai T,Andrews J W. Riboflavin requirement of channel catfish fingerlings[J]. The Journal of Nutrition,1978,108(9):1512-1517.
[10]Chen L,Feng L,Jiang W D,et al. Dietary riboflavin deficiency decreases immunity and antioxidant capacity,and changes tight junction proteins and related signaling molecules mRNA expression in the gills of young grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology,2015,45(2):307-320.
[11]Yates C A,Evans G S,Pearson T,et al. Absence of luminal riboflavin disturbs early postnatal development of the gastrointestinal tract[J]. Digestive Diseases and Sciences,2003,48(6):1159-1164.
[12]Li W,Zhou X Q,Feng L,et al. Effect of dietary riboflavin on growth,feed utilization,body composition and intestinal enzyme activities of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. Aquaculture Nutrition,2010,16(2):137-143.
[13]Hakim Y,Uni Z,Hulata G,et al. Relationship between intestinal brush border enzymatic activity and growth rate in tilapias fed diets containing 30% or 48% protein[J]. Aquaculture,2006,257(1/2/3/4):420-428.
[14]Qian Y,Li X F,Sun C X,et al. Dietary biotin requirement of juvenile blunt snout bream,Megalobrama amblycephala[J]. Aquaculture Nutrition,2014,20(6):616-622.
[15]农业部渔业局. 中国渔业年鉴[M]. 北京:中国农业出版社,2013:31-32.
[16]Li X F,Liu W B,Jiang Y Y,et al. Effects of dietary protein and lipid levels in practical diets on growth performance and body composition of blunt snout bream(Megalobrama amblycephala) fingerlings[J]. Aquaculture,2010,303:65-70.
[17]Zhou Z,Ren Z,Zeng H,et al. Apparent digestibility of various feedstuffs for blunt snout bream,Megalobrama amblycephala[J]. Aquaculture Nutrition,2008,14:153-165.
[18]姜雪姣,梁丹妮,刘文斌,等. 团头鲂对8种非常规饲料原料中营养物质的表观消化率[J]. 水产学报,2011,35(6):932-939.
[19]刘梅珍,石文雷,朱晨炜,等. 饲料中脂肪的含量对团头鲂鱼种生长的影响[J]. 水产学报,1992,16(4):330-336.
[20]周明,刘波,戈贤平,等. 饲料维生素E添加水平对团头鲂生长性能及血液和肌肉理化指标的影响[J]. 动物营养学报,2013,25(7):1488-1496.
[21]Association of Official Analytical Chemists. Official methods of analysis[M]. Washigton D C:AOAC,1980.
[22]Callmer K,Davies L. Separation and determination of vitamin B1,B2,B6 and nicotinamide in commercial vitamin preparations using high performance cation-exchange chromatography[J]. Chromatographia,1974,7:644-650.
[23]Woodward B. Riboflavin requirement for growth,tissue saturation and maximal flavin-dependent enzyme activity in young rainbow trout(Salmo gairdneri)at two temperatures[J]. The Journal of Nutrition,1985,115:78-84.
[24]Jin Y,Tian L X,Zeng S L,et al. Dietary lipid requirement on non-specific immune responses in juvenile grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology,2013,34(5):1202-1208.
[25]Zhang X D,Zhu Y F,Cai L S,et al. Effects of fasting on the meat quality and antioxidant defenses of market-size farmed large yellow croaker (Pseudosciaena crocea)[J]. Aquaculture,2008,280(1/2/3/4):136-139.
[26]Jiang W D,Feng L,Liu Y,et al. Myo-inositol prevents oxidative damage,inhibits oxygen radical generation and increases antioxidant enzyme activities of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. Aquaculture Research,2009,40(15):1770-1776.
[27]Lowry O H,Rosebrough N J,Farr A L,et al. Protein measurement with the Folin phenol reagent[J]. The Journal of Biological Chemistry,1951,193(1):265-275.
[28]Furné M,Hidalgo M C,López A,et al. Digestive enzyme activities in Adriatic sturgeon Acipenser naccarii and rainbow trout Oncorhynchus mykiss:a comparative study[J]. Aquaculture,2005,250(1/2):391-398.
[29]Hakim Y,Uni Z,Hulata G,et al. Relationship between intestinal brush border enzymatic activity and growth rate in tilapias fed diets containing 30 or 48 protein[J]. Aquaculture,2006,257(1/2/3/4):420-428.
[30]Halver J E. The vitamins[M]//Halver J E. Fish nutrition. 3nd ed. New York:Academic Press,2002:66-98.
[31]Amezaga M R,Knox D. Riboflavin requirements in on-growing rainbow trout,Oncorhynchus mykiss[J]. Aquaculture,1990,88:87-98.
[32]Woodward B. Sensitivity of hepatic D-amino acid oxidase and glutathione reductase to the riboflavin status of the rainbow trout(Salmo gairdneri)[J]. Aquaculture,1983,34:193-201.
[33]Serrini G,Zhang Z,Wilson R P. Dietary riboflavin requirement of fingerling Channel catfish(Ictalurus punctatus)[J]. Aquaculture,1996,139:285-290.
[34]Woodward B. Dietary vitamin requirements of cultured young fish,with emphasis on quantitative estimates for salmonids[J]. Aquaculture,1994,124:133-168.
[35]Lanari D,Poli B M,Ballestrazzi R. The effects of dietary fat and NFE levels on growing European sea bass(Dicentrarchus labrax L.):Growth rate,body and fillet composition,carcass traits and nutrient retention efficiency[J]. Aquaculture,1999,179:351-364.
[36]Lackner R. Oxidative stress in fish by environmental pollutants[J]. Fish Ecotoxicology,1998,86:203-224.
[37]韩雨哲,姜志强,任同军,等. 氧化鱼油与棕榈油对花鲈肝脏抗氧化酶及组织结构的影响[J]. 中国水产科学,2010,17(4):798-806.
[38]钱妤,孙存鑫,刘文斌,等. 饲粮生物素水平对团头鲂幼鱼肠道消化酶活性、胴体组成及肝脏抗氧化能力的影响[J]. 浙江农业学报,2014,26(2):309. 314.周西,詹政军,季亚培,等. 饵料种类对黄颡鱼仔稚鱼不同阶段生长和存活的影响[J]. 江苏农业科学,2016,44(5):324-327.
