白蛋白结合型紫杉醇治疗晚期宫颈癌的效果及安全性
2016-07-22姬时宇
姬时宇 胡 毅
解放军总医院肿瘤内一科,北京 100853
白蛋白结合型紫杉醇治疗晚期宫颈癌的效果及安全性
姬时宇胡毅▲
解放军总医院肿瘤内一科,北京100853
目的分析使用白蛋白结核性紫杉醇对晚期宫颈癌患者的疗效及安全性。方法选取2012年5月~2015年8月解放军总医院治疗的晚期妇科癌症患者23例,所有患者均采用白蛋白结合型紫杉醇进行化疗,药物用量为175 mg/m2,滴注时间为30 min,第1天滴注,21 d为1个疗程,所有患者均完成2个疗程以上化疗,治疗后评价其疗效。结果治疗后晚期宫颈癌患者完全缓解1例,部分缓解15例,病情稳定5例,进展2例。总有效率为69.6%。白蛋白结合型紫杉醇的安全性评估发现,患者血液毒性较重,胃肠道毒性、肝肾毒性、神经毒性较轻。结论使用白蛋白结合型紫杉醇对晚期宫颈癌患者进行治疗,其有效性、安全性均较高。
白蛋白结合型紫杉醇;晚期宫颈癌;疗效;安全性
[Abstract]Objective To ana1yze the efficacy and safety of Pac1itaxe1 in patients with advanced cervica1 cancer. Methods From May 2012 to August 2015,23 patients with advanced gyneco1ogic cancer treated in Chinese PLA Genera1 Hospita1 were se1ected,a11 patients were given the a1bumin-bound Pac1itaxe1 chemotherapy,drug dosage was 175 mg/m2,infusion time was 30 min.Infusion at the first day of Chemotherapy,with 21 days for a course of treatment,2 or more cyc1es of chemotherapy were carried out in a11 patients.Curative effect was eva1uated after treatment.Results After treatment,1 cases of comp1ete remission,15 cases of partia1 remission,5 cases of stab1e disease,2 cases of progress,and the tota1 effective rate was 69.6%.Safety eva1uation of a1bumin-bound Pac1itaxe1 found that,the b1ood toxicity was re1ative1y heavy,toxicity of gastrointestina1,1iver and kidney,and neurotoxicity were mi1der.Conclusion A1buminbound Pac1itaxe1 is effective and safe for patients with advanced cervica1 cancer.
[Key words]A1bumin-bound Pac1itaxe1;Advanced cervica1 cancer;Efficacy;Safety
宫颈癌是较常见的妇科癌症之一[1],病因不详,具有高发病率、高死亡率、发病女性越来越年轻化的特点[2-3]。以往,放射疗法是晚期宫颈癌患者的常用治疗方法[4],但是由于晚期宫颈癌患者的肿瘤细胞浸润范围较大,情况危重,放射疗法已无法控制病情,在化疗引入后,才使晚期癌症患者的病情得以控制[5]。白蛋白结合型紫杉醇是目前最常用的化疗药物之一,它是一种新型紫杉醇[6],与普通紫杉醇比较,更加安全有效[7],且越来越多的学者将该类紫杉醇应用到妇科肿瘤的治疗中[8]。笔者采用白蛋白结合型紫杉醇对来解放军总医院(以下简称“我院”)肿瘤科就诊的晚期宫颈癌患者进行治疗,分析其疗效及安全性,现报道如下:
1 资料与方法
1.1一般资料
选取2012年5月~2015年8月来我院治疗的晚期妇科癌症患者23例(诊断标准参照文献[9]),年龄37~78岁,中位年龄49岁,年龄≤60岁20例,>60岁3例;所有患者均发现癌细胞转移,其中卵巢转移10例;腺癌18例,鳞状细胞癌5例;Ⅱa期1例,Ⅲ~Ⅳ期3例,Ⅲc期8例,Ⅳ期11例;首次治疗6例,非首次治疗17例,其中包括手术复发9例,保守治疗后进展8例;患者病程发展情况不一,难治型4例,复发型5例,病程进展中6例。
1.2方法
23例患者均使用白蛋白结合型紫杉醇(美国Abraxis BioScience,注册证号:H20091059)进行治疗,其中单纯使用白蛋白结合型紫杉醇化疗者2例;白蛋白结核性紫杉醇靶向治疗者9例;白蛋白结合型紫杉醇联合铂类化疗药物进行化疗者11例,其中联合奈达铂(江苏奥赛康药业股份有限公司,批准文号:国药准字H20064295)进行治疗的患者1例,联合顺铂(江苏豪森药业股份有限公司,批准文号:国药准字H20040813)治疗4例,联合卡铂(扬子江药业集团有限公司,批准文号:国药准字H20044616)治疗6例;白蛋白结核性紫杉醇靶向治疗者9例中,晚期宫颈癌患者中靶向治疗4例,白蛋白结核性紫杉醇+替吉奥方案1例,白蛋白结核性紫杉醇联合铂类治疗3例,单方治疗1例。药物用量为结合型紫杉醇用量175 mg/m2,滴注30 min,第1天滴注,以21 d为1个疗程,顺铂用量为75 mg/m2,使用250 mL生理盐水稀释后静滴,滴注120 min,化疗第1天滴注;卡铂按350 mg/m2的剂量进行滴注,滴注60 min,化疗第1天滴注;奈达铂按照80 mg/m2的剂量进行滴注,滴注90 min。化疗第1天滴注。均为2个以上疗程。
1.3疗效及安全性评价
化疗结束后,采用WHO对实体瘤的评估标准[7]进行疗效评价,患者恢复情况分为完全缓解(CR)、部分缓解(PR)、病情稳定(SD)、进展(PD),观察2个疗程后的总有效率(ORR)=(CR+PR)/总例数×100%。观察患者的总生存(OS)和无进展生存(PFS)。评判方法为CT或PET/CT。观察白蛋白结合型紫杉醇治疗晚期宫颈癌的疗效、安全性及不良反应。不良反应分级依据世界卫生组织分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ度5个级别:0度为无反应,Ⅰ度为轻度反应,Ⅱ度为中度,Ⅲ度为重度反应,Ⅳ度为极重度反应。
1.4统计学方法
采用SPSS 17.0统计学软件进行数据分析,患者总生存图、无进展生存图则使用Kap1an-Meier生存分析软件进行绘制。
2 结果
2.1疗效分析
治疗后患者的ORR为69.6%,其中CR 1例,PR 15例,SD 5例,PD 2例。
2.2生存分析
癌患者的1年OS为95.7%(22/23),见图1。23例患者1年PFS占30.4%(7/23)。中位PFS为9个月(95%CI:8~17个月)。见图2。
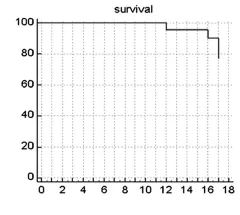
图1 晚期宫颈癌患者治疗后生存情况分析

图2 晚期宫颈癌患者治疗后无进展生存情况分析
2.3不良反应分析
白蛋白结合型紫杉醇的安全性评估研究表明,治疗晚期宫颈癌的23例患者中,血液毒性较重,Ⅰ~Ⅳ度白细胞减少率达到了100%,Ⅰ~Ⅳ度粒细胞降低也超过了50%,血小板减少发生率较低,占21.7%;白蛋白结合型紫杉醇引起的胃肠道反应多为轻度的呕吐反应,Ⅰ~Ⅳ度占73.9%(17例)。肝肾损伤程度较小,谷草转氨酶及谷丙转氨酶只有轻度升高。无严重不良事件发生。上述毒副作用经对症处理后,均恢复到化疗前指标,没有出现因不可逆毒副作用而导致暂停使用白蛋白结合型紫杉醇化疗的患者。见表1。
3 讨论
宫颈癌是较常见的妇科癌症之一,具有高发病率、高死亡率的特点,并且患者年龄愈发年轻化。目前其致病机制至今不详[10],可能与病毒感染、分娩或者性行为有关[11],也可能与地理差异或环境因素有关[12]。研究发现[13],宫颈癌死亡率在妇科肿瘤死亡率中占第二位,在全部肿瘤的死亡率中高达11.67%。随着医疗水平的发展,宫颈癌的发展已得到了很好的控制,但是由于体质差异,也有部分患者发展为晚期癌症。以往常常将放疗作为治疗晚期宫颈癌的手段[14]。但是往往晚期宫颈癌患者的病情较重,癌细胞浸润范围不断扩大,同时伴有部分癌细胞对放射治疗不敏感,因此单纯使用放疗手段无法达到控制病情且延长患者生命周期的目的,在不断的研究中发现,对宫颈癌患者进行化学治疗,可以很好地控制患者的病情,并且可以改善患者的生存质量[15-17]。随着各种化疗药物的问世,宫颈癌患者的生存质量及生存周期都在不断提高。
紫杉醇类药物是目前最常用的化疗药物之一,对于肿瘤的治疗取得了突破性的进展,白蛋白结合型紫杉醇是一种新型紫杉醇[18],与普通紫杉醇比较,更加安全有效,且不良反应更低。相关报道指出[19],白蛋白结合型紫杉醇单独用于肺癌等晚期癌症治疗的研究较多[20-21],且该类型紫杉醇的应用越来越广泛。但是对于该类型紫杉醇联与铂类联合治疗妇科癌症的相关报道较少。笔者采用白蛋白结合型紫杉醇单方或者结合铂类等治疗方案对来我院肿瘤科就诊的晚期宫颈癌患者进行治疗,结果显示,CR 1例,PR 15例,而SD 5例。而2个治疗周期的治疗后ORR达到了69.6%。本次研究中的生存分析结果也显示,患者的1年OS为95.7%。另外,对治疗后患者的不良反应进行总结后发现,患血液毒性较重,同时伴有轻微的消化道毒性、肝肾毒性、神经毒性。与以往的紫杉醇类药物比较,该类型紫杉醇的疗效升高,副作用则明显降低[22-23]。
综上所述,使用白蛋白结合型紫杉醇对晚期宫颈癌进行治疗,其安全性较高,副作用较低。本研究对于临床使用蛋白结核型紫杉醇作为抗癌药物的前景提供了具体的实践基础,具有科学的指导意义。

表1 治疗后患者不良反应发生情况(例)
[1]马亚琪,刘爱军.宫颈癌及癌前病变病理诊断及研究进展[J].实用妇产科杂志,2015,31(11):803-805.
[2]Lynge E,Rygaard C,Bai11et M,et a1.Cervica1 cancer screening at crossroads[J].APMIS,2014,122(8):667-673.
[3]Li S,Hu T,Lv W,et a1.Changes in preva1ence and c1inica1 characteristics of cervica1 cancer in the Peop1e's Repub1ic of China:a study of 10 012 cases from a nationwide working group[J].Onco1ogist,2013,18(10):1101-1107.
[4]Whitfie1d G,Jainpgreen M,Green M,et a1.Quantifying motion for pancreatic radiother radiotherapy margin ca1cu1ation[J].Radiother Onco1,2012,103(3):360-366.
[5]Osman M.The ro1e of neoadjuvant chemotherapy in the management of 1oca11y advanced cervix cancer:a systematic review[J].Onco1 Rev,2014,8(2):250.
[6]Ibrahim NK,Desai N,Legha S,et a1.Phase I and pharmacokinetic study of ABI-007,a Cremophor-free,proteinstabi1ized,nanopartic1e formu1ation of Pac1itaxe1[J].C1in Cancer Res,2002,8(5):1038-1044.
[7]Desai N,Trieu V,Yao Z,et a1.Increased antitumor activity,intratumor Pac1itaxe1 concentrations,and endothe1ia1 ce11 transport of cremophor-free,a1bumin-bound Pac1itaxe1,ABI-007,compared with cremophor-based Pac1itaxe1[J]. C1in Cancer Res,2006,12(4):1317-1324.
[8]曾靖,张蓉.白蛋白结合型紫杉醇在妇科肿瘤中的研究进展[J].国际妇产科学杂志,2014,41(3):232-235.
[9]董家斌,吴尚为.宫颈癌的早期诊断与防治[J].中华现代妇产科学杂志,2008,5(6):496-499.
[10]Martín AG.Mo1ecu1ar bio1ogy of cervica1 cancer[J].C1inica1 and Trans1ationa1 Onco1ogy,2007,9(6):347-354.
[11]蒋丰,陈忠东.晚期宫颈癌的治疗新进展[J].医学信息,2014,(7):516.
[12]郑怀美.妇产科学[M].北京:人民卫生出版社,2008:261-268.
[13]铁木帅龙.妇科普查中宫颈疾病患病情况分析[J].健康大视野,2012,20(11):451.
[14]吴琼,徐晓婷,姬磊,等.不同化疗方案同期联合放疗治疗中晚期宫颈癌的临床观察[J].临床肿瘤学杂志,2014,19(2):15.
[15]卢翠萍,郑秋香,陈珍,等.顺铂单药化疗联合放疗治疗宫颈癌的疗效分析[J].中外医学研究,2015,13(26)∶3-5.
[16]丁金泉,李美丽,张群贵,等.宫颈癌术后应用调强放疗同期化疗的临床效果[J].中国当代医药,2015,22(17):44-46.
[17]孟庆荣,马春季.顺铂联合多西他赛同步化疗治疗中晚期宫颈癌的效果[J].中国当代医药,2015,22(31)∶126-129.
[18]Ibrahim NK,Desai N,Legha S,et a1.PhaseⅠand pharmacokinetic study of ABI-007,a Cremophor-free,protein-stabi1ized,nanopartic1e formu1ation of Pac1itaxe1[J]. C1in Cancer Res,2002,8(5):1038-1044.
[19]曾靖,张蓉,黄曼妮,等.白蛋白结合型紫杉醇联合铂类治疗晚期或复发性妇科肿瘤的临床分析[J].癌症进展,2014,12(4):387-393.
[20]Green MR,Manikhas GM,Or1ov S,et a1.Abraxane,a nove1 Cremophor-free,a1bumin-bound partic1e form of Pac1itaxe1 for the treatment of advanced non-sma11-ce11 1ung cancer[J].Ann Onco1,2006,17(8):1263-1268.
[21]von Hoff DD,Ramanathan RK,Borad MJ,et a1.Gemcitabine p1us nab-Pac1itaxe1 is an active regimen in patients with advanced pancreatic cancer:a phaseⅠ/Ⅱtria1[J].J C1in Onco1,2011,29(34):4548-4554.
[22]Ge1derb1om H,Verweij J,Nooter K,et a1.Cremophor EL:the drawbacks and advantages of vehic1e se1ection for drug formu1ation[J].Eur J Cancer,2001,37(13):1590-1598.
[23]ten Tije AJ,Verweij J,Loos WJ,et a1.Pharmaco-1ogica1 effects offormu1ation vehic1es imp1ications for cancer chemotherapy[J].C1in Pharmacokinet,2003,42(7):665-685.
[24]费鹤良,杨庆尧.PSP对癌症病人化/放疗毒性反应的数据统计分析[J].数理统计与管理,2000,19(6):41-44.
Efficacy and safety of Albumin-bound Paclitaxel in treatment of patients with advanced cervical cancer
JI ShiyuHU Yi▲
Department of Medica1 Onco1ogy,Chinese PLA Genera1 Hospita1,Beijing100853,China
R979.7
A
1673-7210(2016)04(c)-0101-04
全军医学科研“十二五”面上课题(CWS12J120)。
姬时宇(1990.4-),男,硕士研究生,主要从事恶性肿瘤的研究及临床应用工作。
2016-01-20本文编辑:任 念)
