儿科用药非临床安全性评价要则及中药评价的特殊性
2016-07-22孙祖越上海市计划生育科学研究所药理毒理学研究室中国生育调节药物毒理检测中心上海0003国家食品药品监督管理总局药品审评中心北京00038
孙祖越,周 莉,韩 玲(.上海市计划生育科学研究所药理毒理学研究室,中国生育调节药物毒理检测中心,上海 0003;.国家食品药品监督管理总局药品审评中心,北京 00038)
·中药毒理学前沿——发育毒性·
儿科用药非临床安全性评价要则及中药评价的特殊性
孙祖越1,周 莉1,韩 玲2
(1.上海市计划生育科学研究所药理毒理学研究室,中国生育调节药物毒理检测中心,上海 200032;2.国家食品药品监督管理总局药品审评中心,北京 100038)
孙祖越,上海市计划生育科学研究所研究员,中国生育调节药物毒理检测中心(世界卫生组织人类生殖研究合作中心)主任,复旦大学药学院博士生导师。从事药物生殖药理毒理学、药物非临床安全性评价和前列腺疾病药理毒理学研究。主持了国家“重大新药创制”科技重大专项等15个国家及省部级课题,服务企业258个合同项目;主持并荣获2项上海市科技进步二等奖及1项三等奖、1项中国实验动物学会科技二等奖和1项中国药学会科技进步三等奖;作为发明人申请了24项国内专利,其中17项已授权,11项为发明专利;6项科技开发产品,并都投放市场;发表285篇学术论文;主编出版了《前列腺药理学》和《药物生殖与发育毒理学》等5部专著。荣获全国优秀科技工作者和“上海领军人才”称号,享受国务院特殊津贴。现担任亚洲毒理学会常务理事、中国毒理学会副理事长、中国毒理学会生殖毒理专业委员会主任委员和该会中药与天然药物毒理专业委员会副主任委员。

摘要:目前新药研发过程中,对新生和幼龄动物非临床发育毒性研究的需求变得越来越迫切。本文对儿科用药非临床安全性技术评价的本质、重要性和必要性、研究设计考虑、种属选择、年龄匹配、给药途径、给药持续时间和观察指标等方面进行了讨论,并针对中药新药儿科用药的安全性评价特点进行了分析,以期为我国儿童用药非临床安全性研究提供支持和参考,为制定我国相关指导原则积累素材。
关键词:儿科用药;幼龄动物;非临床安全性评价;发育毒性;中药
DOl:10.3867/j.issn.1000-3002.2016.01.003
利用动物来评估药物毒副作用是保障人类临床用药安全和评估用药风险的一个重要步骤。许多传统的毒理研究设计仅能提供成年动物给药的安全性评价(安评)资料,无法充分提供儿科用药的安全性数据。此外,许多药物儿科临床数据的缺乏也是导致儿科用药不良反应发生的重要缘由[1]。
越来越多的学者逐步认识到,儿科人群是临床用药风险评估中的敏感人群,属于特殊群体。自20世纪90年代以来,欧美颁布了一系列法规,强调药物和生物制品在儿科人群中使用的监管[2-4]。例如,2006年美国FDA颁布的《儿科药品的工业非临床安全性评价指南》(Guidance for Industry Non-clinical Safety Evaluation of Pediatric Drug Prod- ucts)[5],2008年欧洲药品管理局(EMA)颁布了《利用幼龄动物开展治疗儿科适应证人用药品非临床试验指南》(Guideline on the Need for Non-clinical Testing in Juvenile Animals on Human Pharma-ceuticals for Pediatric Indications)[6]。
儿科用药非临床安评归根到底还是考察儿科用药的非临床发育毒性。然而,目前我国尚未发布儿科用药非临床安评指导原则,仅有相关的临床指导原则颁布。如2014年国家食品药品监督管理总局颁布了《化学药物儿科人群药代动力学研究技术指导原则》[7],2015年药品审评中心发布了《儿科人群药物临床试验技术指导原则》(征求意见稿)[8],针对用于发育中儿科人群的临床研究及评价的药品进行了原则性规定。
近年来,随着儿童用药需求的增加,已越来越重视幼龄动物非临床发育毒性的研究[9]。本文就儿科用药非临床安评的本质、评价的重要性和必要性以及评价的设计原则与指标设定逐一阐述。另外,考虑到中药新药儿科用药的特殊性以及安评的难度,也在此文中一并阐述,并尝试提出参考性建议。
1 开展儿科用药非临床安全性技术评价的本质
19世纪,美国儿科之父Abraham Jacobi医生认为“儿科学不是通过降低剂量来治疗小型男性和女性,也不是治疗较小身体中的同类疾病,而是有其自身独立的范畴”[10]。他提出不同年龄段的儿童可能存在明显差异,有必要根据年龄进行药物差异化治疗。有关儿童人群特定年龄范围的界定,正如人用药品注册技术要求国际协调会议(ICH)指南E11《儿科人群中药品的临床研究》(E11,Clinical Inves-tigation of Medicinal Products in the Pediatric Popu-lation)中所描述:①早产新生儿,孕38周前出生;②足月新生儿:0~27 d之间;③婴儿/幼儿:28 d~23个月之间;④儿童:2~11岁之间;⑤青少年:12岁至16~18岁之间(根据地域不同)[11]。虽然儿童按年龄分类有一定程度的主观性,但上述分类为儿童人群的发育差异提供了年龄分类的基础。
实际上,药物发育毒性研究是指机体受精前、出生前或后,直到性成熟过程中暴露于药物,产生的发育过程中的不良作用[12]。主要表现为死亡、形态变化(畸形或变异)、生长发育改变和功能性损伤。虽然发育过快或早熟可能也被认为是生长发育的改变,但生长发育改变通常是指发育迟缓。功能性损伤可包括任何正常生理或生化功能的持久性改变,通常代表性地评价包括自发活动、学习和记忆、反射能力的变化、性成熟时间、交配行为和生育力。如图1所示,幼龄动物指出生至刚成年之间的一个阶段,它的使用填补了围生期发育毒性和一般毒性研究之间的“间隙”。因此,本文“儿科用药非临床安评”其实属于发育毒理学研究的范畴,一般应利用幼龄动物开展评价,这也许就是儿科用药非临床安评的本质。

图1 幼龄动物非临床发育毒性研究阶段
2 开展幼龄动物非临床安全性评价的重要性
儿童发育中的器官、系统或代谢途径与发育已成熟的成人相比,可能会对药物产生完全不同的反应。婴儿和儿童身材娇小,往往被认为更易受环境中药物或化学物质的毒性作用的影响。
尽管临床医师已认识到从幼儿到成年存在生理发育的差异,儿童的组织和器官的成熟和功能差异取决于发育的不同阶段,一些早期发育过程中的异常与儿童的特有疾病进展可联系起来。但目前的临床用药并未充分考虑儿童整个发育过程药物剂量的个性化原则。
另外,医师应综合幼龄动物或儿科临床试验的安全性数据考虑具体给药方案,否则很有可能使儿科医师陷入伦理困境。换言之,医师要么剥夺了儿童使用潜在有效药物的权利,要么在缺乏充分安全性和有效性数据的基础上给予儿童治疗。而后者的结果就是,或者剂量不足导致疗效不佳,或者剂量过大导致毒性出现或增加。
医学史上曾有过多次儿科用药不良反应的悲剧,提醒我们开展幼龄动物非临床安评的重要性。例如,新生儿服用磺胺类药物引发的核黄疸[13];局部麻醉剂布比卡因导致的癫痫发作和心脏骤停[14];含有六氯酚的沐浴液通过婴儿皮肤吸收对神经系统产生的影响[15];作为药物制剂配方中的防腐剂苯甲醇,对新生儿产生的致命反应[16];≤2岁儿童采用丙戊酸进行抗惊厥治疗,引发致命的肝毒性[17];蒽环类药物(如多柔比星)在治疗儿童癌症的同时产生的心脏毒性[18];给新生儿注射氯霉素治疗严重细菌感染引起的心血管衰竭(即“灰婴综合征”)[19]。上述这些毒性或不良反应产生的一个共同点,就是在未充分观察药物潜在损害的情况下,进入临床用于儿科人群。
临床上,以往儿科人群药物剂量是依据年龄或体质量的基本公式计算而得,如杨氏法(Young′s Rule)、柯氏法(Cowling′s Rule)或克氏法(Clark′s Rule)[20],也就是说这些剂量推算是来自成人的非临床和临床研究的基本信息。其实,这些做法只是基于一个默认的假设,即对于药物的药代动力学或药效学特性,假设为儿童和成人之间没有发育方面的差异,并认为儿童和成人的疾病发展过程也是类似的。这些偏颇的概念也许就是造成儿科用药错误或失误的根源。
2.1发育中和成熟后的系统毒性敏感性差异
儿童(出生后到成年之间)生长发育过程中可能对药物更加敏感,从生理学和解剖学的角度看,许多因素也会导致药物毒性作用的差异,包括儿童早期发育阶段细胞的快速增殖、与年龄相关的身体组成差异(例如脂肪、肌肉、骨骼组成、水的含量和分布)、肝脏代谢酶的发育水平、与年龄相关的胰腺和胃肠道中蛋白合成和功能的差异、循环中与游离药物结合的血浆蛋白数量和组成、肾功能的成熟、免疫系统功能的成熟程度、受体表达的个体差异、肠道蠕动和胃排空以及血脑屏障的成熟差异等。
由于儿童生长发育迅速,许多细胞、组织和器官系统的结构和功能特点在儿童和成人之间有很大差异。这些发育的差异可能对药物的吸收、分布、代谢和排泄均产生不同的结果,影响着药物的毒性和疗效。例如,由于新生儿期的基础胃酸排出量和胃液分泌物量较低,胃液的pH值(>4)高于年龄较大的儿童和成人,给新生儿口服遇酸分解的化合物则可产生更高的生物利用度[21]。相反,弱酸性药物在新生儿可能需要更高的剂量,以达到在大龄儿童或成人中的治疗水平。此外,随着年龄变化,身体结构和功能的改变可能会改变药物在体内的分布。与成人相比,新生儿和婴儿一般有相对大的与脂肪储备相关的细胞外和总体储水空间,因此具有较高的水脂比例[22],这可能会导致药物分布量的变化,从而影响药物在游离血浆中的水平。
出生后,人类的各器官仍需继续生长和发育至逐步成熟,例如脑神经发育至青春期仍在持续进行,肾至1岁、大多数肺泡至2岁、生殖系统至青春期后、骨骼系统至25~30岁才发育成熟。正常认知和运动功能方面,从出生到3岁,神经发育过程变化会较快,如小脑神经元的迁移,联络皮质突触的形成,血脑屏障的闭合,大脑躯体感觉、视觉和听觉区神经髓鞘的形成等。治疗早产儿肺支气管发育不良时,在上述这些神经发育发生的关键期间若吸入类固醇药物等则可能影响到幼儿发育,由此产生的毒性作用被认为与脑麻痹的发生有关。此外,从功能性角度看,儿科人群缺乏完全成熟的免疫系统,至5~12岁时IgG和IgA的应答水平才达到成人水平[23]。因此,值得关注的是,儿童给药后免疫系统的不良反应比成人表现得更严重或持续时间更长。
某些药物的代谢方式在儿科人群与成人也有所差异,因此不能简单地从成人的经验来推断儿科人群的不良反应。儿科人群和成人间酶活性和(或)浓度成熟程度的差异导致由成人剂量推算到幼儿,给药剂量不会是按比例降低,即相同或较轻的暴露程度下,儿科人群可能更加敏感。如<1月龄新生儿给予氯霉素导致的“灰婴综合征”,此毒性作用可能是致命的,它所引起的循环衰竭,可能与过度和持续的非结合血药浓度过高有关。新生儿由于缺乏Ⅱ相酶,无法通过结合反应,将活性药物转变成无生物活性的水溶性化合物,因而新生儿对氯霉素更加敏感。由于属于剂量依赖性毒性,因此新生儿给予氯霉素的剂量要比婴儿以及成年更低[24]。
儿科人群与成人存在的上述机体结构、功能、代谢特征等诸方面的差异,告诫我们“小儿不是小型成人”。
2.2难于开展儿科用药临床毒性的研究
众多原因使得药物在儿科群体中未得到充分评估,主要涉及传统观念、道德问题、技术的限制、经济和实用性的考虑、长期不良反应的可能性以及之前的法律和法规的缺乏。给儿童开具未经充分毒性评价的药物是不道德的。美国联邦法规认为儿童是弱势群体,作为研究对象需要额外保护。此外,获得儿童本人的同意以及家长或监护人的许可,不同于有完全认知能力的成年人获得知情同意。在临床试验中用于监测儿童的健康和安全的参数主要涉及到技术和伦理问题。
成人资料通常是儿童药代动力学研究的加强版,然而,儿童药物的安全性不能总是从成人获得的数据外推,药物和疗程可能在儿童身上产生或多或少的毒性。基于这些问题,政府部门和专业机构需要采用类似于成人的方法来开展儿童药物的安评。然而,在知情的情况下,父母的担忧会导致开展儿科用药临床毒性研究的难度。
所以,在非临床阶段,开展药物发育毒性的研究就显得更加重要。
2.3幼龄动物非临床毒性研究的预测价值
以往用于预测儿童患者危险的传统模型多半是考虑成人研究资料(安全、有效和暴露),以及成年动物的非临床重复给药毒性、生殖毒性和遗传毒性等研究资料。然而,这种模式是默认为(无论正确或错误)儿科人群和成人之间疾病进程是类似的,即对于某适应证的药物会有一个相似的反应,成人和发育中的儿童在药物安全性的方面没有差异。但实际上,既已了解了儿科人群和成人患者之间风险效益评估方面存在差异,同时也接受成年动物与成人之间药物毒性预测的一致性,那么理所应当在儿科用药临床试验开始前启动非临床幼龄动物安全性研究以预测潜在的毒性或不良反应。
通常,一些幼龄动物(如啮齿类、犬、小型猪和非人灵长类)表现出类似于儿童与年龄相关的发育特点,即适合于毒性实验。幼龄动物与相关年龄儿童发育的相似之处,已证明非临床幼龄动物安全性研究用于识别、评估或预测与年龄相关的儿童毒性是有价值的。
同时,某些对婴幼儿有毒性的药物在幼龄动物上已得到了复制,如婴儿对六氯酚神经毒性的敏感性增加已在相同发育阶段的幼龄大鼠得到复制;发育中的啮齿类动物给予茶碱,其促癫痫作用也印证了儿童所出现的类似风险。此外,对于减少儿童急性淋巴细胞白血病复发的预防性治疗(加或不加化疗药物的放疗),采用幼龄大鼠模型可评价对儿童颅面生长发育的毒性效应等等。但不幸的是,大多数情况下,非临床幼龄动物安全性研究显示的对不良反应或毒性的预测作用,都是这些反应在儿童用药得到证实之后。
3 开展幼龄动物非临床安全性评价的必要性
一个药物是否需要开展幼龄动物非临床安评,要考虑以下几点:①首先要提供拟评价药物的毒性特点资料,获得现有的临床和非临床数据的信息以及特定的观察终点。如明确成人临床试验是否有毒性、前期的成年动物毒性评估中是否有明确的毒性靶器官、生殖毒性实验中是否存在发育毒性现象等。②明确药物的预期作用和预期的目标人群,如是否仅仅是儿科用药,其药理学作用特点,服药儿科人群的最小年龄(如新生儿或>2岁儿童)等。③考虑到临床药物的使用期间、给药的持续时间(如单次还是多次)、动物研究是否有合适的暴露时间、动物模型中受试物的给药方案能否对应预期目标人群的给药途径和给药时间。④在可能的情况下,应清楚种属内和种属间的生理、药理和毒理特点,是否存在种属特异性毒性(如仅仅作用于犬),不同种属成年动物(如大鼠、犬或其他种属)和人类的药代动力学和代谢情况的支持依据等。
上述问题回答了开展幼龄动物非临床安评的必要性、相关的种属选择、给药开始时间以及动物的年龄是否合适等问题。此外,还需了解和预判给药途径的技术因素、毒动学中获取样本的可能性以及临床病理学评估等。幼龄动物研究需仔细研究现有数据,以便获得有价值的新信息,又要考虑非临床实验是否支持儿科临床试验。还要注意的是,为了企业或委托机构获得更好的研发计划和更多的建议,与监管机构进行良好、及时的相互沟通也是至关重要的。同样,因为幼龄动物非临床安评设计是为临床试验计划提供参考,故非临床研究学者与临床医师之间的密切联系也是非常关键的。
4 开展幼龄动物非临床安全性评价设计技巧
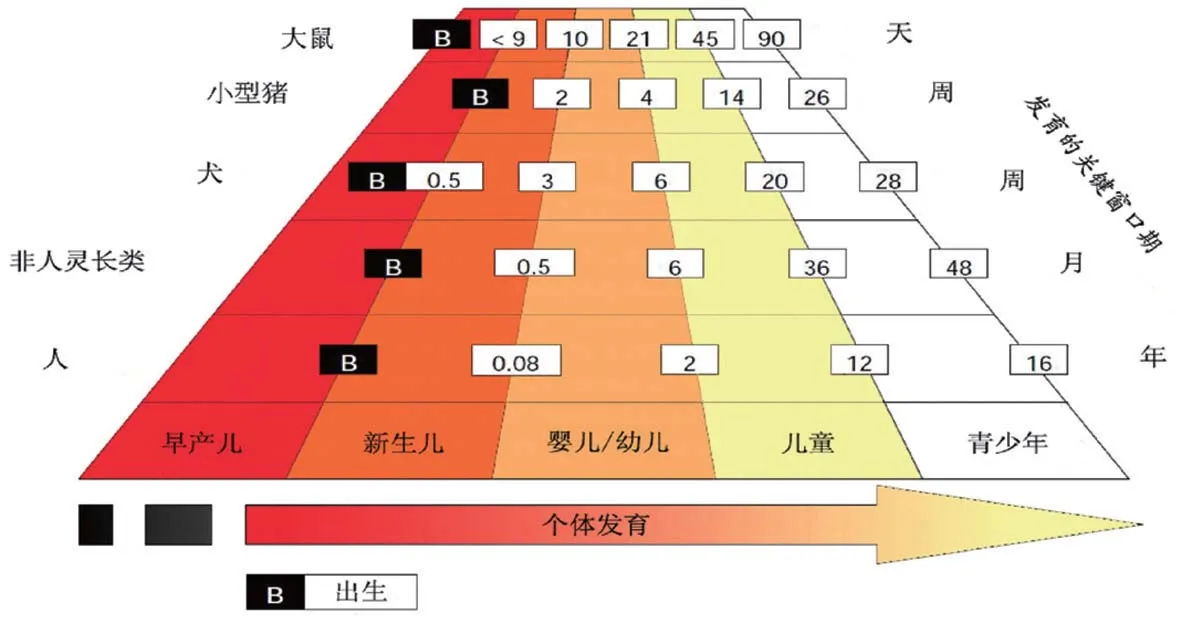
图2 基于中枢神经系统和生殖系统差异的几个种属年龄发展比较
有很多因素影响幼龄动物非临床发育毒性研究的设计,最典型的是年龄,在不同动物上是不一样的,如图2是基于中枢神经系统(central nervous system,CNS)和生殖系统差异的跨种属年龄[25]。同时,开展幼龄动物非临床安评设计还要考虑以下主要因素:①初始给药时动物的发育年龄需与儿科用药目标人群的年龄匹配;②出生后发育毒性研究中所关注的器官系统与目标儿科人群经历同一阶段或相似的发育过程;③预期会对靶器官产生潜在影响的化合物,设定特异性的在体或解剖后评价指标。使得所关注的器官系统能进行有效和深入的研究;④需区别对待药物的急性毒性影响和发育毒性。
如前文所述,经典的幼龄动物实验要覆盖标准的动物生殖与发育毒理学安评以及跨越一部分成年动物一般毒理学评价之间的年龄范围(图1)。围生期发育毒性研究中,母鼠给药,幼仔首次接触受试物是在宫内,接下来就是间接的哺乳暴露。但其哺乳期暴露具有不受控和不确定性,可能导致暴露水平的程度不同,甚至动物因血乳屏障而未能暴露。而幼鼠出生后的给药,因幼龄动物处于哺乳阶段,窝内不同幼鼠与母鼠乳头的接触可能导致药物交叉污染,使窝内幼鼠暴露不均衡。因此,设计任何幼龄动物毒性实验时,要重点考虑母鼠和子鼠潜在的相互影响。
5 幼龄动物非临床安全性评价的指标设定
5.1选择敏感动物种属实验系统
合适的种属选择需要考虑药物的药效学、药代动力学和毒理学特性,甚至是临床特性,同时对研究中所关注的重要器官的发育状态进行幼龄动物和患儿之间的比较,考察其对特定毒性的敏感性以及开展研究的可行性等。啮齿类(大鼠)和非啮齿类(犬)两个传统的种属是常规选择。
特殊情况下,大鼠不合适时,必须考虑其他种属。如药物代谢远不同于人类或在非啮齿类动物已确认了药物的药理活性或毒性靶器官,而在大鼠并未观察到时;此时另一种属,如小鼠、犬[26]、小型猪[27]、兔[28]或非人灵长类动物[29]可能更相关。小型猪也越来越被认为是一个可接受的对犬和灵长类等非啮齿类动物的替代动物[30]。
5.2动物年龄须匹配临床用药人群
幼龄动物研究中的给药周期、首次给药时动物的年龄,取决于可能受到药物影响的器官系统的发育情况以及拟定儿科人群年龄和暴露的持续时间[4-6]。
开始给药的动物年龄应代表儿科人群的预期年龄。在20世纪90年代后期和21世纪初,幼龄大鼠研究常用的起始年龄是出生后第4天(postnatal day 4,PND4),使用小的灌胃针对出PND4的大鼠幼仔给予黏稠性悬液在技术上是可行的,但不可取,因易致动物损伤。可在哺乳中期(如PND15)灌胃较稀释的液体。自2006年FDA新的指导原则颁布以来,考虑更多的是目标儿童的年龄。因此有一种趋势,将给药推迟到幼鼠出生后7~10 d,甚至21 d[31]。例如,治疗儿童中多动症目标人群不可能是<3岁的幼儿,3岁幼儿等同于3~5周的幼鼠。考虑各种因素包括可能的母鼠排斥,不推荐动物断乳前皮肤给药;而孕鼠经胃摄入,可能导致幼仔通过乳汁而暴露。
5.3给药途径力求与临床一致
理想情况应与临床给药途径一致,除非对成年动物的研究已证明另一途径更贴近人类使用。然而,幼龄动物给药途径的选择,必须考虑可行性、给药方法和器具、给药体积、配方和技术人员的经验。每种给药途径的具体技术挑战取决于所涉及的种属和动物的年龄。
5.4给药频率和持续时间需参考临床
断乳前常见的给药频率是每天1次,剂量取决于动物每天的体质量。前期的成年动物研究,包括药代动力学研究,可为给药频率及持续时间提供设计参考。研究者需重视药物在幼龄和成年动物体内的吸收、分布、代谢和排泄的差异,例如关键代谢途径的存在和(或)激活的差异。不同年龄啮齿类幼龄动物的药代动力学研究,其清除率、药物峰浓度和曲线下面积等参数可能存在明显不同。这些差异表明,发育过程中代谢通路的改变可能使暴露系统产生定量差异,并且影响给药频率的选择。
5.5剂量选择与给药方式区别于成年动物
幼龄动物非临床安评的主要目的是识别药物潜在的安全问题以及评价药物对幼龄动物发育系统的影响。因此,在儿科治疗范围,剂量水平应体现合理的暴露倍数,在可能的情况下,高剂量应该出现一些可识别的毒性(如体质量轻度减少)。此外,在幼龄非临床发育毒性研究设计中,为了与成年动物研究数据比较,剂量组应包含成年动物的“未观察到作用剂量(no observed effect level,NOEL)”或“未观察到不良作用剂量(no observed adverse effect level,NOAEL)”。幼龄动物采用不断升级的剂量而追求产生明显毒性(如超过成年动物的NOAEL)的做法是不可取的,因为这可能导致正常发育过程中出现次要的、非代表性的影响。FDA[5]和EMA[6]对于有关高剂量的选择也采纳类似的观点,然而还是建议研究开始前在剂量方面选择与特定的监管机构达成一致意见。在开展明确的良好实验室操作规范(good laboratory practice,GLP)幼龄动物非临床发育毒性研究前,通常会开展剂量选择研究或为解决特定问题而进行的耐受性和剂距研究。
5.6单独进行药代动力学和毒代动力学研究
药物的药代动力学在儿科人群和成人之间以及动物和人类之间可能有着非常明显的差异。因此,首先应进行幼龄动物的药代动力学研究,与成年动物药代动力学数据进行比较,以评价各年龄段可能存在的潜在暴露差异,这种差异可指导临床儿科人群的用药设计,根据不同年龄选择不同的剂量。其次,还可以评估幼龄动物和成年动物中药物的分布差异及代谢差异等。另外,若伴随进行幼龄动物的毒代动力学研究可提供特定的毒性数据,但并未为最终全面评价幼龄动物的安全性提供参考。
5.7侧重发育毒性的特殊指标选择
众多学者普遍认为利用幼龄动物开展研究的目的,是要确定药物是否影响动物的整体发育,以及特殊关注的器官或系统。最基本的指标应检测重复给药毒性研究相同的终点,至少包括临床体征、体质量、临床病理(如可行),增长指标的测量(体质量和终末胫骨长度)、身体的外部指标和性成熟、主要器官系统以及出生后发育器官质量的大体检查和光学显微镜检查。实际中,幼龄大鼠毒性研究通常还应包括一些评价CNS发育和功能(如评估个体发育反射、感觉功能、运动活动与学习记忆测试等),以及生殖发育和功能[32]。
6 中药儿科用药非临床安全性评价的特殊性
中药新药安评的原则与化学药相同,但作为特殊的受试物具有不同于化学药的如下特性:独特的中医药理论体系、有一定的临床用药经验、多为复方用药、成分复杂、物质基础及作用机制不甚明确、有效成分或毒性成分不清、工艺与以往临床用药可能发生改变等等。因此,安评与化学药也有所不同。另一方面,因中药复方制剂多源于临床,积累了一定的临床用药经验及有效和安全性数据,一定程度上为中药新药进行临床研究提供了参考,但也因此使部分研发者产生了中药无毒或低毒,而不重视中药新药安评的现状。应考虑到尽管中药有临床应用的经验,但大多数的药味甚至已上市的药物并无更多或更全面的儿科人群用药的安全性信息。此外,因中药复方制剂成分的多样性和复杂性,使动物的药代动力学和毒动学研究难度增加,也无法通过代谢差异的研究进行敏感动物的筛选,加之目前复方新药申报并未要求进行药代动力学和毒动学研究,故无动物及人体药代动力学数据的支持,也无法像化学药一样从成人临床药代动力学数据推测儿科人群的用药剂量等。
中药安全性研究及评价中除存在许多毒性研究的“黑箱”资讯外,儿科用药的发育毒性研究更显薄弱,实际操作中还存在许多技术上的难点或瓶颈,如给药剂量设计中,因载药量及黏稠度较高,增大给药量较为困难或难以做到充分暴露或更长时间的暴露;中药的特殊异味可导致母鼠对哺乳期幼鼠的排斥等等。
上述这些现状也使我们清楚地认识到开展儿科用中药新药非临床安评的重要性、必要性和紧迫性。诚然,开展中药非临床幼龄动物的安评是一项具有挑战性、难度较大的工作,在遵循上述安评要则的基础上,不但需有较雄厚的生殖与发育毒理学研究的基础,还需对中药特点有全方位的深入了解,更需要有一段较长时间的探索研究。相信通过国家的立法和监管,药物开发人员的意愿和要求,以及我们众多安评人士的研究和努力,儿科用中药新药的非临床安评工作将步入正轨。
7 结语
儿童是人口健康风险评估中的特殊人群,他们暴露于某些信息尚不明确的药物时需要特殊考虑。不少悲剧案例证明了儿童群体在人口科学、医学和公共舆论中的巨大影响力,尽管目前关于风险评估的儿科临床试验更加普遍,但是早期风险识别中越来越多地推荐或要求开展非临床幼龄动物的安评。相信随着研究者的不断探索和不断实践,我国儿科用药的非临床安评的水平会越来越有所提高。
参考文献:
[1]Roberts R,Rodriguez W,Murphy D,Crescenzi T. Pediatric drug labeling:improving the safety and efficacy of pediatric therapies[J].JAMA,2003,290(7):905-911.
[2]Department of Health and Human Services,FDA. Regulations requiring manufacturers to assess the safety and effectiveness of new drugs and Biological products inpediatricpatients-FDA. Final rule[J].Fed Regist,1998,63(231):66631-66672.
[3]FDA.Best Pharmaceuticals for Children Act.Public Law,2002:107-109[EB/OL].(2011-01-10)[2015-12-18]http://www.fda.gov/regulatoryinfor-mation/legislation/significantamendmenttothefdcact/ ucm148011.htm
[4]Guideline ICH Harmonised Tripartite.Guidance on nonclinical safety studies for the conduct of human clinical trials and marketing authorization for pharmaceuticals M3(R2)[C/OL]//International ConferenceonHarmonisationofEchnical Requirements for Registration of PharmaceuticalsforHuman Use,(2009-06-11)[2015-12-18]http://www.ich.org/fileadmin/Public_Web_Site/CH_Prod M3_R2_Guideline.pdf
[5]FDA.Center for Drug Evaluation and Research. Guidance for Industry:Nonclinical Safety Evaluation of Pediatric Drug Products[EB/OL].U.S.Depart-ment of Health and Human Services,Rockville,MD,(2006-02)[2015-12-18].http://www.fda.gov/ downloads/drugs/guidancecomplianceregulatory-information/guidances/ucm079247.pdf.
[6]European Medicines Agency(EMA),Committee for Human Medicinal Products(CHMP).Guide-line on the Need for Non-Clinical Testing in Juve-nile Animals on Human Pharmaceuticals for Pedi-atric Indications[EB/OL].(2008-01)[2015-12-18]. http://www.ema.europa.eu/docs/en_GB/document_library/ Scientific_guideline/2009/09/C500003305.pdf
[7]CFDA.Technical Guidelines for Population Phar-macokinetic Studies of Chemical Medicine in Pe-diatrics(化学药物儿科人群药代动力学研究技术指导原则)[EB/OL].(2014-07-11)[2015-12-18]. http://www.cde.org.cn/zdyz.do? method=largeP-age&id=201
[8]Center for Drug Evaluation of CFDA.Technical Guidelines forPopulationDrugClinicalTrials in Pediatrics(exposure draft)〔儿科人群药物临床试验技术指导原则(征求意见稿)〕[EB/OL].(2015-07)[2015-12-18].http://www.cde.org.cn/zdyz.do?method= largePage&id=22207)[2015-12-18].http://www. cde.org.cn/zdyz.do?method=largePage&id=222
[9]Leconte I,Bailey G,Davis BK,Hew KW,Kim J,Lima BS,et al.Value of juvenile animal studies [J].Birth Defects Res B Dev Reprod Toxicol,2011,92(4):292-303.
[10]Beck MJ,Macginnis G,Padgett EL,Parker GA,Toot JD,Varsho JS.Nonclinical juvenile toxicity testing[M]//Hood RD Developmental and Repro-ductive Toxicology:A Practical Approach.3rd ed. London:CRC Press,2012.
[11]FDA.Guidance for Industry E11.Clinical Investi-gation of Medicinal Products in the Pediatric Pop-ulation[Z].Food and Drug Administration,Center forDrugEvaluationandResearch(CDER),Center for Biologicals Evaluation and Research (CBER),2000:9-12.
[12]Sun ZY,Zhou L.Drug Reproductive and Develop-mental Toxicology(药物生殖与发育毒理学)[M]. Shanghai:Shanghai Science and Technology Press,2015:118-124.
[13]Andersen DH,Blanc WA,Crozier DN,Silverman WA.A difference in mortality rate and incidence of kernicterus among premature infants allotted to two prophylactic antibacterial regimens[J].Pedi-atrics,1956,18(4):614-625.
[14]Gunter JB.Benefit and risks of local anesthetics in infants and children[J].Paediatr Drugs,2002,4(10):649-672.
[15]AndersonJM,CockburnF,ForfarJO,HarknessRA,Kelly RW,Kilshaw B.Neonatal spongioform my-elinopathy after restricted application of hexachlo-rophaneskindisinfectant[J].JClinPathol,1981,34(1):25-29.
[16]Lovejoy FH.Fatal benzyl alcohol poisoning in neo-natal intensive care units.A new concern for pedi-atricians[J].Am J Dis Child,1982,136(11):974-975.
[17]Dreifuss FE,Santilli N,Langer DH,Sweeney KP,Moline KA,Menander KB.Valproic acid hepatic fatalities:a retrospective review[J].Neurology,1987,37(3):379-385.
[18]Kremer L C M,Caron H N.Anthracycline cardio-toxicity in children[J].N Engl J Med,2004,351 (2):120-121.
[19]Weiss CF,Glazko AJ,Weston JK.Chlorampheni-col in the newborn infant.A physiologic explana-tion of its toxicity when given in excessive doses [J].N Engl J Med,1960,262(16):787-794.
[20]Xing LM,Xing KG.Pediatric clinical drug dose calculation method[J].J Math Med(数理医药学杂志),1999,12(3):221-222.
[21]Huang NN,High RH.Comparison of serum levels following the administration of oral and parenteral preparations of penicillin to infants and children of various age groups[J].J Pediatr,1953,42(6):657-658.
[22]Kearns GL,Abdel-Rahman SM,Alander SW,Blowey DL,Leeder JS,Kauffman RE.Develop-mental pharmacology-drug disposition,action,and therapy in infants and children[J].N Engl J Med,2003,349(12):1157-1167.
[23]Holladay SD,Smialowicz RJ.Development of the murine and human immune system:differential effects of immunotoxicants depend on time of exposure[J].Environ Health Perspect,2000,108 (Suppl 3):S463-S473.
[24]Barrington KJ.The adverse neuro-developmental effects of postnatal steroids in the preterm infant:a systematic review of RCTs[J].BMC Pediatr,2001,1(1):1.
[25]Buelke-Sam J.Comparative schedules of develop-ment in rats and humans:Implications for devel-opmental neurotoxicity testing[C]//Toxicological Sciences.Great Clarendon St,Oxford Ox2 6dp,England:Oxford Univ`Press,2003,72:169-169.
[26]Robinson K,Smith SY,Viau A.Dog juvenile tox-icity[M]//Hoberman AM,Lewis E.Pediatric Nonclinical Drug Testing:Principles,Requirements and Practices.Hoboken,New Jersey:John Wiley &Sons,2012:183-212.
[27]Mc Anulty PA,Barrow P,Marsden E.Reproduc-tive system including studies in juvenile minipigs [M]//McAnulty PA,Dayan AD,Ganderup NC,Hastings KL.The Minipig in Biomedical Research. Boca Raton,FL:CRC Press,Taylor and Francis Group,2012:263-276.
[28]HobermanAM,BarnettJF.Juveniletoxicity study design for the rodent and rabbit[M]// Hoberman AM,Lewis E.Pediatric Non-clinical DrugTesting:Principles,Requirementsand Practices.Hoboken,New Jersey:John Wiley& Sons,2012:141-182.
[29]RasmussenAD,NelsonJK,ChellmanGJ,Golub M,Mcanulty PA.Use of barusiban in a novel study design for evaluation of tocolytic agents in pregnant and neonatal monkeys,in-cluding behavioural and immunological endpoints [J].Reprod Toxicol,2007,23(4):471-479.
[30]Jacobs A.Use of nontraditional animals for evalu-ation of pharmaceutical products[J].Expert Opin Drug Metab Toxicol,2006,2(3):345-349.
[31]Bailey GP,Mariën D.Thevalueof juvenile animal studies″What have we learned from pre-clinicaljuveniletoxicitystudies?Ⅱ″[J].Birth Defects Res B Dev Reprod Toxicol,2011,92(4):273-291.
[32]Cappon GD,Bailey GP,Buschmann J,Feuston MH,Fisher JE,Hew KW,et al.Juvenile animal toxicity study designs to support pediatric drug development[J].Birth Defects Res B Dev Reprod Toxicol,2009,86(6):463-469.
(本文编辑:齐春会)
通迅作者:韩 玲,E-mail:hanl@cde.org.cn
Keyprinciplesofnonclinicalsafety evaluationforpediatricdrugs and characteristics of traditional Chinese materia medica evaluation
SUN Zu-yue1,ZHOU Li1,HAN Ling2
(1.Shanghai Institute of Planned Parenthood Research,National Evaluation Center for Toxicology of Fertility Regulating Drugs,Shanghai 200032,China;2.Center for Drug Evaluation,China Food and Drug Administration,Beijing 100038,China)
Abstract:In current research and development of new drugs,the demand for toxicological study using neonatal and juvenile animals is becoming increasingly urgent.In this paper,we discussed the characteristics,importance and necessity of nonclinical safety evaluation for pediatric drugs,considerations for research design,selection of animal species and age,route and duration of drug administration and evaluation indexes.In addition,the characteristics of nonclinical safety evaluation of new traditional Chinese materia medica used for children were analyzed.It is hoped that these studies will not only provide support and reference for nonclinical safety evaluation of pediatric drugs but help accumulate material in formulating relevant guidelines.
Key words:pediatric drug;juvenile animal;nonclinical safety evaluation;developmental toxicity;traditional Chinese materia medica
中图分类号:R99
文献标志码:A
文章编号:1000-3002-(2016)01-0013-08
Foundation item:The project supported by Shanghai Technical Services Platform for Non-clinical Evaluation of Drug Against Male Reproductive and Urinary Diseases(15DZ2290400);and Shanghai Experimental Animal Scientific and Technological Innovative Action Plan(14140901302) HAN Ling,Tel:(010)68921402,E-mail:hanl@cde.org.cn
收稿日期:(2015-12-13接受日期:2015-12-17)
基金项目:上海市男性生殖与泌尿疾病药物非临床评价专业技术服务平台(15DZ2290400);上海市实验动物创新行动计划项目(14140901302)
