草乌多糖金属配合物的制备、表征与抗癌活性研究
2016-07-22李佩佩冯翠宁
张 茜,芮 瑞,李佩佩,冯翠宁,雷 强,龙 跃
(1.郑州大学 化学与分子工程学院, 河南 郑州 450001; 2.锡林郭勒盟蒙医医院 内窥镜科, 内蒙古 锡林浩特 026000)
草乌多糖金属配合物的制备、表征与抗癌活性研究
张茜1,芮瑞2,李佩佩1,冯翠宁1,雷强1,龙跃1
(1.郑州大学 化学与分子工程学院, 河南 郑州 450001; 2.锡林郭勒盟蒙医医院 内窥镜科, 内蒙古 锡林浩特 026000)
摘要:以水为提取溶剂从草乌中提取草乌多糖(RPS),确定了多糖提取的最佳工艺条件:提取温度90 ℃;提取时间4 h;料液比1∶50,并以草乌多糖为配体,制备了4种多糖金属配合物(RPS-Ca、RPS-Zn、RPS-Cu、RPS-Fe).采用MTT(噻唑蓝)法,以配体草乌多糖为对照,测定了4种多糖金属配合物对肝癌细胞(HepG2)、乳腺癌细胞(MCF-7)和结肠癌细胞(HT-29)的抑制作用.实验结果显示,草乌多糖铜配合物对3种癌细胞表现出最强的抑制作用.草乌多糖铜配合物的结构经紫外光谱(UV)、红外光谱(IR)、圆二色谱(CD)、电镜扫描(SEM)和热重分析(TGA)得到表征.
关键词:草乌;多糖金属配合物;制备;表征;抗癌活性
0引言
草乌( Radix Aconiti Kusnezoffii)为毛茛科植物北乌头的干燥块根,是中医和蒙医的常用药[1-3].草乌中含有多种糖类[4],而近年来研究发现,多糖具有抗肿瘤、抗病毒、抗氧化和免疫调节等多种生物学活性,且抗肿瘤活性显著并对人体毒副作用小,因此,将多糖开发为新型抗肿瘤药物是目前抗肿瘤药物研究领域的热点[5].
在对多糖结构进行修饰时,人们意识到多糖结构中所含有的羟基、氨基和羧基等基团可以与金属离子配位,形成多糖金属配合物,这样以多糖作为载体,不但保留了多糖和金属离子各自的活性类型,而且还可以使其活性增强,减少其毒副作用,缩小产品体积[6-8].铜配合物不仅具有抗癌活性,还具有抗炎、抗溃疡、抗抽搐、抗糖尿病和抗诱变剂等作用[9].
笔者前期已经研究了草乌中氨基酸的含量和种类[10],且有关草乌及草乌多糖研究的文献比较多,但草乌多糖与金属离子作用形成多糖金属配合物目前还未见报道.笔者采用水为提取溶剂和Sevage溶剂除蛋白的方法从草乌中提取多糖,并优化了提取工艺,将草乌多糖与金属离子配位合成出4种草乌多糖金属配合物.通过抗癌活性实验,筛选出的草乌多糖铜配合物对3种癌细胞表现出最强的抑制作用,并对其结构进行了表征.
1实验部分
1.1试剂和仪器
草乌(购自内蒙古通辽市);氢氧化钠、无水乙醇、丙酮、无水乙醚、氯化锌、氯化钙、氯化铜和氯化铁均为市售分析纯;测试所用肿瘤细胞购自中国科学院上海生命科学研究院.
循环水式多用真空泵(SHB-Ⅲ)、电子天平(CP214)、旋转蒸发仪(RE5299)、透析袋(MD34)、紫外分光光度计(Perkin Elmer)、傅里叶变换红外光谱仪(Vector 22)、圆二色光谱仪(Applied Photophysics Ltd)、电镜扫描仪(JSM-7100F)、热重分析仪(STA7300).
1.2实验方法
1.2.1草乌中多糖的提取
将草乌样品粉碎后,过250 μm分子筛,乙醇回流脱脂3 h,将其滤渣晾干备用.称取一定量干燥脱脂后的草乌样品按照一定料液比(草乌样品质量与提取溶液体积之比)加入提取溶剂(水、0.5 mol/L NaOH、 0.5 mol/L HCl),在一定温度下(60~100 ℃)提取2~6 h,过滤,合并提取液,浓缩至原体积的1/5. 将5倍量的乙醇加入到上述浓缩液中静置24 h,过滤,用无水乙醇、丙酮、无水乙醚洗涤沉淀,干燥.将固体用适量热水溶解,转移至分液漏斗中,加入1/3体积Sevage溶剂除蛋白质(Sevage溶剂组成为氯仿和正丁醇的摩尔比为4∶1),分出上层液体,加入5倍量乙醇沉淀24 h,过滤,并用无水乙醇、丙酮、无水乙醚洗涤,干燥,得粗制多糖,称重,计算收率.
1.2.2草乌多糖的纯化
将粗制多糖用少量热水溶解,转移至透析袋中用去离子水透析2 d.透析过程中需每12 h 换水一次.透析完毕后,将袋中液体倒入烧杯中,加入5倍量乙醇沉淀24 h,过滤,并用无水乙醇、丙酮、无水乙醚洗涤,干燥,得到精品多糖.
1.2.3多糖金属配合物的制备
取精品多糖0.5 g加入15 mL水溶解,用10%氢氧化钠溶液调节pH值在8.0~8.5,在70 ℃水浴下搅拌,并缓慢滴加2 mol/L氯化铜溶液.当出现絮状沉淀时立即停止滴加,反应1 h后冷却至室温离心,取其上清液.向上清液中加入5倍体积的乙醇沉淀24 h,过滤,并用乙醇、丙酮洗涤、干燥得粗制品0.52 g,然后,将粗制的多糖金属配合物溶于20 mL去离子水中透析3 d.透析过程中需要不断换水.透析完毕后,将袋中液体倒入烧杯中,加入5倍量乙醇沉淀24 h,过滤,并用无水乙醇、丙酮、无水乙醚洗涤,干燥,得到精制草乌多糖铜配合物0.48 g.钙(Ⅱ)、锌(Ⅱ)、铁(Ⅲ)配合物的制备与上述方法相同.
2抗癌活性的测定
2.1实验中所用的肿瘤细胞
所用的肿瘤细胞:人肝癌细胞(HepG2)、乳腺癌细胞(MCF-7)和结肠癌细胞(HT-29).实验细胞均用改良的RPMI-1640培养基(含10%的胎牛血清和1%的双抗)在37 ℃的CO2孵箱中培养(95%的氧气,5%的CO2,保持在适当的湿度).
2.2抗癌活性的测定
采用MTT法染色原理,向每孔中加入 5 g/L的MTT溶液20 μL.4 h后弃去上清液,每孔加入DMSO 150 μL,置于摇床摇10 min使结晶物溶解.在酶标仪上测其吸光度值A(λ=490 nm),结果以复孔A的均值表示. 对测得的数值进行处理,计算抑制率,结果见表1.
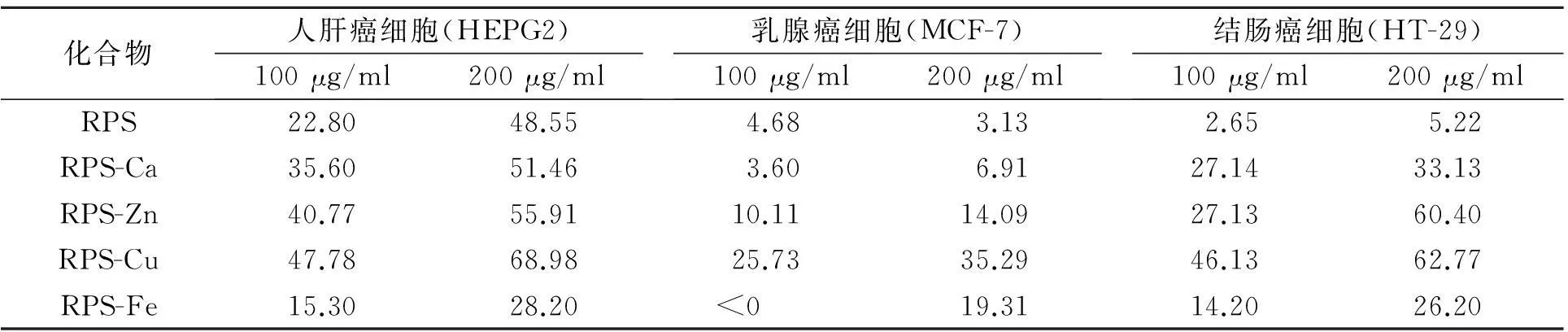
表1 多糖金属配合物对癌细胞的抑制率
3结果与讨论
3.1提取条件的选择
3.1.1提取溶剂的选择
按照一定料液比1∶40,分别以水、0.5 mol/L NaOH、0.5 mol/L HCl为提取溶剂,100 ℃提取3 h,计算粗制多糖收率,结果见图1.

图1 不同溶剂的影响Fig.1 Effect of different solvents
由图1可以看出,水溶剂提取多糖的收率最大,因此,选定水为提取溶剂.
3.1.2料液比的选择
以水为提取溶剂,料液比分别为1∶20、1∶30、1∶40、1∶50和1∶60,100 ℃提取3 h,计算粗制多糖收率,结果见图2.

图2 料液比的影响Fig.2 Effect of ratio of material to liquid
由图2的结果可知,当料液比为1∶50时,多糖的收率最大;当料液比小于1∶50时,收率随着料液比的增加而增大;当料液比超过1∶50时,收率减小.
3.1.3提取温度的选择
以水为提取溶剂,料液比为1∶50,分别于60、70、80、90、100 ℃提取4 h,计算粗制多糖收率,结果见图3.由图3的结果可知,当提取温度由60 ℃增加到90 ℃时,多糖收率增加明显;当温度高于90 ℃后,多糖收率增加趋势减缓,因此,选择90 ℃为提取温度.
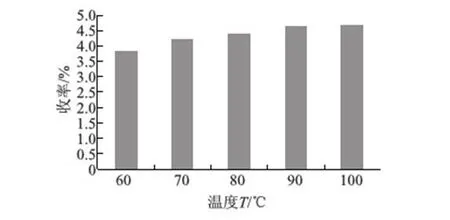
图3 提取温度的影响Fig.3 Effect of extraction temperature
3.1.4提取时间的选择
以水为提取溶剂,料液比为1∶50,90 ℃下提取2、3、4、5、6 h,计算粗制多糖收率,结果见图4.
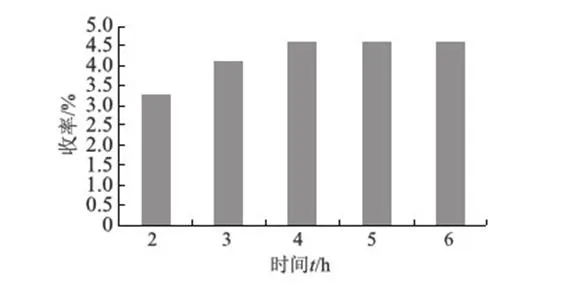
图4 提取时间的影响Fig.4 Effect of extraction time
由图4的结果可知,当提取时间由2 h增加到4 h时,多糖收率增加明显;4 h后多糖收率增加趋势减缓,因此,选择4 h为提取时间.
3.2抗癌活性结果
在合成的4种多糖金属配合物中,多糖钙配合物、多糖锌配合物和多糖铜配合物相对于草乌多糖对3种癌细胞的抑制率都有很大提高,其中多糖铜配合物的抑制作用最大.而多糖铁配合物相对于草乌多糖对人肝癌细胞(HepG2)的抑制率有所降低,且浓度为100 μg/ml时对乳腺癌细胞(MCF-7)几乎没有表现出抑制活性.
3.3多糖金属配合物的表征
草乌多糖和草乌多糖铜配合物的红外光谱如图5所示.草乌多糖红外光谱图主要吸收峰的归属:3 420 cm-1处为—OH的伸缩振动吸收峰;1 732 cm-1处为羰基的伸缩振动吸收峰;1 649.82 cm-1处为—OH的弯曲振动吸收峰.草乌多糖铜配合物的红外光谱图中主要吸收峰的归属:3 416 cm-1处为—OH的伸缩振动吸收峰,与多糖相比发生少量红移; 1 648 cm-1处为羰基的伸缩振动吸收峰;1 623 cm-1处为—OH的弯曲振动吸收峰,与多糖相比发生了明显的红移.
图5 草乌多糖(a)和草乌多糖铜配合物(b)的红外光谱Fig.5 IR spectra of RPS(a)and RPS-Cu(b)
草乌多糖和草乌多糖铜配合物的紫外光谱如图6所示.可以看出,草乌多糖的最大吸收波长在237 nm处,与铜离子作用后最大吸收波长减小为228 nm,这是由于形成配合物之后影响了电子的跃迁,从而导致最大吸收波长发生改变.

图6 草乌多糖(a)和草乌多糖铜 配合物(b)的紫外光谱Fig.6 UV spectra of RPS(a)and RPS-Cu(b)
观察草乌多糖和草乌多糖金属铜配合物的CD谱如图7所示.由图7可以发现,波长在200~300 nm时谱图变化较为明显,波长在248 nm附近铜配合物出现负Cotton效应,而多糖并没有此种效应.

图7 草乌多糖(a)和草乌多糖铜配合物(b)的圆二色光谱Fig.7 CD spectra of RPS(a)and RPS-Cu(b)
扫描电镜是定性分析、表征化合物表面形貌的重要手段之一.草乌多糖和草乌多糖铜配合物的扫描电镜图如图8所示.从图8可以看出,配体草乌多糖呈交联网状,与铜离子配位后,呈颗粒状,配位前后表面形貌发生了显著的变化.
草乌多糖和草乌多糖铜配合物的热重曲线如图9所示.从图9可以看出,草乌多糖的第一段质
量损失在小于177 ℃(质量损失10.62%),草乌多糖铜配合物的第一段质量损失在小于216 ℃(质量损失9.73%),通过对比草乌多糖及其配合物的热重曲线可以看出,形成配合物后,多糖的热稳定性增加.综合以上结果,可以说明多糖与金属离子发生了配位.

图8 草乌多糖(a)和草乌多糖铜 配合物(b)的扫描电镜显微图Fig.8 SEM micrographs of RPS(a)and RPS-Cu(b)
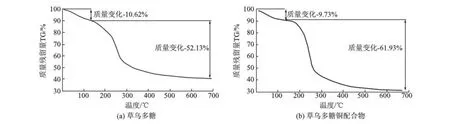
图9 草乌多糖和草乌多糖铜配合物的热重曲线Fig.9 TGA of RPS(a) and RPS-Cu(b)
4结论
确定了草乌中多糖提取的最佳工艺条件:提取溶剂为水,提取温度90 ℃,提取时间4 h,料液比1∶50.通过体外抗癌活性筛选结果发现,实验合成了4种草乌多糖金属配合物,且4种草乌多糖金属配合物除草乌多糖铁外,其余均表现出比草乌多糖高的抑制活性,其中草乌多糖铜配合物对3种肿瘤细胞的抑制作用最强.除此之外,其结构经紫外光谱(UV)、红外光谱(IR)、圆二色谱(CD)、电镜扫描(SEM)和热重分析(TGA)得到表征.
参考文献:
[1]肖培根.川乌草乌附子[M].北京:中国中医药出版社, 2000.
[2]李正邦,吕光华,陈东林,等.草乌中生物碱的化学研究[J].天然产物研究与开发,1997,9(1):9-10.
[3]陈嬿, 朱元龙, 朱任宏.中国乌头的研究[J].药学学报, 1965, 12(7): 435-436.
[4]孙玉军, 陈彦, 吴佳静. 草乌多糖的分离纯化和组成性质研究[J]. 中国药学杂志, 2000, 35(11): 731-732.
[5]林俊, 李萍,陈靠山. 近5年多糖抗肿瘤活性研究进展[J]. 中国中药杂志, 2013, 38(8): 1116-1120.
[6]柴晓华,王飞利,黄洁.金属药物研究新进展[J].化学试剂, 2008, 30(2): 99-103.
[7]王晓晖,白海泉,乌兰格日乐.多糖金属配合物的研究进展[J]. 内蒙古民族大学学报(自然科学版), 2014, 29(5): 516-518.
[8]ZHU Yang, CHEN Yao, LI Qian, et al. Preparation, characterization, and anti-Helicobacter pylori activity of Bi3+-Hericium erinaceus polysaccharide complex[J]. Carbohydrate polymers, 2014, 110: 231-237.
[9]尹富玲, 申佳, 邹佳嘉, 等. 2,2,-联吡啶和去甲基斑蝥酸根桥联双核铜(II)配合物的合成、结构表征及抗癌活性的研究[J]. 化学学报, 2003, 61(4): 556-561.
[10]姚学文,黄丽华,雷强,等. 内蒙古草乌中氨基酸提取工艺的研究及测定[J]. 郑州大学学报(理学版), 2014, 46(4): 97- 100.
Preparation, Characterization, and Anticancer Evaluation of Inner Mongolia Radix Aconiti Kusenezoffii Polysaccharide Metal Complexes
ZHANG Xi1, RUI Rui2, LI Peipei1, FENG Cuining1, LEI Qiang1, LONG Yue1
(1.College of Chemistry and Molecular Engineering,Zhengzhou University,Zhengzhou 450001,China; 2.Department of Endoscope, Xilinguole Meng Mongolian General Hospital, Xilinhaote 026000,China)
Abstract:By using water as extraction reagent,the polysaccharides in Radix Aconiti Kusnezoffii were extracted. The results showed that optimum extraction condition was 90℃, 4 h, and liquid to material ratio 1∶50. Four polysaccharide complexes were prepared using four metal ions(Ca2+,Zn2+,Cu2+,Fe3+) and polysaccharides from Radix Aconiti Kusnezoffii, respectively. All complexes were evaluated for biological activity against three human cancer cell lines (HepG2, MCF-7 and HT-29) by the standard MTT method, and the results showed that PRS-Cu possessed the highest growth inhibitory effects. The complex was characterized by UV, IR, CD, SEM, and TGA.
Key words:radix aconiti kusnezoffii; polysaccharide metal complex; preparation; characterization; anticancer activity
收稿日期:2015-10-20;
修订日期:2015-11-26
基金项目:河南省科技攻关计划资助项目(0624420031);河南省基础研究基金资助项目(022463001)
通信作者:龙跃(1960—) ,男,湖南长沙人,郑州大学教授,主要从事药物合成及天然有机化学研究,E-mail: longyue@zzu.edu.cn.
文章编号:1671-6833(2016)03-0036-04
中图分类号:O629.1
文献标志码:A
doi:10.13705/j.issn.1671-6833.2016.03.008
