肝癌衍生生长因子和血管内皮生长因子在脑胶质瘤中的表达及其与肿瘤微血管密度的相关性研究
2016-07-20符黄德罗起胜邓元央黄华东罗琨祥李传玉韦传东陈源红黄海能
符黄德,罗起胜,邓元央,黄华东,罗琨祥,李传玉,韦传东,陈源红,黄海能
·论著·
肝癌衍生生长因子和血管内皮生长因子在脑胶质瘤中的表达及其与肿瘤微血管密度的相关性研究
符黄德,罗起胜,邓元央,黄华东,罗琨祥,李传玉,韦传东,陈源红,黄海能
533000广西百色市,右江民族医学院附属医院神经外科(符黄德,罗起胜,邓元央,黄华东,罗琨祥,李传玉,黄海能),检验科(韦传东);右江民族医学院基础医学院医学微生物和免疫教研室(陈源红)
【摘要】目的探讨肝癌衍生生长因子(HDGF)和血管内皮生长因子(VEGF)在脑胶质瘤中的表达及其与肿瘤微血管密度(MVD)的相关性。方法选取2008年3月—2013年6月于右江民族医学院附属医院诊治的脑胶质瘤患者52例为脑胶质瘤组,另选取同期于本院行颅脑损伤内减压术患者52例为对照组。收集脑胶质瘤组肿瘤组织和对照组正常脑组织,冷冻保存。实时荧光定量反转录PCR法测定HDGF、VEGF mRNA表达水平。将肿瘤组织和正常脑组织裂解后提取蛋白,分别采用酶联免疫吸附试验(ELISA)和Western blotting测定HDGF、VEGF表达水平。以CD105作为血管内皮细胞的特异性标志物,显微镜下观察5个视野内微血管数计算MVD。自病理检查确诊起,追踪随访观察脑胶质瘤患者至2015-07-30,随访终点为死亡。结果脑胶质瘤组HDGF、VEGF mRNA表达水平高于对照组,经ELISA、Western blotting测定的HDGF、VEGF表达水平均高于对照组,差异有统计学意义(P<0.05)。脑胶质瘤组MVD为(74.3±10.4)个/视野,高于对照组的(9.6±1.4)个/视野,差异有统计学意义(t=15.941,P<0.001)。脑胶质瘤组HDGF mRNA、蛋白(分别经ELISA、Western blotting测定)表达水平与MVD呈正相关(r=0.562、0.382、0.225,P<0.05),VEGF mRNA、蛋白(分别经ELISA、Western blotting测定)表达水平与MVD呈正相关(r=0.676、0.471、0.184,P<0.05)。HDGF表达低水平、高水平的脑胶质瘤患者中位生存时间分别为13.6〔95%CI(11.0,16.1)〕、8.4〔95%CI(6.6,10.2)〕个月,其生存曲线比较,差异有统计学意义(χ2=9.938,P=0.002)。VEGF表达低水平、高水平的脑胶质瘤患者中位生存时间分别为14.3〔95%CI(12.2,16.8)〕、12.6〔95%CI(10.0,15.1)〕个月,其生存曲线比较,差异无统计学意义(χ2=0.735,P=0.391)。MVD低水平、高水平的脑胶质瘤患者中位生存时间分别为14.8〔95%CI(12.3,17.3)〕、10.4〔95%CI(8.1,12.6)〕个月,其生存曲线比较,差异有统计学意义(χ2=4.307,P=0.038)。结论脑胶质瘤组织中HDGF、VEGF表达水平异常升高与肿瘤微血管形成紧密相关,可作为判断肿瘤血管生成和疾病预后的参考标志物。
【关键词】神经胶质瘤;肝癌衍生生长因子;血管内皮生长因子;肿瘤微血管密度
符黄德,罗起胜,邓元央,等.肝癌衍生生长因子和血管内皮生长因子在脑胶质瘤中的表达及其与肿瘤微血管密度的相关性研究[J].中国全科医学,2016,19(17):2019-2023.[www.chinagp.net]
Fu HD,Luo QS,Deng YY,et al.Expression of hepatoma-derived growth factor and vascular endothelial growth factor and their correlation with tumor microvessel density in gliomas[J].Chinese General Practice,2016,19(17):2019-2023.
脑胶质瘤是源自神经上皮的肿瘤,又称胶质细胞瘤,为中枢神经系统最常见的、预后较差的原发性肿瘤,年发病率约5/10万,发病高峰年龄在30~40岁[1]。目前,对于脑胶质瘤的治疗手段主要以手术为主,术后辅以放疗、化疗,但术后平均存活时间仅3~5年,世界卫生组织标准分级Ⅲ~Ⅳ级者为1~2年,其总体治疗效果仍不理想。因此,寻找新的治疗途径或靶点是脑胶质瘤的主要研究方向[2]。肝癌衍生生长因子(HDGF)和血管内皮生长因子(VEGF)均是血管生成的关键促进因子,能刺激肿瘤新生血管的形成,并参与介导肝癌、肺癌、肾癌和颅内肿瘤等多种肿瘤的发生发展过程[3-4]。学者普遍认为,抑制肿瘤血管生成是颅内恶性肿瘤(如脑胶质瘤等)的分子治疗新策略之一[5]。本研究旨在探讨脑胶质瘤组织中HDGF和VEGF表达与肿瘤血管生成的关系,并初步讨论其临床意义。
1对象与方法
1.1研究对象选取2008年3月—2013年6月于右江民族医学院附属医院诊治的脑胶质瘤患者52例为脑胶质瘤组,其中间变性星形细胞瘤31例,胶质母细胞瘤15例,少枝胶质细胞瘤6例;左侧颞叶15例,右侧颞叶12例,右侧颞枕部10例,左侧额叶6例,右侧额叶3例,右侧丘脑2例,左侧顶叶2例,胼胝体部1例,右侧顶叶1例;世界卫生组织标准分级Ⅰ级11例,Ⅱ级19例,Ⅲ级18例,Ⅳ级4例。纳入标准:(1)经术后病理学诊断证实为脑胶质瘤;(2)白细胞计数≥4×109/L,血小板计数≥100×109/L;(3)无明显心、肝、肾、肺功能异常;(4)无免疫系统、神经系统和消化系统等其他系统的基础疾病,无严重感染或乙型肝炎、HIV和人乳头状瘤病毒感染等;(5)Karnofsky功能评分>70分,近1.0个月内未接受过任何抗肿瘤治疗;(6)预计生存时间>3.0个月。另选取同期于本院行颅脑损伤内减压术患者52例为对照组,并排除患有其他可能影响HDGF、VEGF表达水平的血管系统肿瘤者。患者及家属均知情同意本研究,签署知情同意书,研究方案亦通过本院伦理委员会批准。
1.2方法
1.2.1标本采集将脑胶质瘤组肿瘤组织和对照组正常脑组织标本取出后,部分组织迅速置于液氮中冷冻,随后置于-80 ℃冰箱保存,用于实时荧光定量反转录PCR、酶联免疫吸附试验(ELISA)和Western blotting检测;余组织采用10%甲醛溶液固定,常规石蜡包埋,切片,用于肿瘤微血管密度(MVD)的观察。
1.2.2实时荧光定量反转录PCR
1.2.2.1主要仪器和试剂总RNA提取试剂盒由南京凯基生物科技发展有限公司生产(批号KGA1203);TaKaRa反转录和荧光定量PCR扩增试剂盒均购于宝生物工程(大连)有限公司(批号D6110A和DRR081A);荧光定量PCR仪由美国Thermo Fisher公司生产,型号7500 Fast型;低温冷冻超速离心机和NanoDrop 2000c分光光度计均由美国Thermo Fisher公司提供。PCR引物的合成均由生工生物工程(上海)股份有限公司完成,HDGF、VEGF引物序列参考文献[6-7],HDGF上游引物序列:5′-CCGCTCGAGCTACATGTCGCGATCCAACCGG-3′,下游引物序列:5′-CGAAGCTTCCACCAGGCTCTCATGATCTCT-3′;VEGF上游引物序列:5′-CTACCTCCACCATGCCAAGT-3′,下游引物序列:5′-ATGATTCTGCCCTCCTCCTT-3′;β-actin上游引物序列:5′-CAGCTACGAGCTGCCTGACG-3′,下游引物序列:5′-CCTAGAAGCATTTGCGGTGG-3′。
1.2.2.2总RNA提取利用Trizol法提取总RNA,整个提取过程严格按照说明书操作,利用分光光度计测定提取的RNA浓度,取1 μg RNA反转录为cDNA(20 μl体系),结束后将cDNA稀释10倍后置于-80 ℃冰箱备用。
1.2.2.3DNA扩增以25 μl体系的模板量进行扩增,并保持所有目的基因引物量一致,以β-actin作为内参对照;PCR条件均为94 ℃预变性5 min,94 ℃变性60 s,58 ℃退火60 s,72 ℃延伸120 s,持续30个循环;65~95 ℃绘制溶解曲线;选择SYBR Green I/HRM Dye通道,读取Ct值;每个样本各目的基因设置3个复孔,分别计算各样本基因的Ct值,以2-ΔΔCt方法进行定量分析,并用β-actin的Ct值进行校正。
1.2.3ELISA将肿瘤组织和正常脑组织裂解后提取蛋白,取上清液用于ELISA;HDGF试剂盒由上海凯博生化试剂有限公司提供,VEGF试剂盒购于北京博凌科为生物科技有限公司,检测过程由专业检验技术人员严格按照说明书操作完成。
1.2.4Western blotting将肿瘤组织和正常脑组织裂解后提取蛋白,BCA蛋白定量,取每例样本各15 μg蛋白行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)电泳、转膜,5%脱脂牛奶室温封闭2 h,再分别孵育HDGF一抗(1∶500)、VEGF一抗(1∶500)和β-actin(1∶200)(均由美国Santa Cruz公司提供),4 ℃过夜;洗涤后1∶5 000孵育辣根过氧化物酶(HRP)标记的二抗(购自于北京中杉金桥生物技术有限公司),ECL化学发光后,凝胶成像系统显像,采用Image J软件进行蛋白定量分析。
1.2.5MVD以CD105作为血管内皮细胞的特异性标志物,其染色可呈棕色或棕黄色,以10%胞质呈棕黄色者定义为表达阳性;阳性计数参照Eichten等[8]报道的方法,将与相邻微血管、肿瘤细胞或其他结缔组织不相连的任何棕黄色区域均作为一条独立的微血管;先在100倍显微镜下全面观察切片,确定肿瘤组织内血管密度最富集的区域;再在200倍显微镜下,将与周围肿瘤细胞和结缔组织成分明显区别的任何棕黄色内皮细胞或细胞丛作为一条微血管,只要结构不相连,其分支结构也作为一条微血管,观察5个视野内微血管数计算MVD。
1.3随访观察自病理检查确诊起,追踪随访观察脑胶质瘤患者至2015-07-30,第1年每个月随访1次,之后每3个月随访1次;随访终点为死亡或截止时间。

2结果
2.1一般资料两组患者性别、年龄、体质指数(BMI)、Karnofsky功能评分比较,差异均无统计学意义(P>0.05,见表1)。

表1 两组患者一般资料比较
注:BMI=体质指数;a为χ2值
2.2HDGF、VEGF mRNA及蛋白表达水平脑胶质瘤组HDGF、VEGF mRNA表达水平高于对照组,经ELISA、Western blotting测定的HDGF、VEGF表达水平均高于对照组,差异有统计学意义(P<0.05,见表2)。
2.3MVD脑胶质瘤组MVD为(74.3±10.4)个/视野,高于对照组的(9.6±1.4)个/视野,差异有统计学意义(t=15.941,P<0.001)。
2.4HDGF、VEGF mRNA及蛋白表达水平与MVD的相关性脑胶质瘤组HDGF mRNA、蛋白(分别经ELISA、Western blotting测定)表达水平与MVD呈正相关(r=0.562、0.382、0.225,P<0.05),VEGF mRNA、蛋白(分别经ELISA、Western blotting测定)表达水平与MVD呈正相关(r=0.676、0.471、0.184,P<0.05)。对照组患者VEGF、HDGF mRNA及蛋白表达水平与MVD未见直线相关关系(P>0.05)。

Table 2Comparison of HDGF and VEGF mRNA and protein expression between the two groups

组别例数HDGFmRNA 蛋白(ELISA,ng/L) 蛋白(Westernblotting)VEGFmRNA 蛋白(ELISA,ng/L) 蛋白(Westernblotting)对照组521.035.9±3.51.01.017.9±1.51.0胶质瘤组524.7±0.550.8±5.33.0±0.36.4±0.521.6±4.63.6±0.6t值4.8576.4294.5925.14010.3256.192P值0.012<0.0010.0090.004<0.001<0.001
注:HDGF=肝癌衍生生长因子,VEGF=血管内皮生长因子,ELISA=酶联免疫吸附试验
2.5生存分析HDGF表达低水平、高水平的脑胶质瘤患者中位生存时间分别为13.6〔95%CI(11.0,16.1)〕、8.4〔95%CI(6.6,10.2)〕个月,其生存曲线比较,差异有统计学意义(χ2=9.938,P=0.002,见图1)。VEGF表达低水平、高水平的脑胶质瘤患者中位生存时间分别为14.3〔95%CI(12.2,16.8)〕、12.6〔95%CI(10.0,15.1)〕个月,其生存曲线比较,差异无统计学意义(χ2=0.735,P=0.391,见图2)。MVD低水平、高水平的脑胶质瘤患者中位生存时间分别为14.8〔95%CI(12.3,17.3)〕、10.4〔95%CI(8.1,12.6)〕个月,其生存曲线比较,差异有统计学意义(χ2=4.307,P=0.038,见图3)。

图1 不同HDGF表达水平的脑胶质瘤患者生存曲线
Figure 1Survival curve of glioma patients with different HDGF expression levels
3讨论
脑胶质瘤的发生、发展是遗传因素与环境因素共同作用的结果,其可呈浸润性生长,与正常脑组织界限不清,难以完全切除,且对放疗、化疗不甚敏感,极易复发,具有典型的“三高一低”(高发病率、高复发率、高病死率、低治愈率)的特征[9]。当前临床上针对脑胶质瘤的治疗策略主要以手术为主,术后辅以放疗、化疗,但患者的2年和5年生存率分别仅有20%和5%,治疗效果并不理想[10]。因此,随着分子生物学技术的迅猛发展,生物靶向治疗逐步成为脑胶质瘤治疗的主要研究方向,寻找肿瘤诊断和预后的特异性分子标志物以及药物治疗的靶标也成为研究热点。
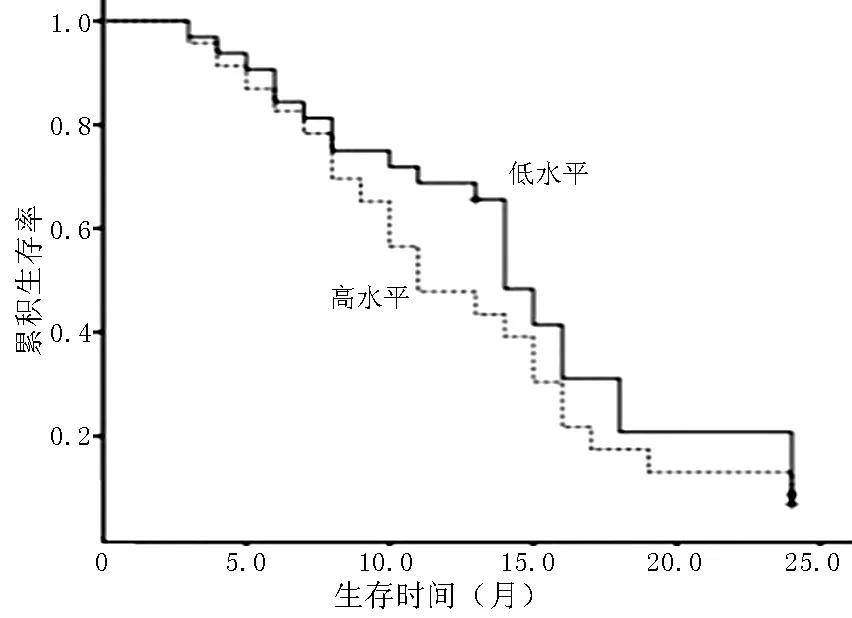
图2 不同VEGF表达水平的脑胶质瘤患者生存曲线
Figure 2Survival curve of glioma patients with different VEGF expression levels
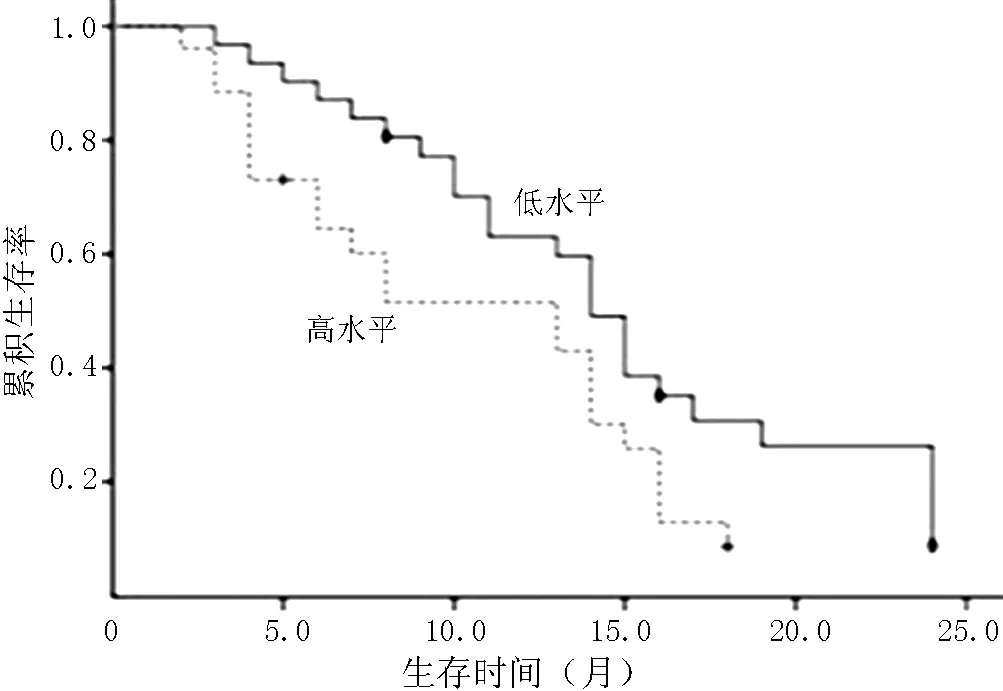
图3 不同MVD水平的脑胶质瘤患者生存曲线
在脑胶质瘤众多相关潜在分子标志物中,HDGF备受瞩目,其不仅参与细胞的增殖、分化,组织器官生长发育,损伤后组织修复等病理生理过程,还被发现在肝癌、非小细胞肺癌、结肠癌、胰腺癌、胃癌、黑色素瘤等多肿瘤组织中表达增高[11]。有研究表明,HDGF的表达与肿瘤的侵袭、转移以及预后紧密相关,很可能是在肿瘤发生、发展和转移等多个环节发挥作用的重要癌基因[12]。然而,HDGF在脑胶质瘤中的表达研究目前仍较少,具体作用尚未十分明确。本研究结果显示,在脑胶质瘤组织中,HDGF mRNA、蛋白表达水平均明显高于正常脑组织,与国外报道结果基本一致[13]。相关性分析显示,HDGF mRNA、蛋白表达水平与MVD呈正相关,说明HDGF在肿瘤血管生成中发挥重要作用。一方面,该结果提示通过阻断或遏制HDGF的过表达能够抑制肿瘤血管的生成,实现对脑胶质瘤生长的抑制;另一方面也表明HDGF可能不仅参与介导脑胶质瘤细胞的增殖过程,还可调控脑胶质瘤的血供系统。随访发现,HDGF表达低水平患者的生存时间明显长于高水平者,印证了HDGF高表达促进肿瘤形成的结论,也说明HDGF表达水平可能与脑胶质瘤的疾病预后紧密相关,靶向干预HDGF可能取得良好的效果。
肿瘤的血管产生是十分复杂的病理生理过程,只有充分的血供才能支持肿瘤组织的生长、浸润和转移。VEGF是促进肿瘤血管生成的关键刺激因子,几乎参与了肿瘤血管生成的每个环节[14]。VEGF可以通过旁分泌等方式,加快血管内皮细胞的增殖速度,重构血管,促进新生血管的形成。一方面,VEGF可能促进原有血管网的扩张和过度生长,另一方面,也能刺激血管内皮祖细胞形成新生血管。由于血管生成前肿瘤细胞极少能够进入血液循环,因此MVD常被用于判定肿瘤血管的生成情况[15]。本研究利用CD105标记肿瘤微血管,结果发现脑胶质瘤患者MVD明显高于对照组,而且VEGF mRNA、蛋白表达水平与MVD呈正相关,提示VEGF在脑胶质瘤形成中扮演血管生长因子的角色,参与肿瘤血管的形成,为肿瘤组织提供养分,从而促进其过度增殖。同时,在脑胶质瘤组织中VEGF mRNA、蛋白表达水平同样高于对照组,提示VEGF可作为判断肿瘤细胞血管生成的参考标志物。但是,在随访中并未发现不同VEGF表达水平患者生存时间存在差异,分析其原因可能有:纳入研究的样本数量较少,导致统计学分析缺乏差异;VEGF的表达可能仅参与了脑胶质瘤血管生成的前期,而当病灶逐渐形成之后,对血供的需求下降,进而VEGF的表达也相应降低,导致这一结果的具体机制仍有待进一步研究。
综上所述,脑胶质瘤组织中HDGF、VEGF表达水平异常升高与肿瘤微血管形成过程紧密相关,可作为判断肿瘤血管生成和疾病预后的参考标志物;靶向阻断HDGF和VEGF的表达,能够抑制肿瘤血管的生成,进而实现遏制肿瘤生长的目的,是潜在的抗脑胶质瘤治疗策略。
作者贡献:符黄德进行课题设计与实施、资料收集整理、撰写论文、成文并对文章负责;罗起胜、邓元央、黄华东、罗琨祥、李传玉、韦传东、陈源红进行课题实施、评估、资料收集;黄海能进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Ostrom QT,Bauchet L,Davis FG,et al.The epidemiology of glioma in adults:a "state of the science" review[J].Neuro Oncol,2014,16(7):896-913.
[2]Ozawa T,Holland EC.Rethinking glioma treatment strategy[J].Oncotarget,2014,5(20):9532-9533.
[3]Hsu SS,Chen CH,Liu GS,et al.Tumorigenesis and prognostic role of hepatoma-derived growth factor in human gliomas[J].J Neurooncol,2012,107(1):101-109.
[4]Shibuya M.Vascular endothelial growth factor and its receptor system:physiological functions in angiogenesis and pathological roles in various diseases[J].J Biochem,2013,153(1):13-19.
[5]Weis SM,Cheresh DA.Tumor angiogenesis:molecular pathways and therapeutic targets[J].Nat Med,2011,17(11):1359-1370.
[6]郭泽,龙卫国,曹伯良,等.HDGF真核表达质粒的构建、表达及其生物活性检测[J].南京医科大学学报:自然科学版,2010(5):602-606.
[7]张鹏飞,周建华,周婉琦,等.CD、Flt-1基因对原代培养的恶性胶质瘤细胞VEGF表达及生长的影响[J].立体定向和功能性神经外科杂志,2014,27(3):144-147.
[8]Eichten A,Adler AP,Cooper B,et al.Rapid decrease in tumor perfusion following VEGF blockade predicts long-term tumor growth inhibition in preclinical tumor models[J].Angiogenesis,2013,16(2):429-441.
[9]Omuro A,DeAngelis LM.Glioblastoma and other malignant gliomas:a clinical review[J].JAMA,2013,310(17):1842-1850.
[10]Plate KH,Scholz A,Dumont DJ.Tumor angiogenesis and anti-angiogenic therapy in malignant gliomas revisited[J].Acta Neuropathologica,2012,124(6):763-775.
[11] Tsai CC,Huang SC,Tai MH,et al.Hepatoma-derived growth factor upregulation is correlated with prognostic factors of early-stage cervical adenocarcinoma[J].Int J Mol Sci,2014,15(11):21492-2504.
[12]Song Y,Hu Z,Long H,et al.A complex mechanism for HDGF-mediated cell growth,migration,invasion,and TMZ chemosensitivity in glioma[J].J Neurooncol,2014,119(2):285-295.
[13]Thirant C,Galan-Moya EM,Dubois LG,et al.Differential proteomic analysis of human glioblastoma and neural stem cells reveals HDGF as a novel angiogenic secreted factor[J].Stem Cells,2012,30(5):845-853.
[14]Lu KV,Bergers G.Mechanisms of evasive resistance to anti-VEGF therapy in glioblastoma[J].CNS Oncol,2013,2(1):49-65.
[15]Keunen O,Johansson M,Oudin A,et al.Anti-VEGF treatment reduces blood supply and increases tumor cell invasion in glioblastoma[J].Proc Natl Acad Sci USA,2011,108(9):3749-3754.
(本文编辑:吴立波)
Expression of Hepatoma-derived Growth Factor and Vascular Endothelial Growth Factor and Their Correlation With Tumor Microvessel Density in Gliomas
FUHuang-de,LUOQi-sheng,DENGYuan-yang,etal.
DepartmentofNeurosurgery,theAffiliatedHospitalofYoujiangMedicalUniversityforNationalities,Baise533000,China
【Abstract】ObjectiveTo investigate the expression of hepatoma-derived growth factor (HDGF) and vascular endothelial growth factor (VEGF) and their correlation with tumor microvessel density (MVD) in gliomas.MethodsFrom March 2008 to June 2013,we enrolled 52 patients with gliomas who received treatment in the Affiliated Hospital of Youjiang Medical University for Nationalities as gliomas group,and enrolled 52 patients who undertook decompression for traumatic brain injury as control group.We collected tumor tissue of glioma group and normal brain tissue of control group and made cryopreservation.Real-time reverse transcription-PCR was were employed to determine the expression of HDGF and VEGF mRNA.We split the tumor tissue and normal cerebral tissue and extracted protein,and ELISA and Western blotting were employed to determine the expression of HDGF and VEGF.With CD105protein as the specific marker for vascular endothelial cells,microvessel count was recorded in five fields of view through microscope,and MVD was calculated.The follow-up observation on the patients was performed since the pathological diagnosis until July 30,2015 or death.ResultsGlioma group were higher in HDGF and VEGF mRNA expression,HDGF and VEGF expression determined by ELISA and Western blotting than control group(P<0.05).The MVD of glioma group was(74.3±10.4)/field of view,higher than(9.6±1.4)/field of view of control group(t=15.941,P<0.001).For patients in glioma group,HDGF mRNA and protein expression determined by ELISA and Western blotting had positive correlation with MVD(r=0.562,0.382,0.225; P<0.05),and VEGF mRNA and protein expression determined by ELISA and Western blotting had positive correlation with MVD(r=0.676,0.471,0.184; P<0.05).The median survival time of patients with low HDGF expression and patients with high HDGF expression was 13.6〔95%CI(11.0,16.1)〕 and 8.4〔95%CI(6.6,10.2)〕 months respectively;patients with different HDGF expression level were significantly different in survival curve (χ2=9.938,P=0.002).The median survival time of patients with low VEGF expression and patients with high VEGF expression was 14.3〔95%CI(12.2,16.8)〕 and 12.6〔95%CI(10.0,15.1)〕 months respectively;patients with different VEGF expression level were not significantly different in survival curve (χ2=0.735,P=0.391).The median survival time of patients with low MVD level and patients with high MVD level was 14.8〔95%CI(12.3,17.3)〕 and 10.4〔95%CI(8.1,12.6)〕 months respectively;patients with different MVD levels were significantly different in survival curve(χ2=4.307,P=0.038).ConclusionThe abnormal elevation of HDGF and VEGF expression level in glioma tissue is closely correlated with the development of tumor microvessel,thus HDGF and VEGF expression level can be used as reference marks for tumor angiogenesis and disease prognosis.
【Key words】Glioma;Hepatoma-derived growth factor;Vascular endothelial growth factor;Tumor microvessel density
基金项目:广西自然科学基金青年基金资助项目(2014GXNSFBA118146)
通信作者:黄海能,533000广西百色市,右江民族医学院附属医院神经外科;E-mail:bshuanghn@163.com
【中图分类号】R 730.264
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.17.008
(收稿日期:2015-10-10;修回日期:2016-03-22)
