高通量筛选酸敏感离子通道1a抑制剂研究
2016-07-20李小曼宋晓宇
羿 菲,李小曼,白 宁,孙 威,姜 波,张 莹,宋晓宇
·论著·
高通量筛选酸敏感离子通道1a抑制剂研究
羿 菲,李小曼,白 宁,孙 威,姜 波,张 莹,宋晓宇
110122辽宁省沈阳市,中国医科大学转化医学研究院
【摘要】目的建立体外稳定过表达酸敏感离子通道1a(ASIC1a)的Fisher大鼠甲状腺上皮细胞(FRT细胞),采用Ca2+敏感荧光染料Fura-2/AM和细胞毒性检测〔乳酸脱氢酶(LDH)释放法〕测定ASIC1a活性,探讨高通量筛选ASIC1a抑制剂的可行性。方法2014年1月—2016年2月,利用分子生物学方法,构建ASIC1a过表达载体pcDNA3.1/myc-His-mASIC1a,通过细胞转染技术建立了稳定过表达ASIC1a的Fisher大鼠FRT细胞。将细胞分成两组,对照组(FRT细胞)和实验组(稳定过表达ASIC1a的FRT细胞),并分别未负载和负载Ca2+敏感荧光染料Fura-2/AM,采用酶标检测仪测定双波长(340 nm和380 nm)的值,计算F340/F380。对照组和实验组细胞经不同pH值酸液(pH值7.5、7.0、6.5、6.0、5.5)刺激后,采用酶标检测仪测定450 nm波长处LDH释放量。结果对照组与实验组未负载Fura-2/AM细胞F340/F380比较,差异无统计学意义(P>0.05);实验组负载Fura-2/AM细胞F340/F380较对照组升高(P<0.05);对照组和实验组负载Fura-2/AM细胞F340/F380较未负载Fura-2/AM细胞升高(P<0.05)。pH值6.5、6.0、5.5时,实验组细胞LDH释放量大于对照组(P<0.05);对照组和实验组细胞不同pH值时LDH释放量比较,差异有统计学意义(P<0.05)。结论本研究成功建立稳定过表达ASIC1a的FRT细胞,Ca2+敏感荧光染料Fura-2/AM和细胞毒性检测(LDH释放法)两种方法测定ASIC1a活性,使高通量筛选ASIC1a抑制剂成为可能,为发现高选择性和高活性的天然小分子ASIC1a抑制剂奠定了基础。
【关键词】高通量筛选分析;酸敏感离子通道1a;上皮细胞;乳酸脱氢酶
羿菲,李小曼,白宁,等.高通量筛选酸敏感离子通道1a抑制剂研究[J].中国全科医学,2016,19(17):2033-2037.[www.chinagp.net]
Yi F,Li XM,Bai N,et al.High thoughtout screening of ASIC1a inhibitors[J].Chinese General Practice,2016,19(17):2033-2037.
酸敏感离子通道(acid-sensing ion channels,ASICs)是一类由细胞外酸化激活的阳离子通道,广泛分布于外周神经系统、中枢神经系统、消化系统等器官及部分肿瘤组织中。参与轻触觉、酸味觉、痛觉形成,在缺血性脑损伤、学习与记忆等多种生理及病理过程中发挥重要作用[1-3]。其中ASIC1a同聚体通道对H+敏感性较高,但只表现出快速失活成分。ASIC1a电流对离子的选择性依次为pNa+>pLi+>pCa2+>pK+>pCs+[4-5]。研究发现,ASIC1a介导的Ca2+超载在脑卒中引起的神经元损伤机制中具有重要作用[6-7]。那么研发特异有效的小分子ASIC1a抑制剂就成为治疗缺血性脑损伤的分子靶向。阿米洛利(amiloride)及其类似物是目前已知的一大类小分子ASICs抑制剂,但无选择性、抑制作用小和不良反应大等缺点导致其只能在实验研究中起作用[8-10]。而蜘蛛毒素(PcTx1)能特异性地抑制ASIC1a,比N-甲基-M天冬氨酸受体(NMDARs)拮抗剂具有更长时间的保护作用,但在临床应用上仍然具有困难[11],那么研发高选择性和高活性的天然小分子ASIC1a抑制剂成为当今研究的热点。通常检测ASIC1a功能的方法是应用全细胞膜片钳技术记录ASIC1a的开关电流,但耗时长、效率低,无法实现高通量筛选[6],所以本研究将探索适合于筛选高选择性和高活性的天然小分子ASIC1a抑制剂的高通量筛选方法,为脑卒中的靶向治疗奠定理论基础。
1材料与方法
1.1实验材料2014年1月—2016年2月,Fisher大鼠甲状腺上皮细胞(FRT细胞)购于ATCC,以含10%胎牛血清的DMEM/F12培养基(Gibco)培养于37 ℃、5% CO2环境中。荧光二抗Alexa fluo 594、Lipofectamine 2000均购于Invitrogen公司,C-myc抗体和Ca2+敏感荧光染料Fura-2/AM均购于Sigma,乳酸脱氢酶(LDH)释放检测试剂盒购于南京建成生物工程研究所。细胞毒性检测(LDH释放法)溶液:溶液A(pH值为7.5和7.0)500 ml:150 mmol/L氯化钠(NaCl)4.38 g,5 mmol/L氯化钾(KCl)0.19 g,1 mmol/L氯化镁(MgCl2)0.1 g,2 mmol/L氯化钙(CaCl2)0.15 g,10 mmol/L 4-羟乙基哌嗪乙磺酸(HEPES)1.19 g,10 mmol/L葡萄糖 0.9 g,用氯化氢(HCl)或氢氧化钠(NaOH)调制适当的pH值;溶液B(pH值为6.5、6.0
本研究背景和创新点:
酸敏感离子通道1a(ASIC1a)介导的Ca2+超载在脑卒中引起的神经元损伤机制中具有重要作用,研发高选择性和高活性的天然小分子ASIC1a抑制剂成为当今治疗脑卒中的关键,但目前仍未得到解决。全细胞膜片钳技术能很好地记录ASIC1a的开关电流,但此方法不能应用于高通量筛选研究。本研究构建了稳定过表达ASIC1a的Fisher大鼠甲状腺上皮细胞(FRT细胞),分析Ca2+敏感荧光染料Fura-2/AM和细胞毒性检测(乳酸脱氢酶释放法)两种方法在高通量筛选应用中的可行性,为得到高选择性和高活性的天然小分子ASIC1a抑制剂提供可能。
和5.5)500 ml:150 mmol/L NaCl 4.38 g,5 mmol/L KCl 0.19 g,1 mmol/L MgCl20.1 g,2 mmol/L CaCl20.15 g,10 mmol/L 2-(N-吗啡啉)乙磺酸(MES) 0.98 g,10 mmol/L葡萄糖 0.9 g,用HCl或NaOH调制适当的pH值。
1.2方法
1.2.1ASIC1a过表达载体pcDNA3.1/myc-His-mASIC1a的构建根据分子克隆实验指南中重组载体的方法[12],采用反转录聚合酶链式反应(RT-PCR)法克隆ASIC1a基因,ASIC1a上游引物为5′-CCCAAGCTTAGCATGGAACTGAAGACCGAG-3′,下游引物为5′-GCTCTAGAGCAGGTAAAGTCCTCAAACG-3′。琼脂糖凝胶电泳后,切胶回收DNA片段,并与pcDNA3.1/myc-His载体(购于Invitrogen)分别进行Hind Ⅲ和XbaⅠ双酶切,回收载体片段后,利用T4 DNA连接酶在16 ℃条件下,过夜连接,并转化,挑取单克隆进行测序鉴定。
1.2.2稳定过表达ASIC1a的FRT细胞的建立FRT细胞转染前24 h内采用胰酶消化,以70%~80%的密度铺到6孔板。将pcDNA3.1/myc-His-mASIC1a按照Lipofectamine 2000说明书步骤操作,瞬时转染到FRT细胞中,并进行新霉素(neomycin)筛选(浓度为500 mg/L),获得稳定过表达ASIC1a的FRT细胞。
1.2.3细胞免疫荧光染色将稳定过表达ASIC1a的FRT细胞去掉培养基,采用磷酸盐缓冲液(PBS)洗涤3次。4%多聚甲醛溶液室温下固定20 min后,采用0.05%聚乙二醇辛基苯基醚(TritonX-100)进行细胞膜穿孔15 min。2% BSA封闭液室温下封闭1 h。加入鼠源C-myc抗体(1∶1 000)室温2 h或4 ℃过夜。采用PBS洗涤3次,15 min/次。羊抗鼠荧光二抗Alexa fluo 594(1∶500)室温下反应1 h。去除二抗工作液,采用PBS洗涤3次,15 min/次。封固,荧光显微镜下观察并照相。
1.2.4Ca2+敏感荧光染料Fura-2/AM测定ASIC1a活性(1)将细胞分成两组,对照组(FRT细胞)和实验组(稳定过表达ASIC1a的FRT细胞),FRT细胞和稳定过表达ASIC1a的FRT细胞分别按约15 000个细胞/孔的密度铺于黑壁透明底的96孔板上,培养24 h。用PBS洗涤3次后加入0 μmol/L或2 μmol/L Fura-2/AM,37 ℃孵箱避光负载40 min。用含0.2% BSA的PBS洗涤3次,充分除去细胞外的Fura-2/AM。(2)Fura-2/AM无Ca2+结合能力,最大发射波长为510 nm,最大激发波长为380 nm,负载液的荧光光谱基本上同于此。Fura-2/AM与细胞内游离的Ca2+结合形成Fura-2-Ca2+复合物,最大激发波长从380 nm漂移到340 nm,固定发射波长510 nm,采用FluoStar Optima多功能酶标仪测定双波长(340 nm和380 nm)的值,计算F340/F380。实验重复5次。
1.2.5细胞毒性检测(LDH释放法)测定ASIC1a活性将细胞分成两组,对照组(FRT细胞)和实验组(稳定过表达ASIC1a的FRT细胞)。按照LDH释放检测试剂盒说明书方法检测不同pH值酸液(溶液A、溶液B)(pH值7.5、7.0、6.5、6.0、5.5)刺激后细胞LDH释放量。LDH释放法具体步骤:空白孔:双蒸水25 μl,基质缓冲液25 μl;标准孔:双蒸水5 μl,0.2 mmol/L标准液20 μl,基质缓冲液25 μl;测定孔:待测样本20 μl,基质缓冲液25 μl,辅酶I 5 μl;对照孔:双蒸水5 μl,待测样本20 μl,基质缓冲液25 μl。混匀,37 ℃温浴15 min。空白孔、标准孔、测定孔、对照孔分别加入2,4-二硝基苯肼25 μl,混匀,37 ℃温浴15 min。空白孔、标准孔、测定孔、对照孔分别加入0.4 mol/L NaOH溶液250 μl,混匀,室温放置5 min,每个样本取200 μl,波长450 nm处,酶标仪测定吸光度(OD值)。实验重复5次。

2结果
2.1ASIC1a过表达载体pcDNA3.1/myc-His-mASIC1a的构建以实验室已存的小鼠脑cDNA为模板,应用ASIC1a特异引物扩增出1条1 580 bp mASIC1a条带(见图1A),经HindⅢ和XbaⅠ双酶切后目的基因mASIC1a片段和pcDNA3.1/myc-His(见图1B)。ASIC1a过表达载体pcDNA3.1/myc-His-mASIC1a用ASIC1a特异引物经PCR扩增出1条1 580 bp左右的基因片段(见图1C),说明ASIC1a过表达载体pcDNA3.1/myc-His-mASIC1a构建成功。
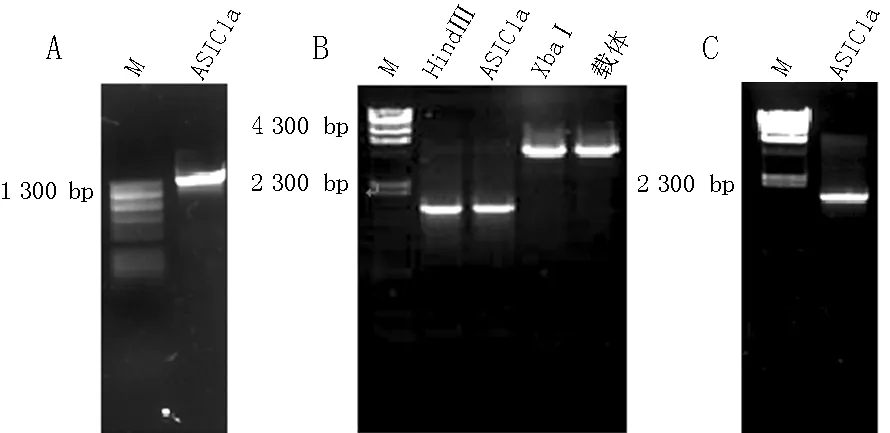
注:M=marker,ASIC1a=酸敏感离子通道1a;A:ASIC1a的PCR扩增产物;B:HindⅢ和XbaⅠ双酶切后扩增产物;C:ASIC1a过表达载体pcDNA3.1/myc-His-mASIC1a的PCR扩增产物
图1ASIC1a过表达载体pcDNA3.1/myc-His-mASIC1a的PCR扩增产物
Figure 1The PCR amplification product of ASIC1a overexpression vector pcDNA3.1/myc-His-mASIC1a
2.2稳定过表达ASIC1a的FRT细胞的建立将pcDNA3.1/myc-His-mASIC1a转染入FRT细胞,应用免疫荧光方法观察ASIC1a在FRT细胞中的表达情况。免疫荧光结果显示,ASIC1a表达在FRT细胞的细胞膜上,并且ASIC1a表达纯度很高(见图2),筛选成功,可以应用于后续实验研究。
2.3Ca2+敏感荧光染料Fura-2/AM测定ASIC1a活性对照组与实验组未负载Fura-2/AM细胞F340/F380比较,差异无统计学意义(P>0.05);对照组与实验组负载Fura-2/AM细胞F340/F380比较,差异有统计学意义(P<0.05);对照组和实验组负载Fura-2/AM细胞F340/F380高于未负载Fura-2/AM细胞,差异有统计学意义(P<0.05,见表1)。

Table 1Comparison of F340/F380 of cells loaded with Fura-2/AM and cells not loaded with Fura-2/AM calcium between control group and experiment group

组别未负载Fura-2/AM负载Fura-2/AMt值P值对照组0.37±0.064.86±0.3811.54<0.01实验组0.41±0.058.70±0.2631.45<0.01t值0.538.28P值0.61<0.01

图2稳定过表达ASIC1a的FRT细胞免疫荧光染色(×40)
Figure 2FRT cell immunity fluorescence staining with stable ASIC1a overexpression
2.4细胞毒性检测(LDH释放法)测定ASIC1a活性pH值7.5、7.0时,对照组与实验组细胞LDH释放量比较,差异无统计学意义(P>0.05);pH值6.5、6.0、5.5时,实验组细胞LDH释放量大于对照组,差异有统计学意义(P<0.05);对照组和实验组细胞不同pH值时LDH释放量比较,差异有统计学意义(P<0.05,见表2)。
3讨论
本研究通过建立稳定过表达ASIC1a的FRT细胞,应用Ca2+敏感荧光染料Fura-2/AM测定ASIC1a活性,发现稳定过表达ASIC1a的FRT细胞F340/F380升高,可以作为高通量筛选ASIC1a抑制剂的方法之一。酸中毒机制是通过激活ASIC1a,引起Ca2+超载,导致细胞中毒乃至死亡。目前,常用有效的检测细胞毒性的方法是通过测定LDH释放量来反映细胞中毒程度。本研究发现,pH值下降,稳定过表达ASIC1a的FRT细胞LDH释放量增加,为进一步高通量筛选ASIC1a抑制剂提供可能。
缺血性脑损伤是一个由多因素参与、多蛋白相互调控的过程。研究者普遍认为“兴奋毒性”和“酸毒性”是引起缺血性脑损伤的两个重要的机制,过量的谷氨酸激活NMDARs导致大量Ca2+内流,从而激活了CaMKⅡ,CaMKⅡ又依次调节NMDARs和ASIC1a的磷酸化[6]。缺血过程中,NMDARs的激活又增强了ASIC1a同聚体和包含ASIC1a的异聚体通道通透Ca2+和Na+的电流[6]。由此可见,在脑缺血期间,兴奋性中毒和酸中毒存在着功能上的协同作用,最终导致神经元的死亡。尽管对缺血性脑卒中的细胞与分子反应的研究已取得了巨大的进展,但仍无有效的治疗措施[6]。随着谷氨酸受体拮抗剂在临床上应用的失败,研发ASICs的有效抑制剂必然成为治疗缺血性脑卒中的新靶点。
ASIC1a是导致缺血性脑损伤的重要分子机制。细胞外酸化激活ASIC1a通透Ca2+,导致细胞内Ca2+超载,引起神经元中毒损伤[6]。本研究首先根据细胞的特性、贴壁性以及是否能应用于高通量筛选等方面选择FRT细胞作为工具细胞,并建立了稳定过表达ASIC1a的FRT细胞。目前检测ASIC1a功能的方法是应用全细胞膜片钳技术记录ASIC1a的开关电流,但此技术不适于高通量筛选大规模药物,耗时长、效率低[6],所以探索合适的高通量筛选方法就显得尤为重要。本研究探索两种测定方法:(1)Ca2+敏感荧光染料Fura-2/AM,优点是具有高荧光强度、高灵敏度、误差小、低亲和力,能实时监测Ca2+浓度的变化,但易出现探针泄漏、房室化、受其他二价阳离子干扰、耗费大等现象。(2)细胞毒性检测(LDH释放法),优点是经济、快速、简便、适用范围广,可做定量测定,具有大量样本快速检测的优点。但LDH是细胞本身生长代谢的产物,可能存在自发释放现象,并且LDH分子较大,当细胞膜严重破损时才能被释放,故不能较早地反映细胞的功能,另外较高浓度的胎牛血清中所含的LDH、培养液中的丙酮酸盐都可能会干扰结果[13]。本研究应用以上两种方法均得到了较好的实验结果,为发现高选择性和高活性的天然小分子ASIC1a抑制剂奠定了基础,为研究缺血性脑卒中诱发神经元损伤的机制和治疗提供理论基础。

表2 对照组与实验组不同pH值时细胞LDH释放量比较±s,n=5)
注:与同组pH值7.5时比较,aP<0.05;与同组pH值7.0时比较,bP<0.05;与同组pH值6.5时比较,cP<0.05
综上所述,本研究对比分析FRT细胞和稳定过表达ASIC1a的FRT细胞中Ca2+敏感荧光染料Fura-2/AM测定的F340/F380和细胞毒性检测(LDH释放法)测定的LDH释放量,这两种方法均可以作为高通量筛选高选择性和高活性的天然小分子ASIC1a抑制剂的功能方法。由于ASIC1a是快速转运Ca2+通道,Ca2+敏感荧光染料Fura-2/AM和细胞毒性检测(LDH释放法)方法对Ca2+快速变化的敏感性、受其他因素干扰情况以及人为误差等因素仍存在诸多不明确性,还需后续实验进一步优化,从而为研发高选择性和高活性的天然小分子ASIC1a抑制剂提供新思路和新方法。
作者贡献:羿菲、宋晓宇构思并设计实验、分析数据、撰写论文、并对文章负责;李小曼进行资料收集整理;白宁、孙威、姜波、张莹进行实验实施和评估;宋晓宇负责文章审校。
本文无利益冲突。
参考文献
[1]Osmakov DI,Andreev YA,Kozlov SA.Acid-sensing ion channels and their modulators[J].Biochemistry(Mosc),2014,79(13):1528-1545.
[2]Chen CC,England S,Akopian AN,et al.A sensory neuron-specific,proton-gated ion channel[J].Proc Natl Acad Sci U S A,1998,95(17):10240-10245.
[3]Alvarez de la Rosa D,Krueger SR,Kolar A,et al.Distribution,subcellular localization and ontogeny of ASIC1 in the mammalian central nervous system[J].J Physiol,2003,546(1):77-87.
[4]Xiong ZG,Chu XP,Simon RP.Acid sensing ion channels——novel therapeutic targets for ischemic brain injury[J].Front Biosci,2007,1(12):1376-1386.
[5]Babini E,Paukert M,Geisler HS,et al.Alternative splicing and interaction with di- and polyvalent cations control the dynamic range of acid-sensing ion channel 1(ASIC1)[J].J Biol Chem,2002,277(44):41597-41603.
[6]Xiong ZG,Zhu XM,Chu XP,et al.Neuroprotection in ischemia:blocking calcium-permeable acid-sensing ion channels[J].Cell,2004,118(6):687-698.
[7]O′Bryant Z,Vann KT,Xiong ZG.Translational strategies for neuroprotection in ischemic stroke——focusing on acid-sensing ion channel 1a[J].Transl Stroke Res,2014,5(1):59-68.
[8]Gao J,Duan B,Wang DG,et al.Coupling between NMDA receptor and acid-sensing ion channel contributes to ischemic neuronaldeath[J].Neuron,2005,48(4):635-646.
[9]Leng TD,Si HF,Li J,et al.Amiloride analogs as ASIC1a inhibitors[J].CNS Neurosci Ther,2016.[Epub ahead of print].
[10]Ugawa S,Ueda T,Ishida Y,et al.Amiloride-blockable acid-sensing ion channels are leading acid sensors expressed in human nociceptors[J].J Clin Invest,2002,110(8):1185-1190.
[11]Escoubas P,De Weille JR,Lecoq A,et al.Isolation of a tarantula toxin specific for a class of proton-gated Na+channels[J].J Biol Chem,2002,275(33):25116-25121.
[12]Sambrook J,拉塞尔DW.分子克隆实验指南[M].黄培堂,译.3 版.北京:科学出版社,2008:26-99.
[13]Su J,Tang Y,Liu L,et al.Regulation of acid-sensing ion channel 1a function by tissue kallikrein may be through channel cleavage[J].Neurosci Lett,2011,490(1):46-51.
(本文编辑:陈素芳)
High Thoughtout Screening of ASIC1a Inhibitors
YIFei,LIXiao-man,BAINing,etal.
InstituteofTranslationalMedicine,ChinaMedicalUniversity,Shenyang110122,China
【Abstract】ObjectiveTo establish the FRT cell of Fisher rats of stable in vitro ASIC1a overexpression,Ca2+-sensitive fluorescent dye Fura-2/AM and cytotoxicity test(LDH releasing method) were used to determine the activity of ASIC1a,to discuss the feasibility of high throughput screening of ASIC1a inhibitors.MethodsFrom January 2014 to February 2016,molecular biology method was used to establish ASIC1a overexpression vector pcDNA3.1/myc-His-mASIC1a.By cell transfection technique,we established FRT cell of Fisher rats with stable ASIC1a overexpression.The cells were divided into two groups:control group(FRT group) and experiment group(FRT cells with stable ASIC1a overexpression);two groups were loaded or not loaded with Ca2+-sensitive fluorescent dye Fura-2/AM,and enzyme mark detector was employed to determine dual-wave length(340 nm and 380 nm) and the ratio of F340/F380.After the cells in control group and experiment group were stimulated by acid liquid of different pH values(7.5,7.0,6.5,6.0 and 5.5),the LDH release at 450 nm wave length was determined using enzyme mark detector.ResultsControl group and experiment group were not significantly different in F340/F380 of cells loaded with Fura-2/AM(P>0.05);experiment group was higher than control group in F340/F380 of cells loaded with Fura-2/AM(P<0.05);control group and experiment group had higher F340/F380 in cells loaded with Fura-2/AM than in cells not loaded with Fura-2/AM(P<0.05).When pH value were 6.5,6.0 and 5.5,experiment group was higher than control group in LDH release(P<0.05);control group and experiment group were significantly different in LDH release in the cases of different pH values(P<0.05).ConclusionStable ASIC1a overexpression cells are established,and Ca2+-sensitive fluorescent dye Fura-2/AM and cytotoxicity test(LDH releasing method) are used to determine the activity of ASIC1a,which make the high thoughtout screening of ASIC1a inhibitors possible and lay a foundation for finding natural small molecule ASIC1a inhibitors with specificity and high activity.
【Key words】High-throughput screening assays;Acid-sensing ion channels1a;Epithelial cells;Lactate dehydrogenase
基金项目:国家自然科学基金资助项目(81502414);教育部“创新团队发展计划”资助项目(IRT13101)
通信作者:宋晓宇,110122辽宁省沈阳市,中国医科大学转化医学研究院;E-mail:xysong@mail.cmu.edu.cn
【中图分类号】R 965.1
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.17.011
(收稿日期:2016-03-01;修回日期:2016-05-10)
