Rack1与β-catenin在胃癌组织中的表达与临床意义
2016-07-18王一郭琳刘乙蒙任丽莉刘超肖建英
王一,郭琳,刘乙蒙,任丽莉,刘超,肖建英Δ
(1.辽宁医学院 研究生院,辽宁 锦州 121001;2.锦州市食品药品检验所,辽宁 锦州 121000)
Rack1与β-catenin在胃癌组织中的表达与临床意义
(1.辽宁医学院 研究生院,辽宁 锦州 121001;2.锦州市食品药品检验所,辽宁 锦州 121000)
目的 研究蛋白激酶1活化受体(protein kinase 1 activation receptors,Rack1)和β-连环蛋白(β-catenin)在胃癌组织中的表达情况,以及与胃癌临床病理特征的关系,探讨二者的相关性及临床意义。方法 采用免疫组织化学SP法检测Rack1与β-catenin在70例胃癌组织和30例距癌组织边缘10 cm以上的癌旁胃组织中的表达情况。结果 与癌旁胃组织相比,Rack1在胃癌组织中的表达明显降低(P<0.01),β-catenin在胃癌组织中出现明显的膜表达缺失(P<0.01)。胃癌组织中Rack1蛋白的高表达率、β-catenin膜表达的缺失率均在不同TNM分期、肿瘤的分化程度以及有无淋巴结转移方面差异有统计学意义(P<0.01),而Rack1和β-catenin在胃癌组织的表达水平与不同年龄、性别、肿瘤直径、肿瘤浸润深度方面的差异无统计学意义。胃癌组织中Rack1蛋白表达与β-cantenin膜表达缺失呈显著负相关(r=-0.691,P=0.000)。结论 Rack1和β-catenin蛋白的异常表达可能共同参与胃癌的发生发展,并影响胃癌的淋巴转移。
胃癌;Rack1;β-catenin;免疫组织化学
胃癌是一类常见的消化道恶性肿瘤,每年死亡人数在各类恶性肿瘤中位居第二[1]。在临床表现中,各种病理类型的胃癌发生发展与转归有所不同,其调控的分子机制尚不清楚。蛋白激酶1活化受体(protein kinase 1 activation receptors,Rack1)是一种细胞构架蛋白并且参与诸多细胞内信号通路的传导,Rack1有助于使与其结合的蛋白质或分子稳定在失活或者活化状态[2]。β-连环蛋白(β-catenin)是调控Wnt信号传导的核心分子,Wnt/β-catenin通路是最经典的一条Wnt信号通路,广泛存在于多细胞生物体内[3],此通路的障碍或异常调控影响着肿瘤的发生与发展。在目前的研究中,有关Rack1在胃癌组织中的表达以及对胃癌预后影响的报道极为少见。本实验应用免疫组织化学方法检测Rack1与β-catenin在胃癌组织中的表达及分析二者的相关性,并探讨二者表达水平与胃癌不同临床病理特征间的关系,为胃癌早期诊断、治疗及预后判断提供实验依据。
1 材料与方法
1.1 一般资料 收集辽宁医学院附属第一医院2012年3月7日~2013年6月20日期间,病理科切除的70例胃癌标本。其中男性43例,女性27例;年龄≥60岁的26例,<60岁的44例;肿瘤直径≤5 cm的28例,>5 cm的42例;未侵及浆膜的34例,侵及浆膜的36例;有淋巴结转移的47例,无淋巴结转移的23例;有远隔转移的33例,无远隔转移的37例;高-中分化30例,低分化40例;Ⅰ-Ⅱ期41例,Ⅲ-Ⅳ期29例;患者术前均未接受过化疗与放疗。另选取30例距癌组织边缘10 cm以上的癌旁正常胃组织标本作为对照,以上标本临床病例资料完整。
1.2 试剂与仪器
1.2.1 试剂:鼠抗人β-catenin单克隆抗体购于美国BD公司(产品编号:262505),兔抗人单克隆Rack1抗体购自MILLIPORE公司(产品编号:MABN1036);DAB显色试剂盒购置于北京中杉金桥生物技术有限公司(产品编号:ZLI-9017)。PV二步法试剂盒购置于北京中杉金桥生物技术有限公司(产品编号:PV-9003)。
1.2.2 仪器:OlympusDP72型显微镜购于日本Olympus公司。
1.3 实验方法 采用免疫组织化学SP法,将组织切片置于60 ℃烤箱中2 h,组织切片按实验常规步骤脱蜡水化。高压锅将抗原修复液加热至沸腾,140 ℃高压修复3 min后冷却至50 ℃以下。3%的H2O2去除氢化物酶,去背景染色。加入一抗,Rack1(1:200),β-catenin(1:200)4 ℃过夜保存。从4 ℃冰箱取出,室温复温1 h后滴加二抗,DAB显色,苏木素复染10 min、盐酸酒精分化5 s、自来水冲洗、脱水、二甲苯透明、中性树脂封片、显微镜下观察。同时用磷酸盐缓冲液代替一抗做阴性对照,用已知的Rack1与β-catenin的阳性表达标本做阳性对照。
1.4 结果判定
1.4.1 Rack1表达:Rack1蛋白的阳性表达主要定位于细胞浆,Rack1阳性细胞计数是指在400倍光镜下随机选取每张切片的5个视野,每个高倍视野计数多于300个细胞。采用双评分法,阳性细胞所占的百分比<5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分。阳性细胞染色强度评分,无着色记0分,浅黄色记1分,棕黄色记2分,棕褐色记3分。综合评分由两类积分相乘,0分为阴性(-),1~4分为弱阳性(+),5~9分为阳性(++),>10分为强阳性(+++)。(+)~(++)为低表达,(+++)以及(+++)以上为高表达。
1.4.2 β-catenin表达:从细胞膜、细胞质和细胞核着色3个方面判断β-catenin的表达特征。β-catenin的免疫组织化学结果参照文献[4]评定,阳性染色呈棕黄色。在光学显微镜下,随机选择5个高倍视野进行观察,每一视野计数多于300个细胞,细胞膜阳性细胞率>70%评定为正常表达,反之为膜表达缺失。细胞质或细胞核阳性表达,阳性细胞数>10%为异位表达。膜表达缺失与异位表达均为阳性表达。所有切片均由两位资深病理科医生应用双盲法进行临床评价。
1.5 统计学方法 数据采用SPSS17.0软件进行统计分析,计数资料采用例数或率表示,2组间比较采用χ2检验分析,2指标之间的相关性采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Rack1在胃癌组织和癌旁胃组织中的表达 Rack1蛋白在癌旁胃组织和胃癌组织中的阳性表达均定位于细胞质(见图1B、C、D)。Rack1在胃癌组织(图1C、D)中的表达明显低于癌旁胃组织(图1B),并且Rack1在高中分化的胃癌组织(图1C)中的表达量高于低分化胃癌组织(图1D)。
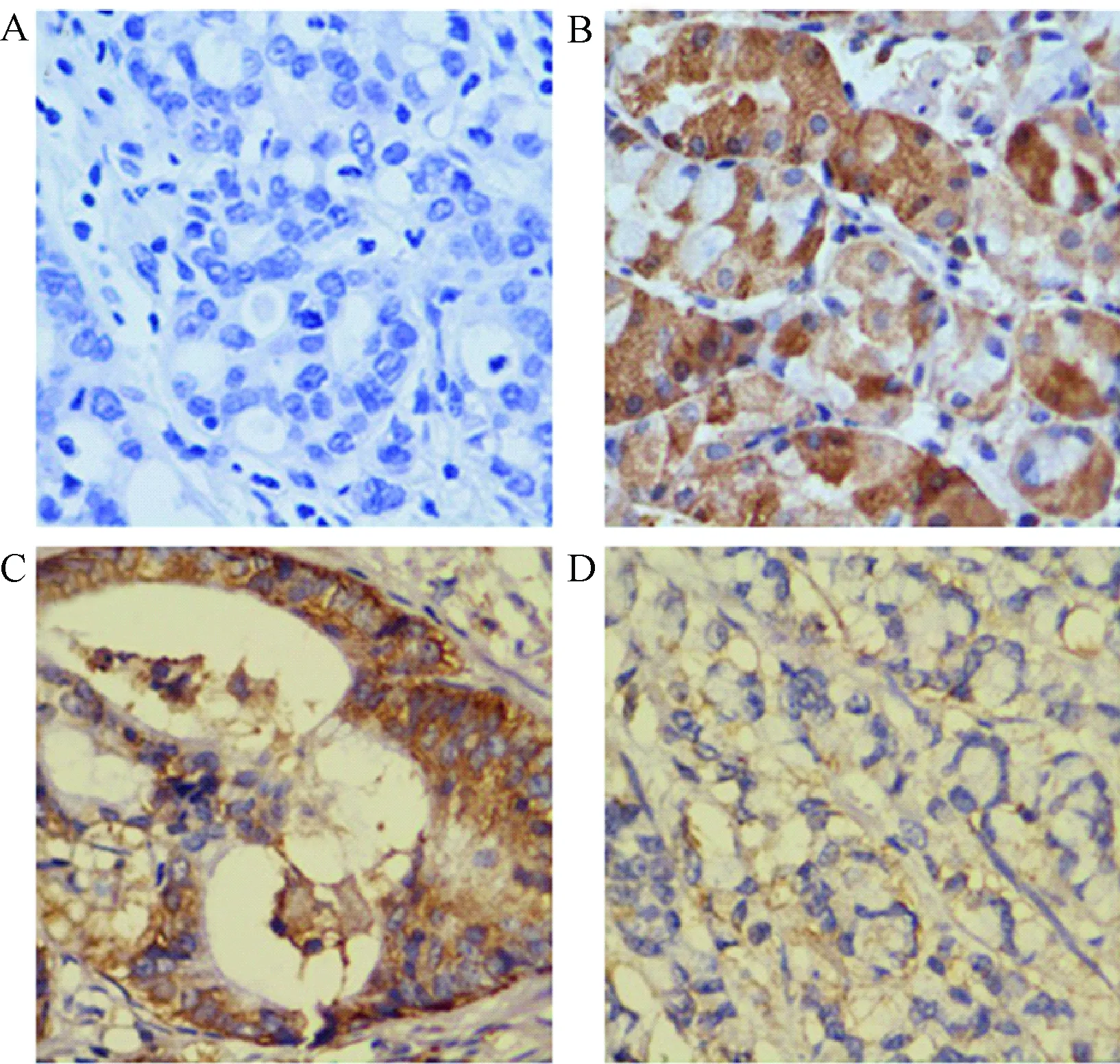
图1 Rack1在胃癌组织和癌旁胃组织中的表达(SABC×400)A:阴性对照;B:癌旁胃组织;C:高中分化胃癌组织;D:低分化胃癌组织Fig.1 Expressions of Rack1 in tissues of carcinoma and para-carcinoma(SABC×400)A:negative control; B:para-carcinoma tissue;C:well-differentiated and severe-differentiated gastric carcinoma tissue;D: poorly differentiated gastric carcinoma tissue
分析结果显示,Rack1在癌旁胃组织中高表达率为86.7%(26/30),在胃癌组织中高表达率为34.3%(24/70),胃癌组织中Rack1的高表达率明显低于癌旁胃组织(χ2=23.048,P<0.05)。见表1。
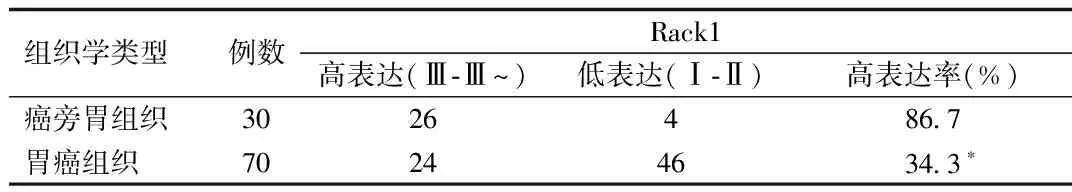
表1 70例胃癌组织和30例癌旁胃组织中Rack1表达
*P<0.05,与癌旁胃组织比较,compared with para-carcinoma tissue
2.2 β-catenin在胃癌组织和癌旁胃组织中的表达 β-catenin在癌旁胃组织中的阳性表达主要定位于细胞膜(图2B),而在胃癌组织中的阳性表达主要定位于细胞质和细胞核(图2C、D),即β-catenin在胃癌组织中出现明显的膜表达缺失。
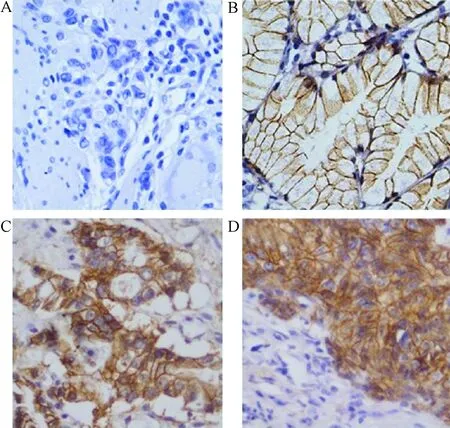
图2 β-catenin在胃癌组织和癌旁正常胃组织中的表达(SABC×400) E:阴性对照;F:癌旁胃组织;G:高中分化胃癌组织;H:低分化胃癌组织 Fig.2 Expressions of β-catenin in tissues of carcinoma and para-carcinoma(SABC×400)A:negative control; B:para-carcinoma tissue;C:well-differentiated and severe-differentiated gastric carcinoma tissue;D: poorly differentiated gastric carcinoma tissue
分析结果显示,β-catenin在癌旁胃组织中发生膜表达缺失率为10.0%(3/30),在胃癌组织中发生膜表达缺失率为62.9%(44/70)。胃癌组织中β-catenin的膜表达缺失率明显高于癌旁胃组织(χ2=23.048,P<0.05)。见表2。

表2 70例胃癌组织和30例癌旁胃组织中β-catenin表达
*P<0.05,与癌旁胃组织比较,compared with para-carcinoma tissue
2.3 Rack1与β-catenin蛋白在胃癌组织的表达与临床病理参数的关系 胃癌组织中Rack1蛋白表达的高低与TNM分期、肿瘤的分化程度以及有无淋巴结转移有关。Rack1在Ⅰ-Ⅱ期胃癌组织中的表达高于在Ⅲ-Ⅳ期胃癌组织中的表达(P<0.01);在高-中分化胃癌组织中Rack1的表达高于低分化胃癌组织(P<0.01);Rack1在无淋巴结转移的胃癌组织中的表达高于有淋巴结转移的胃癌组织(P<0.01)。
同时,β-catenin膜表达的缺失率也与肿瘤的分化程度、TNM分期以及有无淋巴结转移有关。β-catenin在低分化胃癌组织的膜表达缺失明显高于高中分化的胃癌组织(P<0.01);β-catenin在Ⅲ、Ⅳ期胃癌标本中的膜表达缺失明显高于Ⅰ、Ⅱ期胃癌标本(P<0.01);并且β-catenin在有淋巴结转移的胃癌组织中的膜表达缺失显著高于无淋巴结转移的胃癌组织中的膜表达缺失(P<0.01)。而Rack1和β-catenin在胃癌组织的表达水平与年龄、性别等因素无关。见表3。
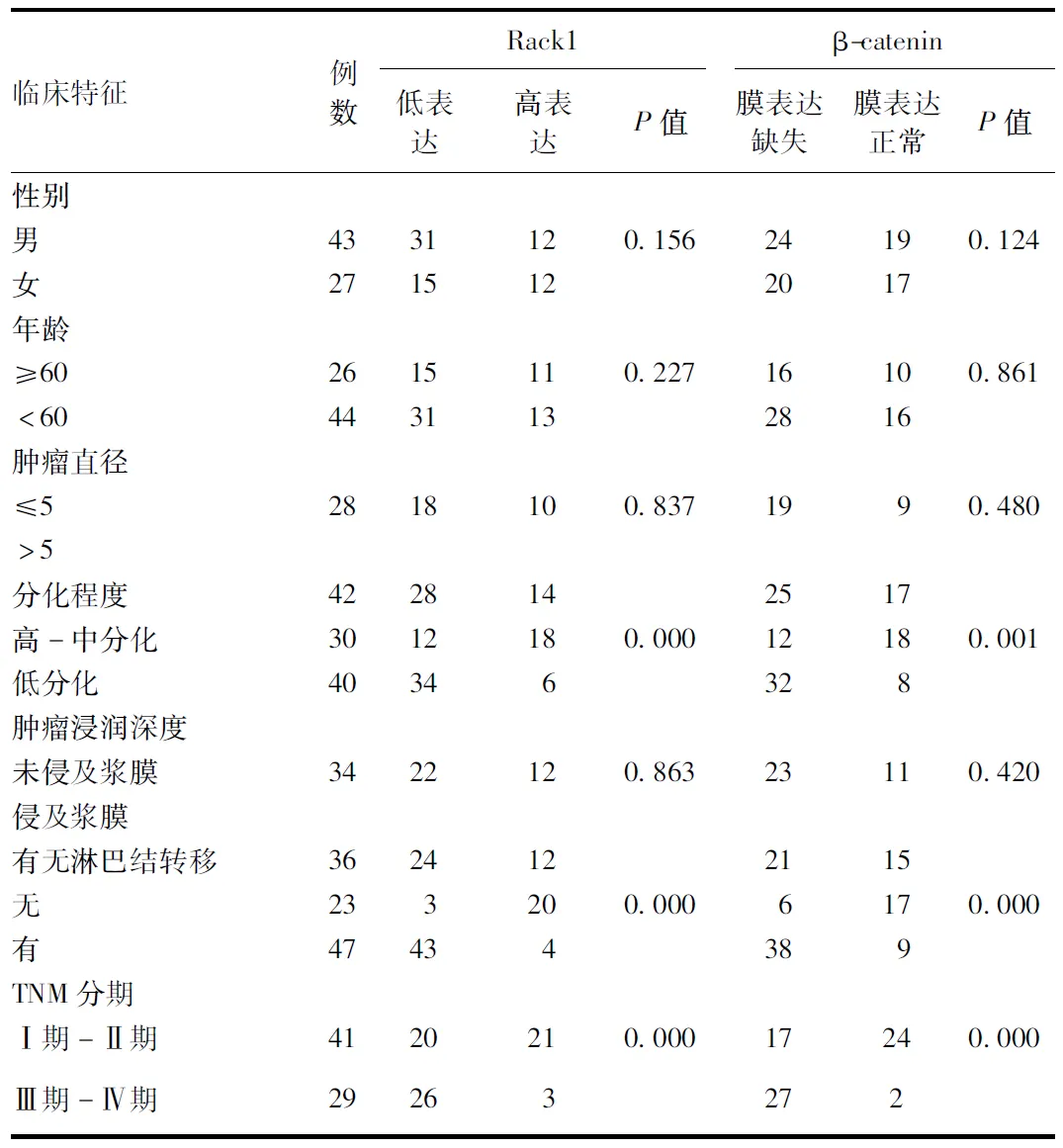
表3 Rack1与β-catenin蛋白在胃癌组织中的表达与临床病理参数的关系(n)
2.4 胃癌组织中Rack1蛋白表达与β-catenin膜表达缺失的相关性分析 在70例胃癌组织中,Rack1蛋白高表达、β-catenin膜表达缺失为4例;β-catenin蛋白高表达、β-catenin膜表达正常为20例;Rack1蛋白低表达、β-catenin膜表达缺失为40例;Rack1蛋白低表达、β-catenin膜表达正常为6例。采用Spearman相关分析表明,Rack1蛋白表达水平越低,β-catenin膜表达缺失越高;相反Rack1蛋白表达越高,β-catenin膜表达缺失越低,二者呈显著负相关(r=-0.691,P=0.000)。见表4。

表4 胃癌组织中Rack1蛋白表达水平与β-catenin蛋白膜表达缺失的相关性(n)
3 讨论
研究表明,Rack1与G蛋白β亚基具有高度同源性,并且Rack1所具有的七叶螺旋桨结构,可促进Rack1与其它蛋白质相结合[5]。Rack1作为调控多条重要肿瘤侵袭转移信号通路的关键基因,亦可整合不同的信号通路,协调关键信号分子相互作用,在肿瘤细胞功能活动中发挥重要作用[6-7]。Rack1可以通过激活蛋白激酶C(PKC)来促进肿瘤的侵袭转移和多种细胞功能[8-9]。有研究发现,Rack1在胃癌组织中表达下调,且其表达水平与肿瘤的分化程度和浸润深度显著相关[10-11]。本研究发现Rack1在胃癌组织中的表达量明显低于癌旁正常胃组织(P<0.05),且表达水平的高低与TNM分期、肿瘤的分化程度、以及有无淋巴结转移有关。即:Rack1在Ⅰ-Ⅱ期胃癌组织中的表达高于在Ⅲ-Ⅳ期胃癌组织中的表达(P<0.01);在高-中分化组中Rack1的表达高于低分化组(P<0.01);Rack1在无淋巴结转移组中的表达高于有淋巴结转移组(P<0.05),提示Rack1表达水平可能影响胃癌的发生发展与转移。
Wnt/β-catenin通路是Wnt通路中一条最经典的通路,其核心部件在进化中是高度保守的。当Wnt信号通路发生异常调控时,会影响细胞正常的生长、分化、增殖与迁移,从而导致肿瘤的发生[12-13]。有文献报道,在Wnt信号缺失的情况下,胞质内的β-catenin会被磷酸化而降解,随β-catenin含量的上升,它进入并聚集在细胞核内,与特定的转录因子相互作用,激活Wnt/β-catenin信号通路靶基因的转录,引起细胞迁移能力和细胞极性的改变,从而诱发肿瘤的发生[14]。本研究表明,胃癌组织中β-catenin膜表达的缺失率与肿瘤的分化程度、TNM分期以及有无淋巴结转移有关。β-catenin膜表达的缺失率随胃癌分化程度的降低而升高(P<0.05); β-catenin在Ⅲ期-Ⅳ期胃癌标本中的膜表达缺失率明显高于Ⅰ期-Ⅱ期胃癌标本(P<0.01);并且β-catenin的膜表达缺失率也与有无淋巴结转移有关,有淋巴结转移组的膜表达缺失率明显高于无淋巴结转移组的膜表达缺失率(P<0.05)。本实验结果提示,β-catenin膜表达缺失率的高低可能与胃癌的发生发展及淋巴转移有关。
文献报道[15], Rack1显著促进Wnt/ β-catenin信号通路,并促进其核心分子β-catenin的降解,使其信号通路的活化受到抑制。由于Rack1与β-catenin在肿瘤的发生发展及侵袭转移中起重要作用,所以本研究联合检测Rack1与β-catenin在胃癌中表达的相关性。结果发现:Rack1表达水平与β-catenin膜表达缺失呈显著负相关(r=-0.691,P=0.000)。提示二者表达量的变化可能与胃癌的发生发展及转移等过程有关,所以联合检测Rack1与β-catenin在胃癌组织中的表达情况有助于进一步探讨胃癌发展趋势,为预后判断提供有利的实验依据。
综上所述, Rack1和β-catenin蛋白的异常表达可能共同参与胃癌的发生发展,并影响胃癌的淋巴转移。因此,深入研究Rack1与β-catenin蛋白,将有助于进一步探讨胃癌发生的分子机制。在临床治疗中,联合检测这两个蛋白,有望为肿瘤的治疗提供有效的新靶点。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2]Namikawa T,Kobayashi M,Kitagawa H,et al.Early gastric cancer with widespread duodenal invasion within the mucosa[J].Dig Endosc, 2010,22(3):223-227.
[3]张德龙,王伟,张力,等.Wnt/β-cantenin 信号途径促进肌源性干细胞向神经细胞分化[J].解放军医学院学报,2014(35):383-387.
[4]Loyer EM,David CL,Dubrow RA,et al.Vascular involvement in pancreatic adenocarcinoma:reassessment by thin-section CT[J].Ab-dom Imaging, 1996,21(3):202-206.
[5]Yoon HM,Ryu KW,Nam BH,et al.Is the new seventh AJCC/UICC staging system appropriate for patients with gastric cancer[J].J AM Coll Surg,2012,214(1):88-96.
[6]Shi S,Deng YZ,Zhao JS,et al.Rack1 promotes non-small lung cancer tumorigenicity through activating Sonic hedgehog signaling pathway.J Biol Chem,2012,287(11):7845-7858.
[7]Bird RJ, Baillie GS, Yarwood SJ.Interaction with receptor for activated C-kinase 1 (RACK1) sensitizes the phosphodiesterase PDE4D5 towards hydrolysis of cAMP and activation by protein kinase C[J].Biochem J,2010,432(1):207-216.
[8]Yang WH,Lan HY,Huang CH,et al.Rack1 activation mediates Twist1-induced cancer cell migration[J].Not Cell Biol,2012,40(5):1553-1560.
[9]Lee HE,Park DJ,Kim WH,et al.Targeting the PI3K/AKT/mTOR signaling pathway in glioblastoma:novel therapeutic agents and advances in understanding.Tumor Biol,2013.34(4):1999-2002.
[10]Deng YZ,Yao F,Li JJ,et al.Rack1 Suppresses Gastric Tumorigenesis by Stabilizing the beta-catenin Destruction Complex[J].GASTROE-NTEROLOGY,2012,142(4):812-839.
[11]Liu AN,Zhu ZH,Chang SJ,et al.Twist expression associated with epithel-mesenchymal transition in gastric cancer[J]. Mol Cell Biochem,2012,367(1-2):195-203.
[12]Loganc Y,Nusse R.The Wnt signaling pathway in development and disease[J].Annu Rev Cell Dev Biol,2004,20:781-810.
[13]Sareddy GR,Challa S,Panigrahi MA.Wnt/beta-catenin/Tcf Signaling Pathway Activation in Malgnant Progression of Rat Gliom as Induced by Transplacental N-Ethyl-N-N introsourea Exposure[J].Neurochem Res,2009,34(7):1278-1288.
[14]Gnad T, Feoktistova M, Leverkus M,et al.Helicobacter pylori-induced activation of beta-catenin involves low density lipoprotein receptor-related protein 6 and Dishevelled[J].Mol Cancer,2010(9):31.
[15]牛磊,郗洪庆,陈凜,等.Lgr5-Wnt/β-catenin信号通路与胃癌干细胞的研究进展[J].解放军医学院学报,2014,35(12):1268-1272.
(编校:王俨俨)
Expressions and clinical significance of Rack1 and β-catenin in gastric carcinoma tissue
WANG Yi-zhao1, GUO Lin2, LIU Yi-meng1, REN Li-li1, LIU Chao1, XIAO Jian-ying1Δ
(1.School of Graduates,Liaoning Medical University, Jinzhou 121001, China; 2.Jinzhou Institute for Food and Drug Control, Jinzhou 121000, China)
ObjectiveTo explore the expression levels of protein kinase 1 activation receptors(Rack1)and β-catenin in gastric carcinomas and the relations with clinical pathological parameters, and correlation between Rack1 and β-catenin and their significance.MethodsImmunohistochemical SP method was used to detect the expressions of Rack1 and β-catenin protein in 70 cases of human gastric carcinomas and 30 cases of gastric mucosa(distance from tumor edge ≥10 cm).ResultsCompared to the gastric surrounding tissues, the expression of Rack1 in gastric cancer decreases apparently(P<0.01),and the expression of β-catenin deletion was more significant in the membrane of gastric cancer(P<0.01).There were significant difference in high expression of Rack1 protein and deletion expression of β-catenin of gastric carcinomas between different TNM stage, tumor differentiation and lymphatic metastasis(P<0.01),while there were no significant difference between different age, gender, diameter of tumor and the depth of neoplasm invasiveness.The expression of Rack1 and the deletion of β-catenin in membrane had a negative correlation(r=-0.691,P=0.000).ConclusionThe abnormal expression of Rack1 and β-catenin may be relevant to the occurrence and development of gastric carcinomas It also affects the lymphatic metastasis of gastric carcinomas.
gastric carcinomas; Rack1; β-catenin; immunohistochemical
辽宁省科技厅项目(2013225305)
王一曌,女,硕士在读,研究方向:生物化学与分子生物学,E-mail:babyyizhao@126.com;肖建英,通信作者,女,博士,教授,研究方向:生物化学与分子生物学,E-mail:xiaojianying@lumn.edu.cn。
R735.2
A
10.3969/j.issn.1005-1678.2016.03.08
