江苏省苏南地区4 972例体检人员腰椎骨密度流行病学调查
2016-07-18张东军周新宇田士兵孙燕叶霞
张东军 周新宇 田士兵 孙燕 叶霞
江苏省苏南地区4 972例体检人员腰椎骨密度流行病学调查
张东军 周新宇 田士兵 孙燕 叶霞
目的 探讨苏南地区体检人群腰椎骨密度(BMD)情况及年龄、身高、体质量、体重指数(BMI)等对腰椎BMD的影响,为本地区骨质疏松(OP)防治提供参考依据。方法 选择2014-07—2015-10间4 972例在江苏省太湖康复医院体检人群为研究对象,采用美国HOLOGIC公司的Discovery WI骨密度仪对受试者L1~L4椎体进行检测。同时采集年龄、体质量、身高、骨密度等指标,并计算BMI。按5岁为一组进行分组,用IBM SPSS 19.0统计软件进行分析。结果 男性骨质减少1 356例,占总数的41.6%;OP 318例,占总数的9.75%。女性骨质减少577例,占总数的33.70%;OP 211例,占总数的12.32%。大部分受试者的BMD与年龄呈负相关(P<0.05),而与身高、体质量及BMI呈正相关(P<0.05)。男性胖瘦人群间的BMD差异有统计学意义(P=0.000),而女性偏瘦人群与非偏瘦人群的BMD差异有统计学意义(P=0.000)。结论 苏南地区男性整体的骨质健康状况不如女性,但女性的OP患病率高于男性。女性骨丢失时间明显早于男性也快于男性。年龄、身高、体质量和BMI均是影响BMD的因素,以体质量对骨密度的影响最大。
苏南地区;腰椎;骨密度;年龄;身高;体质量;体重指数
骨质疏松症(osteoporosis,OP)是以骨组织纤维结构受损,骨基质和骨矿成分等比例的不断减少,骨脆性增加和骨折危险度升高的一种全身骨代谢障碍的疾病[1]。随着我国人口老龄化的加速,OP发病率逐年升高,不仅会增加患者的经济负担、降低患者的生活质量,还会成为严重的公共卫生及社会问题。由于OP的不可逆转性,一旦发生即使治疗亦不可能恢复骨的正常结构,因此该病的预防显得更为重要。骨密度(bone mineral density,BMD)是目前OP诊断的金标准,也是预测脆性骨折的主要危险因素和判断抗OP药物临床疗效的重要指标[2-3]。而DXA是世界上公认的BMD测量的首选方法,也是诊断OP的金标准[4]。由于BMD在种族及地域上有一定的差异,因此文献上各地区的骨密度情况屡有报道,但江苏省苏南地区的BMD情况报道较少。
本次研究共采集4 972例苏南地区体检人群腰椎BMD及年龄、性别、身高、体质量等相关数据,旨在得出不同年龄段的腰椎BMD变化规律及其与性别、年龄、身高、体质量及体重指数(body mass index,BMI)的关系,为本地区健康管理及OP的防治提供参考。
1 资料和方法
1.1 研究对象 选择2014-07—2015-10在我院体检的苏南地区人群为研究对象,共采集到4 972例受试者,主要职业为企事业单位在职及退休人员,年龄20~91岁,平均(49.43±10.88)岁:其中男性3 260例,平均(49.93±11.00)岁;女性1 712例,平均(48.46±10.58)岁。所有受试者均排除:患有骨代谢疾病(如青春期延迟、低性腺激素、甲旁亢、甲亢、慢性阻塞性肺疾病、骨髓瘤等等)、服用影响骨代谢的药物(如类固醇激素、促性腺激素释放激素、降钙素、双膦酸盐、抗癫痫药、避孕药及利尿剂等等)、患有严重肝肾疾病及近期制动达3个月以上者[3]。
1.2 检测方法 ①首先,在同一台机械秤上测量每一位受试者的身高、体质量,计算出BMI,BMI计算公式:BMI(kg/m2)=体质量(kg)/身高(m)2。中国人理想BMI为18.5~23,本例将研究对象分成4组:BMI<18.5;18.5≤BMI<23;23≤BMI<28;BMI≥28。BMD检测使用美国HOLOGIC公司的Discovery WI骨密度仪对受试者L1~L4椎体进行检测,自动得出相应的面积、骨矿含量及BMD数值、T值、Z值。②受试对象按每5岁为一组分为13组,分别为≤25岁、26~30岁、31~35岁、36~40岁、41~45岁、46~50岁、51~55岁、56~60岁、61~65岁、66~70岁、71~75岁、76~80岁及>80岁组。
1.3 统计学处理 将收集的数据录入电脑,采用IBM SPSS 19.0统计软件进行分析,计量资料用均值±标准差描述、计数资料用频数表示。组间均值比较采用独立样本t检验。年龄、身高、体质量、BMI与BMD的相关性行偏相关分析及Pearson相关性检验。各年龄段及不同体重指数人群间BMD差异用方差分析。
2 结果
2.1 受试人群的年龄、身高、体质量、BMI及BMD、骨质情况及其之间的相关性 女性偏瘦人群多于男性而男性肥胖人群多于女性,差异有高度统计学意义(P<0.01);女性OP发生率多于男性而男性骨质减少发生率多于女性,差异有统计学意义(P<0.05,表1)。男性腰椎骨密度与身高、体质量及BMI之间呈正相关,Pearson相关系数:体质量>BMI>身高;女性的腰椎骨密度与身高、体质量及BMI之间亦呈正相关,Pearson相关系数:身高>体质量>BMI(表2)。

表1 受试人群胖瘦分布及骨质情况[n(%)]

表2 受试人群骨密度及其与年龄、身高、体质量、体重指数的相关性分析
2.2 不同年龄段人群的身高、体质量、BMI及腰椎BMD、骨质情况及其之间的相关性(表3) 随着年龄的增加,在26~30岁形成腰椎骨量峰值,之后腰椎BMD逐渐下降,到71~75岁又有所回升。各年龄段组间差异有统计学意义(P<0.05):≤45岁组(≤25岁、26~30岁、31~35岁、36~40岁及41~45岁各组间差异没有统计学意义,P>0.05)、46~50岁组、51~55岁组、55~70岁组(55~60岁及61~65岁、66~70岁组间差异没有统计学意义,P>0.05)、>70岁组(70~71岁、75~80岁及>80岁组间差异没有统计学意义)。从46岁开始腰椎BMD呈下降趋势,到70岁以后又有所回升。在剔除性别变量影响的情况下,除了≤25岁的身高及体质量、26~30岁和76~80岁的身高、>80岁的身高和体质量及BMI与腰椎BMD间的差异无统计学意义(P>0.05)外,其他年龄段身高、体质量及BMI与腰椎BMD间都有着一定的正相关性。

表3 不同年龄段腰椎BMD及其与身高、体质量、BMI的偏相关分析
2.3 男、女性不同年龄段腰椎BMD情况(表4) 男性人群按腰椎BMD分为4组:26~30岁组、56~60岁组、71~75岁组,其余年龄段为一组(组间差异没有统计学意义,P>0.05);各组间差异有统计学意义(P<0.05)。男性骨量峰值出现在26~30岁,BMD从30岁开始呈下降趋势,到56~60岁到达最低点,61~65岁又开始上升,一直到80岁以上BMD值仍维持在较高水平。女性人群按腰椎BMD分为以下几组:≤45岁组、46~50岁组、51~55岁组、56~60岁组、61~65岁组、66~75岁组,大于76岁组,各组间差异有统计学意义(P<0.05)。女性骨量峰值出现在≤25岁,41~45岁形成一个小峰值,之后逐渐下降,71~75岁腰椎BMD又有一短暂的升高,76岁以后开始下降。50岁之前男性与女性腰椎BMD值相当,50岁以后女性腰椎BMD值下降速度明显高于男性。
表4 男、女性不同年龄段人群间的腰椎BMD情况(±s)

表4 男、女性不同年龄段人群间的腰椎BMD情况(±s)
年龄段(岁) 男性女性人数 BMD(g/cm2) 人数 BMD(g/cm2)≤25 35 0.986±0.112 14 1.027±0.131 26~30 103 1.013±0.115 63 0.983±0.111 31~35 175 0.991±0.107 109 0.988±0.091 36~40 265 0.982±0.118 150 0.994±0.109 41~45 489 0.981±0.115 336 1.002±0.111 46~50 713 0.972±0.117 383 0.985±0.120 51~55 570 0.968±0.123 260 0.919±0.126 56~60 415 0.967±0.123 171 0.859±0.108 61~65 220 0.974±0.131 111 0.813±0.117 66~70 126 0.978±0.146 65 0.768±0.110 71~75 86 0.996±0.155 31 0.801±0.125 76~80 50 1.003±0.151 14 0.724±0.101>80 13 1.019±0.162 5 0.779±0.126总计 3 260 0.977±0.122 1 712 0.942±0.136
2.4 男、女性BMI与腰椎BMD之间的相关性(表5)男性不同胖瘦人群的腰椎BMD值有着明显的差异(P=0.000),BMI越小则BMD越低,且偏瘦人群与正常人群之间的差异明显大于其他组,说明瘦弱相对于肥胖更能影响男性的腰椎BMD。女性偏瘦人群与正常人群相对BMD有着明显的差异(P=0.000),而正常人群与偏胖人群、偏胖人群与肥胖人群之间的腰椎BMD差异无统计学意义(P>0.05)。
表5 男、女性不同胖瘦人群的骨密度均值及胖瘦各组间差异(±s)
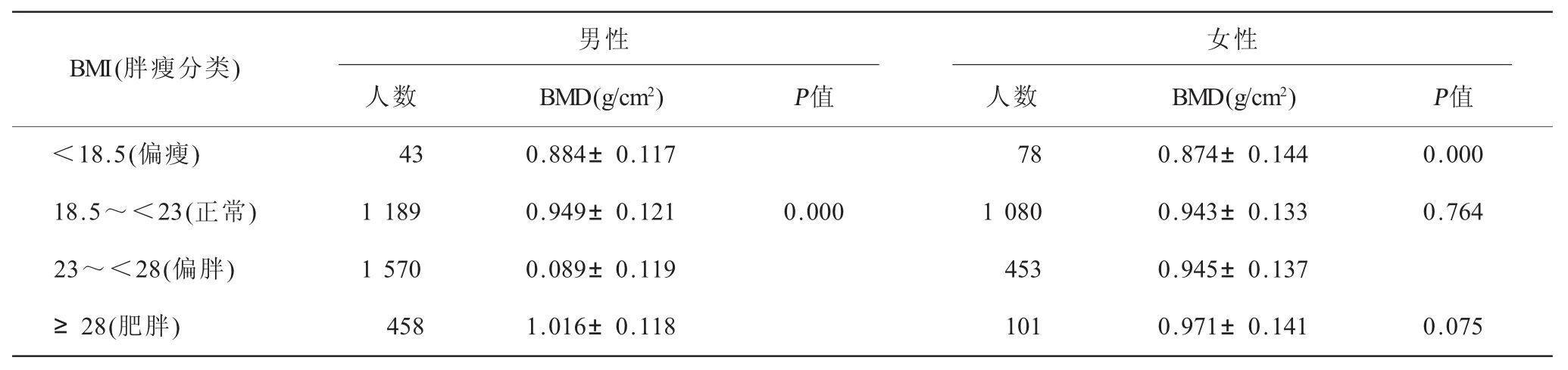
表5 男、女性不同胖瘦人群的骨密度均值及胖瘦各组间差异(±s)
女性人数 BMD(g/cm2) P值 人数 BMD(g/cm2) P值<18.5(偏瘦) 43 0.884±0.117 78 0.874±0.144 0.000 18.5~<23(正常) 1 189 0.949±0.121 0.000 1 080 0.943±0.133 0.764 23~<28(偏胖) 1 570 0.089±0.119 453 0.945±0.137≥28(肥胖) 458 1.016±0.118 101 0.971±0.141 0.075男性BMI(胖瘦分类)
3 讨论
OP是一种不可逆性的疾病,可以给患者带来许多不良的后果,其中以脆性骨折最为严重,因此早期发现骨质异常,预防OP的发生尤为重要。本次针对苏南地区人群调查显示,男性的平均骨量水平高于女性,但是男性整体的骨质健康状况却不如女性(男性骨量减少率为41.60%、女性骨质减少率为33.70%),而女性的OP患病率(12.32%)高于男性(9.75%)。有学者指出BMD峰值骨量会影响一生的骨矿物质含量,可作为评估人体骨量丢失出现的时间及骨丢失程度的重要参考依据[5]。本次调查中,男性腰椎骨量峰值出现在26~30岁,女性腰椎骨量峰值出现在≤25岁,之后BMD逐渐下降;这与文献(北京男女骨密度峰值均出现在30~39岁[6])有所出入,原因可能与地域差异、生活方式的不同及生活压力增大有关。
从调查来看,女性骨丢失时间明显早于男性也快于男性,与相关文献报道一致[7-8],女性50岁以后腰椎BMD下降加速且降幅明显高于男性,这与女性绝经有很大的关系 [本例女性平均绝经年龄为(50.19±3.54)岁]。在调查中还发现,男女性在71~75岁腰椎BMD都有一定的升高,特别以男性为重,这与随着年龄增加椎体小关节硬化、骨质增生发生率增加有关。
调查发现,大多数情况下受试者腰椎BMD与年龄呈负相关(分组研究中男性人群年龄与BMD没有统计学上的相关性,可能与椎体增生、硬化产生的BMD偏差有关),而与身高、体质量及BMI均呈正相关,特别是BMI<18.5的偏瘦体质更能影响腰椎BMD的数值,而女性人群肥胖对于腰椎BMD的影响却较小。值得注意的是,小于25岁人群腰椎BMD不受体质量的影响,而小于30岁的人群腰椎BMD与身高无关。本次调查还发现大于76岁人群的身高、大于80岁人群的体质量、BMI都与腰椎BMD间无统计学差异,这可能与此年龄段腰椎骨质增生、硬化有关,建议60岁以后老年人BMD检测采用髋关节等非腰椎部位。
通过此次调查研究,我们给出了苏南地区不同年龄段及不同性别人群的腰椎骨质状况、峰值骨量及其与年龄、身高、体质量及BMI的关系;同时还发现除了年龄、身高的不可控因素外,我们可以通过适当增加体质量的方式来增加我们腰椎的骨量,高的体质量或BMI会明显减少OP发生的概率[6-9]。希望此次调查结果对本地区的骨质健康管理及OP的预防起到一定的参考作用。
[1]马学东,魏新萍,郭平,等.上海市闵行地区老年人骨密度水平及骨质疏松患病情况[J].中国老年学杂志,2015,35(18):5255-5257.
[2]汪纯,何进卫,秦跃娟,等.阿仑膦酸钠对绝经后骨质疏松疗效及与雌激素13受体基因Alu I多态性的关系[J].中华骨质疏松和骨矿盐疾病杂志,2009,2(3):155-159.
[3]朱锐,沈霖,杨艳萍.年龄、身高、体重、体重指数与武汉地区绝经后骨质疏松症患者骨密度的关系[J].中华骨质疏松和骨矿盐疾病杂志,2010,3(4):234-238.
[4]Nelson B.Watts.Fundamentals and pitfalls of bone densitometry using dualenergy X-ray abaorptiomatry(DXA)[J].Osteoporos Int,2004,15(11):847-854.
[5]张萌萌,李亚刚,刘颖,等.长春市16 019例汉族人群骨密度调查及骨质疏松发病率分析[J].中国骨质疏松杂志,2009,15(7):534-537.
[6]王亮,马远征,张妍,等.北京地区9 103例体检人群骨密度流行病学调查研究[J].中国骨质疏松杂志,2014,20(8):952-955.
[7]Nagy H,Feyt C,Chapurlat R,et al.Familial resemblance of boneturnoverrateinmenaged 40 andover-theMINOS study[J].Journal of Bone and Mineral Metabolism,2013,31(2):222-230.
[8]丁朝晖,杜建民,王兰珍.原发性骨质疏松的病因学及危险因素[J].中国骨质疏松杂志,2012,18(10):965-968.
[9]刘芳,彭越文,古振,等.年龄、体重、体重指数对岳阳市中老年人骨密度的影响[J].中国骨质疏松杂志,2013,19(9):950-953.
Objective To investigate the lumbar bone mineral density(BMD)status among the physical examination personnel at southern regions of Jiangsu Province,and to investigate the influence of age,height,weight and body mass index(BMI)on lumbar BMD,so as to provide reference for the prevention and treatment of osteoporosis(OP)in the region.Methods 4 972 physical examination personnel at Taihu Rehabilitation Hospital,Jiangsu Province from July 2012 to October 2015 were taken as study objects,and DXA(Discovery WI,HOLOGIC,American)was adopted to check vertebral body L1~L4of the objects.Meanwhile the indexes of age,weight,height and lumbar BMD were collected to calculate BMI.They were divided into subgroups by 5-year range.The results were analyzed with IBM SPSS version 19.0.Results 1 356 males showed osteopenia,accounting for 41.6%and 318 males showed OP,accounting for 9.75%.577 females showed osteopenia,accounting for 33.70%and 211 females showed OP,accounting for 12.32%.BMD of most objects was negatively correlated with age(P<0.05),while it was positively correlated with body height,body weight and body mass index(BMI)(P<0.05).The differences of lumbar BMD in fat males and thin males were of statistical significance(P=0.000),while the differences of lumbar BMD in thin females and not thin females of statistical significance(P=0.000).Conclusion Bone health status in males was inferior to females in southern regions of Jiangsu Province.But the OP prevalence rate among females was higher than that among males.The osteopenia time of females was obviously earlier and faster than males.Age,height,weight and BMI are the influencing factors of lumbar BMD.Body mass is the most important factor for lumbar BMD.
Southern regions of Jiangsu Province;Lumbar spine;Bone mineral density(BMD);Age;Height;Weight;Body mass index(BMI)
2016-06-07)
1005-619X(2016)11-1223-04
10.13517/j.cnki.ccm.2016.11.047
214086 江苏省太湖康复医院
