一株兼有β-甘露聚糖酶活性聚磷菌的分离和鉴定
2016-07-15孙明辉孙会忠王小东朱金峰李广良陈启龙河南省烟草公司漯河市公司河南漯河46000河南科技大学农学院河南洛阳47003
孙明辉,孙会忠,王小东,朱金峰*, 李广良,陈 冲,陈启龙(.河南省烟草公司漯河市公司,河南 漯河 46000;.河南科技大学农学院,河南 洛阳 47003)
一株兼有β-甘露聚糖酶活性聚磷菌的分离和鉴定
孙明辉1,孙会忠2,王小东2,朱金峰1*, 李广良1,陈 冲1,陈启龙1
(1.河南省烟草公司漯河市公司,河南 漯河 462000;2.河南科技大学农学院,河南 洛阳 471003)
摘 要:从烟草(Nicotiana tabacum L.)秸秆处理厂土壤中分离到1株兼有β-甘露聚糖酶活性的聚磷菌株,编号为YYF02;菌株YYF02经过48 h发酵后,培养基上清液中游离态磷含量达到 130.5 µg/mL,β-甘露聚糖酶活性达到 8.9 U/mL,确定YYF02具有β-甘露聚糖酶和聚磷的双重活性;对菌株YYF02生长特性的研究表明,其最适生长温度是26~36 ℃,最适pH 5.5~7.5,适宜在低盐环境中生长。通过形态特征、生化特性测定和16S rDNA序列的综合分析,确定菌株YYF02为沙雷氏菌属的嗜线虫沙雷氏菌Serratia nematodiphila,暂命名为Serratia nematodiphila YYF02。菌株YYF02对后期的诱变育种、全基因组育种和烟草专用菌肥开发等研究具有重要意义。
关键词:β-甘露聚糖酶;聚磷菌;分离;鉴定;生长特性
磷是烟草(Nicotiana tabacum L.)植物形态建成不可缺少的营养三要素之一,一般耕作土壤中有效磷低于10mg/kg时被认为是缺磷,我国约有74%的耕地缺磷[1-2]。实际生产中长期大量施用磷肥,再加上土壤组成中大量的本底磷源,土壤中的磷库是巨大的,所以土壤缺磷一般是“遗传学缺磷”,而不是“土壤学缺磷”[3]。难溶性磷酸盐是土壤中绝大部分磷主要的存在形式,植物不能直接吸收利用[4]。改善土壤磷存在形态,进而改善磷素供应、提高土壤磷库的利用率是改善和解决磷素不足的根本性措施[4]。微生物在磷元素的合成与分解途径中起着非常重要的作用,所以聚磷菌也往往是各种微生物菌肥不可或缺的重要组成部分 。但目前关于聚磷菌开发和应用中存在的主要问题首先是优良的聚磷菌遗传资源不够丰富,对野生聚磷菌的分离和筛选缺乏持续性的关注;其次缺乏对聚磷菌株持续性的改造,如诱变育种、工程菌的构建等;第三是缺乏对聚磷菌株其他活性功能的兼顾,忽视了微生物在土壤中综合效能的发挥。烟草对营养需求严格,配方施肥已经是烟草栽培中的关键技术之一,通过聚磷菌微生物来改善烟草根际土壤磷元素的供应状况,对改善烤烟品质有着积极的意义[5-6]。β-甘露聚糖酶能够水解β-1,4-D-甘露糖主链,属于半纤维素酶类,对降低土壤环境污染和改善根际土壤营养供应具有调节功能[7-8]。随着传统植烟区连作年限的延长,耕作层土壤理化特性、养分供应环境的恶化日益显著。在此背景下,筛选具有生物调节功能的益生菌,对烟草菌肥的开发具有重要意义。本文以烟草秸秆处理厂土壤为材料,对聚磷菌进行了筛选鉴定,并对目标菌株的β-甘露聚糖酶活性和生长特性进行了初步探索。
1 材料与方法
1.1 试验材料
土壤样品采自漯河市烟草公司烟草秸秆处理厂。解磷菌分离筛选培养基:葡萄糖 5.0g,(NH4)2SO40.5g,NaCl 0.5g,KCl 0.3g,MgSO4·7H2O 0.3g,FeSO4·7H2O 0.03g,MnSO4·4H2O 0.03g,鸡蛋黄10 mL,菊糖1.0g,琼脂粉18.0g,蒸馏水1 000 mL,自然pH。
基础培养基:葡萄糖5g,(NH4)2SO40.5g,NaCl 0.3g,KCl 0.3g,MgSO4·7H2O 0.3g,FeSO4·7H2O 0.03g,MnSO4·4H2O 0.03g,Ca3(PO4)28g,蒸馏水1 000 mL,pH 7.0。魔芋粉鉴别培养基:魔芋精粉5g,MgSO4·7H2O 5g,NaNO33g,K3PO41g,FeSO4·7H2O 0.01g,琼脂粉20g,蒸馏水1000 mL,自然pH。
1.2 试验方法
1.2.1 菌株筛选方法 富集培养:在条件30 ℃、160r/min下摇床富集培养48 h,操作步骤参考文献[7]进行。分离培养:无菌操作条件下取适量富集培养液涂布于固体分离培养基,于 30 ℃恒温培养 4 d。用接种环挑取生长良好、特征典型、解磷圈大而显著的单菌落,在固体分离培养基平板上划线纯化,获得目标菌株活体纯培养物,并转接于磷细菌斜面培养基4 ℃保藏。
1.2.2 聚磷活性及 β-甘露聚糖酶活性确定 将YYF02菌株活化后,采用不加琼脂的聚磷菌分离筛选培养基震荡培养12 h,制得种子液,以2%接种量接种于250 mL装液量的500 mL三角瓶中,35 ℃、160r/min震荡培养48 h,将培养液4000r/min离心10min。采用钼蓝比色法测定上清液中有效磷含量,以未接种处理作为对照,操作步骤参考文献[9]。
将 YYF02菌株活化后,采用基础培养基震荡培养12 h,制得种子液,以2%接种量接种于250 mL装液量的500 mL三角瓶中,35 ℃、220r/min震荡培养48 h,将培养液4 000r/min离心10min,收集上清液为粗酶液,以接种 Bacillus sp.YYFG1 (CCTCC No.M2015117)作为对照。采用DNS法测定粗酶液的β-甘露聚糖酶活性,操作步骤参考文献[10-11]。
1.2.3 菌株 YYF02基本生长特性测定 温度对生长的影响:将YYF02以2%(菌悬液OD600=0.2)的接种量接入基础培养基中,分别置于20、22、24、26、28、30、32、34、36、38、40、42和 44 ℃,180r/min培养48 h,用分光光度计测定600 nm波长的菌体OD值。重复3次取平均值,下同。
pH对生长的影响:分别将基础培养基pH调为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和 10.0,分别将YYF02以 2%(菌悬液OD600=0.2)的接种量接入,30 ℃、180r/min培养48 h,用分光光度计测定600 nm波长的菌体OD值。
NaCl对生长的影响:将YYF02按2%(菌悬液OD600=0.2)接种量分别接入NaCl含量(w/v,下同)分别为0、0.1%、0.3%、0.5%、1.0%、4.0%、7.0%和10.0%基础培养基中,30 ℃、180r/min培养48 h,用分光光度计测定600 nm波长的菌体OD值。
1.2.4 菌株的鉴定 ①菌株的生化指标测定:参考文献[12-13]。②菌株的16S rDNA分析:通过GVBacterial Genomic DNA Extraction Kit提取菌株总DNA,以细菌 16S rDNA 通用引物 27F:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物:1492R:5′-TAGGGTTACCTTGTTACGACTT-3′进行PCR扩增获取目的序列。PCR产物经电泳、胶回收、连接质粒载体、转化、培养、蓝白斑筛选等步骤,选取阳性克隆进行测序等步骤,得到菌株的 16S rDNA基因序列。并采用MEGA6.0软件构建系统发育进化树。最后综合形态特征、生化指标测定及16S rDNA序列分析,对目标菌株进行鉴定,参考文献[14-15]进行。
2 结 果
2.1 解磷菌株的获得
通过平板分离培养,获得一株兼有β-甘露聚糖酶活性的解磷菌株,菌株在魔芋粉鉴别培养基形成的水解圈(图1-1)和在解磷菌分离筛选培养基形成的溶磷圈均大而显著(图1-2),判断具有解磷活性,初步确定为目标菌株,菌株编号为YYF02。
2.2 YYF02的解磷活性及β-甘露聚糖酶活性
试验测定结果表明,YYF02经过48 h发酵后,发酵液培养基上清液中游离态磷含量为 130.5 µg/mL,而空白对照为 4.3 µg/mL,二者相差约 30倍,说明YYF02具有较强的解磷活性;YYF02同样经过48 h发酵后,β-甘露聚糖酶活性达到了8.9 U/mL,对照处理仅为0.2 U/mL,说明YYF02菌株还具有一定的降解半纤维素的能力。故将YYF02作为鉴定菌株。
2.3 菌株YYF02基本生长特性
2.3.1 温度对菌株生长的影响 由图2可知,菌株YYF02在24 ℃以下和38 ℃以上温度条件下生长缓慢;在26和36 ℃温度条件,OD值较大且变化幅度较小,说明菌株在此温度范围生长良好,故最适生长温度可界定为26~36 ℃。
2.3.2 pH对菌株生长的影响 图 3可知,菌株YYF02在pH值小于4.5或大于9时几乎不进行生长;pH大于5时,OD值跃升明显;pH大于7.5时,OD值则迅速下降,这说明菌株生长喜好偏酸至中性环境;当pH介于5.5和7.5之间时,OD值维持高位,且变化幅度较小,故最适 pH值可界定为5.5~7.5。
2.3.3 NaCl含量对菌株生长的影响 由图4可知,当NaCl含量介于0.1%~3%时,OD值均在1以上,而且相互之间变化幅度不大;当NaCl含量在大于3%时,OD值迅速降低,当大于7%时,几乎不再生长,说明菌株生长适于低盐环境。
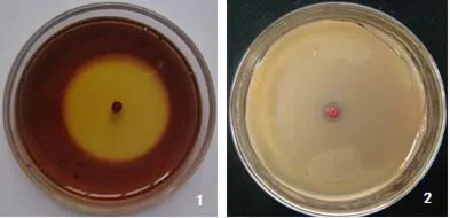
图1 菌株的磷降解圈示意图(1.β-甘露聚糖酶形成的水解圈;2.溶磷圈)Fig.1 The diagram of phosphorus degradation circle of the strain(1.Formation of the hydrolysis ring by β-mannanase;2.Dissolved phosphorus ring)
2.4 菌株YYF02的多相分类特征
2.4.1 形态特征 菌株 YYF02为短杆菌,菌体长1.0~2.0 μm、宽0.8~1.2 μm,端圆。常成对排列,也可单个存在,偶有链状。具荚膜,周生鞭毛,能运动,在LB平板上菌落边缘整齐,湿润,有光泽,不透明,低凸起,一般呈红色(图5)。
2.4.2 生化特征 吲哚反应阴性,甲基红反应阴性,硫化氢试验阴性,赖氨酸脱羧酶反应阴性;枸盐酸盐反应阳性,明胶水解阳性,接触酶反应阳性,发酵D-葡萄糖产酸,能利用D-甘露醇、蔗糖、麦芽糖、海藻糖作为惟一的碳源,不利用乳糖、肌醇、棉子糖作为惟一碳源。
2.4.3 16S rDNA分析 测序获得的 YYF02菌株16S rDNA基因序列长度为 1 504 bp。将序列提交NCBI(美国国立生物技术信息中心)获取的基因序列编号为KU095822。通过NCBI的blast在线分析功能进行同源性比对,并选取同源性较高的序列通过MEGA6.06软件构建菌株的N-J系统发育进化树(图 6)。结果表明,菌株 YYF02分别与 Serratia nematodiphila strain DZ0503SBSI(NR044385.1)、S.Nematodiphila strain 36(FJ662869.1)聚为同一分支上,且Bootstrap自举值达到100%。综合菌株的形态特征观察、生理生化测定结果及16S rDNA序列分析结果,将菌株 YYF02鉴定为嗜线虫沙雷氏菌Serratia nem atodiphila,暂命名为Serratia nematodiphila YYF02。
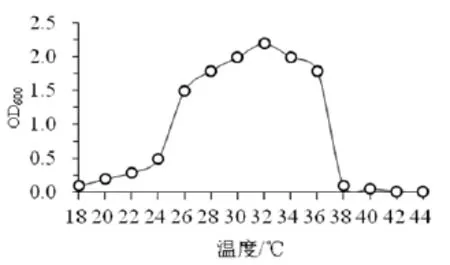
图2 温度对菌株YYF02生长的影响Fig.2 The effect of temperature on the growth of strain YYF02
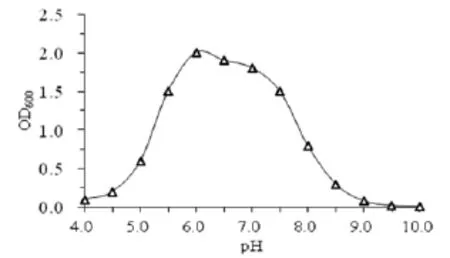
图3 pH对菌株YYF02生长的影响Fig.3 The effect of pH on the growth of strain YYF02
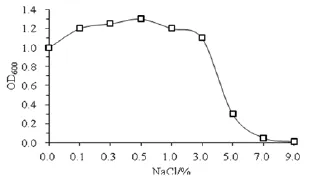
图4 NaCl对YYF02菌株生长的影响Fig.4 The effect of NaCl on the growth of strain YYF02

图5 菌株YYF02形态的显微观察(1.扫描电镜照片,×20 000;2.光镜照片,×1000)Fig.5 Microscopic observation of the morphology of strain YYF02(1.Scanning electron micrograph photos,×20 000;2.Light microscope photos, ×1 000)

图6 菌株YYF02的Neighbor-Joining系统发育树Fig.6 The Neighbor-joining phylogenetic tree of strain YYF02
3 讨 论
文献报道的聚磷菌资源主要有:假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、土壤杆菌属(Agrobacterium)、产碱菌属(Alcaligenes)、沙雷氏菌属(Serratia)、黄杆菌属(Flavobacterium)、埃希氏菌属(Escherichia)、固氮菌属(Azotobacter)、多硫杆菌属(Thiobacillus)、欧文氏菌属(Erwinia)、色杆菌属(Chromobacterium)、沙门氏菌属(Salmonella)、肠细菌属(Enterbacter)、微球菌属(Micrococcus)等;解磷放线菌绝大部分为链霉菌属(Streptom);解磷真菌主要是青霉属(Penicillium)、曲霉属(Aspergillus)和根霉属(Rhizopus)[16-18]。本研究分离筛选出的菌株YYF02经过48 h发酵后,培养基上清液中游离态磷含量达到 130.5 µg/mL,与同类文献相比[4,6,16],发酵周期较短,这有利于加快对土壤中磷素的调控速度;同时,该菌还具有一定的产β-甘露聚糖酶活性,这就意味着该菌还具有一定的降解半纤维素的能力,对改善土壤中的碳素循环具有促进作用。菌株 YYF02通过多项分类鉴定为Serratia nematodiphila,截至目前,还未见沙雷氏菌属兼有 β-甘露聚糖酶活性聚磷菌菌株方面的报道。菌株YYF02适生温度从26 ℃到36 ℃,适应幅度较大;适宜生长的pH范围为5.5~7.5;喜好低盐环境,这些基本的生物学特征,与烟草发育要求的适宜土壤条件基本吻合[19],具备开发利用的生物学要素。在烟草实际栽培中,前茬作物的秸秆还田、间作套种等耕作形式,都会使耕作层土壤中存在大量的半纤维素类高分子物质,高分子碳水化合物及时有效降解对改善土壤中碳素循环起着重要作用。因此,菌株YYF02兼有磷素调控和β-甘露聚糖酶活性的双重效应,有着更加突出的应用潜力和价值,是后期菌肥开发、诱变育种等的良好备用微生物资源。
参考文献
[1] 赵小蓉,林启美.微生物解磷的研究进展[J].土壤肥料,2001(3):7-11.
[2] 李海云,孔维宝,达文燕,等.土壤溶磷微生物研究进展[J].生物学通报,2013,48(7):1-5.
[3] 余贤美,沈奇宾,李炳龙,等.土壤磷细菌分离和筛选方法建立[J].热带作物学报,2008,29(3):321-325.
[4] 钟传青,黄为一.不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J].土壤学报,2005,42(2):286-294.
[5] 张宝贵,李贵桐.土壤生物在土壤磷有效化中的作用[J].土壤学报,1998,35(1):104-111.
[6] 赵小蓉,林启美,李保国.溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J].微生物学报,2002,42(2):236-241.
[7] 杨先芹,孙丹,杨文博,等.地衣芽孢杆菌NK-27菌株β-甘露聚糖酶的产酶条件及粗酶性质[J].南开大学学报:自然科学版,2002,35(2):117-122.
[8] 赵月菊,薛燕芬,马廷和,等.β-甘露聚糖酶的结构生物学研究现状和展望[J].微生物学报,2009,49(9):1131-1137.
[9] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2014:63-65.
[10]许光辉,郑洪光.土壤微生物分析方法手册[M].北京:农业出版社,1986:168-171.
[11]李长影,孔雯,王家昕,等.β-甘露聚糖酶产生菌的分离鉴定和酶学性质[J].华中农业大学学报,2011,30 (2):138-142.
[12]黄亚东,时小艳.微生物实验技术[M].北京:中国轻工业出版社,2012:198-216.
[13]范俐.微生物基础与实验技术[M].厦门:厦门大学出版社,2012:167-187.
[14]陶天申,杨瑞馥,东秀珠.原核生物系统学[M].北京:化学工业出版社,2007:313-316.
[15]陈瑜.临床常见细菌、真菌鉴定手册[M].北京:人民卫生出版社,2009:73-79.
[16]Nielsen J L, Nguyen H, Meyer R L, et al.Identification of glucose-fermenting bacteria in a full-scale enhanced biological phosphorus removal plant by stable isotope probing[J].Microbiology, 2012, 158(7): 1818-1825.
[17]王俊宏,张蕊,王梦亮.解磷微生物在农业上的应用[J].山西农业科学,2010,38(9):86-88.
[18]黄雪娇,王晗,李振轮.解磷微生物的研究进展[J].安徽农业科学,2013,41(19):8083-8084,8087.
[19]郭治兴,陈泽鹏,王静,等.广东省烟草土壤生态适宜性评价[J].中国烟草科学,2011,32(4):75-80.
Isolation and Identification of a Phosphate Accumulating Strain with β-mannanase Activity
SUN Minghui1, SUN Huizhong2, WANG Xiaodong2, ZHU Jinfeng1*, LI Guangliang1,CHEN Chong1, CHEN Qilong1
(1.Henan Tobacco Companies Luohe Branch, Luohe, Henan 462000, China; 2.College of Agriculture, Henan University of Science and Technology, Luoyang, Henan 471003, China)
Abstract:A phosphorus accumulating strain YYF02 with β-mannanase activity was isolated from the soil of tobacco straw processing plant, and numbered YYF02.After 48 h fermentation, the free phosphorus content in culture medium reached 130.5 µg/mL, and the activity of β-mannanase was 8.9 U/mL, indicating that YYF02 has the dual activities of β-mannanase and phosphorus accumulating.Studies on the growth characteristics of the strain YYF02 showed that the optimum growth temperature is 26-36 ℃, with a optimum pH range of 5.5-7.5, and that the strain is suitable to grow in low salt environment.After comprehensive analysis of morphological characteristics, biochemical characteristics and 16S rDNA sequences, strain YYF02 was identified as Serratia nematodiphila, and temporarily named Serratia nematodiphila YYF02.Strain YYF02 has great potential in mutation breeding, genome breeding and development of tobacco special fertilizers.
Keywords:β-mannanase; phosphate accumulating strain; isolation; identification; growth characteristics
中图分类号:S572.062
文章编号:1007-5119(2016)02-0023-06
DOI:10.13496/j.issn.1007-5119.2016.02.005
基金项目:河南省烟草公司科技项目(HYKJ2012M04;HYKJ201302);上海烟草集团责任有限公司项目(SZBCW2014-00830);河南科技大学博士科研启动基金(4024-13480045)
作者简介:孙明辉(1969-),男,农艺师,主要研究方向为烟草栽培。E-mail:lylhsys@126.com。*通信作者,E-mail:lylhsys@126.com
收稿日期:2015-08-03 修回日期:2015-09-20
