缺血后处理减轻大鼠肢体缺血再灌注后肺损伤的实验研究
2016-07-14李开济贺宝玲卢秋玲门秀丽赵利军
李开济,贺宝玲,卢秋玲,门秀丽,赵利军
缺血后处理减轻大鼠肢体缺血再灌注后肺损伤的实验研究
李开济,贺宝玲,卢秋玲,门秀丽,赵利军
摘要:目的观察缺血后处理(I-postC)对大鼠肢体缺血再灌注(LIR)后肺损伤的影响,探讨缺血后处理的器官保护作用及可能机制。方法Wistar大鼠24只随机分为3组(n=8),对照组(Control组)、缺血再灌注组(IR组)和缺血后处理组(I-postC组)。结扎大鼠双后肢根部以阻断血流4 h,后再恢复血流灌注4 h,制作大鼠LIR动物模型。Control组橡皮带松弛环绕双后肢不阻断血流,I-postC组在血流再灌注前,行重复3次的缺血5 min-再灌注5 min,再恢复4 h的血流再灌注。留取血液及肺组织标本,测定各组动物动脉血气指标氧分压[p(O2)]和二氧化碳分压[p(CO2)],检测血浆及肺组织的丙二醛(MDA)含量及黄嘌呤氧化酶(XOD)和超氧化物歧化酶(SOD)水平,光镜及电镜下观察肺组织的病理形态学改变。结果LIR后p(O2)和p(CO2)明显降低,血浆和肺组织中SOD活性明显降低,而XOD、MDA明显增加(P<0.05);镜下可见肺间质内血管扩张充血,中性粒细胞浸润,血管周围间隙增大,肺泡间隔增宽,肺泡腔内有渗出液等损伤表现。与IR组比较,I-postC组p(O2)和p(CO2)明显增加,血浆及肺组织SOD活性升高;而XOD、MDA水平降低(P<0.05);镜下观察肺组织只可见轻度病理改变。结论I-postC可通过抑制脂质过氧化反应减轻大鼠LIR后肺损伤的程度。
关键词:再灌注损伤;肺;氧化性应激;丙二醛;黄嘌呤氧化酶;超氧化物歧化酶;缺血后处理
肢体缺血再灌注(limb ischemia reperfusion,LIR)损伤是临床外科十分常见的病理现象。近年来国内外学者研究证实,在LIR发生过程中,机体其他远隔器官也会受到累及[1]。肺脏是LIR中最易受累器官之一,急性肺损伤(acute lung injury,ALI)甚至急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是常见的危重表现形式[2]。积极探讨减轻缺血再灌注对远隔器官损伤的措施是目前研究的热点之一,缺血后处理(ischemic postconditioning,I-postC)是本领域较新的研究成果,即在缺血组织得到长时间血流再灌注之前,先进行一次或数次短暂的缺血再灌注,通过激活机体内源性保护机制而减轻随后持续再灌注引起的组织损伤。后续研究发现此保护作用同样适用于远隔器官及远隔后处理[3]。本研究进一步从氧化应激(oxidative stress)的角度观察I-postC对肢体缺血再灌注后肺组织的保护作用,并探讨其病理生理学机制。
1 材料与方法
1.1动物与分组24只健康清洁级Wistar大鼠购自河南医科大学实验动物中心(质量合格证号:0001190),体质量200~250 g,普食喂养,动物使用许可证号:SYXK(冀)2010-0038。采用计算机辅助实验动物随机分组(CAR)程序[4]将动物随机分为3组(n=8):对照组(Control组),缺血再灌注组(IR组),缺血后处理组(I-postC组)。术前24 h禁食,自由饮水。
1.2模型制备及标本采集止血带法制作大鼠LIR动物模型[1],即:将动物乙醚浅麻醉,用标准化弹性的橡皮筋环绕结扎大鼠双后肢根部阻断血流4 h(硬质套管辅助),然后剪断橡皮筋恢复血流灌注4 h。以结扎后双后肢皮肤苍白、温度降低为缺血标准;以松解后局部皮肤逐渐变红,温度回升且肿胀等作为血流再灌注的标准,并辅以激光多普勒血流仪监测血流情况,综合判断筛选成功模型。Control组双后肢仅松弛环绕橡皮筋,不阻断血流,I-postC组则在血流再灌注前先行缺血5 min,再灌注5 min处理,并重复3次,再恢复血流持续灌注4 h。各组动物在再灌注4 h时经腹主动脉取血约0.5 mL(隔绝空气,即将穿刺针头插入橡皮塞内),立即送血气分析,再取肝素抗凝血4 mL,经3 500 r/min离心15 min,所得血浆标本分装在干净的Eppendorf管中,-70℃保存备用。同时立即开胸取出肺脏,液氮速冻,-70℃储藏备用。此外,每组取3份右肺中叶,切取2/3迅速投入4%甲醛溶液中固定,光镜标本待用。将剩余1/3的组织块立即投入冷4%戊二醛-磷酸缓冲液,后续处理后电镜标本待用。
1.3指标及检测 (1)血气分析指标动脉血氧分压[p(O2)]和二氧化碳分压[p(CO2)]。穿刺腹主动脉取血约0.5 mL,立即隔绝空气经雅培血气分析仪(型号:i-STAT 300)检测p(O2)和p(CO2)。(2)血浆超氧化物歧化酶(SOD)、黄嘌呤氧化酶(XOD)、丙二醛(MDA)水平。以冻存的血清标本为样品,严格按照试剂盒(南京建成生物科技有限公司)说明书进行操作,利用比色法测定吸光度,通过各指标的公式计算出各样本的结果。(3)肺组织MDA、XOD、SOD水平。将冻存的肺组织标本解冻并匀浆,3 500 r/min离心15 min,取上清液为测试样品,余步骤同(2)。(4)肺组织光镜观察。切取的肺组织经4%甲醛溶液固定,常规脱水,包埋,切片,脱蜡,HE染色,透明,封片,观察。(5)肺组织电镜观察。切取的肺组织立即投入冷的4%戊二醛-磷酸缓冲液,切成1 mm×1 mm×1 mm的小块预固定,后转入2.5%戊二醛中固定,经丙酮脱水、环氧树脂618包埋、超薄切片、染色后在透射电镜(日立H-7650型)下观察肺组织的超微结构。
1.4统计学方法采用SPSS 17.0统计软件进行分析。符合正态分布的计量资料用均数±标准差(x±s)表示,组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1各组动物p(O2)和p(CO2)结果与Control组比较,IR组和I-postC组的p(O2)和p(CO2)均明显降低(P<0.05),肺换气功能障碍明显。I-postC组较IR组p(O2)和p(CO2)有所提升(P<0.05),低氧血症和过度通气有所缓解,见表1。

Tab.1 The values of p(O2)and p(CO2)of arterial blood gas in three groups表1 各组动物p(O2)和p(CO2)结果 (n=8,mmHg,x±s)
2.2各组动物血浆中MDA、XOD、SOD水平与Control组比较,IR组和I-postC组血浆MDA、XOD均明显升高,SOD则降低(P<0.05),全身脂质过氧化反应增强而抗氧化酶活性降低;I-postC组较IR 组MDA、XOD降低(P<0.05),全身氧化应激损伤程度减轻,见表2。

Tab.2 The plasma values of MDA,XOD and SOD in three groups表2 各组动物血浆中MDA、XOD和SOD水平 (n=8,x±s)
2.3各组动物肺组织MDA、XOD和SOD水平与Control组比较,IR组和I-postC组肺组织MDA、XOD均明显升高,而SOD降低(P<0.05),肺组织处于氧化应激状态;I-postC组较IR组,MDA和XOD降低,而SOD则升高(P<0.05),I-postC有抑制脂质过氧化反应和保护自由基清除酶的作用,见表3。

Tab.3 The values of MDA,XOD and SOD of lung tissue in three groups表3 各组动物肺组织中MDA、XOD和SOD水平 (n=8,x±s)
2.4光镜下肺组织形态学改变Control组肺组织结构完整清晰,无损伤表现。与Control组比较,IR组肺组织水肿,可见肺泡隔增宽,肺毛细血管充血扩张,大量炎性细胞聚集、附壁,血管周围间隙增大。部分肺泡腔中可见出血和蛋白渗出物,并伴有局限性肺不张。而在I-postC组,肺组织结构损伤不及IR组严重,肺泡基本形态尚可,肺泡腔的渗出和充血不明显,仅有轻度血管扩张和炎性细胞浸润。见图1。
2.5电镜下肺组织形态学改变电镜下可见Control组肺组织细胞及细胞器形态规整,无水肿、变形和变性等损伤表现。IR组可见肺泡毛细血管内皮细胞、Ⅰ型肺泡上皮细胞水肿变性,肺泡壁增厚,Ⅱ型肺泡上皮细胞膜微绒毛减少,线粒体肿胀、嵴减少,且胞质中板层小体明显减少,肺间质水肿,细胞结构破坏。I-postC组细胞形态尚可,水肿不明显,细胞损伤程度较IR组有所减轻,见图2。
3 讨论
近年来,在再灌注损伤的研究领域,缺血预适应(ischemic preconditioning,IP)和I-postC是备受瞩目的两大热点[1,5]。虽然IP的器官保护作用是肯定的,但其需要在缺血发生之前就反复多次阻断血流,在诸如血管栓塞等不可预见性疾病的防治中,IP的应用受到很大限制。和缺血不同,临床上再灌注更多是可预见甚至可控制的过程[5],因此I-postC有更强的实用性和可行性。有学者研究发现,通过“温和再灌注”可以减少缺血器官的梗死面积和水肿程度,避免无复流现象,这也是对I-postC器官保护作用的有力支持[6]。在此基础之上发展而来的远隔后适应为保护远隔器官开辟了新的研究领域,目前关于缺血后适应对LIR后肺脏的保护作用和机制值得关注。
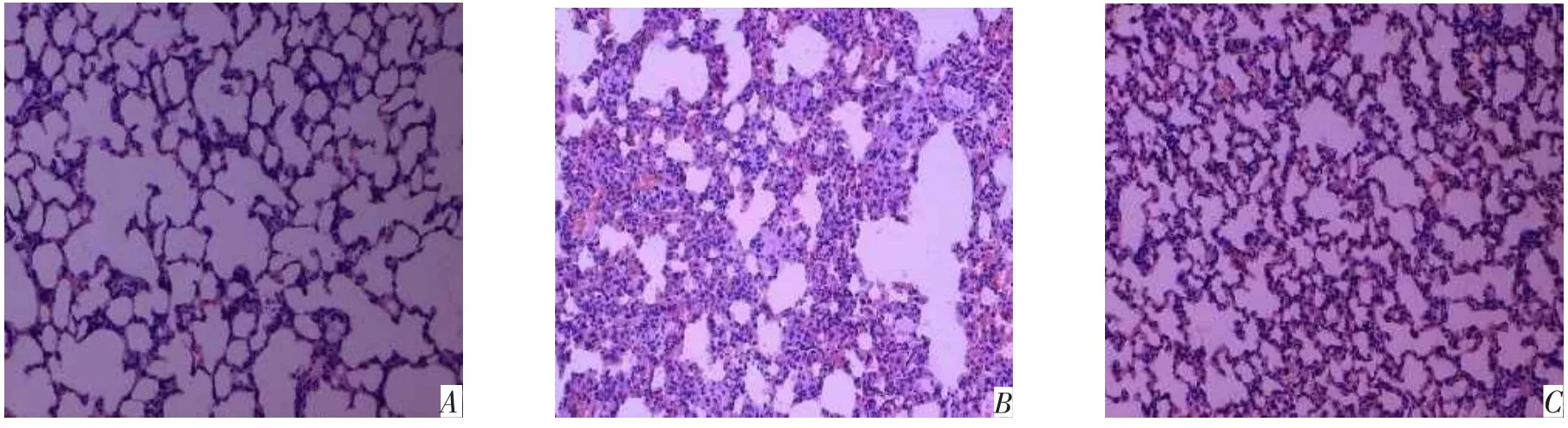
Fig.1 The lungtissue structure of three groups under light microscope(HE,×200)图1 各组肺组织结构光镜观察(HE,×200)
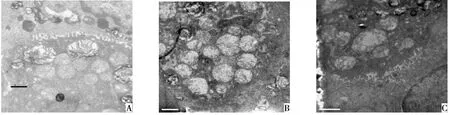
Fig.2 The lungtissue structure of three groups under electron microscope图2 各组肺组织结构电镜观察
LIR可因严重的全身氧化应激反应引起肺组织的损伤[7]。肺气体交换功能障碍是评价肺损伤程度的敏感指标[8]。本研究发现,再灌注后p(O2)和p(CO2)明显降低,p(O2)降低是LIR致肺损伤,进而导致气体交换功能明显障碍的直接表现,低氧进一步刺激外周化学感受器,反射性引起呼吸的加深加快,CO2排出过多[9],从而使p(CO2)也明显降低。光镜下和电镜下肺组织的病理变化是肺气体交换功能障碍的结构基础。缺血及血液再灌注可经多种途径激活XOD而催化大量自由基生成。性质相对稳定的MDA可间接反映体内自由基水平和脂质过氧化反应的程度。自由基清除酶SOD的降低与缺血缺氧使其生成不足、消耗过多以及被激活的中性粒细胞携带至炎症部位等因素密切相关[10]。而I-postC组血浆中XOD、MDA水平明显低于IR组,提示氧化应激程度有所减轻;血液SOD水平与IR组无明显差异,可能与过多消耗而来不及合成补充有关系。血气指标的变化也从功能方面验证了I-postC抑制氧化损伤的作用,是肢体I-postC保护肺功能直接而有力的依据。
有研究表明,在I-postC的病理生理过程中,多种细胞外信号被激活,G蛋白偶联受体作为启动细胞内再灌注损伤补救通路(reperfusion injury salvage pathway,RISK)的桥梁,活化多种细胞内保护性蛋白,从而使组织细胞的损伤得以减轻[11]。在多次的肢体缺血及再灌注过程中,血液内皮源性的缓激肽、一氧化氮(NO)、前列腺素I2(PGI2)等是I-PostC远隔组织保护作用的触发器,可激活细胞内蛋白激酶C(PKC)、丝裂原活化蛋白激酶(MAPK)及酪氨酸蛋白激酶(TPK)等,促进热休克蛋白(HSP)或ATP敏感性K+通道的磷酸化[11]。另有报道,I-postC可延迟腺苷的清除,并激活细胞膜上腺苷A2、A3受体,阻止线粒体通透性转换孔(mPTP)的开放,抑制细胞凋亡的发生[12]。这些细胞信号转导效应的改变均有助于维持细胞骨架的完整性,在肺组织可减轻肺呼吸膜的损伤,提高肺换气的效率。本研究着重从氧化应激的角度,证实了缺血后处理可通过抑制脂质过氧化反应减轻大鼠LIR后肺损伤的程度。I-postC是多因素参与、多路径调节的复杂过程,它们之间相互调控,共同实现组织器官的保护作用。
参考文献
[1]Zhao LJ,Men XL,Li HJ,et al.Ischemic postconditioning reduces myocardial damage in rats suffering from limb ischemia-reperfusion [J].Chinese Journal of Pathophysiology,2012,28(10):1892-1894,1900.[赵利军,门秀丽,李宏杰,等.缺血后适应减轻大鼠肢体缺血再灌注后的心肌损伤[J].中国病理生理杂志,2012,28(10):1892-1894,1900].doi:10.3969/j.issn.1000-4718.2012.10.030.
[2]Zhang J,Wu Y,Weng Z,et al.Glycyrrhizin protects brain against ischemia-reperfusion injury in mice through HMGB1-TLR4-IL-17A signalingpathway[J].Brain Res,2014,1582:176-186.
[3]Zhao LJ,Kong XY,Men XL,et al.The preventive role of salvia miltiorrhiza on multiple organ edema in rats suffered from limb ischemia-reperfusion[J].Tianjin Med J,2012,40(8):806-808.[赵利军,孔小燕,门秀丽,等.丹参对大鼠肢体缺血再灌注后多器官水肿的预防作用[J].天津医药,2012,40(8):806-808].doi:10.3969/j.issn.0253-9896.2012.08.017.
[4]Zhao W,Gan X,Su G,et al.The interaction between oxidative stress and mast cell activation plays a role in acute lung injuries induced by intestinal ischemia-reperfusion[J].J Surg Res,2014,187 (2):542-552.
[5]Men X,Han S,Gao J,et al.Taurine protects against lung damage following limb ischemia reperfusion in the rat by attenuating endoplasmic reticulum stress-induced apoptosis[J].Acta Orthop,2010,81(2):263-267.
[6]Yu J,Li R,Wang Q,et al.Effects of dexmedetomidine preconditioning on imbalance of nitric oxide/endothelin-1 and remote lung injury in patients with lower limb ischemia-reperfusion[J].Tianjin Med J,2015,43(5):537-541.[于健,李睿,王琦,等.右美托咪啶预处理对下肢缺血再灌注性肺损伤及一氧化氮/内皮素-1失衡的影响[J].天津医药,2015,43(5):537-541].doi:10.11958/j. issn.0253-9896.2015.05.024.
[7]Wu QL,Shen T,Ma H,et al.Sufentanil postconditioning protects the myocardium from ischemia-reperfusion via PI3K/Akt-GSK-3β pathway[J].JSurgRes,2012,178(2):563-570.
[8]Wang YX,Song XR,Ji ML,et al.Expressions of ICAM-1 and TNF-α in rats with acute lunginjury induced by left heart ischemic reperfusion[J].Journal of Zhengzhou University(Medical Science),2012,47(4):475-478.[王煜霞,宋晓荣,姬明丽,等.左心缺血再灌注大鼠急性肺损伤组织中ICAM-1与TNF-α的表达[J].郑州大学学报(医学版),2012,47(4):475-478].
[9]Roy SK,Kubiak BD,Albert SP,et al.Chemically modified tetracycline 3 prevents acute respiratory distress syndrome in a porcine model of sepsis+ischemia/reperfusion-induced lung injury[J]. Shock,2012,37(4):424-432.
[10]Moeini M,Nematbakhsh M,Fazilati M,et al.Protective role of recombinant human erythropoietin in kidney and lung injury following renal bilateral ischemia-reperfusion in rat model[J].Int J Prev Med,2013,4(6):648-655.
[11]Venna VR,Verma R,O′Keefe LM,et al.Inhibition of mitochondrial p53 abolishes the detrimental effects of social isolation on ischemic brain injury[J].Stroke,2014,45(10):3101-3104.
[12]Zhang Y,Leng YF,Xue X,et al.Effects of penehyclidine hydrochloride in small intestinal damage caused by limb ischemia-reperfusion[J].World JGastroenterol,2011,17(2):254-259.
(2015-08-24收稿2015-12-03修回)
(本文编辑李国琪)
Experimental studies of ischemia postconditioning alleviated lung injury after limb ischemia reperfusion in rats
LI Kaiji,HE Baoling,LU Qiuling,MEN Xiuli,ZHAO Lijun
Department of Pathophysiology,Basic Medical College,North China University of Science and Technology,Hebei 063000,China Corresponding AuthorE-mail:786411506@qq.com
Abstract:ObjectiveTo observe the effects of ischemic postconditioning(I-postC)on lung injury after limb ischemia reperfusion(LIR)in rats,and to investigate the protective effect and the mechanisms.MethodsTwenty-four Wistar rats were divided into three groups:control group(group Control),ischemia-reperfusion group(group IR)and ischemic postconditioning group(group I-postC).Referring to routine method in our department,the model rats underwent 4-hour ischemia and 4-hour reperfusion of hind limbs were made.In group Control,the rubber band around the limb was loose,which did not block the blood flow.Rats in group I-postC were given repeated 3 times of 5 min ischemia-5 min reperfusion,and then did perfusion 4 h before reperfusion.The blood and lung samples were collected for detecting arterial gas of partial pressure of oxygen[p(O2)]and partial pressure of carbon dioxide[p(CO2)].The plasma and lung tissue levels of malondialdehyde(MDA),superoxide dismutase(SOD)and xanthine oxidase(XOD)were detected.The morphological changes of lung tissue were observed under light microscope and electron microscope.ResultsIt was found that after suffering from ischemia-reperfusion,levels of p(O2)and p(CO2)decreased significantly.The activity of SOD in plasma and lung tissues decreased,but XOD and MDA increased significantly(P<0.05).With microscope,lung interstitial vascular dilation,infiltration of neutrophils,the width of the alveolar space,alveolar septal thickening and alveolar exudate were found.Compared with IR group,it was found that p(O2)and p(CO2)increased significantly in group I-postC.The activity of SOD in plasma and lung tissues increased,but XOD and MDA decreased significantly(P<0.05).The mild damage of pathological changes were found.ConclusionIschemic postconditioning can reduce the lung injury after limb ischemia reperfusion in rats,which may be related to the inhibition of lipid peroxidation.
Key words:reperfusion injury;lung;oxidative stress;malondialdehyde;xanthine oxidase;superoxide dismutase;ischemic postconditioning
中图分类号:R363.2
文献标志码:A
DOI:10.11958/20150003
基金项目:河北省卫生厅医学研究重点课题(20130060)
作者单位:河北省唐山市,华北理工大学基础医学院病理生理学系(邮编063000)
作者简介:李开济(1994),男,临床医学专业本科生,主要从事肢体缺血再灌注损伤机制与防治的研究
通讯作者E-mail:786411506@qq.com
