改良的乳小鼠心肌细胞原代培养方法
2016-07-14莫显刚刘应才
吴 丹,冯 健,莫显刚,刘应才
(1.西南医科大学附属医院心血管内科,四川泸州 646000;2.贵阳医学院附属医院老年病科,贵州贵阳 550004)
技术方法
改良的乳小鼠心肌细胞原代培养方法
吴 丹1,冯 健1,莫显刚2,刘应才1
(1.西南医科大学附属医院心血管内科,四川泸州 646000;2.贵阳医学院附属医院老年病科,贵州贵阳 550004)
【摘要】目的 建立一种稳定而快速的乳小鼠心肌细胞的原代培养方法。方法 用多聚赖氨酸预包被处理培养皿,采用两步法(0.25%胰酶4℃过夜,0.5 mg/mL-1.0 mg/mL II型胶原酶 +5 mg/mL白蛋白的胶原消化液37℃短时多次消化),通过差速贴壁70 min+5-溴脱氧尿嘧啶的使用来纯化心肌细胞。倒置相差显微镜下观察心肌细胞形态变化,台盼蓝染色法检测细胞存活率,α-actinin特异性免疫荧光染色鉴定心肌细胞并计算纯度。结果心肌细胞形态良好,自发搏动,细胞成活率可达到98%,纯度可达到95%。结论 本方法培养的心肌细胞存活率高,纯度高,是一种理想的心肌细胞原代培养方法。
【关键词】乳小鼠;心肌细胞;原代培养
目前,对于心血管疾病机制的研究,在器官与组织水平上,通过基因敲除和转基因小鼠建立的心血管动物模型作出了极大的贡献;在细胞分子水平上,原代培养心肌细胞作为一种体外实验研究模型无可替代,它既能够排除神经、体液、内分泌等因素的干扰而单独地观察研究心脏的发育以及心血管疾病的发生、发展机制[1],同时具有自发搏动性,保持了其在体内的许多结构和功能。关于啮齿类动物心肌细胞培养要追溯到20世纪60年代,Harary and Farley[2]首次从成年大鼠分离培养出心肌细胞。近些年来,大鼠心肌细胞的分离和培养技术越来越成熟,然而小鼠心肌细胞的分离与培养却十分困难,由于心肌细胞为高度分化的近终末细胞[3],丧失增殖分裂分化能力等特点,并且心肌细胞的培养存在存活率低、活力差、纯度低、易于污染等问题,本实验基于以往乳鼠心肌细胞的分离培养的经验和方法加以改进[4,5],建立了一种新型的乳小鼠心肌细胞的原代培养方法,此方法高效,稳定,能获得大量的心肌细胞,活力好、存活率高、纯度高。
1材料和方法
1.1材料
1.1.1实验材料:出生0~3 d的乳小鼠,雌雄不限,SPF级 ,生产许可证:SCXK(川)2013-17,使用许可证:SYXK(川)2013-181。由四川医科大学实验动物中心提供。CO2培养箱,超净工作台,恒温水浴箱,显微眼科手术剪刀、镊子三套,倒置相差显微镜,倒置荧光显微镜,恒温离心机,澳洲胎牛血清(Bovogen),多聚赖氨酸,DMEM/F12培养基(Hyclone),胰酶,II型胶原酶(Gibico),5-溴脱氧尿嘧啶核苷(BrdU)(Sigma),青链霉素双抗,40 g/L多聚甲醛,Triton X-100(Amresco),α-actinin(博士德),Dylight488标记的抗小鼠IgG(博士德),DAPI (Beyotime)。
1.1.2试剂的配制:配制含10%胎牛血清,1%青链霉素双抗的高糖DMEM/F12完全培养液,用完全培养液配制胶原消化液(0.5 mg/mL-1.0 mg/mL II型胶原酶 +5 mg/mL白蛋白)。
1.2实验方法
1.2.1乳小鼠心肌细胞的分离、纯化和培养:
1.2.1.1心肌组织的分离:取出生0~3 d的乳小鼠20只,浸泡于75%的酒精中8~10 s消毒后迅速送入超净工作台,将其固定于无菌泡沫板上,用眼科剪将乳小鼠胸骨正中偏左的皮肤剪开,用镊子分离皮肤,充分暴露胸部,换另一把眼科剪做一纵向切口打开胸腔,尽量不要超出第一次剪开的皮肤范围,忌打开腹腔,以免引起污染,根据心脏的搏动,顺势将心脏挤出。
取心脏放入冰冷的PBS缓冲液中吹打清洗,尽量将红细胞清洗干净,用眼科镊辅助眼科剪将多余的心房及周围肺组织等去除,随后将心脏移到另一个干净的培养皿,将心脏剪裂2~3下(裂而不断的程度即可),共清洗3遍。(此步骤在冰上操作)。
1.2.1.2心肌细胞的分离与培养:将心脏组织吸入玻璃培养瓶中,加入0.25%胰酶(含EDTA)10 mL,静置,4°C过夜(12~16 h)。第2天,取出过夜的心脏组织,加入完全培养液 10 mL,37°C恒温水浴5 min,中止胰酶的消化作用;弃去上清液,加入胶原消化液10 mL(注意弃上清液时勿把心脏组织吸走)。置于37°C的恒温水浴箱,1 min用手轻摇。弃上清液,将心脏组织移入另一个培养瓶中加入12 mL胶原消化液,置于37°C恒温水浴箱上,用手轻摇30 min,将上清液移入新的离心管中。重复消化3~4次,仅见絮状样物质即心肌组织消化彻底。将收集的上清液离心1 000 r/min 5 min,弃上清液,加完全培养液30 mL,轻轻拍打管壁使得细胞悬浮于其中,随后接种在100 mm培养皿中,放于37°C、5%CO2培养箱中孵育70 min,差速贴壁以除去成纤维细胞和内皮细胞等非心肌细胞。轻轻吸出细胞悬液,台盼蓝染液染色计数,根据不同的实验目的用完全培养基调整细胞密度,加入BrdU使其在培养液的终浓度为0.1 mmol/L,轻轻混匀后,将其接种到在事先用多聚赖氨酸预包被处理过的6孔板中,37°C、5%CO2培养箱中孵育48 h后,换无BrdU的完全培养基,以后每隔48 h换液1次。
1.2.2台盼蓝染色检测细胞存活率:取心肌细胞悬液90 μL加入0.4%台盼蓝染液10 μL均匀混合,静置3 min左右后,取1~2滴已混匀的细胞悬液沿着盖玻片边缘滴入,将计数板放置于倒置相差显微镜下观察计数,未着上色折光性强的圆形细胞为活的心肌细胞,染成蓝色的为死细胞。随机取4个视野进行细胞计数,计数心肌细胞的存活率(%)=活细胞数/(活细胞数+死细胞数)×100%,重复计数计算5次。
1.2.3心肌细胞搏动和形态学观察:将心肌细胞接种到多聚赖氨酸预包被处理过的100 mm培养皿中培养贴壁后,倒置相差显微镜下观察心肌细胞的搏动频率、节律、强度,以判断心肌细胞的活力,观察心肌细胞的生长状态、形态学变化并拍照。
1.2.4心肌细胞纯度鉴定(α-actinin免疫荧光染色):将心肌细胞以1~2×105的密度接种于预先放有经多聚赖氨酸预包被处理过的无菌玻片的24孔板中,制成细胞爬片;贴壁培养48 h后取出爬片,用0.01 mmol/L的 PBS缓冲液漂洗3次,(每次2 min);以40 g/L的多聚甲醛固定液固定5~10 min,每孔加0.5 mL,吸去固定液,用0.01 mmol/L 的PBS缓冲液漂洗3次,每次2 min;用3%Triton X-100室温打孔通透30 min,吸去通透液,0.01 mmol/L的PBS缓冲液漂洗3次,每次2 min(避免晃动);加入200 μL 5%白蛋白37度孵育60 min,甩去多余液体,不洗;取1∶100稀释的200 μL α-actinin抗体滴加到接种有心肌细胞的盖玻片上,4°C冰箱过夜,用0.01 mmol/L的PBS缓冲液漂洗3次,每次2 min;滴加1:100稀释的Dylight488标记的抗小鼠IgG室温避光孵育60 min,用0.01 mmol/L的PBS缓冲液漂洗3次,每次2 min;用DAPI染液进行染核,室温避光孵育3~5 min,0.01 mmol/L的PBS缓冲液漂洗3次,每次2 min;用吸水纸吸干爬片上的液体,滴加含抗荧光猝灭剂的封片液封片。荧光显微镜下观察采集图像,免疫荧光染色阳性的为心肌细胞,随机取10个高倍镜下视野计数阳性细胞数目及细胞总数,重复5次(阳性细胞率=阳性细胞数目/细胞总数 ×100%)。
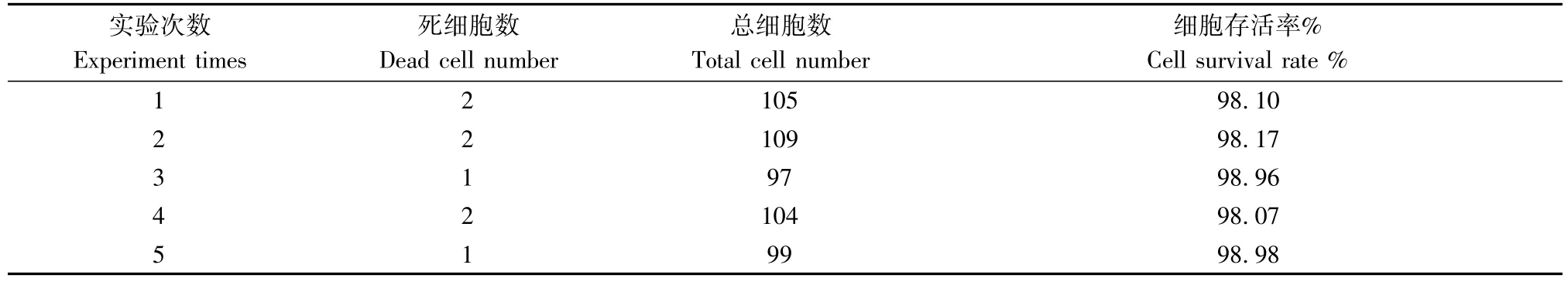
表1 心肌细胞存活率的测定Tab.1 Determination of the survival rate of cardiomyocytes
2 结果
2.1心肌细胞分离纯化、存活率测定及比较
实验显示,用多聚赖氨酸预包被处理培养皿,采用两步法(0.25%胰酶4°C过夜,0.5 mg/mL-1.0 mg/mL II型胶原酶 +5 mg/mL白蛋白的胶原消化液37°C短时多次消化),可以获得大量的心肌细胞,台盼蓝染色检测细胞存活率可达98%以上(表1),明显比传统混合酶消化法(78.18%)、两步法(90.47%)分离培养的心肌细胞存活率高(图1)。此方法简便、经济、细胞贴壁培养好,利用差速贴壁法[6]除去成纤维细胞等非心肌细胞以及加入化学试剂BrdU抑制残余成纤维细胞的生长增殖[7],在培养2~5 d后观察视野中绝大多数细胞为搏动的心肌细胞或者连接成片的心肌细胞团,未见明显的成纤维细胞等非心肌细胞生长增殖。
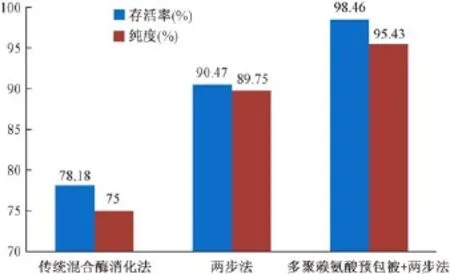
图1 3种方法培养心肌细胞的存活率及纯度比较Fig.1 Survival rates and purity of the cardiomyocytes cultured by 3 methods.
2.2心肌细胞形态学观察及比较
刚分离消化下来的心肌细胞悬浮于细胞液中呈圆形或者椭圆形,培养2~4 h后细胞开始贴壁生长,刚开始细胞呈单个、圆形,6~8 h后偶见单个心肌细胞搏动,搏动频率较慢,呈梭形。24 h后细胞几乎完全贴壁且均匀分布,伸出伪足,呈梭形、星形或不规则多边形(图2A),细胞搏动明显,频率和节律不一致,约60~100次/min不等;48 h后细胞伸出的伪足相互形成交联,成簇成团,交织密集呈网状(图2B),呈同步收缩,约120~140次/min。通过多聚赖氨酸预包被培养皿 +两步法分离培养的心肌细胞数目明显比传统混合酶消化法、两步法分离培养的心肌细胞数目多(图3)。
2.3心肌细胞纯度鉴定及比较
在倒置荧光显微镜下可见:在胞浆中辅肌动蛋白(α-actinin)特异性染成绿色为免疫荧光染色阳性,DAPI染色的细胞核呈蓝色(图4,5),证实是心肌细胞;细胞胞浆不着色,胞核呈蓝色的为非心肌细胞。结果显示95%以上的细胞中α-actinin染色都为阳性(表2),纯度明显高于传统混合酶消化法(75%)、两步法(89.75%)分离培养的心肌细胞(图1,5),可见该方法分离培养得到的心肌细胞纯度高,少见其他非心肌细胞的生长。

图2 普通光学显微镜下心肌细胞(标尺=200 μm)(A)Cardiomyocytes cultured for 24 hours;(B)Cardiomyocytes cultured for 48 hoursFig.2 Cardiomyocytes observed under a light microscope(Bar=200 μm)

图3 普通光学显微镜下3种方法分别培养48h的心肌细胞(标尺=200 μm)(A)Traditional mixed enzyme digestion method;(B)Two-step method;(C)The polylysine pre-packs culture dish+two-step methodFig.3 Cardiomyocytes cultured for 48 hours in 3 methods,observed under a light microscope(Bar=200 μm)
表2 心肌细胞纯度(±s,n=10)Tab.2 Purity of the cardiomyocytes(±s,n=10)
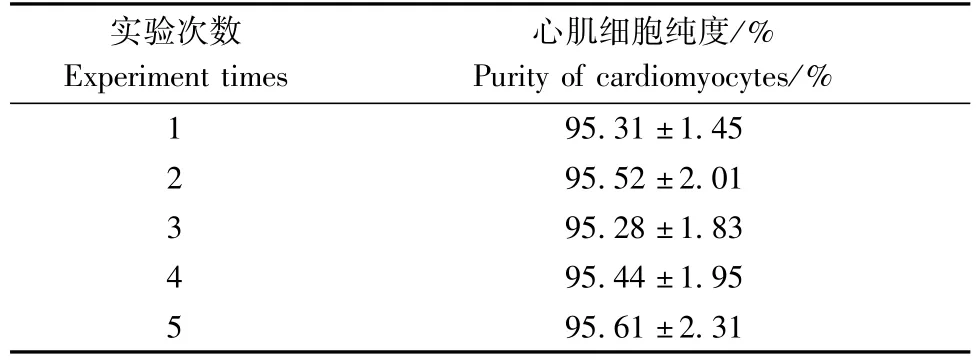
表2 心肌细胞纯度(±s,n=10)Tab.2 Purity of the cardiomyocytes(±s,n=10)
实验次数Experiment times心肌细胞纯度/% Purity of cardiomyocytes/% 1 95.31±1.45 2 95.52±2.01 3 95.28±1.83 4 95.44±1.95 5 95.61±2.31
3 讨论
近年来,关于心血管疾病研究的各领域,基于心肌细胞原代培养技术的信号通路、离子通道、基因表达等方面的探索研究,在细胞与分子水平揭示心血管疾病的发生发展及防治机制起着不可替代的作用。心肌细胞原代培养俨然已成为心血管研究中的一种根本方法和重要技术。目前,对于成年鼠心肌细胞的原代培养技术相对难度系数大,因此,乳鼠心肌细胞的原代培养技术更加应用广泛。然而,乳鼠心肌细胞的原代培养各个过程极易受各种处理因素及相关操作水平的干扰,一直存在心肌细胞的贴壁率低、成活率低、搏动率少以及纯度低等诸多不足,这些将会对随后的相关实验结果造成较大的影响,因此如何使消化分离下来的心肌细胞达到理想的成活率、纯度是亟待解决的瓶颈问题。
心肌细胞的培养方法主要包括组织块贴壁法和酶消化分离法两种[8]。组织块贴壁法[9]虽然操作简便,经济,但由于组织块贴壁不良、培养周期长、含大量成纤维细胞等非心肌细胞且不是每一块组织都能长出细胞,成功率低,现在已几乎不用。酶消化分离法主要使用的酶是胰酶和胶原酶,胰酶不仅对组织间蛋白成分起分解作用还对细胞膜蛋白、胞内的微管微丝有很强的破坏作用,因此单独的胰酶长时间的消化造成大量的心肌细胞丧失贴壁和自发搏动的能力,极大的影响细胞的活力和存活率,此外经胰酶消化处理后的组织可释放出大量的絮状般胶原蛋白,难以将上清液分离开,获得的心肌细胞数目少且活力差。胶原酶主要是对细胞与细胞间的胶原纤维起分解作用,适当的应用胶原酶可将成团的心肌细胞充分分散开从而增加心肌细胞消化数目,其作用力缓和,对心肌细胞损伤小,但是难以完全消化。目前,大多数采用的是传统混合酶(胰酶 +胶原酶)消化[10,11],尽管分离消化下来的细胞数目多,但是仍存在细胞贴壁不佳、活性不好以及纯度不高等问题。
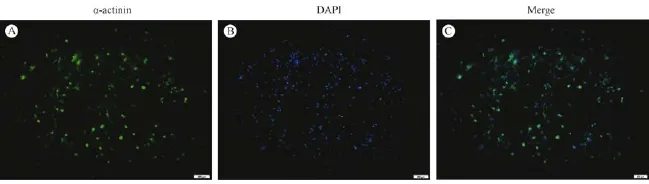
图4 心肌细胞的免疫荧光鉴定(标尺=200 μm)(A)Green is α-actinin specific staining;(B)Blue is the DAPI-stained cell nucleus;(C)Overlapping image of specific staining with α-actinin and DPAI-stained cell nucleus.Fig.4 Immunofluorescence identification of the cardiomyocytes(Bar=200 μm)
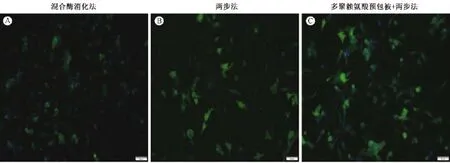
图5 3种方法分别培养的心肌细胞(标尺=100 μm)(A)Traditional mixed enzyme digestion method;(B)Two-step method;(C)The polylysine pre-packs culture dish+two-step methodFig.5 Morphology of the cardiomyocytes cultured by the 3 methods(Bar=100 μm)
本文观察了传统混合酶消化法、二步法及多聚赖氨酸预包被处理+二步法分离培养的心肌细胞,结果显示不论是存活率还是细胞纯度二步法(0.25%胰酶4°C过夜,0.5 mg/mL-1.0 mg/mL II型胶原酶 +5 mg/mL白蛋白的胶原消化液37°C短时多次消化)分离培养的心肌细胞远远优于传统混合酶消化法,而在二步法的基础上,将培养皿进行多聚赖氨酸预包被处理后,不仅可以获得更多的心肌细胞,而且细胞贴壁更好、成活率更高,形态结构正常,搏动好,纯度更高。
(1)多聚赖氨酸预包被处理培养皿:由于小鼠的心肌细胞比较脆弱易损[12],在实验的各个步骤中分离消化时间和力度把握不佳,就会出现细胞贴壁不佳甚至几乎不贴壁的现象,因此,用细胞外基质组分(如胶原蛋白、纤连蛋白、层粘连蛋白、复合细胞外基质蛋白或者人工基质如多聚赖氨酸)来预包被细胞培养皿可促进心肌细胞贴壁生长[13]。
(2)0.25%胰酶(含EDTA)4°C过夜:EDTA是钙离子的鳌合剂,一种非酶性消化物,主要作用是破坏细胞间的连接,在胰酶中加EDTA可增强胰酶的消化作用,降低对细胞的损害,具有更佳的消化效果,而胰酶在37°C,pH 8.0条件下消化作用最强,严重破坏心肌细胞,4°C条件过夜下可抑制胰酶的活性。加入0.25%胰酶(含EDTA)4°C过夜对心肌组织进行预消化,既能温和缓慢地分解消化组织间蛋白,使紧密的组织结构变得疏松,也不会对细胞本身造成损伤破坏,提高细胞成活率。
(3)用完全培养液来配胶原消化液,既能终止胰酶对组织细胞蛋白的再消化,又能为细胞生存提供营养成分,避免在消化过程中造成对细胞的损害或者活力降低。由于乳小鼠心肌细胞对酶的消化特别敏感,如果酶的浓度过高或者用量过大,细胞将会丧失贴壁和搏动的能力,造成细胞成活率降低,但浓度过低,消化不足时,细胞将会聚集成团,造成细胞密度急剧减少,无法满足后续实验要求。Ⅱ型胶原酶的浓度控制在0.5mg/mL~1.0 mg/mL可达到理想的消化,在胶原酶中加入白蛋白(5 mg/ ml),保护细胞,提高消化分离的细胞质量。
(4)37°C短时多次消化,不仅可让胶原酶充分消化组织,以便获得足够数目的心肌细胞,而且可降低因长时间的消化造成对细胞的损伤,避免出现消化过度以及随之而来的细胞贴壁差,成活率低,搏动少,纯度低等问题。由于小鼠心肌细胞比较脆弱,分离消化过程中,不宜用玻璃棒进行搅拌消化或吸管吹打消化,振荡力度不宜过大,每次都应在37℃恒温水浴轻轻震荡下消化,以提高心肌细胞的获得率。此外,温度超过37℃时不但大大降低酶的活性,也会大大的降低细胞的活力;消化酶的作用时间对心肌细胞的获得有很大影响,一般消化3~5次,每次消化时间应控制在8 min以内,消化时间过长、次数过多,则获得的心肌细胞活力不佳,贴壁不良;时间过短,次数过少,消化不足,则获得的心肌细胞量少。此外,应避免产生气泡,因为气泡的表面张力会牵拉损伤细胞。
本实验通过长期反复的实践证明,应用多聚赖氨酸预包被处理培养皿+两步法分离消化心脏组织,联合差速贴壁法(贴壁70 min)+化学试剂抑制法(在培养基中加0.1 mmol/LBrdU)纯化心肌细胞,能够建立一种理想的乳小鼠心肌细胞原代培养方法,有助于心肌细胞形态、电生理、生化、分子生物学及生物力学等方面实验的开展,满足心血管疾病基础与临床研究。
参考文献:
[1] Hadad I,Veithen A,Springael JY,et al.Stroma cell-derived factor-1α signaling enhances calcium transients and beating frequency in rat neonatal cardiomyocytes[J].Plos ONE,2013,8(2):e56007.
[2] Harary I,Farley B.In vitro studies of single isolated beating heart cells[J].Science,1960,131(3414):1674-1675.
[3] Anderson PA,Greig A,Mark TM,et al.Molecular basis of human cardiac troponin T isoforms expressed in the developing,adult,and failing heart[J].Circ Res,1995,76(4):681 -686.
[4] 朱晓丽,王丽,马依彤,等.乳鼠心肌细胞和心肌成纤维细胞体外分离培养方法的优化 [J].中国动脉硬化杂志,2015,01:90-99.
[5] Louch WE,Sheehan KA,Wolska BM.Methods in cardiomyocyte isolation,culture,and gene transfer[J].Mol Cell Cardiol,2011,51(3):288-298.
[6] 庞勇军,孙莉,谢文娟,等.新生大鼠心肌细胞分离、纯化及培养方法的改进[J].上海交通大学学报:医学版,2011,31 (4):520-523.
[7] Chiu CZ,Wang BW,Chung TH,et al.Angiotensin II and the ERK pathway mediate the induction of myocardin by hypoxia in cultured rat neonatal cardiomyocytes[J].Clin Sci(Lond),2010,119(7):273-82.
[8] 司徒镇强.细胞培养[M].第2版.北京:世界图书出版社,2007:54-57.
[9] 王琼,郭勇,余鸿,.乳鼠心肌细胞酶消化培养和贴块培养法的比较[J].中国比较医学杂志,2006,01:38-40.
[10] 辛毅,许秀芳,黄益民,等.乳小鼠心肌成纤维细胞和心肌细胞的分离培养及荧光鉴定 [J].新乡医学院学报,2011,28(5):541-546.
[11] 阳海鹰,丁巍,丁爱石,.新生小鼠心肌细胞培养模型的建立及其在毒性评价研究中的应用[J].军事医学科学院院刊,2010,34(1):30-33.
[12] 王丽娟,贾大林,齐国先.成年小鼠心肌细胞的分离培养及鉴定[J].中国实验动物学报,2007,03:175-178.
[13] Nawroth JC,Lee H,Feinberg AW,et al.A tissue-engineered jellyfish with biomimetic propulsion[J].Nat Biotechnol,2012,30(8):792-797.
〔修回日期〕2015-12-15
An improved method for primary culture of neonatal mouse cardiomyocytes
WU Dan1,FENG Jian1,MO Xian-gang2,LIU Ying-cai1
(1.Department of Cardiology,the Affiliated Hospital of Southest Medical University,Luzhou Sichuan 646000,China;2.Department of Geriatrics,the Hospital Affiliated to Guiyang Medical College,Guiyang 550004)
【Abstract】Objective To establish a stable and fast method for primary culture of mouse cardiomyocytes. Methods Dishes were coated with polylysine firstly.A two-step approach was used to isolate and digest mouse cardiomyocytes cells(0.25%trypsin in 4°C overnight and 0.5 mg/mL to 1.0 mg/mL collagenase+5 mg/mL albumin collagen digestion liquid in 37°C for short-time digestion),then the cardiomyocytes were purified through differential adhesion for 70 min and 5-bromodeoxyuridine(BrdU).The cell morphology was observed under an inverted microscope. The survival rate of cardiacmyocytes was detected by trypan-blue staining and their purity was identified by α-actinin immunofluorescence staining.Results The cardiomyocytes were in good shape and pulsed spontaneously.The survival rate of the cardiomyocytes reached 98%and the purity was 95%.Conclusions This method described in this study is an ideal method for primary culture of mouse cardiomyocytes with a high survival rate and high purity.
【Key words】Neonatal mouse;Cardiomyocytes;Primary cell culture
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)04-0062-06
doi:10.3969.j.issn.1671-7856.2016.04.011
[基金项目]国家自然科学基金(编号:31300946,31260250),沪州市人民政府-沪州医学院科技战略合作科技项目(2013LZLY-J22)。
[作者简介]吴丹(1991-)女,硕士研究生,研究方向:冠心病的基础与临床,Email:15681536087@163.com。
[通讯作者]冯健(1982-)男,主治医师,博士,研究方向:冠心病的基础与临床,Email:415623fj@163.com。
