腺相关病毒介导的狨猴P53基因沉默
2016-07-14向志光邓仪晨苏静芬刘云波
石 亮,张 晨,向志光,邓仪晨,苏静芬,刘云波
(1.中国医学科学院医学实验动物研究所,北京 100021;2.北京大学生命科学学院,北京 100871)
腺相关病毒介导的狨猴P53基因沉默
石 亮1,张 晨2,向志光1,邓仪晨1,苏静芬1,刘云波1
(1.中国医学科学院医学实验动物研究所,北京 100021;2.北京大学生命科学学院,北京 100871)
【摘要】目的 在细胞和整体动物水平,利用RNA干扰技术下调绒猴p53基因表达。方法 对狨猴p53基因做生物信息学分析,针对靶序列设计shRNA干扰序列,构建在腺相关病毒载体上,转染非洲绿猴肾细胞(cos-7),在细胞水平用荧光定量PCR检测p53mRNA抑制效果,以Western blot方法检测p53蛋白水平表达变化;优选shRNA干扰序列,包装含shRNA干扰序列的8型腺相关病毒,静脉注射感染狨猴;手术取少量肝脏组织,用Western blot和免疫组化方法检测p53蛋白水平的变化。结果 细胞水平研究发现2个有效RNA干扰靶点,mRNA干扰效率分别为(82.7±8.1)%和(80.7±7.5)%(P<0.05);蛋白表达下调(77.3±11.5)%和(73.7±10.7)%(P<0.05);2只绒猴感染病毒后,经活体荧光成像分析可见病毒在肝脏、睾丸、颈部等位置分布,狨猴肝脏P53蛋白经Western blot、免疫组化分析未见明显变化。结论 本研究在细胞水平实现绒猴P53基因表达下调,但整体动物水平狨猴肝脏P53蛋白表达未发现明显变化;今后需在感染方式等方面做进一步优化。
【关键词】AAV8;P53;RNA干扰;狨猴
RNAi技术可以特异性剔除或关闭特定基因的表达,广泛应用于基因功能研究与基因治疗领域。利用RNAi的方法已经成功在啮齿类动物的受精卵中下调基因的表达,建立相关的动物模型[1],但是在狨猴上还没有相应研究。腺相关病毒(adenoassociated virus,AAV)是一种重要的基因载体,主要用于基因治疗、基因功能研究、动物模型建立,相对慢病毒、腺病毒等病毒载体有着它独特的优点,安全性高、免疫原性低、长期表达等[2]。可以利用AAV介导RNA干扰实现动物水平基因表达的改变。P53是一种重要的肿瘤抑制基因。在所有恶性肿瘤中,50%以上会出现该基因的突变,他们中的大多数是错义突变进而减少p53肿瘤抑制活性。研究表明p53除了具有肿瘤抑制功能外,还参与细胞凋亡、细胞周期阻滞、DNA损伤修复、调节机体代谢、参与免疫反应等多种生理过程[3]。相关的研究主要集中在啮齿类动物,但由于与人亲缘性较远,应用受到许多因素的限制。狨猴是一种很小的非人灵长类动物,其生理学、行为学以及细胞因子激素水平等与人非常相似。因此研究非人灵长类动物基因调控对于基因功能与疾病治疗具有重要意义。在细胞水平上的验证,由于狨猴细胞系较少且转染效率不高,选用cos-7细胞,设计的干扰靶点序列与非洲绿猴p53基因完全同源[4]。本实验利用RNAi技术,以AAV为载体,希望在狨猴体内下调p53蛋白,进而研究p53基因及下游相关基因功能,以期建立一种非人灵长类动物的基因调控的策略。
1 材料和方法
1.1实验动物
狨猴3只,体重分别为345 g、355 g、360 g,年龄分别为2岁9月、3岁1月、3岁3月,全部雄性,由中国医学科学院医学实验动物研究所北方资源中心提供。饲养条件:温度25℃ ~30℃,湿度45% ~80%,12 h照明/12 h黑暗(8:00~20:00亮灯),单笼饲养,自由饮水,早晚喂食,中午喂食水果。
1.2P53基因shRNA干扰载体构建
根据狨猴p53基因的序列,依照shRNA的设计原则在Life Technology在线设计若干靶点的shRNA序列。将目的片段构建载体质粒PAAV-luciferaseshRNA上,转化,酶切鉴定,测序。测序引物为U6-F:5'-TACGATACAAGGCTGTTAGAGAG-3'。对照组选用不和任何基因同源性的Scramble序列。
1.3荧光定量PCR
提取总的RNA,逆转录后进行SYBR-Green法荧光定量 PCR。P53基因所用引物为 F:5'-CCCTTCCCAGAAAACCTACC-3',R:5'-CTCCGTCA TGTGCTGTGACT-3'预计扩增出220 bp的目的片段,内参基因GAPDH所用引物F:5'-ACATCATCC CTGCCTCTACTGG-3',R:5'-AGTGGGTGTCGCT GTTGAAGTC-3,扩增产物长度260 bp[5]。PCR反应程序:95℃预变性3 min,94℃30 s,60℃30 s,72℃30 s共 40个循环。同一样品做三次重复,采用2-△△Ct进行结果分析。
1.4Western Blot
裂解细胞或组织,测定浓度,取相同量蛋白与buffer混匀,沸水煮5 min变性,电泳,转膜,封闭,一抗4°C孵育过夜,二抗室温1 h,进行曝光。最后结果用Image J软件对图像进行灰度分析。
1.5AAV8的包装
AAV载体质粒、包装质粒和辅助质粒(8型)三质粒法共转染293T细胞。收集细胞和培养上清液,离心弃除杂质,过滤除菌,浓缩,纯化,QPCR测定病毒滴度,-80℃保存备用。
1.6病毒注射动物
一只作为对照组,注射含有scramble序列的对照病毒。两只作为实验组,注射含有shRNA1的病毒。按照其体重以2×1012vg/kg后肢静脉注射[6]。在注射后的1 d、1周、2周、3周进行活体荧光成像检测,监测病毒的侵嗜情况。四周后,盐酸氯胺酮(3 mg/kg)肌内注射麻醉动物,手术取米粒般大小的肝脏组织。Western blot和免疫组化方法检测肝脏p53蛋白水平的变化情况。
1.7免疫组织化学染色
石蜡切片脱蜡至水,3%H2O2室温孵育 10 min,PBS浸泡5 min,0.01 mol/L枸橼酸钠缓冲液微波炉修复,5% 山羊血清封闭 30 min,滴加一抗(p53抗体,1∶100)37℃孵育2 h,PBS冲洗,先后滴加适量二抗工作液I和II,PBS冲洗。DAB显色,自来水冲洗,复染,脱水,透明,封片。
1.8统计学方法
用SPSS 16.0统计软件进行分析,P<0.05表示差异显著性。
2 结果
2.1腺相关病毒shRNA干扰载体构建
根据狨猴p53基因序列信息和shRNA干扰序列设计基本原则,设计出两个有效靶点。靶点序列与我们在细胞水平验证的非洲绿猴p53基因完全同源。具体序列信息和对应狨猴p53基因的位置见表1。
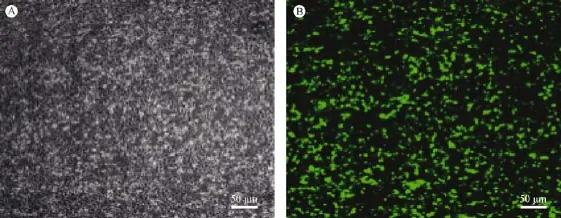
图1 质粒转染48 h后荧光表达图(×40,标尺=50 μm)Note.A:Under an ordinary microscope.B:Under a fluorescent microscope.Fig.1 The fluorescence image of plasmid expression at 48 hours after transfection.(×40,Bar=50 μm)
2.2细胞水平p53基因沉默效率检测
为验证设计的靶点序列的有效性,转染干扰序列的质粒48 h后,对照质粒中含有GFP报告基因,在荧光显微镜下验证转染效率,证明构建的含干扰序列的质粒成功进入细胞,可以进行后续实验,见图1。
荧光定量PCR结果采用2-△△Ct进行分析。如图2所示,对应的2个靶点序列p53基因mRNA表达量均显著下降(P<0.05)。其中shRNA1 mRNA水平沉默效率(82.7±8.1)%,shRNA2 mRNA水平沉默效率为(80.7±7.5)%。两个靶点对p53基因在mRNA水平均有明显的沉默效率。
Western blot结果用Image J软件对图像进行灰度分析。如图3所示,对应的2个靶点序列p53蛋白表达量均显著下降(P<0.05)。其中shRNA1蛋白水平沉默效率(77.3±11.5)%,shRNA2蛋白水平沉默效率为(73.7±10.7)%。两个靶点对p53蛋白有明显的降低,蛋白水平和mRNA水平检测结果基本保持一致。
2.3活体荧光成像
活体荧光成像技术检测病毒在狨猴体内的侵嗜情况。见图4,上下两只实验组动物都注射含有PAAV-luciferase-shRNA病毒。可以发现注射病毒后1 d睾丸处就有少量荧光,1周后颈部位置也出现荧光,3周后可以看见后肢大腿、颈部、睾丸、腹部等都有不同程度的荧光。证明病毒进入对应位置,相应荧光位置有高效的侵嗜性,可以推测肝脏有病毒的侵嗜。
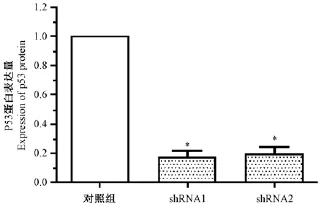
图2 P53基因mRNA表达Note.*compared with the control group(P<0.05)Fig.2 The mRNA expression of P53 gene
2.4肝脏组织p53基因沉默效率检测
免疫组化方法检测实验组与对照组p53蛋白的变化,如图5所示,p53蛋白在正常的肝脏组织中表达很低,只有少量肝脏细胞有核染色,实验组和对照组没有表现出明显差异。采用Western blot方法分别检测实验组和对照组中p53蛋白水平的变化。如图6所示,通过Image J软件对图像进行灰度分析,实验组 p53蛋白水平沉默效率为(7.3± 8.9)%,两组比较差异无统计学意义(P>0.05)不能证明有蛋白水平变化。
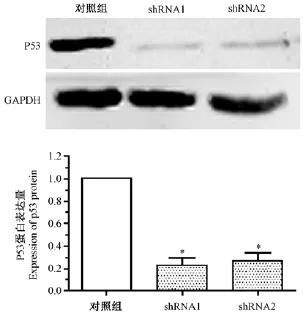
图3 P53蛋白表达Note.A:Western blot image.B:The results of gray scale analysis.*Compared with the control group(P<0.05).Fig.3 The expression of p53 protein
3 讨论
狨猴是最小型的实验灵长类动物,其体型小、繁殖快、遗传进化及生理生化方面与人类相近,是人类疾病研究的理想实验动物之一,常用于神经科学、免疫学、药物毒理、肿瘤等方面研究[7]。目前利用灵长类动物建立稳定的基因调控方法还面临巨大的困难,如基因敲除方法面临阳性打靶率低和移植成活率不高以及缺陷基因造成胚胎致死。本研究希望利用RNAi技术在狨猴体内实现p53基因表达的下调。在细胞水平的验证,由于狨猴的细胞系较少并且体外转染效率较低,所以选用cos-7细胞,设计的靶点序列在狨猴和非洲绿猴都完全同源,都位于p53基因的开放阅读框中。
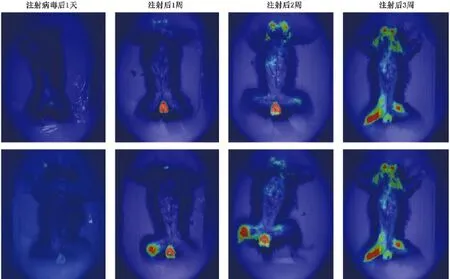
图4 注射病毒后活体荧光图像(标尺=500 μm)Note.Fluorescent colors represent the degree of invaded viruses:red>yellow>green,the deeper color means a higher degree virus invasion.(Bar=50 μm)Fig.4 In vivo fluorescence imaging after injection of virus
AAV由于其安全性好、宿主细胞范围广(分裂和非分裂细胞)、免疫源性低、在体内表达外源基因时间长等特点[8],被视为最有前途的基因转移载体之一。目前AAV有几十种不同的血清型,各个血清型对组织细胞有不同侵嗜性。AAV-8对肝脏、肌肉等有很强的亲和性,活体荧光成像的结果与前期研究基本相同[9]。肝脏部位只有少量荧光,可能由于荧光透射性较弱或者病毒注射量偏少。手术取少量肝脏组织,不会造成动物的死亡而进行后续研究。在肝脏中没有检测到p53蛋白的变化,后续需要在感染方式与序列靶点做进一步优化,以及处死动物检测睾丸、大腿肌肉、颈部等位置p53蛋白是否变化。

图5 狨猴肝脏组织p53蛋白免疫组化图(×40,标尺=100 μm)Note.The arrows indicate P53 protein immunohistochemical stainingFig.5 The p53 protein in the marmoset liver. (×40,Bar=100 μm)
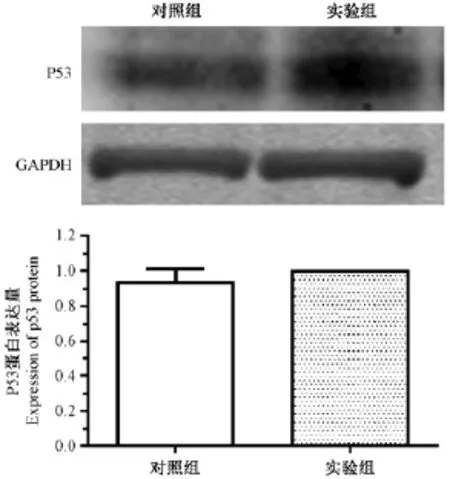
图6 注射病毒后狨猴肝脏p53蛋白表达Note.A:Western blot image.B:The results of gray scale analysis. #Compared with the control group(P>0.05)Fig.6 The expression of liver p53 protein after injection of virus
综上所述,本研究以RNA干扰技术为基础,利用8型腺相关病毒作为载体,在细胞水平实现了p53蛋白的降低,在狨猴动物水平的研究还需优化条件与完善策略。
致谢:感谢中国医学科学院医学实验动物研究所检测中心佟巍老师,刘先菊老师提供指导,感谢中国医学科学院医学实验动物所北方资源中心尚海全、肖冲、马喜山等老师在实验操作的帮助。
参考文献:
[1] Murai S,Katagiri Y,Yamashita S.Maturation-associated Dbf4 expression is essential for mouse zygotic DNA replication[J]. Dev Growth Differ,2014,56(9):625-639.
[2] Mingozzi F,High KA.Immune responses to AAV in clinical trials[J].Curr Gene Ther,2011,11(4):321-330.
[3] Kamada R,Toguchi Y,Nomura T,et al.Tetramer formation of tumorsuppressorproteinp53:structure,function,and applications[J].Biopolymers,2015.(Accepted article and published online)
[4] 苏静芬,张晨,李雨函,等.恒河猴p53基因沉默靶点在细胞水平的验证[J].中国比较医学杂志,2014,24(08):7 -10.
[5] Zhou HW,LouSQ,ZhangK.Recoveryoffunctionin osteoarthritic chondrocytes induced by p16INK4a-specific siRNA in vitro[J].Rheumatology(Oxford),2004,43(5):555 -568.
[6] Okada H,Ishibashi H,Hayashita-Kinoh H,et al.Robust longterm transduction of common marmoset neuromuscular tissue with rAAV1 and rAAV9[J].Mol Ther Nucleic Acids,2013,2:e95.
[7] Okano H,Hikishima K,Iriki A,et al.The common marmoset as a novel animal model system for biomedical and neuroscience research applications[J].Semin Fetal Neonatal Med,2012,17 (6):336-340.
[8] Miyake K,Miyake N,Yamazaki Y,et al.Serotype-independent method of recombinant adeno-associated virus(AAV)vector production and purification[J].J Nippon Med Sch,2012,79 (6):394-402.
[9] Borel F,Kay MA,Mueller C.Recombinant AAV as a platform for translating the therapeutic potential of RNA interference[J]. Mol Ther,2014,22(4):692-701.
〔修回日期〕2016-02-25
Adeno-associated virus mediated p53 gene silence in marmosets
SHI Liang1,ZHANG Chen2,XIANG Zhi-guang1,DENG Yi-chen1,SU Jing-fen1,LIU Yun-bo1
(Institute of Medical Laboratory Animal Science,Chinese Academy of Medical Sciences,Beijing 100021,China;2.College of Life Science,Peking University,Beijing 100871)
【Abstract】Objective To decrease the p53 gene expression at cellular and animal levels in marmoset using RNA interference technique.Methods The shRNA interference sequences were designed and inserted into the adeno-associated virus vector plasmid after bioinformatics analysis.The plasmids were transfected into African green monkey kidney cos-7 cells.The suppression of p53 mRNA was detected by real-time PCR,and the changes of p53 protein expression were detected by Western bolt.The adeno-associated virus-8 was injected through the hind leg vein.The changes of p53 protein expression in the liver tissue was detected by Western blot and immunohistochemistry.Results We screened two RNA interference effective arget sequences.The expression of p53 mRNA was suppressed(82.7±8.1)%and(80.7± 7.5)%,respectively(P<0.05),and the expression of p53 protein was decreased(77.3±11.5)%and(73.7± 10.7)%,respectively(P<0.05).The two marmosets after virus infection showed that there were virus distributions in the liver,testes,and neck detected by in vivo fluorescence imaging.The expression of p53 in the marmoset liver was detected by western blot,immunohistochemistry analysis showing no obvious changes.Conclusions In the present study,the decrease of P53 gene expression at cellular level is achieved,however,the liver P53 protein in the marmoset liver is not significantly changes.Further optimization of the way of infection is needed in the future.
【Key words】AAV8 virus;p53;RNA interference;Marmoset
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)04-0053-05
doi:10.3969.j.issn.1671-7856.2016.04.009
[基金项目]国家科技支撑计划(No.2014BAI03B01)。
[作者简介]石亮(1988-),男,硕士研究生,研究方向:实验动物学。
[通讯作者]刘云波,男,教授,研究方向:实验动物学。E-mail:yunboliu@126.com。
