20种氨基酸近红外光谱及其分子结构的相关性
2016-07-12陶琳丽杨秀娟曹志勇邓君明王姗姗梅凤艳张名伟
陶琳丽,黄 伟,杨秀娟,曹志勇,邓君明,王姗姗,梅凤艳,张名伟,张 曦*
1.云南农业大学动物科学技术学院,云南省动物营养与饲料重点实验室,云南 昆明 650201 2.云南农业大学基础与信息工程学院,云南 昆明 650201
20种氨基酸近红外光谱及其分子结构的相关性
陶琳丽1,黄 伟1,杨秀娟1,曹志勇2,邓君明1,王姗姗1,梅凤艳1,张名伟1,张 曦1*
1.云南农业大学动物科学技术学院,云南省动物营养与饲料重点实验室,云南 昆明 650201 2.云南农业大学基础与信息工程学院,云南 昆明 650201
旨在研究20种氨基酸的分子结构与其近红外光谱的相关性,为氨基酸近红外光谱在动物科学、食品和医药等方面的推广应用奠定一定的理论基础。应用岛津傅里叶变换红外光谱仪IRPrestige-21及其近红外附件FlexIRTM Near-Infrared Fiber Optics module,采集20种氨基酸标准物质在1 000~2 502 nm波长范围内的近红外光谱,分辨率8 cm-1,每个样品扫描3次,每次扫描50遍,取其平均值为氨基酸标准品的近红外光谱。根据氨基酸侧链基团的不同,分别比较脂肪族氨基酸、芳香族氨基酸和杂环氨基酸中各氨基酸分子结构与其近红外光谱的相关性。研究表明,20种氨基酸在1 000~2 502 nm区域有非常明显的近红外光谱吸收且差异显著。分子量较大的脂肪族氨基酸其近红外光谱受侧链基团的影响较大,而甘氨酸近红外光谱受羧基和氨基的影响较大;两种芳香族氨基酸近红外光谱的差异主要来自于苯环,酪氨酸苯环上的—OH基团降低了苯分子的对称性,导致更多振动吸收峰的出现;杂环氨基酸因其侧链上杂环分子基团构成不同,其近红外光谱在1 600~1 800 nm区域差异较大。综上,20种氨基酸主要存在4个特征光谱区:第1特征光谱区为1 050~1 200 nm主要由C—H基团的二级倍频构成;第2特征光谱区为1 300~1 500 nm主要由C—H基团的组合频构成;因侧链基团分子构成不同,在第3特征光谱区1 600~1 850 nm和第4特征光谱区2 000~2 502 nm表现出差异较大的特征吸收峰。因此,可以利用此4个近红外光谱特征区域对氨基酸进行定量和定性分析,提高氨基酸近红外光谱模型预测的准确性。
近红外光谱;氨基酸;分子结构;标准物质
引 言
氨基酸是含有一个碱性氨基和一个酸性羧基的有机化合物,在生物分子的结构和功能研究中有重要的作用。从细菌到人类,所有蛋白质都由20种标准氨基酸组成,根据其侧链基团的性质,可分为脂肪族氨基酸、芳香族氨基酸和杂环氨基酸。
氨基酸常用的检测方法有离子交换色谱法、高效液相色谱法、气相色谱法等紫外检测方法[1],需要对样品进行衍生化和显色反应,样品预处理过程较为繁琐。现代近红外光谱分析技术,可充分利用全谱或多波长下的光谱数据进行定性或定量分析,其原理是利用有机物质的含氢基团(C—H,N—H,O—H等)在波长780~2 500 nm区域跃迁时产生的光谱变化,结合计算机学与化学计量学测定样品中多种化学成分含量[2]。构成生命体的20种氨基酸主要是由C—H,N—H和O—H等基团构成,这些基团在近红外区域会产生明显的倍频和组合频吸收峰。研究表明,应用近红外光谱可以定量检测饲料、肉与肉制品、谷物、茶叶、中草药等[3-5],但不同氨基酸预测的准确率存在一定差距,这是由于不同氨基酸的侧链基团存在一定差异,其近红外光谱也会因分子构成的不同表现出光谱差异,如果单纯从数学模型的角度解决此问题,则效果不明显。因此,研究20种氨基酸标准物质近红外光谱,找出氨基酸化学结构与其近红外光谱的关联性,对今后氨基酸近红外光谱的定量定性检测具有十分重要的意义。
1 实验部分
1.1 试验材料
18种氨基酸标准物质(甘氨酸Gly、丙氨酸Ala、缬氨酸Val、亮氨酸Leu、异亮氨酸Ile、丝氨酸Ser、苏氨酸Thr、甲硫氨酸Met、半胱氨酸Cys、天门冬氨酸Asp、谷氨酸Glu、精氨酸Arg、赖氨酸Lys、苯丙氨酸Phe、酪氨酸Tyr、色氨酸Trp、组氨酸His、脯氨酸Pro)购自中国药品生物制品检定所,每瓶含量100mg,固态,除Met纯度为99.7%、Glu纯度为99.5%以外,其余十六种氨基酸纯度均为100%。
剩余两种氨基酸标准物质(天冬酰胺Asn、谷氨酰胺Gln)购自上海安谱科学仪器有限公司,每瓶含量20mg,固态,Asn纯度为99.38%,Gln纯度为99.5%。
1.2 近红外光谱采集
近红外光谱采集使用岛津傅里叶变换红外光谱仪IRPrestige-21及其配套近红外附件FlexIRTMNear-Infrared Fiber Optics module,光谱采集软件为岛津IRsolution 1.50,光谱室温度恒定25 ℃,湿度38%。将每个氨基酸标准品放入45×25规格容量瓶中,使用微量样品勺将样品聚集为直径为5 mm,厚度为3 mm以上的圆柱体,将光纤探头直接置于待测氨基酸样品上,进行光谱扫描。光谱扫描的波长范围为1 000~2 502 nm,分辨率8 cm-1,每个样品扫描3次,每次扫描50遍,取三次扫描数据平均值为氨基酸标准品的近红外光谱。

图1 侧链为烃基脂肪族氨基酸的1 000~2 502 nm近红外光谱图及其分子结构
2 结果与讨论
2.1 脂肪族氨基酸
脂肪族氨基酸共有15种,按其侧链的不同,又可分为侧链为烃链的脂肪族氨基酸,侧链含有羟基的脂肪族氨基酸、侧链含硫原子的脂肪族氨基酸、侧链含有羧基的脂肪族氨基酸、侧链含有酰胺基的脂肪族氨基酸和侧链显碱性的脂肪族氨基酸。
2.1.1 侧链为烃链的脂肪族氨基酸
侧链只有烃链的脂肪族氨基酸有Gly,Ala,Val,Leu和Ile五种,分子量为75.07,89.09,117.15,131.17和131.17,其近红外图谱见图1。

2.1.2 侧链含有羟基的脂肪族氨基酸
侧链含有羟基的脂肪族氨基酸是Ser和Thr,分子量为105.09和119.12。图2显示,Thr相对于Ser在侧链主链上增加一个端甲基,其近红外光谱也表现出明显差异。Ser在1 000~2 502 nm处的近红外光谱有四个光谱吸收区,分别为1 192,1 451,1 666~1 722和2 082~2 502 nm。Thr的近红外光谱与其相比,吸收峰明显提前,且在1 377 nm处的吸收峰明显小于Ser在1 451 nm处的吸收峰,这可能是因为Thr侧链中多增加了一个端甲基,影响了OH基团在1 400 nm左右波长范围内的吸收峰的出现,转而表现为C—H的组合频。研究表明,OH基团的一级倍频吸收大致位于1 410 nm处,且会随着醇分子结构的不同出现在不同的位置[6],这也间接的说明了Ser和Thr在1 451和1 377 nm存在差异的原因。Ser在1 666~1 722 nm处,可以看到有两个明显的吸收小峰,而Thr在1 635 nm后整体基线抬高至2 000 nm,两者在此范围内的吸收有明显的差异。

图2 侧链含有羟基的脂肪族氨基酸1 000~2 502 nm近红外光谱图及其分子结构
2.1.3 侧链含有硫原子的脂肪族氨基酸
侧链含有硫原子的脂肪族氨基酸是Met和Cys,分子量为149.21和121.16。由图3可知,Met近红外光谱在1 185和1 420 nm的吸收峰均高于Cys的1 191和1 408 nm处的吸收峰,这与其侧链中多出一个亚甲基和一个端甲基有关。Met在1 698和1 740 nm处有两个明显的吸收峰,且此区域的峰宽明显宽于Cys在1 743 nm左右的吸收峰。研究发现苯硫酚和1-丁硫醇的S—H一级倍频弱吸收峰出现在1 970~1 980 nm[6],Cys在1 743 nm附近出现的多点吸收峰,推测与S—H一级倍频相关。两种氨基酸在2 160~2 190 nm处均有一个宽吸收峰,除此之外Met在2 102 nm处有一较小的吸收峰,而Cys此处无吸收,Cys在2 400 nm处的吸收峰明显高于Met。与图1相比可知,在1 600~1 800 nm范围内近红外光谱的差异与硫原子相关。

图3 侧链含有硫原子的脂肪族氨基酸1 000~2 502 nm近红外光谱图及其分子结构
2.1.4 侧链含有羧基的脂肪族氨基酸
侧链含有羧基的脂肪族氨基酸是Asp和Glu,显酸性,分子量为133.10和147.13。由图4可知,Glu的侧链相对于Asp,增加了一个亚甲基,两者的近红外光谱从形状上来看非常的相似。和前面的脂肪族氨基酸相同,在1 165~1 170,1 378左右,1 691~1 733和2 148~2 502 nm四个波段范围内有明显的吸收峰。Glu在四个波段范围内的吸收峰明显提前于Asp,且在1 691 nm处的吸收峰明显高于Asp在1 733 nm处的吸收峰,这可能与其侧链中多增加的一个亚甲基有关。2 140 nm处气相甲酸出现OH伸缩振动和CO伸缩振动的组合频吸收峰[6],Glu和Asp在2 150~2 175 nm附近的强吸收峰推测与此有关。

图4 侧链含有羧基的脂肪族氨基酸1 000~2 502 nm近红外光谱图及其分子结构
2.1.5 侧链含有酰胺基的脂肪族氨基酸
侧链含有酰胺基的脂肪族氨基酸是Asn和Gln,分子量为132.12和146.15。由图4和图5可知,当Asp和Glu侧链中的—OH基团被—NH2基团取代后,本来光谱差异不明显的天门冬酸和Glu,转变为Asn和Gln后近红外光谱发生了非常明显的改变。除与烷基相关的1 165和1 178 nm吸收峰与Asp和Glu相似外,其余的吸收峰均差异较大。天冬酰氨在1 556~1 560 nm内有较高的吸收峰,在1 700 nm附近只有几个较弱的吸收峰,而谷酰胺则分别在1 527 nm左右和1 722 nm左右有两个明显的吸收区域。两者光谱差异最大的是在2 000~2 502 nm,天冬酰氨在1 979 nm处有一个大的吸收峰,从2 084 nm区域开始直到2 500 nm吸收峰呈现多个峰值不高的小峰。而Glu除在1 994 nm处有一个大的吸收峰外,在2 225 nm处出现了一个更大的吸收峰。由图5可知,对于含有酰氨基的氨基酸,受侧链上—CH2基团的影响较大,其差异主要表现在N—H的一级倍频1 400~1 800nm和组合频1 900~2 502 nm区域。

图5 侧链含有酰胺基的脂肪族氨基酸1 000~2 502 nm近红外光谱图及其分子结构
2.1.6 侧链显碱性的脂肪族氨基酸
侧链显碱性的脂肪族氨基酸是Arg和Lys,分子量为174.20和146.19。由图6可知,Arg的侧链末端含有一个胍基,Lys的侧链末端只含有一个NH2基团,因此Arg的近红外光谱也相对复杂。图6中,1 000~2 502 nm范围也出现了四个近红外吸收谱区,分别为1 204,1 421,1 722和2 120~2 502 nm区域。Arg在1 000~2 502 nm处的近红外光谱吸收谱区较多,除1 202 nm的吸收峰外,在1 052 nm处也有一个明显的吸收。研究表明,NH2的二级倍频吸收位于1 035 nm[6],则Arg在1 052 nm的吸收峰有可能是NH2的二级倍频吸收峰位移到此处。Arg在1 538 nm处有一明显的吸收峰,而后直到1 817 nm范围内都是一些弱的吸收,而Lys谆在1 722 nm处有一强的吸收峰。研究表明,以四氯化碳为溶剂的二异丁胺在1 667~1 820 nm处呈现6个锯齿状的吸收峰[6],Lys在此范围内也出现类似吸收峰,因为二异丁胺也有和两个碳元素相连接的—NH基团,因此推测此吸收峰的出现与Arg的—NH基团有关。Arg和Lys在2 000~2 502 nm范围内的吸收峰也差异明显,Arg有两个较强的吸收峰区域,而Lys从2 120 nm后表现为多个高度相似的吸收峰。
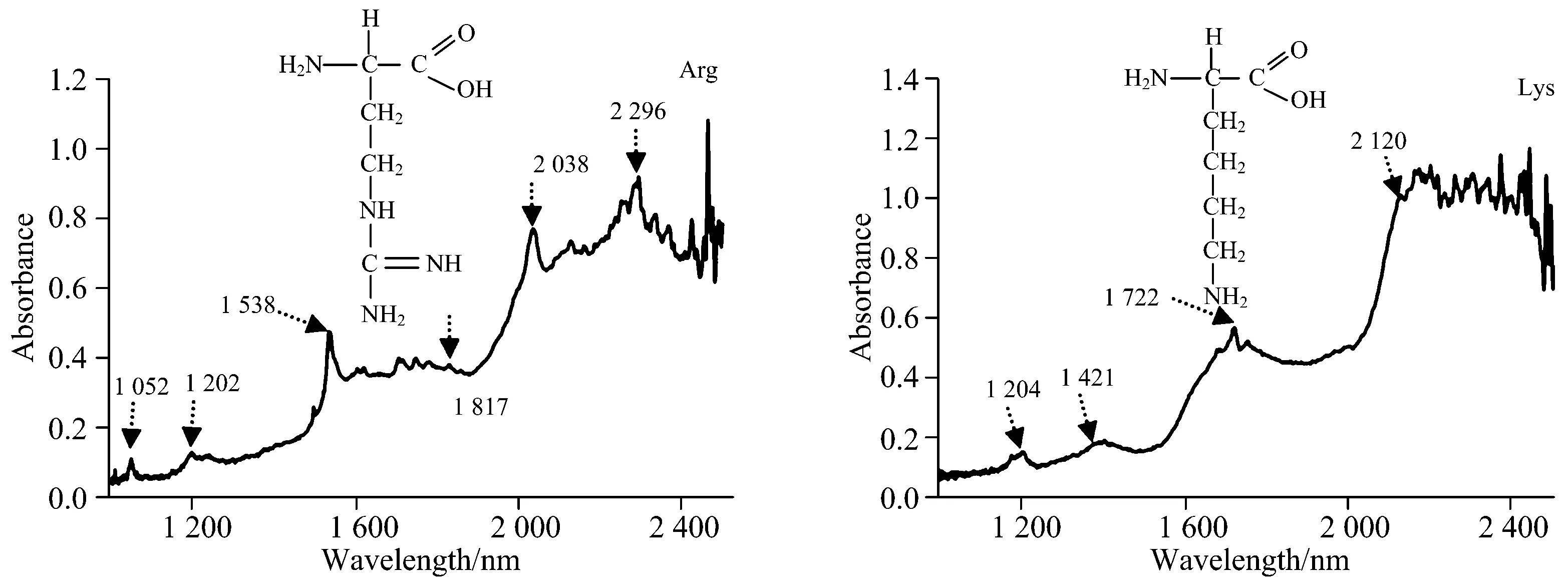
图6 侧链显碱性的脂肪族氨基酸1 000~2 502 nm近红外光谱图及其分子结构
2.2 芳香族氨基酸
芳香族氨基酸有Phe和Tyr,分子量为165.19和181.19。由图7可知,Tyr侧链上的苯环连有一个—OH,其近红外光谱也相对复杂的多,这是因为—OH基团降低了苯分子的对称性,导致更多振动吸收峰的出现[6]。在图7中,Phe和Tyr在1 138和1 137 nm处有一明显吸收峰,此吸收峰可能是烷基的二级倍频,在1 400 nm左右,有轻微的基线抬高,可能是烷基在此处的组合频受到侧链上苯环的影响所致。Phe在1 675 nm左右有一明显的吸收峰和两个弱吸收峰,而苯在1 670 nm处存在非红外活性伸缩振动的一级倍频吸收的双峰[6],Tyr在此区域内的两个吸收峰分别为1 601和1 682 nm。从2 086 nm开始,Tyr在此处有5外连续的吸收峰,呈现一个手掌的形状,除此之外,还在2 331 nm处有一尖的吸收峰,Phe在此区域内的峰形则相对变化不大,从2 160 nm个开始出现连续的波形吸收峰。研究发现,酚在1 920~2 100 nm间的一系列强的组合频吸收带均为OH的吸收,1 920和1 968 nm处的吸收峰是由OH伸缩振动与芳环间的相互作用产生的。2 020 nm处的吸收峰是OH伸缩振动和变形振动的组合频,2 054和2 090 nm可能是OH伸缩振动和与其他振动存在相互作用的C—O伸缩振动的组合频[6]。据此,推测Tyr自2 087 nm处开始的手指状吸收峰与苯环上的OH基团相关,因苯环上除连有OH基团外,还有对位上其他基团,因此吸收峰整体后移。

图7 芳香族氨基酸1 000~2 502 nm近红外光谱图及其分子结构

图8 杂环氨基酸1 000~2 502 nm近红外光谱图及其分子结构
2.3 杂环氨基酸
杂环氨基酸有Trp,His和Pro三种,分子量为204.23,155.16和115.13。如图8所示,Trp和His都是丙酸,侧链基团中的沼环均连接在第3碳原子上,吲哚基是Trp的特有化学基团,由吡咯与苯并联去掉一个氢原子构成。Trp的近红外光谱因含有苯环,因此和芳香簇氨基酸类似在1 680 nm也出现了一个明显的吸收峰。除此之外,Trp在1 505 nm处有一个较高的吸收峰,推测与吲哚基的出现有关。His的侧链杂环基团是咪唑基,显碱性,其近红外光谱吸光度值明显低于其余19种氨基酸,N—H基团在不同的物质中吸收峰出现的区域不同,通常出现在1 000 nm附近、1 430~1 620和1 950~2 100 nm等区域[7],且随着结合基团不同出现前后偏移,因此推测His在1 600~1 800 nm处出现的吸收峰与咪唑基相关。Pro是一种α-亚氨基酸,是α-氨基酸的侧链取代了自身氨基上的一个氢原子而形成的杂环结构。其近红外吸收光谱与大多数氨基酸相同,也分为1 160,1 362左右,1 650~1 700和2 162~2 502 nm四个区域。有研究表明,环状烷烃衍生物的一级倍频出现在1 660 nm附近[8-9],因此,Pro在1 160和1 362 nm与C—H基团的吸收峰相关,而1 686 nm附近的吸收峰与其杂环结构相关。
3 结 语
综上,20种氨基酸在1 000~2 502 nm区域有非常明显的近红外光谱吸收且差异显著。在1 050~1 200 nm区域和1 300~1 500 nm区域的吸收峰主要由C—H基团的二级倍频和组合频构成。因侧链基团的分子构成不同,在1 500~1 850和2 000~2 502 nm区域表现出各自特征吸收峰,故而可以利用此四个近红外光谱特征区域对氨基酸进行定量和定性分析。根据待测样品中的氨基酸构成,合理确定氨基酸近红外预测模型的光谱区域,提高模型预测的准确性,促进近红外光谱学在食品、药品、饲料、医学等方面的推广应用。
[1] BAO Hai-xia,DAI Xin-hua(暴海霞,戴新华).Chemical Reagents(化学试剂),2013,35(7):577.
[2] YU Xiao-lan,XU Ning,HE Yong(於筱岚,徐 宁,何 勇).Spectroscopy and Spectral Analysis(光谱学与光谱分析),2014,34(9):2377.
[3] WU Jian-guo,SHI Chun-hai,ZHANG Xiao-ming,et al(吴建国,石春海,张小明,等).Acta Agronomica Sinica(作物学报),2003,29(5):688.
[4] REN Ji-ping,HUANG Su-xi(任继平,黄苏西).China Feed(中国饲料),2005,5:24.
[5] SHI Yan,WANG Gang-li,LIN Rui-chao(石 岩,王钢力,林瑞超).Chinese Journal of Pharmaceutical Analysis(药物分析杂志),2007,27(1):90.
[6] Jerry Workman Jr,Lois Weyer.Practical Guide to Interpretive Near-Infrared Spectroscopy(近红外光谱解析实用指南).Translated by CHU Xiao-li,XU Yu-peng,TIAN Gao-you (褚小立,许育鹏,田高友,译).Beijing:Chemical Industry Press(北京:化学工业出版社),2009.8.
[7] Goddu R F.Advances in Analytical Chemistry and Instrumentation,1960,1:347.
[8] Gassman P G.Chem Ind (London),1962,3:740.
[9] Gassman P G,Zalar F V.Journal of Organic Chemistry,1966,31:166.
*Corresponding author
(Received Nov.5, 2015; accepted Mar.23, 2016)
Correlations Between Near Infrared Spectra and Molecular Structures of 20 Standard Amino Acids
TAO Lin-li1, HUANG Wei1, YANG Xiu-juan1, CAO Zhi-yong2, DENG Jun-ming1, WANG Shan-shan1, MEI Feng-yan1,ZHANG Ming-wei1, ZHANG Xi1*
1.Faculty of Animal Science and Technology, Key Laboratory of Animal Nutrition and Feed Science of Yunnan Province, Yunnan Agricultural University, Kunming 650201, China 2.College of Basic Science and Information Engineering, Yunnan Agricultural University, Kunming 650201, China
The objective of the research was to study the correlations between near infrared spectra and molecular structures of 20 standard amino acids.It was to establish the theoretical foundation for widely use of the amino acids near infrared spectra in animal science, food and medicine.Measurement of the near infrared spectra was performed using a Shimadzu Fourier transform infrared spectrophotometer IRPrestige-21, with FlexIRTM Near-Infrared Fiber Optics module.The spectrometric data acquisitions were performed by Shimadzu IRsolution 1.50 system.The spectrometric room temperature was 25 ℃ and humidity was 38%.Spectra of 20 amino acid standard substances were collected by reflectance mode from 1 000 to 2 502 nm in 8 cm-1increment.Each sample was scanned in three times, each scan was 50 cycles, and the average value of three times scan result was used for each sample.Based on the differences of amino acids side chains, the correlations between near infrared spectra and molecular structures were compared in the fat family amino acids, aromatic amino acids and heterocycle amino acids.The result shows that all 20 standard amino acids have very specific absorption line patterns.It is distinctly different in these absorption line patterns.Near-infrared spectra of high molecular weight fat family amino acids are affected by side chains.Near-infrared spectra of glycine are affected by carboxyl and amino.The differences of near-infrared spectra between two aromatic amino acids are in benzene ring.—OH groups on benzene ring of tyrosine lower the symmetry of benzene molecule.It leads to the emergence of more vibration absorption.Near-infrared spectra of heterocycle amino acids are distinctly different in 1 000~2 502 nm because of side chains.In conclusion, there are four different characteristic spectral regions.The first one is 1 050~1 200 nm spectral region which is composed mainly of second-order frequency doubling of C—H group.The second is 1 300~1 500 nm spectral region which is composed mainly of combination tune of C—H group.Due to side chains of amino acid have different molecular structure, they yield a complete set of near infrared fingerprint spectra between 1 600~1 850 and 2 000~2 502 nm.In another words, these four characteristic regions of near infrared spectra can be used to build the model of qualitative analysis and quantitative analysis for amino acid, and improves the accuracy and reliability of model.
Near infrared reflectance spectroscopy (NIRS); Amino acids; Molecular structures; Standard substance
2015-11-05,
2016-03-23
国家高技术研究发展专项(863计划)项目(2011AA100305),云南省科技创新工程项目(2008LA020)和云南省应用基础研究计划面上项目(2011FB056)资助
陶琳丽,1974年生,云南农业大学动物科学技术学院副教授 e-mail: tllkm@qq.com *通讯联系人 e-mail: 943727490@qq.com
O434.3
A
10.3964/j.issn.1000-0593(2016)09-2766-08
猜你喜欢
杂志排行
光谱学与光谱分析的其它文章
- 基于高光谱的环首都地区数字高程模型与可吸入颗粒物的空间相关性研究
- 大豆硒蛋白构象的光谱法研究
- Synthesis of La-Co-O Mixed Oxides via Polyethylene Glycol-Assisted Co-Precipitation Method for Total Oxidation of Benzene
- Mercury in Sclerotia of WolfiporiaExtensa (Peck) Ginns Fungus Collected Across of the Yunnan Land
- 可拓神经网络模式识别对成品油的鉴别与测量
- Spectroscopic Analysis of Organophosphorus Pesticides Using Colorimetric Reactions
