华南地区低有机质污泥碱性厌氧产酸(VFAs)性能机理与菌群分析
2016-07-12姚创刘晖罗晓栋岳建雄李诗瑶陈大志广东省工程技术研究所广东省水环境污染控制重点实验室广东广州50440仲恺农业工程学院环境科学与工程学院广东广州505
姚创,刘晖,罗晓栋,岳建雄,李诗瑶,陈大志(广东省工程技术研究所,广东省水环境污染控制重点实验室,广东 广州50440;仲恺农业工程学院环境科学与工程学院,广东 广州505)
华南地区低有机质污泥碱性厌氧产酸(VFAs)性能机理与菌群分析
姚创1,刘晖2,罗晓栋1,岳建雄1,李诗瑶1,陈大志1
(1广东省工程技术研究所,广东省水环境污染控制重点实验室,广东 广州510440;2仲恺农业工程学院环境科学与工程学院,广东 广州510225)
摘要:目前,我国利用剩余污泥产挥发性脂肪酸(VFAs)的碳源化研究主要集中在对华东和北方地区污水厂污泥的利用,而采用华南地区污水厂剩余污泥进行产酸的研究较少,且对其开展实际现场产酸特性的研究更是少见报道。采用半连续式厌氧产酸反应器,对广东省肇庆市鼎湖区污水处理厂剩余污泥产挥发性脂肪酸的系统特性进行了试验研究。研究结果表明,系统在碱性条件下(pH=10.0)具有良好的水解产酸性能。VFAs对应的COD (VFAs-COD)占SCOD的比重较大,平均占比73.89%,高于现有同类研究结果2%~15%。同时仅伴随着少量的多糖和蛋白质积累(对应的COD占SCOD的比重为5%~15%)。乙酸为主要的VFAs组成成分,平均占比51.43%,系统优势菌几乎全部为产酸菌,包括Acetoanaerobium sp.、Clostridiales bacterium Z-810、Proteinivorax tanatarense strain Z-910、Tissierella sp.,其中Acetoanaerobium sp.、Clostridiales bacterium Z-810在同类研究中暂无报道。系统产酸过程中可实现33.5%的污泥减量率。
关键词:剩余污泥;碱性产酸;溶解性有机物;挥发性脂肪酸;污泥减量;菌群
2015-07-31收到初稿,2015-10-06收到修改稿。
联系人:陈大志。第一作者:姚创(1984—),男,博士研究生,工程师。
Received date: 2015-07-31.
Foundation item: supported by the Special Scientific Research of Guangzhou Science and Technology Plan Projects (Common Project) (201510010283).
引 言
已有研究表明,乙酸等短链挥发性脂肪酸是提高城市污水处理系统中营养物去除效果(尤其是除磷)的优异碳源[1-2]。因此,将剩余污泥厌氧发酵过程控制在水解酸化阶段,以获得VFAs作为低碳源污水处理系统氮、磷去除所需补充碳源的研究(碳源化利用),于近年来逐渐兴起成为热点[3-5]。目前,实现污泥发酵产VFAs的方法包括酸碱处理[6]、热碱处理[7-8]、超声波处理[9]、碱加微波预处理[10]等,其中,热、超声和微波等存在操作能耗较高,且工程放大应用较困难等问题,因而采用单独强碱来控制厌氧系统产VFAs被认为是一种简单高效的方式。科研人员亦针对其影响因素[温度[11]、停留时间(HRT/SRT[12])、污泥类型[13]等]开展了一系列的研究,取得了积极的成果。
但是,我国关于污泥碱性厌氧产VFAs的研究主要集中在对华东和北方地区的剩余污泥利用,而针对华南地区污水厂剩余污泥产酸的研究很少,尤其是实际现场产酸特性研究暂未见报道。与上述地区的污水厂相比,华南地区污水处理厂的进水含碳量、剩余污泥有机质含量均更低,这些差异均会对污泥碱性产酸的碳源化利用性能产生显著影响。
因此,本文在广东省肇庆市鼎湖区污水处理厂建立了一套厌氧产酸系统,利用污水厂实际的剩余污泥开展碱性产酸的碳源转化系统特性研究,探讨低有机质污泥的产酸特点、稳定性与机制,以求为该技术在华南地区的工程化应用打下理论与数据基础。
1 试验材料与方法
1.1试验材料
1.1.1剩余污泥试验用剩余污泥取自广东省肇庆市鼎湖区污水处理厂的污泥回流泵房,污水厂的处理工艺为A2/O微曝氧化沟。剩余污泥经泵提升,经过预浓缩后进入厌氧产酸反应器,作为试验用泥。进泥的主要性质如表1所示。
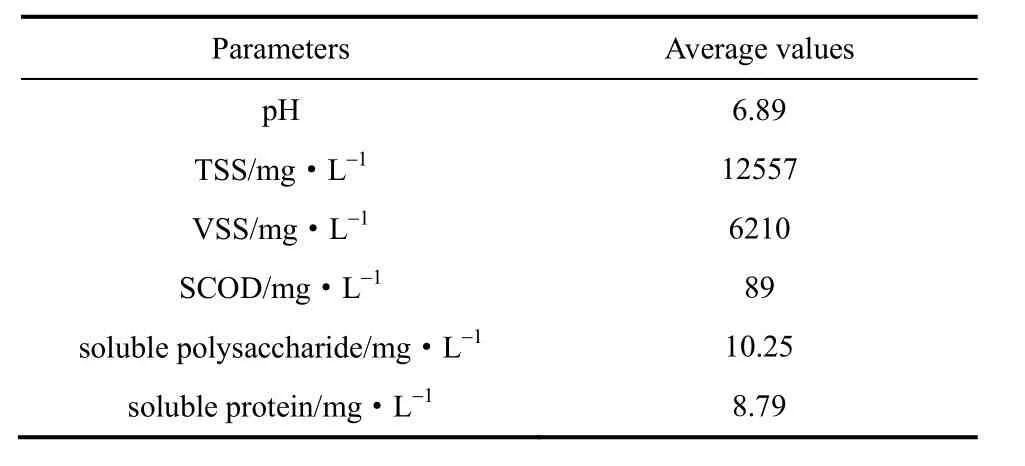
表1 剩余污泥主要性质Table 1 Characteristics of excess sludge
1.1.2试验装置采用半连续式运行方式进行污泥厌氧产酸系统现场试验。试验装置如图1所示。厌氧罐内壁为不锈钢材质,内径为0.9 m,总体积为0.9 m3。厌氧罐内壁外有一注水夹层,通过外接加热循环系统对厌氧罐进行控温。为使产酸过程中泥水充分混合,厌氧罐中间设置有不锈钢搅拌桨,采用变频器(VFD-EL)调节转速,控制顶端的三相电机驱动。厌氧罐上端设置有进泥口,内部设置有超声波液位计、温度电极(PT100)和pH电极(PH6308PT),以监控系统的进出泥量、温度和pH。厌氧罐下端设置有电磁阀和不锈钢污泥泵,用以控制厌氧罐的排泥。
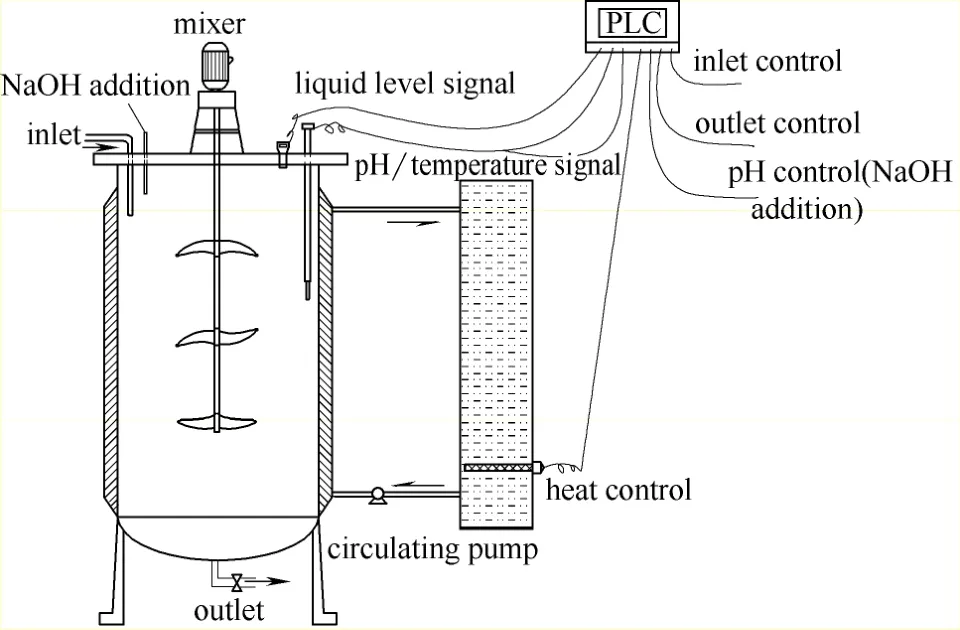
图1 试验装置Fig.1 Experimental apparatus
1.2试验方法
1.2.1反应器运行厌氧产酸系统日常运行采用PLC(三菱FX1S-20MR-001)自动控制,污泥停留时间(SRT)为8 d。系统每日定时开启出泥电磁阀和排泥泵,从厌氧罐排出混合液至指定液位。之后顺序开启进泥泵,将预浓缩后的污泥泵入罐体内至指定液位。进、出泥过程中,搅拌器一直开启(转速50 r·min-1),以使系统混合均匀,并保持稳定的污泥停留时间。进泥完毕后,系统根据监测到的pH自动开启加碱泵(氢氧化钠),保持系统pH为10.0左右,进入正常的产酸过程。同时,根据实际环境温度情况开启自动控温功能(系统启动时间为10月下旬)。
1.2.2检测方法进、出系统的污泥样品均先经离心机(转速为8000 r·min-1)离心分离,上清液过孔径为0.45 μm的滤膜,取滤液检测溶解性物质含量,包括:COD(SCOD)、挥发性脂肪酸(VFAs)、多糖、蛋白质。
其中,总悬浮固体(TSS)、挥发性悬浮固体(VSS)、SCOD测定采用标准方法[14]。多糖测定采用苯酚-硫酸法[15],蛋白质测定采用考马斯亮蓝法[16]。VFAs测定采用气相色谱法[17]。
1.2.3DNA提取、扩增与DGGE分析
(1) 总DNA提取
进泥、系统稳定后的出泥样品经0.22 μm的滤膜过滤后,采用CTAB法提取滤膜上样品的总DNA。向样品中加入5 ml CTAB提取液(100 mmol·L-1Tris·Cl,100 mmol·L-1EDTA-Na2,200 mmol·L-1NaCl, 2% CTAB,pH 8.0)中,37℃振荡45 min。加入20%的SDS至终浓度为2%,65℃水浴2 h。12000 r·min-1,10 min离心,收集上清。上清用等体积的酚:氯仿:异戊醇(25:24:1)抽提2次,加入终浓度1/10体积的醋酸钠(pH 5.2)及0.6倍体积异丙醇,4℃沉淀1 h。12000 r·min-1冷冻离心20 min,收集沉淀,用70%乙醇洗涤2次,晾干后溶于50 μl TE(pH 8.0)。测定提取的总DNA浓度,用TE将其稀释至100 ng·ml-1。
(2)16S rDNA的V3区PCR扩增
用16S rDNA通用引物27F/1492R进行第一轮扩增(27F:5′AGAGTTTGATCCTGG CTCAG3′; 1492R:5′TACGACTTAACCCCA ATCGC3′),后将PCR产物稀释50倍后作为模板进行第二轮扩增,扩增引物为F357-GC/518R(F357-GC: 5′CGCCCGCCG CGCGCGGCGGGCGGGGCGGGGGCACGGGGGG CCTACGGGAGGCAGCAG3′; R518: 5′ATTACC GCGGCTGCTGG3′)。50 ml PCR反应体系包括1× Buffer(含2.0 mmol·L-1MgCl2),dNTP 200 mmol·L-1,引物各0.2 mmol·L-1,Taq酶2.5 U,模板DNA 1 ml。反应程序为:94℃预变性5 min; 30次循环[94℃ 30 s ;56℃ 30 s;72℃ 1.5 min (27F/1492R)/30 s (F357-GC/518R)];72℃ 10 min。取PCR产物各3 ml,用1%的琼脂糖凝胶进行电泳检测,凝胶成像系统拍摄电泳图谱。
(3)变性梯度凝胶电泳DGGE
采用Bio-Rad公司的D-Code突变检测系统对样品进行DGGE分析。所用的聚丙烯酰胺凝胶浓度为8%(丙烯酰胺:双丙烯酰胺=37.5:1),变性剂浓度为35%~70%(100%的变性剂为7 mol·L-1尿素,40%去离子甲酰胺)。在70 V电压下,60℃恒温,1×TAE中电泳14 h。电泳完毕后,用超纯水冲洗胶,然后将胶放进含1%Goldview的染液中,置于摇床上染色30 min后,凝胶成像系统拍摄图谱。
(4)条带回收与测序
选取较有代表性的条带,用洁净的手术刀片将目标DGGE条带完整地切下并装入1.5 ml离心管中,备用。用ddH2O漂洗切胶条带1次,后加入50 μl ddH2O,用枪头将凝胶压碎,于4 ℃存放过夜,以浸泡液为模板进行PCR扩增。取1 ml浸泡液为模板,采用引物F338/518R进行16S rRNA V3区扩增(F338: 5′CCTACGGGAGGCAGCAG3′),1%琼脂糖凝胶电泳检测,产物送Invitrogen上海分公司以引物F338进行测序。
2 结果与讨论
2.1SCOD的变化
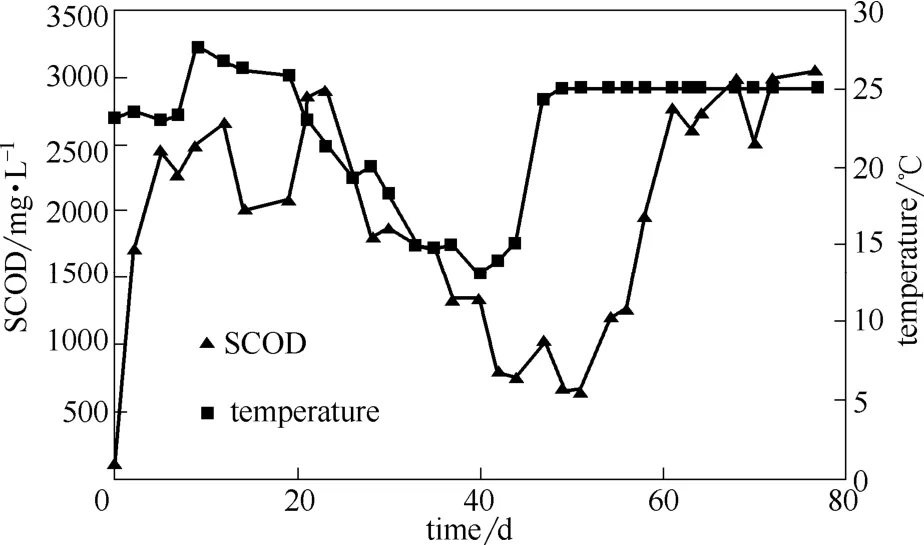
图2 SCOD变化曲线Fig.2 Variation curve of SCOD
剩余污泥在碱性条件和水解酶的作用下,会释放胞内外有机物质进入液相,使系统内的SCOD值增加(SCOD组成包括VFAs、多糖、蛋白质、腐殖酸等)。如图2所示,厌氧系统经过7 d左右,SCOD开始进入一个较高的水平,并在前25 d(未开启温控)内基本稳定,保持在2500 mg·L-1左右。之后,第26~47天(未开启控温),SCOD快速下降,最低降至745 mg·L-1(第47天),此时段,对应SCOD比产生速率从511.4 mg COD·(g VSS)-1迅速降低到150~200 mg COD·(g VSS)-1左右。从第47天开始(温度控制在25℃),系统的SCOD逐步恢复正常,保持在2507~3000 mg·L-1左右。
由上可知,在前25 d与48~77 d这两个时段里,系统稳定运行后的SCOD值差别不大,均可以实现有效的污泥水解。但是在中期的26~47 d,SCOD值显示出一个先下降后上升的U形谷底。分析发现,该时段主要运行参数(SRT、pH)与其他两个时段一致,唯一不同的是由于季节变化导致的天气变冷(该时段未开启温控系统,温度最低降至13℃),且图2中亦显示SCOD降低与温度下降基本保持同步。而已有研究表明,在15~55℃的范围内,温度降低不利于污泥破解后胞内外物质释放[11],温度降低亦会导致污泥水解酶的活性降低[18],从而使SCOD下降。因此,可以推知,本试验中,季节变化带来的温度下降(低于20℃)是造成中期SCOD值显著降低的主要原因,当温度处于20~25℃范围,系统可以取得较稳定的污泥水解效果。
2.2VFAs的变化
剩余污泥碱性产酸系统内,存在着能耐受强碱条件的产酸菌,可以将液相中的溶解性有机物质(如多糖、蛋白质等)转化成各类脂肪酸,此时产甲烷作用被抑制,从而实现VFAs积累。图3(a)结果表明,在厌氧系统启动的前两个星期,产酸发酵液中VFAs对应的浓度(VFAs-COD)就达到了1500~2000 mg COD·L-1,同时仅伴随着少量的多糖和蛋白质积累(仅占比5%~15%),这表明该时段整个系统的产酸性能较好,污泥水解过程中释放的多糖与蛋白质等有机物很快就被产酸菌利用产生VFAs[19]。与SCOD变化趋势一致,在26~47 d,产酸量亦出现了明显的降低(最低为629.39 mg COD·L-1),这是由于SCOD降低使液相中用于产酸的有机基质减少,同时产酸菌活性亦受到低温的不利影响[20]。当开启控温至25℃左右时,系统的产酸作用很快恢复,VFAs最高上升至2252.28 mg COD·L-1。总体来说,系统的VFAs占SCOD比重较大,平均占比73.89%,是SCOD主要组成成分。
图3(b)为系统中各单独VFA组分含量占VFAs含量的比值,结果表明,试验过程中各酸类物质在VFAs中的占比随着温度的变化,出现了一定程度的波动。但是,乙酸(HAc)始终为厌氧产酸系统中VFAs的主要组成成分,占VFAs总量的30.97%~68.04%,平均占比51.43%。丙酸则为仅次于乙酸的主要成分(平均占比为20.98%)。这一结果与Chen 等[21-22]采用污泥碱性产酸研究的结论是一致的。
上述结果表明,在本试验中,采用强碱性条件抑制厌氧系统的产甲烷过程并强化水解酸化作用,可以实现良好的短链脂肪酸积累效果(尤其是乙酸、丙酸)。
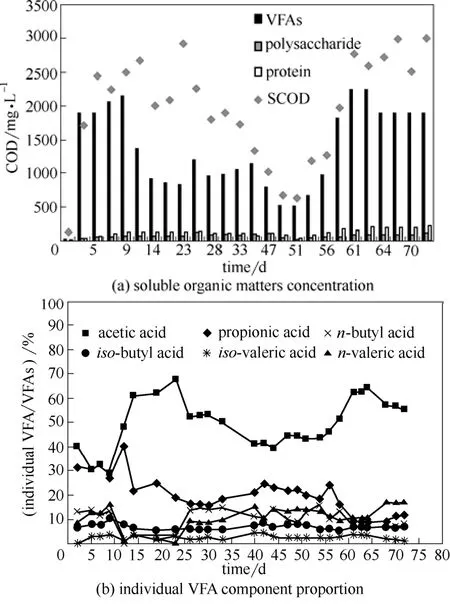
图3 VFAs变化Fig.3 Variation of VFAs
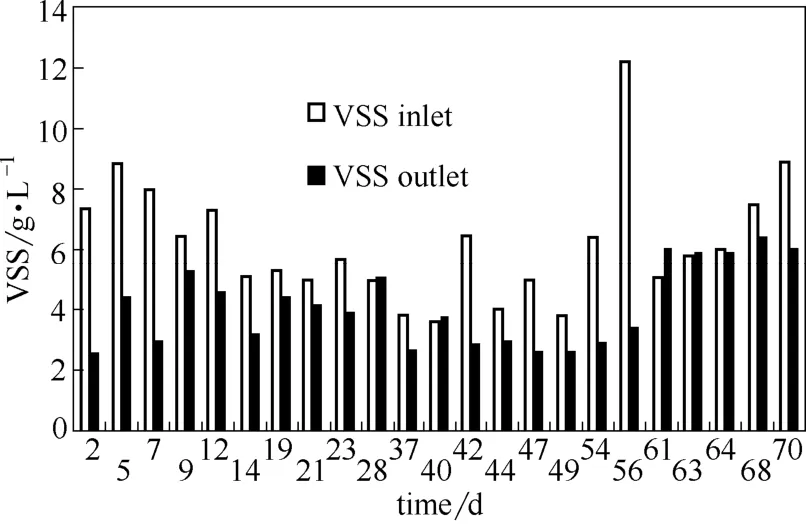
图4 进、出泥VSS变化Fig.4 VSS variations of inlet/outlet sludge
2.3VSS变化
污泥水解酸化过程中,强碱作用可以使污泥破碎以及胞外聚合物结构破坏,从而在释放胞内外物质的同时实现污泥减量。图4结果表明,系统运行过程中污泥减量效果明显,平均污泥减量率为33.5%,这表明,污泥水解作用在强碱性条件下得到了强化,从而实现了良好的污泥减量[23]。这点与Yuan等[24]对污泥水解产酸过程中的污泥减量效果类似,其研究中实现了23%~40%的污泥减量。而Gao等[25]采用两步碱性发酵产酸,最终实现了42.1%的污泥减量率,这是由于其采用两级碱处理强化污泥的破解,从而达到了较本试验更好的污泥减量率。尽管如此,本研究依然取得了可观的污泥减量效果。
2.4系统菌群分析
图5中的样品分别为进泥(样品A)和系统稳定后的污泥(样品B,第65天)。从图中可知,样品B的DGGE图谱条带数量减少,这表明在强碱(pH=10.0)条件下,一些无法耐受强碱的菌类被淘汰,从而使系统菌群的多样性有所下降。
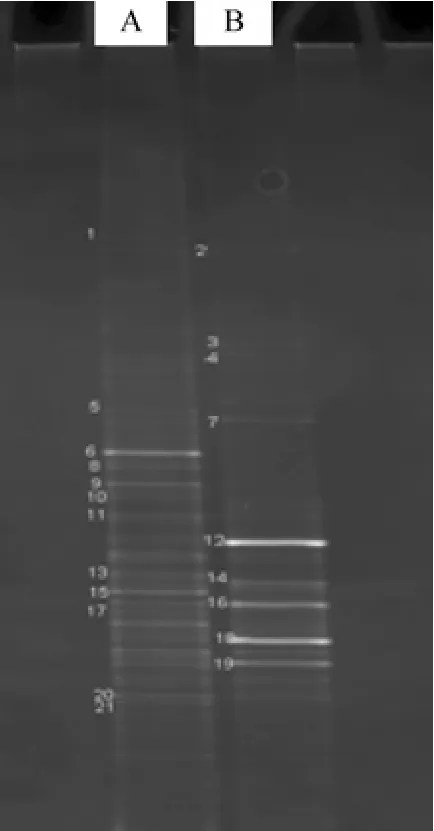
图5 DGGE图谱Fig.5 Profile of DGGE
样品A的图谱中,大多为生物脱氮除磷工艺的污泥中常见菌类,如动胶菌(条带6,Zoogloea remigera)、硝化菌(条带8,Candidatus nitrospira)、反硝化菌(条带11,Azoarcus denitrificians)等。样品B的图谱中,条带12、14、16、18、19亮度较高,代表了厌氧产酸反应器的主要微生物菌群。测序结果表明,条带12、14分别为Clostridiales bacterium Z-810、Proteinivorax tanatarense strain Z-910,这两种微生物均可在碱性厌氧条件下,利用蛋白质、二糖、丙酮等基质作为碳、氮和能量来源,用于产生直链或支链有机酸类物质[26]。条带16、19均为Tissierella sp.,该类菌可以利用有机物代谢产生乙酸、丁酸、氨氮、CO2等物质[27]。条带18为 Acetoanaerobium sp.,厌氧条件下可以利用H2和CO2产乙酸[28]。
DGGE结果亦表明,本研究中的厌氧碱性产酸系统优势菌类(条带12、14、16、18、19代表微生物)均属于Firmicutes(门),该菌门的许多微生物被认为是产酸作用的主要来源,这一结果在以往研究中已得到证实[11,21]。尽管如此,关于产酸系统菌群研究结果还是存在一定的差异,主要体现在产酸菌的种属不同,如Chen等[21]研究系统中Clostridium spp.的存在为主要的产有机酸来源,而Jie等[29]则发现Pseudomonas sp.可能在VFAs积累过程中发挥重要作用。本研究中Clostridiales bacterium Z-810 sp.、Acetoanaerobium sp.则是系统产酸作用的主要功能菌,但该菌种在现有类似污泥产酸系统中未见报道,即本文的产酸菌类型与其他类似系统相比具有特异性。
上述结果证实了在pH=10.0条件下,厌氧产酸反应器内产酸菌占据了优势,该类菌可以充分利用剩余污泥碱性破碎、水解产生的溶解性有机物产挥发性有机酸,从而保证了系统良好的产酸性能。其中,Acetoanaerobium sp.的大量存在实现了发酵液中较高的HAc占比。
3 污泥碱性厌氧产酸性能对比
表2中列出了江苏、哈尔滨两个地方的污泥碱性厌氧产酸研究结果,以此分别作为华东和北方地区的代表。从表中可以发现,肇庆污水处理厂的污泥VSS/TSS值明显低于上述其他两地,更低的VSS含量使其厌氧水解产酸性能显示出明显差异。
众所周知,在强碱抑制产甲烷菌活性的条件下,作为厌氧产酸的限制性步骤,系统SCOD主要来源于污泥破解释放的胞内物质、污泥吸附的有机物和胞外聚合物(EPS)的解离,产生的SCOD随即被产酸菌利用,从而转化成挥发性脂肪酸。Li等[5]的研究中,进泥TSS和VSS浓度均高于本试验,SCOD比产生速率(0.426)亦明显高于本试验结果(0.319)。分析认为,该差异主要是由于VSS更高,污泥中水解酸化菌数量更多,同时,污泥自身、胞外及吸附的可利用有机物(如EPS中有机物含量等)更多[11,30]。在强碱破解和水解酶作用下,胞内外结构破坏后可释放更多的有机物进入液相中,并迅速被更多的水解酸化菌利用。因此,本试验更低的VSS含量使SCOD比产生速率较低,对应的VFAs比产生速率亦更低(0.214)。尽管如此,本试验的VFAs/SCOD、HAc/VFAs比值均更高。
与Li等[11]的研究相比,两者进泥TSS差别不大,但本试验中污泥VSS/TSS更低,即有机质含量更低,因此,对应的SCOD、VFAs比产生速率更小,发酵液中多糖、蛋白质浓度亦明显更低。两者的VFAs/SCOD比值相差不大,但是本文中HAc/VFAs明显更高。
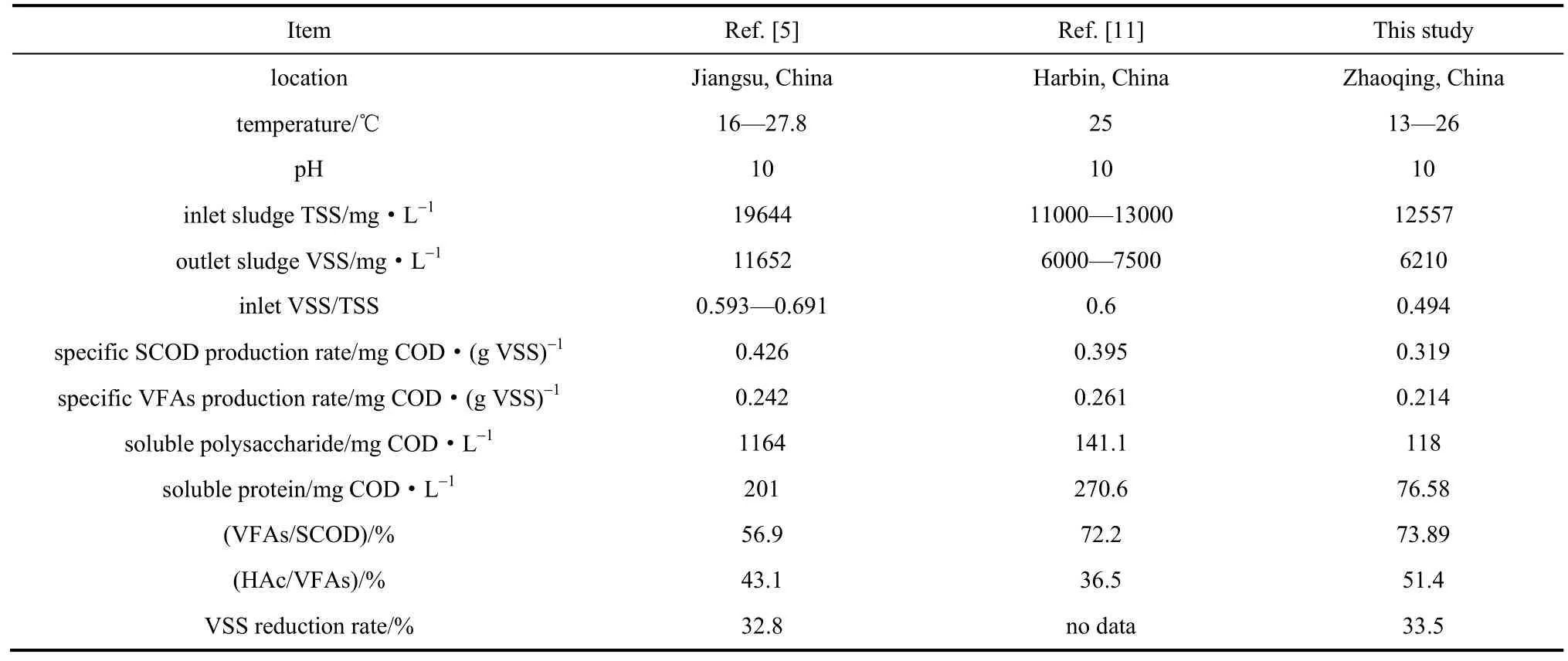
表2 污泥厌氧产酸性能对比Table 2 Comparison of anaerobic VFAs production
值得一提的是,尽管本研究中的SCOD、VFAs比产生速率较其他两研究更低,但是VFAs/SCOD、HAc/VFAs比值却更高,这可能跟系统菌群结构有关。即由于各研究的试验地点不一样,不同地区的污泥物化性质、有机质含量及组分构成等必然存在差别,即使控制相同的运行条件(如SRT、pH等),系统的产酸菌数量、产酸菌类型等依然可能存在差别(如本研究中的产酸菌类型就与其他研究不同),而不同产酸菌的生理特性(如比生长速率、底物利用能力等)会存在差异,最终使各研究结果(VFAs含量、VFAs组分占比)不一样。这方面需要该领域研究人员进行进一步的研究,揭示不同污泥碱性产酸菌的特性差异。
4 结 论
(1)采用半连续式反应器进行污泥碱性产酸(pH=10.0,SRT=8 d),系统发酵液中VFAs-COD 占SCOD的比重较大,平均占比73.89%,该结果高于其他同类研究2%~15%,可以实现良好的产酸效果。发酵液VFAs组成成分中,乙酸和丙酸为主要成分,分别占VFAs的比重为51.43%、20.98%,高于现有同类研究结果。
(2)剩余污泥产酸过程中,系统取得明显的污泥减量效果,减量率达到33.5%。
(3)剩余污泥产酸体系中优势菌群为Acetoanaerobium sp.、Clostridiales bacterium Z-810、Proteinivorax tanatarense strain Z-910、Tissierella sp.,该菌群结构保证了系统具有良好的产酸性能。其中Acetoanaerobium sp.、Clostridiales bacterium Z-810在同类研究中暂无报道。
(4)尽管南方地区冬季温度较华东和北方地区更高,但是温度对系统性能影响依然明显,在实际应用过程中,应充分考虑控温系统的设计,以保持在冬季低温时(<20℃)稳定的水解产酸效果。
References
[1]TONG J,CHEN Y G. Recovery of nitrogen and phosphorus from alkaline fermentation liquid of waste activated sludge and application of the fermentation liquid to promote biological municipal wastewater treatment [J]. Water Research,2009,43 (12): 2969-2976.
[2] 苗志加,薛桂松,翁冬晨,等. 不同碳源对EBPR系统厌氧计量学参数的影响 [J]. 化工学报,2012,63 (12): 4034-4041. MIAO Z J,XUE G S,WENG D C,et al. Influence of different carbon sources on anaerobic stoichiometry parameters of EBPR system [J]. CIESC Journal,2012,63 (12): 4034-4041.
[3]LONGO S,KATSOU E,MALAMIS S,et al. Recovery of volatile fatty acids from fermentation of sewage sludge in municipal wastewater treatment plants [J]. Bioresource Technology,2015,175: 436-444.
[4] YUAN H Y,CHEN Y G,ZHANG H,et al. Improved bioproduction of short-chain fatty acids (SCFAs) from excess sludge under alkalineconditions [J]. Environmental Science & Technology,2006,40 (6): 2025-2029.
[5]LI X,CHEN H ,HU L F,et al. Pilot-scale waste activated sludge alkaline fermentation,fermentation liquid separation,and application of fermentation liquid to improve biological nutrient removal [J]. Environmental Science & Technology,2011,45 (5): 1834-1839.
[6]YUAN Y,PENG Y Z,LIU Y,et al. Change of pH during excess sludge fermentation under alkaline,acidic and neutral conditions [J]. Bioresource Technology,2014,174: 1-5.
[7]SUN X Y,WANG W,CHEN C,et al. Acidification of waste activated sludge during thermophilic anaerobic digestion [J]. Procedia Environmental Sciences,2012,16: 391-400.
[8]LIU X G,DONG B,DAI X H. Hydrolysis and acidification of dewatered sludge under mesophilic,thermophilic and extreme thermophilic conditions: effect of pH [J]. Bioresource Technology,2013,148: 461-466.
[9]YAN Y Y,FENG L Y,ZHANG C J,et al. Ultrasonic enhancement of waste activated sludge hydrolysis and volatile fatty acids accumulation at pH 10.0 [J]. Water Research,2010,44 (11): 3329-3336.
[10]YANG Q,YI J,LUO K,et al. Improving disintegration and acidification of waste activated sludge by combined alkaline and microwave pretreatment [J]. Process Safety and Environmental Protection,2013,91 (6): 521-526.
[11]LI X L,PENG Y Z,REN N Q,et al. Effect of temperature on short chain fatty acids (SCFAs) accumulation and microbiological transformation in sludge alkaline fermentation with Ca(OH)2adjustment [J]. Water Research,2014,61: 34-45.
[12]FENG L Y,WANG H,CHEN Y G,et al. Effect of solids retention time and temperature on waste activated sludge hydrolysis and short-chain fatty acids accumulation under alkaline conditions in continuous-flow reactors [J]. Bioresource Technology,2009,100 (1): 44-49.
[13]YUAN Q,BARANOWSKI M,OLESZKIEWICZ J A. Effect of sludge type on the fermentation products [J]. Chemosphere,2010,80 (4): 445-449.
[14]State Environmental Protection Administration of China. Monitoring and Analytic Methods of Water and Wastewater [M]. 4th ed. Beijing: Environmental Science Press of China,2002.
[15]DUBOIS M,GILLES K A,HAMILTON J K. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry,1956,28 (3): 350-356.
[16]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry,1976,72 (1/2): 248-254.
[17]CHEN Y G,LIU K,SU Y L,et al. Continuous bioproduction of short-chain fatty acids from sludge enhanced by the combined use of surfactant and alkaline pH [J]. Bioresource Technology,2013,140: 97-102.
[18]YAN S T,MIYANAGA K,XING X H,et al. Succession of bacterial community and enzymatic activities of activated sludge by heat-treatment for reduction of excess sludge [J]. Biochemical Engineering Journal,2008,39 (3): 598-603.
[19]HUANG L,CHEN B,PISTOLOZZI M,et al. Inoculation and alkali coeffect in volatile fatty acids production and microbial community shift in the anaerobic fermentation of waste activated sludge [J]. Bioresource Technology,2014,153: 87-94.
[20]JIANG J G,ZHANG Y J,LI K,et al. Volatile fatty acids production from food waste: effects of pH,temperature,and organic loading rate [J]. Bioresource Technology,2013,143: 525-530.
[21]ZHANG P,CHEN Y G,ZHOU Q,et al. Understanding short-chain fatty acids accumulation enhanced in waste activated sludge alkaline fermentation: kinetics and microbiology [J]. Environmental Science & Technology,2010,44 (24): 9343-9348.
[22]CHEN Y G,JIANG S,YUAN H Y,et al. Hydrolysis and acidification of waste activated sludge at different pHs [J]. Water Research,2007,41 (3): 683-689.
[23]DOĞAN I,SANIN F D. Alkaline solubilization and microwave irradiation as a combined sludge disintegration and minimization method [J]. Water Research,2009,43 (8): 2139-2148.
[24]YUAN Q,SPARLING R,OLESZKIEWICZ J A. Waste activated sludge fermentation: Effect of solids retention time and biomass concentration [J]. Water Research,2009,43 (20): 5180-5186.
[25]GAO Y Q,PENG Y Z,ZHANG J Y,et al. Biological sludge reduction and enhanced nutrient removal in a pilot-scale system with 2-step sludge alkaline fermentation and A2/O process [J]. Bioresource Technology,2011,102 (5): 4091-4097.
[26]KEVBRIN V,BOLTYANSKAYA Y,ZHILINA T,et al. Proteinivorax tanatarense gen. nov.,sp. nov.,an anaerobic,haloalkaliphilic,proteolytic bacterium isolated from a decaying algal bloom,and proposal of Proteinivoraceae fam. nov [J]. Extremephiles,2013,17 (5): 747-756.
[27]HARMS C,SCHLEICHER A,COLLINS M D,et al. Tissierella creatinophila sp. nov.,a gram-positive,anaerobic,non-spore-forming,creatinine-fermenting organism [J]. International Journal of Systematic Bacteriology,1998,48: 983-993.
[28]SLEAT R,MAH R A,ROBINSON R. Acetoanaerobium noterae gen. nov.,sp. nov.: an anaerobic bacterium that forms acetate from H2and CO2[J]. International Journal of Systematic and Evolutionary Microbiology,1985,35: 10-15.
[29]JIE W G,PENG Y Z,REN N Q,et al. Volatile fatty acids (VFAs) accumulation and microbial community structure of excess sludge (ES) at different pHs [J]. Bioresource Technology,2014,152: 124-129.
[30]XIONG H L,CHEN J L,WANG H,et al. Influences of volatile solid concentration,temperature and solid retention time for the hydrolysis of waste activated sludge to recover volatile fatty acids [J]. Bioresource Technology,2012,119: 285-292.
Mechanism and microbial community analysis of anaerobic acid production (VFAs) by low carbon sludge in South China at alkaline condition
YAO Chuang1,LIU Hui2,LUO Xiaodong1,YUE Jianxiong1,LI Shiyao1,CHEN Dazhi1
(1Guangdong Research Institute of Engineering and Technology,Guangdong Provincial Key Laboratory of Water Environment Pollution Control,Guangzhou 510440,Guangdong,China;2School of Environmental Science and Engineering,Zhongkai University of Agriculture and Engineering,Guangzhou 510225,Guangdong,China)
Abstract:Nowadays,the researches of VFAs production by excess sludge focused mainly on the utilization of the excess sludge from wastewater treatment plant (WWTP) in east and north areas of China,and few on the sludge in south China. Meanwhile,the related on-site experimental research for VFAs production property by sludge from WWTP in south China was rarely reported. Research on VFAs production by excess sludge was conducted at alkaline condition by semi-continuous anaerobic reactor,which was located at Dinghu wastewater treatment plant in Zhaoqing,Guangdong Province. The results showed that great hydrolysis and acidification properties of the system could be achieved at alkaline condition (pH=10.0). The percentage of VFAs-COD/SCOD was 73.89% in average,which was about 2%—15% higher than that of existing similar researches. Meanwhile,only small amount of polysaccharide and protein were accumulated (5%—15% of SCOD). Acetic acid was the maincomponent of VFAs with the proportion of 51.43%. And the dominant microbial species in the system were all nearly acid production microorganisms including Acetoanaerobium sp.,Clostridiales bacterium Z-810,Proteinivorax tanatarense strain Z-910 and Tissierella sp.,among which Acetoanaerobium sp. and Clostridiales bacterium Z-810 were not reported in other similar researches. The excess sludge reduction rate of 33.5% could be achieved.
Key words:excess sludge; alkaline fermentation; SCOD; VFA; sludge reduction; microbial community
DOI:10.11949/j.issn.0438-1157.20151230
中图分类号:X 703
文献标志码:A
文章编号:0438—1157(2016)04—1565—07
基金项目:广州市科技计划项目科学研究专项(一般项目)(201510010283)。
Corresponding author:CHEN Dazhi,gyshuanjing@163.com
