面筋蛋白外啡肽B5对传染性支气管炎灭活疫苗免疫效果的影响
2016-07-12周业飞周梅仙
周业飞,周梅仙
(南京晓庄学院食品科学学院,南京 211171)
面筋蛋白外啡肽B5对传染性支气管炎灭活疫苗免疫效果的影响
周业飞,周梅仙
(南京晓庄学院食品科学学院,南京 211171)
摘要:麦谷蛋白源外啡肽B5来源于麦谷蛋白酶解产物,具有阿片样活性。作者通过进一步优化化学合成工艺制备外啡肽B5,并将其添加到传染性支气管炎病毒(IBV)H120株灭活疫苗中,免疫后21 d(35日龄) 采用IBV M41株病毒液进行点眼、滴鼻攻毒。通过测定免疫仔鸡的生产性能、淋巴细胞增殖水平、血清抗体水平、临床症状及组织病理学变化等指标,评价外啡肽B5的应用效果。结果显示,经过化学合成工艺优化后获得了高纯度的外啡肽B5(HPLC浓度大于98%),7~35日龄肉鸡的平均体增重试验组比对照组显著提高13.8%,料肉比试验组比对照组显著降低15.1%;同时一定浓度的外啡肽B5能够诱导肉仔鸡产生较强的淋巴细胞增殖反应(P<0.01),免疫鸡群抗体水平显著高于对照组,在IBV M41株攻毒试验中,试验组可以显著减轻病毒感染肉仔鸡临床症状,肺和肾无组织病理学变化,免疫保护率达到96.7%。外啡肽B5可望开发成一种新型动物功能性饲料添加剂或动物疫苗佐剂。
关键词:面筋蛋白;外啡肽B5;功能性饲料添加剂;动物疫苗佐剂
目前,疫苗接种是预防动物传染性疾病最有效的手段之一,对动物疫苗的生产工艺研究具有重大的社会和经济效益。佐剂是绝大部分疫苗特别是灭活疫苗不可或缺的一部分,它属于一种非特异性免疫增强剂,先于抗原使用或与抗原混合使用后,可增强机体对该抗原的免疫反应或改变免疫应答的类型[1]。比起单独使用抗原进行免疫的方式,将佐剂配合抗原进行免疫,不仅可以减少抗原的使用量,而且可以提高机体抗体水平,达到有效免疫保护。因此佐剂的开发研制,也成为新型疫苗发展的必然趋势[2]。生产实践中,多来源、多途径地开发低廉高效、速效、长效的佐剂系统,成为动物疫苗行业重要的发展环节之一。
阿片肽是一种神经免疫肽,广泛调控机体神经系统、内分泌系统及免疫系统,分为内源性阿片肽和外源性阿片肽。内源性阿片肽是在体内合成,存在于动物体脑、神经和外周组织中的吗啡样作用物质,目前主要有脑啡肽、内啡肽、强啡肽、孤啡肽和内吗啡肽等[3]。随后科学家们又发现麦谷蛋白和酪蛋白的胃蛋白酶酶解产物同样具有阿片样活性,由于这些阿片肽均来自外源性食物,其阿片活性同吗啡一样能被纳洛酮(一种阿片拮抗剂)所逆转,所以称为外源性阿片肽,简称外啡肽(exorphine)[4]。
麦谷蛋白外啡肽B5是从麦谷蛋白酶解物中分离纯化得来,分子式为C30H38N6O7,相对分子质量约为594.67 u(图1)。对其生物学活性功能进行了探索,目前已发现可以延缓各种动物的胃排空,抑制肠内容物的转移;调控内分泌作用,引起血清胰岛素、催乳素和生长抑素含量显著升高,还能影响痛觉抑制系统、情感和记忆过程等功能[5-6]。S.Fukudome等[7]用竞争性ELISA方法评定B5的免疫活性,并比较了其他几种麦谷外啡肽的免疫活性,结果发现,不同蛋白酶酶解得到的外啡肽尽管其阿片活性相同,但免疫活性却大不相同。从本研究前期申报的国家发明专利“一种生物活性小肽的合成方法及其作为畜禽饲料添加剂的用途”并获得授权来看,外啡肽B5作为动物功能性饲料添加剂还是首次被报道。
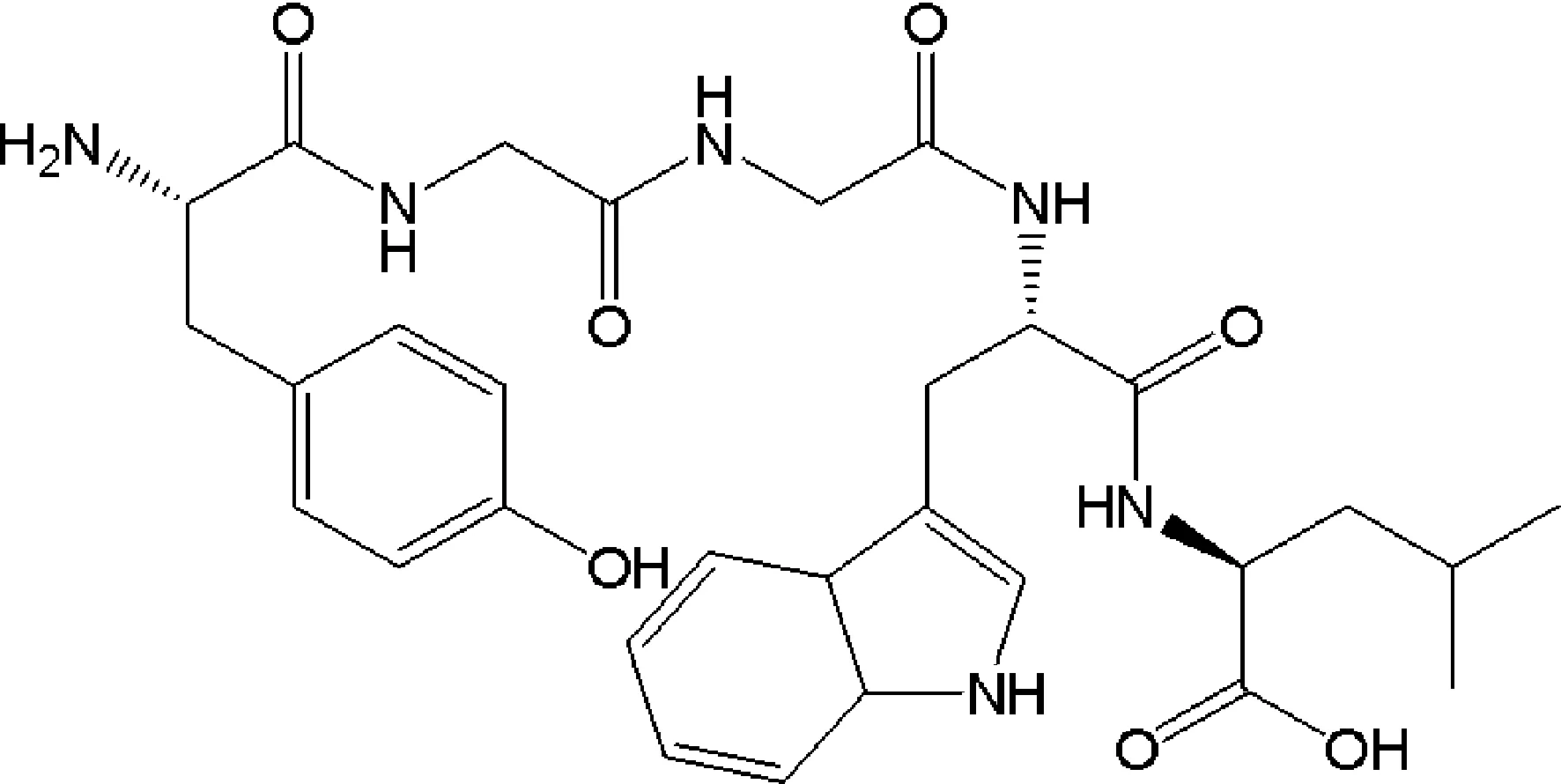
图1 外啡肽B5结构(分子式为C30H38N6O7,相对分子质量约为594.67 u)Fig.1 Structures of the GE-B5 (Molecular Formula:C30H38N6O7, MW:594.67 u)
因此,根据外啡肽B5潜在的市场价值,本研究在前一阶段工作的基础上,对化学合成法制备外啡肽B5工艺进一步优化,并对动物生产性能和免疫学功能进一步研究,从而达到以提高动物生产性能、减少药物使用和增强动物特定病原保护力为目的的健康高效养殖,也为能将外啡肽B5开发成新型饲料添加剂和动物疫苗佐剂提供基础。
1材料与方法
1.1材料
1.1.1试验动物和病毒毒株180只1日龄IBV非免疫雏鸡,由江苏省海安县双效种禽有限责任公司孵禽场提供;试验所用的疫苗抗原传染性支气管炎病毒(infectious bronchitis virus,IBV)H120株和攻毒毒株IBV M41,由江苏省生物教学示范中心保存提供,经9~10日龄SPF鸡胚增殖一代而获得。SPF鸡胚由南京天邦生物科技有限公司提供。
1.1.2外啡肽B5的人工化学合成外啡肽B5根据其氨基酸一级结构组成,采用优化后的小肽固相化学合成方法进行。在本合成方法中,氨基酸或肽链上的α-氨基用叔丁基氧羰基(Boc)保护,羧基由甲氧基(OMe)保护,肽键以N,N′-二环己基碳二亚胺(DCC)为缩合剂在二异丙基乙胺(DEAE)中合成,Boc保护基则在肽链形成后用三氟醋酸(TFE)除去。具体合成路线如图2所示。
Boc-Trp-Leu-OMe(化合物3)由亮氨酸甲酯盐酸盐(化合物2,7 mmol)和Boc-色氨酸(化合物1)合成,产物为纯白色固体,收率91.2%。
Trp-Leu-OMe三氟醋酸盐(化合物4)由Boc-Trp-Leu-OMe在二氯甲烷中用三氟醋酸去Boc保护得到,收率95%。
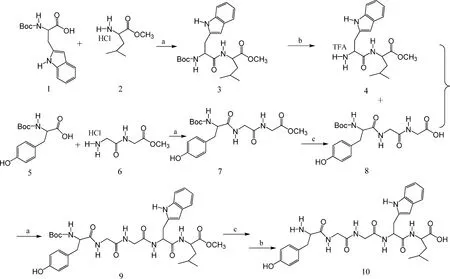
a.DIEA,DCC,HOBt;b.TFA,CH2Cl2;c.1 mol·L-1NaOH,CH3OH图2 外啡肽B5合成路线Fig.2 Schematic description of Gluten Exorphin B5 synthesis
Boc-Tyr-Gly-Gly-OMe(化合物7)由Gly-Gly-OMe盐酸盐(化合物6)和Boc-Tyr-OH (化合物5)合成,产物为白色固体,收率81%。
Boc-Tyr-Gly-Gly-OH(化合物8)则是在冰浴条件下,在Boc-Tyr-Gly-Gly-OMe(化合物7)经NaOH皂化,HCl中和的方法得到。
Boc-Tyr-Gly-Gly-Trp-Leu-OMe(化合物9)用化合物4和化合物8合成,合成方法与化合物3的合成方法类同。
化合物9经NaOH皂化,HCl中和脱去甲氧基保护后加入三氟醋酸(TFA) 去除Boc保护得到Tyr-Gly-Gly-Trp-Leu-OH(化合物10),反应完后减压旋去二氯甲烷与未反应的三氟醋酸,然后用离子交换树脂去除三氟醋酸,冷冻干燥得到五肽粗品。随后用300~400目硅胶柱层析进行纯化。产物经高效液相色谱(HPLC)分析和纯化,质谱(MS)鉴定,证实为目标产物,纯度达98%,合成产物保存在-20 ℃备用。
1.1.3主要试剂淋巴细胞分离液为美国贝克曼库尔特有限公司产品;RPMI1640固体粉状培养基(Gibco公司),根据说明书要求用去离子水配制,然后加入双抗(青、链霉素各100 U·mL-1),临用前加入10%的小牛血清[赛齐(上海)生物工程有限公司]作为细胞培养生长液;四甲基偶氮唑蓝(MTT,噻唑蓝,Amresco公司)溶液和ConA(Sigma公司),分别配制成5 mg·mL-1和1 mg·mL-1的溶液,0.22 μm混合纤维素酯微孔滤膜过滤,分装备用;RNA 提取试剂盒TRIzol Regeant购自Invitrogen公司;反转录酶M-MLV为Promega公司产品;DEPC水为北京鼎国昌盛生物技术有限责任公司产品;二甲亚砜(DMSO)、乙醇、异丙醇和氯仿等其他试剂均为分析纯。
1.2IB抗原制备及残留毒检测
试验所用的疫苗抗原IBV M41株经9~10日龄SPF鸡胚增殖一代而获得。将新收获的IBV H120鸡胚尿囊液(每0.1 mL≥106EID50)按常规方法用0.1%甲醛灭活24 h,作为疫苗抗原,置4 ℃冰箱保存备用。取上述灭活病毒液按0.1 mL·枚-1剂量接种9~10日龄鸡胚,37 ℃培养,盲传3代,观察接种鸡胚死亡情况,取存活鸡胚尿囊液测定HA效价。
1.3灭活疫苗制备
疫苗的制备参考“兽用生物制品规程”方法[8],将不同终浓度的外啡肽B5(试验1组10 mg·L-1,2组20 mg·L-1,3组40 mg·L-1,4组80 mg·L-1)按1∶4的比例与上述灭活病毒液混匀后即成含一定浓度外啡肽B5灭活疫苗成品,置4 ℃冰箱保存备用。阳性对照组为铝胶佐剂疫苗,将50%氢氧化铝胶生理盐水与同样的灭活病毒液按1∶4的比例混合,常规方法乳化,保存备用。
1.4疫苗质量与安全检测
将配好的灭活疫苗按现行《中国兽药典》附录进行灭活检验[8],接种普通琼脂板和血平板,置37 ℃培养5 d,观察疫苗在2种培养基中是否有细菌生长。同时将灭活疫苗按1 mL·只-1剂量颈部皮下注射14日龄仔鸡,对照组接种相同剂量灭菌生理盐水。接种后连续观察14 d,观察供试鸡的精神状态以及是否有因接种疫苗引起的局部或全身不良反应。
1.5动物分组及处理
180只1日龄IBV非免疫雏鸡随机分为6组,每组30只,笼养,自由采食饮水。试验1~5组在14和21日龄时分别用105.0EID50·0.1 mL-1剂量的灭活疫苗经肌肉注射进行免疫,每只注射0.1 mL。第六组为空白对照组,不做任何处理。
1.6鸡生产性能测定
分别于7和35日龄称取空腹体重,计算7~35日龄段的体增重和饲料转化率。
1.7鸡淋巴细胞(PBMC)增殖试验
1.7.1鸡外周血淋巴细胞的制备分别从首免、首免后14和21 d从鸡翅静脉无菌取1 mL血液,小心沿侧壁加入到含有4 mL淋巴细胞分离液玻璃离心管中液面上,以2 000 r·min-1离心15 min;收集上层与淋巴细胞分离液(下层)两相界面上的细胞(白色云雾层),放入新的10 mL玻璃离心管中,并以无菌PBS缓冲液补至总体积8 mL,混匀后,再以2 000 r·min-1离心10 min;吸去上清液,细胞沉淀经PBS反复洗涤2次,即得所需的外周血淋巴细胞;经活细胞染色计数后,用RPMI-1640完全营养液调节细胞密度至5×106·min-1;按100 μL·孔-1将细胞悬液加到96孔细胞板中培养备用。1.7.2淋巴细胞增殖试验淋巴细胞增殖试验按W.Jiang等[9]的方法稍作调整。将外啡肽B5终质量浓度调整至10、20、40、80 mg·L-1作为刺激原,每孔加入100 μL,对照孔加入100 μL RPMI-1640完全营养液,阴性对照孔为PBS,阳性对照孔为ConA(终质量浓度为10 mg·L-1),各做3个重复孔。37 ℃下培养44 h后每孔加入40 μL MTT(5 mg·mL-1),37 ℃下继续培养4 h。吸弃培养液,每孔加入100 μL DMSO,振荡溶解结晶沉淀,在酶标仪上测定OD570 nm值,计算刺激指数(刺激指数SI=刺激孔的OD值/未刺激孔的OD值)。
1.8血清抗体检测
分别于14、21和28日龄每组各取10只进行翅静脉采血,分离血清,参考OIE的方法用HI微量法检测接种鸡血清样品中的抗体效价[10]。
1.9攻毒保护试验
首免后21 d(35日龄)用1∶10稀释的IBV M41株病毒尿囊液对所有试验鸡进行点眼、滴鼻攻毒,0.5 mL·只-1。攻毒后5 d每组扑杀10只鸡,无菌采集肺和肾组织,-70 ℃保存,待检。继续观察剩余鸡群的临床症状、发病及死亡状况,对死亡鸡进行剖检,观察IBV靶器官组织病理变化。将鸡扑杀后采集的病料按1∶4加PBS缓冲液研磨成组织悬液,反复冻融3次后,10 000 r·min-1离心15 min,取上清用0.22 μm微孔滤膜过滤除菌。取0.5 mL滤过液经尿囊腔接种3枚10日龄SPF鸡胚,37 ℃孵育,弃去24 h内死亡胚,72 h后无菌收集尿囊液,根据TRIzol的说明书要求,从鸡胚尿囊液中提取病毒RNA,应用RT-PCR方法扩增IBVN基因,从而判断IBV病原是否为阳性。
攻毒后5 d,将所有存活鸡处死,取肺和肾组织固定于4%甲醛中,石蜡包埋,常规病理组织切片处理,HE染色检测组织病理变化。
1.10数据统计
应用SPSS13.0软件对数据统计分析,进行ANOVA及Duncan’s多重分析,比较各组差异显著性。
2结果
2.1外啡肽B5的化学合成
通过小肽的固相化学合成,外啡肽B5的合成达到预期目标,MS测定相对分子质量为594 u(图3),HPLC测定其产物浓度大于98%(图4)。
2.2外啡肽B5对肉鸡生长性能的影响
由表1可知,试验初期各组肉鸡体重无显著性差异,而在35日龄时20 mg·L-1剂量组肉鸡体增重显著比对照组肉鸡体增重高14.5%(P<0.05),同时20 mg·L-1剂量组料肉比比对照组降低了15.1%(P<0.05)。由此得出,添加适量的外啡肽B5可以提高肉仔鸡的体增重,提高饲料转化率,从而提高动物的生产性能。

表1 不同剂量外啡肽B5对肉鸡体重、饲料转化率的影响)
*表示差异显著(P<0.05)。下表同
* means significant difference (P<0.05).The same as below
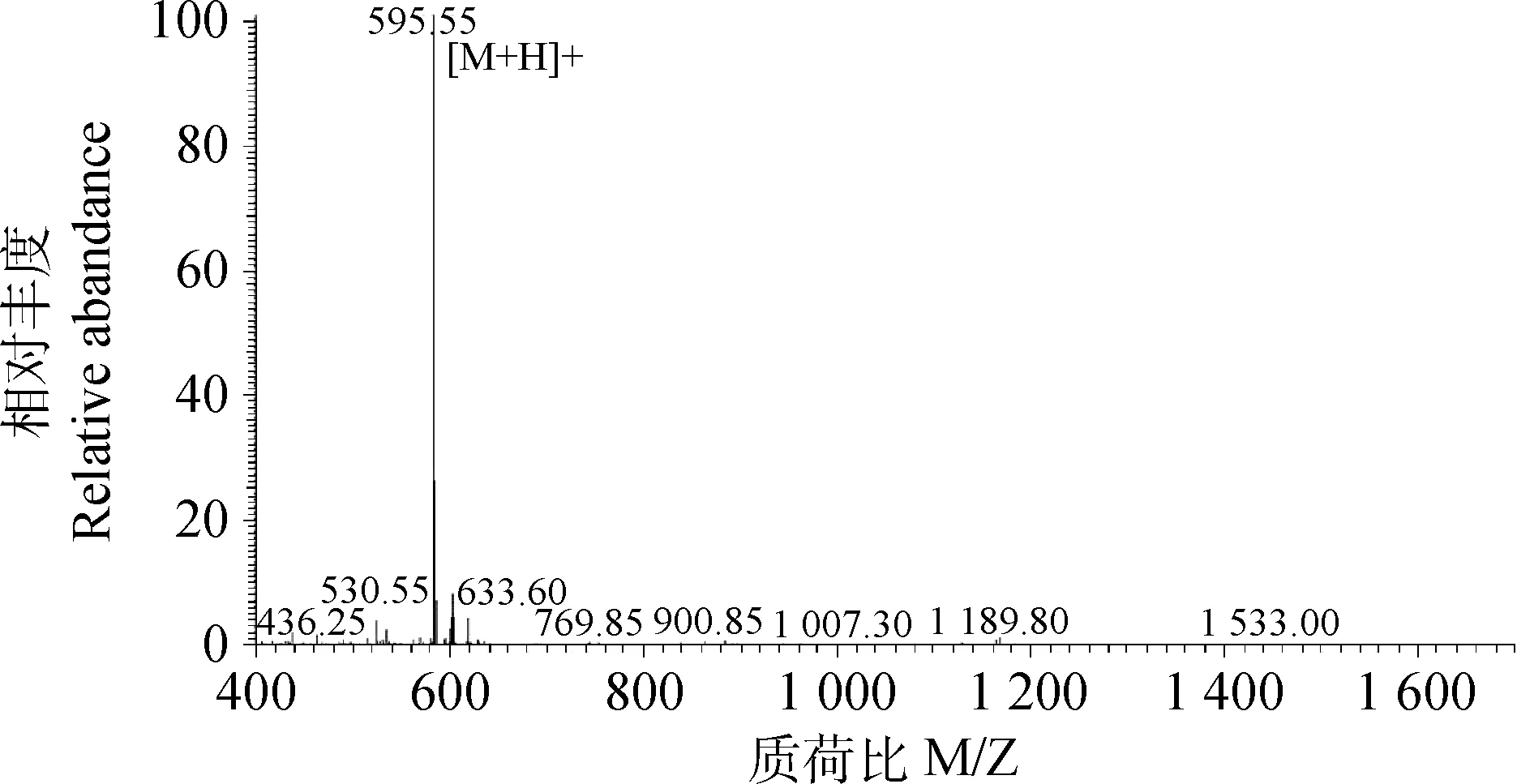
图3 外啡肽B5的质谱检测图谱Fig.3 MS mass spectrogram of gluten exorphin B5

图4 外啡肽B5的HPLC检测图谱Fig.4 HPLC chromatogram of the purified gluten exorphin B5
2.3外啡肽B5对鸡PBMC增殖效应

*.P < 0.05;**. P<0.01图5 MTT法测定外啡肽B5对鸡PBMC增殖效应Fig.5 The influence of gluten exorphin B5 on the proliferation of the chicken peripheral blood mononuclear cells (PBMCs) measured with the MTT method
通过MTT法测定外啡肽B5对鸡PBMC增殖效果,从图5中可见,外啡肽B5在浓度为20、40和80 mg·L-1时SI值显著比对照组高(P<0.05或P<0.01).在所有质量浓度中20 mg·L-1效果最显著(P<0.01)。
2.4外啡肽B5对鸡血清抗体效价变化
用HI微量法对所采集的免疫鸡群的血清样品进行IBV抗体检测,从表2中可看出,IBV血清抗体在14 dpi时,80 mg·L-1剂量组显著比对照组[Al(OH)3组]提高了0.8个滴度(P<0.05);21 dpi时,20、40和80 mg·L-1剂量组分别显著比对照组[Al(OH)3组]提高了1.4、1.0和2.0个滴度(P<0.05)。28 dpi时,20 mg·L-1剂量组显著比对照组[Al(OH)3组]提高了3.0个滴度(P<0.05)。证明20 mg·L-1剂量对鸡群抗体免疫力影响是一个最佳剂量。
2.5外啡肽B5对IBV M41攻毒保护变化
用IBV M41毒株病毒尿囊液对五组免疫鸡及对照组进行攻毒后,试验组除了试验2组(20 mg·L-1剂量组)外,其余均出现典型IBV临诊症状,发病率为3.3%~100%,但无鸡死亡;多数鸡攻毒48 h后临诊症状开始明显,14 d左右症状基本消失。病鸡临床症状表现为精神沉郁、羽毛蓬松、两翅下垂、张口呼吸、甩鼻、甩头、气管啰音、尖叫、缩脖等,有些鸡出现腹泻、采食量和体重明显下降、饮水增多;对照组所有鸡表现为精神沉郁、甩头、气管啰音、尖叫等呼吸道症状,采食量下降,个别鸡还出现排白色稀便,鸡群的发病率为100%,死亡率为3.3%(表3)。
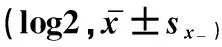
表2 鸡血清中IBV抗体效价变化
表3 外啡肽B5对IBV M41毒株攻毒保护变化
a.攻毒后每天记录鸡的死亡数;b.经RT-PCR鉴定为阳性的鸡发病数
a.The death chicken was recorded each day after challenge and is presented as total number of dead chickens in each group;b.The dead and euthanized chicken was determined as affected chicken by RT-PCR amplification of IBV N protein cDNA band out of the lung and/or kidney tissues
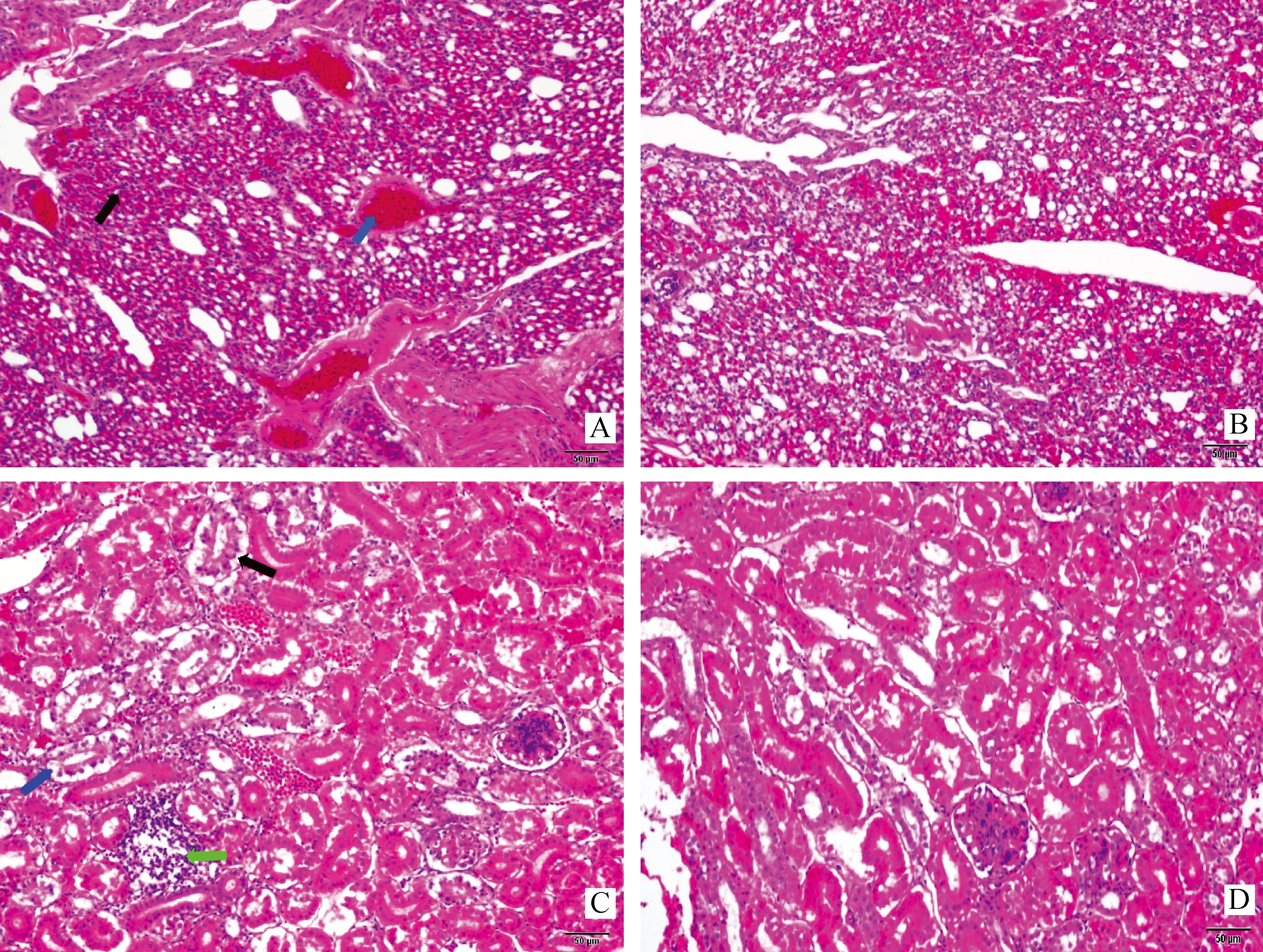
A.攻毒5 d后对照组肺组织;B.攻毒5 d后试验组肺组织;C.攻毒5 d后对照组肾组织;D.攻毒5 d后试验组肾组织A.The lung of control group 5 dpc;B.The lung of experimental group 5 dpc;C.The kidney of control group 5 dpc;D.The kidney of experimental group 5 dpc图6 攻毒肉鸡肺和胃组织病理学变化(200×)Fig.6 The changes in lung and kidney tissue of the chicken of experimental and control group after challenge (a light microscope at 200×magnification)
2.6组织病理学变化
攻毒5 d后对照组(PBS)肉鸡肺的主要病变是肺间质性炎、小支气管腔内渗出物、小支气管壁周围炎细胞浸润和肺组织充血、出血等病理变化,肾的主要病变是肾小管上皮细胞变性坏死和间质性炎。而添加了一定剂量的外啡肽B5和Al(OH)3组肺和肾则没有明显的病理变化(图6)。
3讨论
传统方法制备功能性生物活性小肽主要采用酶解法,如使用木瓜蛋白酶、胰蛋白酶、胃蛋白酶等,但容易产生令人难以接受的腥味或苦味,且生产成本高[11-13];其次是从原料中直接提取法,产率低、成本高;还可以用DNA重组技术法,虽然目前用基因工程技术表达的重组蛋白质无论在人医还是兽医临床使用均非常普遍[14-15],但本研究的外啡肽B5相对分子质量小,碱基序列短,使得应用DNA重组技术法制备外啡肽B5操作复杂,周期长,后期纯化成本高[16]。还有应用微生物特别是真菌发酵产生生物活性小肽,但由于其生产的小肽纯度不高,从严格意义上来说还不能称作是功能性生物活性小肽。现今,多种化学合成的多肽药物已经应用于临床,并取得良好的治疗效果,因此本研究在前人的基础上[17],进一步优化人工化学合成的方法制备麦谷蛋白源外啡肽B5。本研究减少了反应步骤,降低了生产成本。从而更大限度满足外啡肽B5后续的生产实际需要。
淋巴细胞是动物机体内重要的免疫活性细胞[18]。外啡肽B5可以明显促进外周血淋巴细胞增殖,并且也有一定的剂量反应关系,在剂量20 mg·L-1时表现最强。对照组测得的IBV特异性抗体反应较低,而在添加了一定剂量的外啡肽B5后,肉鸡血清抗体水平显著比对照组高,该结果表明一定剂量的外啡肽B5能诱导动物机体产生良好的体液免疫应答反应。并且试验鸡对IBV M41株强毒攻毒提供了良好的免疫保护,该结果证实免疫一定剂量外啡肽B5后除能激发动物机体产生针对外源抗原的体液免疫应答反应以外,同时也可能产生了良好的细胞免疫应答反应。这些数据都证明外啡肽B5具有免疫增强作用,因此有望将其开发成一种新型免疫增强剂。
佐剂是动物疫苗中的重要组成部分,是一种非特异性免疫增强剂,能够提高疫苗抗原对动物机体的免疫原性和抗原提呈作用,增强疫苗实际免疫效果,被广泛应用于疫苗研究与生产[19]。传统的灭活疫苗佐剂是选用白油,但白油对动物有一定的不良反应,并且不易在局部肌肉中消散。因此,选择合适的灭活疫苗佐剂,对于提高灭活疫苗免疫效果和减少不良反应有重要的意义。本试验选用了外啡肽B5和传统的铝佐剂进行了比较,免疫效果表明20 mg·L-1剂量的外啡肽B5明显比铝佐剂免疫效果好。同时外啡肽B5还是一种水溶性佐剂,对局部肌肉产生的不良反应较小,在动物体内易于扩散,吸收快,故产生抗体早。而且应用外啡肽B5佐剂制成动物灭活疫苗工艺简单,仅需与疫苗抗原简单混匀,不需经过强力乳化等较复杂生产工艺,且稳定性好。
4结论
通过人工化学合成工艺改进,降低了外啡肽B5的生产成本,在肉鸡应用外啡肽B5可使体增重提高14.5%,料肉比降低15.1%,因此外啡肽B5可开发成一种新型动物功能性饲料添加剂;外啡肽B5对肉鸡外周血T淋巴细胞的分裂增殖具有促进作用,能提高机体血清抗体滴度,在IBV M41株攻毒试验中,可以显著减轻病毒感染肉仔鸡临床症状,无组织病理学变化,免疫保护率达到96.7%。因此外啡肽B5还可开发成动物疫苗佐剂。
参考文献(References):
[1]ABD EL RAHMAN S,WINTER C,EL-KENAWY A,et al.Differential sensitivity of well-differentiated avian respiratory epithelial cells to infection by different strains of infectious bronchitis virus[J].JVirol,2010,84(17):8949-8952.
[2]AUTRAN B,CARCELAIN G,COMBADIERE B,et al.Therapeutic vaccines for chronic infections[J].Science,2004,305(5681):205-208.
[3]HUGHES J,SMITH T W,KOSTERLITZ H W,et al.Identification of two related pentapeptides from the brain with potent opiate agonist activity[J].Nature,1975,258(5536):577-580.
[4]ZIOUDROU C,STREATY R A,KLEE W A.Opioid peptides derived from food proteins.The exorphins[J].JBiolChem,1979,254(7):2446-2449.
[5]FUKUDOME S,YOSHIKAWA M.Opioid peptides derived from wheat gluten:their isolation and characterization[J].FEBSLett,1992,296(1):107-111.
[6]FUKUDOME S,SHIMATSU A,SUGANUMA H,et al.Effect of gluten exorphins A5 and B5 on the postprandial plasma insulin level in conscious rats[J].LifeSci,1995,57(7):729-734.
[7]FUKUDOME S,JINSMAA Y,MATSUKAWA T,et al.Release of opioid peptides,gluten exorphins by the action of pancreatic elastase[J].FEBSLett,1997,412(3):475-479.
[8]中国兽药典委员会.中华人民共和国兽药典[M].北京:中国农业出版社.
Commission of Chinese Veterinary Pharmacopoeia.Veterinary Pharmacopoeia of the people’s republic of China[M].Beijing:China Agriculture Press.(in Chinese)
[9]JIANG W,JIANG P,LI Y,et al.Recombinant adenovirus expressing GP5 and M fusion proteins of porcine reproductive and respiratory syndrome virus induce both humoral and cell-mediated immune responses in mice[J].VetImmunolImmunopathol,2006,113(1-2):169-180.
[10]Office International des Epizooties (OIE).Manual of standards for diagnostic tests and vaccines[S]//Avian Infectious Bronchitis.6th edn,2008:443-455.
[11]KOGUT M H,GENOVESE K J,HE H,et al.BT cationic peptides:small peptides that modulate innate immune responses of chicken heterophils and monocytes[J].VetImmunolImmunopathol,2012,145(1-2):151-158.
[12]DING W,GUO X,ATAKU K.Characterization of peptides in ensiled alfalfa treated with different chemical additives[J].AnimSciJ,2013,84(12):774-781.
[13]SUDA Y,VILLENA J,TAKAHASHI Y,et al.Immunobiotic Lactobacillus jensenii as immune-health promoting factor to improve growth performance and productivity in post-weaning pigs[J].BMCImmunol,2014,15:24.
[14]MEIR R,KRISPEL S,SIMANOV L,et al.Immune responses to mucosal vaccination by the recombinant A1 and N proteins of infectious bronchitis virus[J].ViralImmunol,2012,25(1):55-62.
[15]LYU K,WANG G C,HE Y L,et al.Crystal structures of enterovirus 71 (EV71) recombinant virus particles provide insights into vaccine design[J].JBiolChem,2015,290(6):3198-3208.
[16]THORMAR H.Patented non-antibiotic agents as animal feed additives[J].RecentPatFoodNutrAgric,2012,4(2):155-168.
[17]FANCIULLI G,DETTORI A,FENUDE E,et al.Intravenous administration of the food-derived opioid peptide gluten exorphin B5 stimulates prolactin secretion in rats[J].PharmacolRes,2003,47(1):53-58.
[18]MOSMANN T R,SAD S.The expanding universe of T-cell subsets:Th1,Th2 and more[J].ImmunolToday,1996,17(3):138-146.
[19]JAWALE C V,LEE J H.Characterization of a Salmonella Typhimurium ghost carrying an adjuvant protein as a vaccine candidate for the protection of chickens against virulent challenge[J].AvianPathol,2014,43(6):506-513.
(编辑白永平)
Gluten Exorphin B5 Enhances Immunogenicity and Protective Efficacy of Infectious Bronchitis Virus Vaccine in Broilers
ZHOU Ye-fei,ZHOU Mei-xian
(SchoolofFoodScience,NanjingXiaozhuangUniversity,Nanjing211171,China)
Abstract:Gluten exorphin B5 (GE-B5) was a food-derived opioid peptide identifiedinvitroin enzymatic digests of wheat gluten,and it was a good candidate of functional feed additives and adjuvant for vaccine development because of its immune function.In this study,we chemically synthesized GE-B5,and then added it to vaccine against infectious bronchitis virus (IBV) H120 strain to immunize chickens for evaluating their growth performance,immunogenicity and protective efficacy.On 0,14,and 21 dpi,the changes in proliferation of peripheral blood mononuclear cells (PBMC) and serum antibody titer were evaluated respectively by MTT method and hemagglutination inhibition assay.The results showed that administration of GE-B5 significantly raised anti-IB antibody titer in the chicken serum and also markedly promoted PBMCs proliferation.Following challenge with IBV Mass 41 strain,chickens inoculated with GE-B5 showed fewer and less severe clinical signs,lower death rate,lower mortality and showed higher protection,as compared to those of the control groups.The result of pathological tissue section showed that the lung and kidney became shorter pathological phenomenon than the control group.This study confirmed that in addition to its immunoregulatory activity and immunopromoting effects,GE-B5 can also promote weight gain.These data have important implications for functional feed additives and novel adjuvants designed for future vaccines.
Key words:gluten;exorphin B5;functional feed additives;adjuvant
doi:10.11843/j.issn.0366-6964.2016.03.020
收稿日期:2015-06-20
基金项目:江苏省农业委员会农业三新工程项目(SXGC[2015]016);南京晓庄学院院级重点项目(2012NXY10;2013NXY07)
作者简介:周业飞(1977-),男,江苏沭阳人,副教授,博士,主要从事动物免疫学研究,E-mail:yfzhou@njxzc.edu.cn
中图分类号:S858.315.3
文献标志码:A
文章编号:0366-6964(2016)03-0566-08
