宿主细胞F-actin聚集在顶复门原虫入侵过程中的作用研究
2016-07-12吴彩艳林栩慧廖申权戚南山吕敏娜孙铭飞
吴彩艳,王 祯,李 娟,林栩慧,廖申权,戚南山,吕敏娜,孙铭飞*
(1.广东省农业科学院动物卫生研究所,广东省兽医公共卫生公共实验室,广东省畜禽疫病防治研究重点实验室,广州 510640;2.华南农业大学兽医学院,广州 510642)
宿主细胞F-actin聚集在顶复门原虫入侵过程中的作用研究
吴彩艳1,2#,王祯1,2#,李娟1,林栩慧1,廖申权1,戚南山1,吕敏娜1,孙铭飞1*
(1.广东省农业科学院动物卫生研究所,广东省兽医公共卫生公共实验室,广东省畜禽疫病防治研究重点实验室,广州 510640;2.华南农业大学兽医学院,广州 510642)
摘要:病原入侵宿主细胞,由宿主细胞肌动蛋白(F-actin)聚集引起的细胞骨架重排起着极其重要的作用,本文主要就宿主细胞整合素介导的宿主细胞F-actin聚集重排在顶复门原虫入侵过程中的作用进行系统的阐述,对解析顶复门原虫的入侵机制及以此研制新型寄生虫病药物和疫苗具有非常重要的意义。
关键词:顶复门原虫;宿主细胞;F-actin聚集;入侵
顶复门原虫是一类专一性的细胞内寄生原虫,种类繁多,分布广泛,主要包括弓形虫(Toxoplasmagondii)、隐孢子虫(Cryptosporidiumspp. )、疟原虫(Plasmodiumspp.)、巴贝斯虫(Babesiaspp.)及艾美耳球虫(Eimeriaspp.) 等,是人和动物的重要病原,常引起人和动物死亡[1-3]。这类原虫具有相似的亚细胞结构——由极环、棒状体、微丝体、类锥体和膜下微管等组成的顶复合器(apical complex)。顶复合器不仅是该类寄生虫分类学上的标志,而且使顶复门原虫具有保守的入侵宿主细胞机制[4-5]。因此入侵机制的研究对顶复门原虫具有普遍意义,诸多研究发现顶复门原虫在入侵宿主细胞过程中,首先由虫体的多种入侵相关蛋白质分子(如微线、棒状体及致密颗粒分泌相关蛋白质)黏附宿主细胞,而后激活宿主细胞F-actin聚集引起细胞骨架重排,从而实现虫体侵入宿主细胞[6]。
1顶复门原虫入侵与宿主细胞F-actin聚集的关系
1.1肌动蛋白在宿主细胞骨架组成中的重要作用
肌动蛋白是一类高度保守的蛋白质,存在于所有真核细胞中,参与细胞分裂、运动、迁移、变形、收缩、生长等多种重要生理活动。在细胞中有两种基本形式,以单体(globular actin monomer,G-actin) 和寡聚体及聚合体(filament actin,F-actin) 形式存在,执行不同的生理功能,聚合与非聚合形式的肌动蛋白在细胞中处于一种动态平衡[7]。其中F-actin是构成细胞骨架的重要成分,细胞骨架对于维持细胞的形态结构和内部结构的有序性,以及在细胞运动、物质运输、能量转换、信息传递、细胞分化等方面起重要作用[8-9]。构成细胞骨架的蛋白质通过与肌动蛋白结合,控制 F-actin的装配与拆卸,调节F-actin的长度、极性、稳定性和三维结构,并将 F-actin与细胞质和细胞膜的其他成分相连接,行使细胞的多种生物学功能[10]。其中属于此类蛋白质的肌动蛋白解聚因子(actin filament-depolymerizing protein)在近年的研究中被陆续发现,并认为在细胞骨架重构和收缩的调节过程中发挥着关键作用[11]。
1.2顶复门原虫入侵与宿主细胞 F-actin聚集密切相关
几乎所有的细胞内病原微生物入侵均是由宿主细胞F-actin聚集引起细胞骨架重排实现的[12]。顶复门原虫入侵宿主细胞的过程包括黏附和侵入两个阶段,研究认为,宿主细胞F-actin聚集重排发生在虫体侵入阶段[13]。T.gondii进入哺乳动物细胞不仅是一个积极主动的入侵过程,而且伴随着宿主细胞骨架重排;入侵行为的发生依赖虫体自身的动力与F-actin聚集引起的宿主细胞骨架重排二者共同作用,并推测这一现象可以延伸至整个顶复门原虫[14]。为进一步验证这种推测,利用毒伞素(phalloidin)染色证实C.parvnm在感染宿主细胞过程中,F-actin聚集于宿主细胞与虫体的交界处,随着虫体的发育,F-actin聚集的长度增加,并且F-actin只存在于黏附部位,而非整个虫体;在黏附部位由虫体顶端分泌多种蛋白质(如微线蛋白、蛋白激酶、热激蛋白等)黏附于宿主细胞,同时宿主细胞上的受体被激活,进而通过一系列复杂的信号通路激发F-actin聚集,进而引起细胞骨架发生重排,导致细胞结构发生改变,从而实现虫体的入侵[15]。当C.parvnm感染HCT-8细胞30 s即可检测到酪氨酸磷酸化,酪氨酸磷酸化被认为与F-actin聚集相关,入侵30 min后,在虫体与宿主细胞黏附部位即可检测到F-actin聚集,且聚集的F-actin来源于宿主细胞,由宿主细胞F-actin聚集引起的细胞骨架重排一直持续到纳虫空泡形成[16]。同样P.falciparum在入侵HCT-8细胞过程中,F-actin聚集依赖的动力也来源于宿主细胞骨架蛋白的磷酸化[17]。
利用抑制F-actin聚集的抑制剂——细胞松弛素D(cytochalasin D)孵育HCT-8细胞后,感染C.parvnm,结果入侵率明显下降,当抑制剂去除后,抑制作用还可以持续24 h,说明宿主细胞F-actin聚集在C.parvnm感染的早期发挥作用[18]。将E.tenella子孢子感染以Cytochalasin D处理的MDBK细胞,子孢子的入侵率也显著下降,免疫组化试验结果显示MDBK与Cytochalasin D共孵育后F-actin聚集明显减少,由于Cytochalasin D破坏了细胞微丝的形成从而阻碍了F-actin的聚集,进而抑制E.tenella入侵宿主细胞[19]。在T.gondii感染宿主细胞过程中,也有类似结果[20]。
因此在虫体入侵宿主细胞时,宿主细胞F-actin聚集是必需的[20-21]。
1.3顶复门原虫入侵过程中宿主细胞 F-actin聚集重排通路的形成
对顶复门原虫(如T.gondii、C.parvnm、P.falciparum等)入侵机制的研究显示,虫体在入侵宿主细胞过程中,宿主细胞F-actin聚集重排起着非常重要的作用[22]。
宿主细胞 F-actin 聚集重排引起细胞骨架发生改变,是所有细胞内感染病原微生物的关键[23]。宿主细胞 F-actin 的聚集重排是通过一系列复杂的信号转导实现的[24-25],外源微生物分泌的相关蛋白质、胞外信号激活蛋白(如肿瘤转移信号蛋白等)与宿主细胞膜上的相关受体蛋白质[如表皮生长因子(EGF)、整合素(integrin)、G 蛋白偶联受体(GPCR)等]互作[26-27],然后启动一系列不同的信号转导通路,如 FAK-c-Src-Cortacin、PI3K-Cdc42-WASP-Arp2/3、Ras-ERK-Calpain-TK、PI3K-Akt、RhoA-PKC-MAP、Rac-PAK-LIMK 和 PIP5K-PIP2-Profilin 等,最终在 ADF /cofilin 家族蛋白、皮层肌动蛋白(cortactin)和钙离子等参与下使宿主细胞的 F-actin 发生了聚集重排[28-29]。而宿主细胞 F-actin 聚集重排引起的细胞骨架改变,正向调节病原微生物的入侵[30]。
不同细胞内感染的微生物所诱导的宿主细胞聚集F-actin的机制不尽相同,C.parvnm将F-actin作为形成连接复合体结构的重要组成部分,与细胞膜蛋白结合,因此推断F-actin在C.parvnm入侵过程中可能扮演一个更加积极主动的角色[31]。在C.parvnm与HCT-8细胞黏附部位可以检测到促使F-actin聚集的蛋白质,如肌动蛋白相关蛋白(Arp2/3complex),血管扩张刺激磷蛋白(VASP)和综合征蛋白(N-WASP)[32]。这些黏合蛋白通过与F-actin相互作用来调节F-actin的聚集,并与其他蛋白质连接形成F-actin网络,使单体actin分子聚合成螺旋形的F-actin[33]。而T.gondii没有像C.parvnm一样将宿主细胞F-actin形成连接复合体,而是将F-actin高度聚集形成了actin噬斑,在每个分子复合物中,F-actin作为结合分子都被结合到细胞膜蛋白上,并且在入侵的早期未检测到酪氨酸磷酸化[34]。
2Integrin介导的宿主细胞F-actin聚集重排在顶复门原虫入侵过程中的作用
2.1Integrin的组成及生物学作用
Integrin是一类位于细胞表面结构和功能相似的糖蛋白,是细胞表面具有黏附和转导功能的受体,在调节细胞生存、增殖、黏附、分化等方面起着重要作用[35-36]。该类蛋白质是由α、β亚基通过非共价键组成具有功能的异二聚体,每个亚基都有一个较长的胞外域、一个跨膜域和一个较短的胞内域(图1)。其中胞外域与细胞外基质(cell-extra-cellular matrix,ECM)结合,识别配体分子中的特定序列,跨膜域可以与许多细胞因子及其可溶性调节因子共同作用而调节整合素的功能,胞内域可与α-辅肌动蛋白(α-actinin)、纽蛋白(vinculin)、踝蛋白(talin)、张力蛋白(tensin)等细胞骨架蛋白相连接,通过这些细胞骨架蛋白最终连接到actin,引起细胞形态的变化,也可直接或间接与连接蛋白结合而激活胞内酶链系统,介导细胞内外之间的双向信号转导[35-36]。
2.2Integrin介导的宿主细胞F-actin聚集重排信号转导通路
在激活宿主细胞F-actin聚集重排信号转导的众多受体中,Integrin被认为是最重要的受体,参与细胞骨架的形成及信号转导,在外源微生物入侵宿主细胞过程中起主导作用[37]。由Integrin介导的人类细胞F-actin聚集信号通路显示:宿主细胞的Integrin主要通过下游的黏着斑激酶(focal adhesion kinase,FAK)、非受体酪氨酸激酶(c-Src)、磷酸肌醇3-激酶(Phosphoinositide3-kinase,PI3K)、整合素连接激酶(integrin-linked kinase,ILK)、RAS致癌同源蛋白(ras homologus oncogenes,Rho)、癌症相关蛋白(Rac和Cdc42-WASP-Arp2/3)等几个信号转导通路激活了细胞表面F-actin的聚集,从而引起细胞骨架结构发生改变,进而实现了外源微生物的入侵[38]。当宿主细胞受到刺激后,Integrin的信号转导具有双向性:(1)激动剂作用后,细胞内信号分子与Integrin胞内段相互作用,产生内向外信号(inside-out signal),导致Integrin活化,将Integrin从对ECM、可溶性蛋白质等配体的低亲和状态转变为高亲和状态,上调Integrin受体与配体的结合能力。(2)Integrin活化后,配体与Integrin胞外段结合,产生外向内信号(outside-in signal),F-actin聚集引起细胞骨架发生重排[39]。
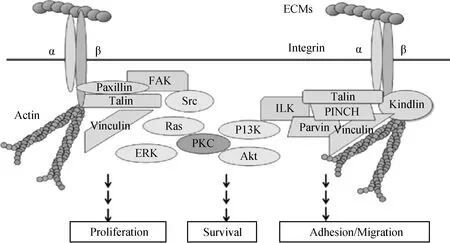
图1 整合素、编辑蛋白和信号通路[33]Fig.1 Integrins,adaptor proteins,and signaling pathways
2.3Integrin对顶复门原虫入侵的作用
当Integrin的活性发生改变时,其介导的宿主细胞F-actin聚集亦发生相应的变化,直接影响基质与细胞骨架的相互作用。亚细胞定位显示Integrin 家族成员之一的Integrin α2(ITGA2)基因表达的蛋白在宿主细胞与C.parvnm接触部位维持较高水平。分别利用抗Integrin的两个亚基——ITGA2和ITGB1单克隆抗体孵育HCT-8细胞后,感染C.parvnm后入侵率均发生下降;ITGA2基因敲除细胞感染C.parvnm,导致其入侵率下降;将C.parvnm感染ITGA2基因过表达细胞后,其入侵率上升[40]。由此说明HCT-8细胞的ITGA2和ITGB1基因都参与了F-actin聚集,且对C.parvnm的入侵属于正调控。因此宿主细胞的基因可能参与了虫体入侵时的相互作用,可能作为部分调节因子在接触部位使F-actin重组。
3展望
多年来国内外学者对顶复门原虫的入侵机制进行了深入研究,但多集中于虫体本身的一些分泌蛋白质,对于分泌蛋白质如何与宿主细胞上的受体互作从而发挥效应这一最为关键环节尚缺乏系统研究。后续研究发现入侵行为的发生依赖虫体自身的能动性与宿主细胞F-actin聚集引起的细胞骨架重排二者共同作用,即入侵机制的研究与虫体及宿主细胞均相关。以往将研究重点集中在虫体本身的变化上,而对宿主细胞本身研究的较少,致使对顶复门原虫入侵机制研究多年而未取得重大突破。近年从宿主细胞角度研究寄生虫的入侵机制,取得了重要进展。
在顶复门原虫中,由艾美耳球虫引起的鸡球虫病仍普遍发生,抗药性严重,疫苗免疫又存在散毒现象,致使养鸡业面临巨大的风险和挑战,究其原因是对鸡球虫入侵机制不明确,致使鸡球虫病的防控不得要领,因此对鸡球虫入侵机制进行深入系统的研究已经迫在眉睫。虽然国内外学者开展了许多基于鸡球虫的相关研究工作,但是对鸡球虫入侵机制的研究主要集中在鸡球虫本身,即把重点放在研究鸡球虫分泌的各种微线蛋白、顶膜抗原、棒状体蛋白等在入侵过程中的作用,期望寻找具有保护作用的抗原,研制基因工程疫苗,但迄今为止,都没有保护效果良好的基因工程疫苗问世。而在鸡球虫入侵宿主细胞过程中,对宿主细胞自身的结构变化研究较少,所以基础研究的不足直接导致鸡球虫入侵机制的研究不透彻。
从宿主细胞角度对顶复门原虫(如艾美耳球虫、疟原虫、巴贝斯虫等)入侵机制进行研究,为进一步探明顶复门系统的入侵提供了新的思路。
参考文献(References):
[1]DUBREMETZ J F,GARCIA-RéGUET N,CONSEIL V,et al.Apical organelles and host-cell invasion by Apicomplexa[J].IntJParasitol,1998,28(7):1007-1013.
[2]DUBEY J P.Toxoplasma,Hammondia,Besnoitia,sarcocystis,and other tissue cyst-forming coccidian of man and animals[M].New York:Academic Press,1977:101-237.
[3]LEVINE N D.Progress in taxonomy of the Apicomplexan protozoa[J].JProtozool,1988,35(4):518-520.
[4]KIM K,WEISS L M.Toxoplasmagondii:the model apicomplexan[J].IntJParastiol,2004,34(3):423-432.
[5]FRANCIA M E,STRIEPEN B.Cell division in apicomplexan parasites[J].NatRevMicrobiol,2014,12(2):125-136.
[6]SIBLEY L D.Invasion and intracellular survival by protozoan parasites[J].ImmunolRev,2011,240(1):72-91.
[7]EHRLICHER A J,KRISHNAN R,GUO M,et al.Alpha-actinin binding kinetics modulate cellular dynamics and force generation[J].ProcNatlAcadSciUSA,2015,112(21):6619-6624.
[8]WICKSTEAD B,GULL K.The evolution of the cytoskeleton[J].JCellBiol, 2011,194(4):513-525.
[9]DOS REMEDIOS C G,CHHABRA D,KEKIC M,et al.Actin binding proteins:regulation of cytoskeletal microfilaments[J].PhysiolRev,2003,83(2):433-473.
[10]SUETSUGU S,TAKENAWA T.Regulation of cortical actin networks in cell migration[J].IntRevCytol,2003,229:245-286.
[11]HAASE S,ZIMMERMANN D,OLSHINA M A,et al.Disassembly activity of actin-depolymerizing factor(ADF) is associated with distinct cellular processes in apicomplexan parasites[J].MolBiolCell,2015,26(17):3001-3012.
[12]GONZALEZ V,COMBE A,DAVID V,et al.Host cell entry by apicomplexa parasites requires actin polymerization in the host cell[J].CellHostMicrobe,2009,5(3):259-272.
[13]MILIOTIS M D,TALL B D,GRAY R T.Adherence to and invasion of tissue culture cells byVibriohollisae[J].InfectImmun,1995,63(12):4959-4963.
[14]GAJI R Y,HUYNH M H,CARRUTHERS V B.A novel high throughput invasion screen identifies host actin regulators required for efficient cell entry byToxoplasmagondii[J].PLoSOne,2013,8(5):e64693.
[15]ELLIOTT D A,CLARK D P.Cryptosporidiumparvuminduces host cell actin accumulation at the host-parasite interface[J].InfectImmun,2000,68(4):2315-2322.
[16]FRONEY J R,DEWALD D B,YANG S,et al.A role of host phosphoinositide 3-kinase and cytoskeletal remodeing duringCryptosoridiumparvuminfection[J].InfectImmun,1999,67(2):844-852.
[17]OLSHINA M A,ANGRISANO F,MARAPANA D S,et al.Plasmodium falciparum coronin organizes arrays of parallel actin filaments potentially guiding directional motility in invasive malaria parasites[J].MalarJ,2015,14:280.
[18]CHEN X M,LARUSSO N F.Mechanisms of attachment and internalization ofCryptosporidiumparvumto biliary and intestinal epithelial cells[J].Gastroenterology,2000,118(2):368-379.
[19]BUMSTEAD J,TOMLEY F.Induction of secretion and surface capping of microneme proteins inEimeriatenella[J].MolBiochemParasitol,2000,110(2):311-321.
[20]CALDAS L A,SEABRA S H,ATTIAS M,et al.The effect of kinase,actin,myosin and dynamin inhibitors on host cell egress byToxoplasmagondii[J].ParasitolInt,2013,62(5):475-482.
[21]ELLIOTT D A,COLEMAN D J,LANE M A,et al.Cryptosporidiumparvuminfection requires host cell actin polymerization[J].InfectImmun,2001,69(9):5940-5942.
[22]PEREZ-CORDON G,NIE W,SCHMIDT D,et al.Involvement of host calpain in the invasion ofCryptosporidiumparvum[J].MicrobesInfect,2011,13(1):103-107.
[23]WETZEL D M,SCHMIDT J,KUHLENSCHMIDT M S,et al.Gliding motility leads to active cellular invasion byCryptosporidiumparvumsporozoites[J].InfectImmun,2005,73(9):5379-5387.
[24]WINKELMAN J D,BILANCIA C G,PEIFER M,et al.Ena/VASP Enabled is a highly processive actin polymerase tailored to self-assemble parallel-bundled F-actin networks with Fascin[J].ProcNatlAcadSciUSA,2014,111(11):4121-4126.
[25]WEI L,SURMA M,GOUGH G,et al.Dissecting the mechanisms of doxorubicin and oxidative stress-induced cytotoxicity:The involvement of actin cytoskeleton and ROCK1[J].PLoSOne,2015,10(7):e0131763.
[26]MASTERS T A,PONTES B,VIASNOFF V,et al.Plasma membrane tension orchestrates membrane trafficking,cytoskeletal remodeling,and biochemical signaling during phagocytosis[J].ProcNatlAcadSciUSA,2013,110(29):11875-11880.
[27]GRIERA M,MARTIN-VILLAR E,BANON-RODRGUEZ I,et al.Integrin linked kinase(ILK) regulates podosome maturation and stability in dendritic cells[J].IntJBiochemCellBiol,2014,50:47-54.
[28]SAWHNEY R S,COOKSON M M,OMAR Y,et al.Integrin alpha2-mediated ERK and calpain activation play a critical role in cell adhesion and motility via focal adhesion kinase signaling:identification of a novel signaling pathway[J].JBiolChem,2006,281(13):8497-8510.
[29]ZHENG K,KITAZATO K,WANG Y,et al.Pathogenic microbes manipulate cofilin activity to subvert actin cytoskeleton[J].CritRevMicrobiol,2015,8:1-19.
[30]CHEVALIER S A,TURPIN J,CACHAT A,et al.Gem-induced cytoskeleton remodeling increases cellular migration of HTLV-1-infected cells,formation of infected-to-target T-cell conjugates and viral transmission[J].PLoSPathog,2014,10(2):e1003917.
[31]SCHAFER D A,JENNINGS P B,COOPER J A.Dynamics of capping protein and actin assemblyinvitro:uncapping barbed ends by polyphosphoinositides[J].JCellBiol,1996,135(1):169-179.
[32]CHEN X M,LARUSSO N F.Mechanisms of attachment and internalization ofCryptosporidiumparvumto biliary and intestinal epithelial cells[J].Gastroenterology,2000,118(2):368-379.
[33]CONDEELIS J.How is actin polymerization nucleatedinvivo?[J].TrendsCellBiol,2001,11(7):288-293.
[34]DOBROWOLSKI J M,SIBLEY L D.Toxoplasmainvasion of mammalian cells is powered by the actin cytoskeleton of the parasite[J].Cell,1996,84(6):933-939.
[35]WIESNER S,LEGATE K R,FSSLER R.Integrin-actin interactions[J].CellMolLifeSci,2005,62(10):1081-1099.
[36]MORGNER J,WICKSTRÖM S A.The weakest link:a new paradigm for stabilizing the integrin-actin connection[J].CellCycle,2013,12(18):2929-2930.
[37]AGERER F,LUX S,MICHEL A,et al.Cellular invasion by Staphylococcus aureus reveals a functional link between focal adhesion kinase and cortactin in integrin-mediated internalisation[J].JCellSci,2005,118(10):2189-2200.
[38]OZAKI I,HAMAJIMA H,MATSUHASHI S,et al.Regulation of TGF-β1-induced pro-apoptotic signaling by growth factor receptors and extracellular matrix receptor integrins in the liver[J].FrontPhysiol,2011,2:78.
[40]ZHANG H L,GUO F G,ZHU G.Involvement of host cell integrin α2 inCryptosporidiumparvuminfection[J].InfectImmun,2012,80(5):1753-1758.
(编辑白永平)
A Role for Host Cell F-actin Polymerization during the Protozoan Parasite Infection
WU Cai-yan1,2#,WANG Zhen1,2#,LI Juan1,LIN Xu-hui1,LIAO Shen-quan1,QI Nan-shan1,LÜ Min-na1,SUN Ming-fei1*
(1.GuangdongProvincialKeyLaboratoryofLivestockDiseasePrevention,GuangdongOpenLaboratoryofVeterinaryPublicHealth,InstituteofAnimalHealth,GuangdongAcademyofAgriculturalSciences,Guangzhou510640,China;2.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou510642,China)
Abstract:An important role for host cell F-actin polymerization caused the cytoskeleton rearrangement during the pathogen infection.This article mainly illuminate that integrin mediated host cell F-actin polymerization during the protozoan parasite invasion,the results can help to analyze the invasive mechanism and develop new drugs and vaccines of parasitic disease,so this research has very important significance.
Key words:protozoan parasite;host cell;F-actin polymerization;infection
doi:10.11843/j.issn.0366-6964.2016.03.002
收稿日期:2015-08-21
基金项目:国家自然科学基金项目(31402186);广东省农业科学院院长基金项目(201413);广东省科技计划项目(2013B031500005;2014A020208052;2014B090901035;2015A020210086;2015B050501007)
作者简介:吴彩艳(1978-),女,蒙古族,内蒙古赤峰人,副研究员,博士生,主要从事鸡球虫入侵机制的研究,E-mail:wucaiyan906@163.com;王祯(1989-),男,河南驻马店人,硕士生,E-mail:tsofts@163.com。#同等贡献作者 *通信作者:孙铭飞,博士,副研究员,主要从事寄生虫病研究,E-mail:smf7810@126.com
中图分类号:S852.72
文献标志码:A
文章编号:0366-6964(2016)03-0423-06
