不同生长时期梅花鹿鹿茸差异蛋白质组学分析
2016-07-12张然然刘华淼邵元臣周盼伊邢秀梅
张然然,刘华淼,邵元臣,周盼伊,苏 莹,王 磊,邢秀梅
(中国农业科学院特产研究所 特种经济动物分子生物学重点实验室,长春 130112)
不同生长时期梅花鹿鹿茸差异蛋白质组学分析
张然然,刘华淼,邵元臣,周盼伊,苏莹,王磊,邢秀梅*
(中国农业科学院特产研究所 特种经济动物分子生物学重点实验室,长春 130112)
摘要:旨在从分子水平认识鹿茸生长机制,本研究以10、40、60与130d的梅花鹿鹿茸为试验材料,运用双向凝胶电泳(2-DE)、质谱鉴定技术与生物信息学方法对梅花鹿鹿茸生长过程中差异表达蛋白质进行研究。结果显示,有46种蛋白质差异性表达,且主要参与细胞骨架、转运过程、信号转导、细胞凋亡、骨发育、蛋白质合成、核酸代谢、免疫、能量代谢、细胞增殖、抗氧化、蛋白质折叠等生物学过程。结合鹿茸的快速生长与快速骨化的独特生长过程,对差异表达蛋白质中的骨发育相关蛋白、抗氧化蛋白、细胞凋亡相关蛋白做进一步分析,发现P4HB、SPARC、过氧化物还原酶2、过氧化物还原酶4、半乳糖凝集素1、视黄酸结合蛋白1等6种蛋白质在鹿茸快速生长与快速骨化过程中起着重要的作用,为鹿茸生长与骨化机制的进一步研究奠定基础。
关键词:梅花鹿;鹿茸;不同生长时期;双向凝胶电泳;蛋白质组学
鹿茸是唯一完全再生的哺乳动物器官,并具有独特的生长过程。每年春天鹿角自动脱落,并从角柄上长出新鹿茸,随后快速生长并形成分支,秋天鹿茸的生长速度变慢,软骨组织逐渐骨化形成硬骨,次年春天再次脱落,开始新一轮的循环。鹿茸的生长可分为两个阶段:生长期与骨化期。在生长期,鹿茸生长速度惊人,最高可达2.75cm·d-1(加拿大马鹿)[1],同时还伴随着皮肤、神经与血管的快速生长;在骨化期,鹿茸的骨化速度急剧加快,并完成皮肤、血管、神经的退化过程。鹿茸快速生长与快速骨化的机制一直是生物学家研究的重点,但迄今仍未取得突破性进展。随着蛋白质组学技术逐渐发展成熟,可从整体水平上揭示蛋白质表达特征,实现对生物体功能的解析。现今蛋白质组学技术也逐渐应用于鹿茸生长机制的探究,如韩国学者H.J.Park等首次采用双向凝胶电泳结合MALDI-TOF质谱技术建立鹿茸蛋白质表达谱,并成功鉴定出130种蛋白质[2],使人们对鹿茸蛋白质表达特征有初步了解。
本研究以不同生长时期梅花鹿鹿茸为试验材料,应用双向凝胶电泳与MALDI-TOF-TOF质谱鉴定技术揭示鹿茸生长过程中蛋白质表达特征,从分子水平进一步认识鹿茸的生长与骨化过程。
1材料与方法
1.1化学试剂
尿素、硫脲、3-[(3-胆酰胺基丙基)二甲基铵基]-2-羟基-1-丙磺酸盐(CHAPS)、二硫苏糖醇(DTT)、两性电解质(Bio-Lyte,pH3~10)、Clean-upKit蛋白纯化试剂盒、固定化的pH梯度胶条(pH4~7,非线性)、矿物油、碘乙酰胺、丙烯酰胺、甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)、N,N,N',N'-四甲基乙二胺(TEMED)、Tris碱、过硫酸铵(AP)、甘氨酸均为Bio-Rad公司产品(Hercules,CA,USA);牛血清白蛋白(BSA)为Sigma公司产品(St.Louis,MO,USA);胰酶为Roche公司产品(Mannheim,Germany);甲醇、碳酸氢铵、三氟乙酸、乙腈、甲酸、甘油甲醛购自长春试剂公司。

图1 不同生长时期梅花鹿鹿茸组织Fig.1 Velvet antlers of sika deer in different growth stages
1.2试验样品
鹿茸均取自中国农业科学院特产研究所中心鹿场5岁梅花鹿,取样时间分别为10、40、60与130d。
1.3蛋白质提取
新鲜鹿茸组织切成1mm×1mm小块,PBS洗去鹿茸组织表面的血液及杂质,液氮研磨机研磨成细粉。取2g细粉加入10mL蛋白质裂解液(7mol·L-1尿素、2mol·L-1硫脲、4%CHAPS、65mmol·L-1DTT、0.2%Bio-Lyte、1%PMS),超声3min,冰上裂解2h,每隔30min,振荡器震荡1min。4 ℃ 20 000g离心15min,收集上清液,使用2D-cleanup蛋白纯化试剂盒进一步除去蛋白质溶液中的脂类等杂质。
1.4蛋白质浓度测定
Bradford法测定蛋白质浓度[3],BSA作标准曲线,测定595nm波长处的吸光度。
1.5双向电泳
梅花鹿鹿茸双向凝胶电泳采用pH4~7,17cmIPG非线性胶条,加入300μL蛋白质溶液,等电聚焦程序设置:50V水化 14h;100V快速升压1.5h;200V快速升压1.5h;500V快速升压1h;1 000V快速升压1.5h;10 000V线性升压6h;10 000V快速升压,最终累积增压达到70 000V,完成蛋白质等电聚焦。
将等电聚焦完全的胶条从聚焦盘中取出,湿润滤纸擦去胶条表面的矿物油,置于5mL胶条平衡缓冲液I中(6mol·L-1尿素、1%DTT、2%SDS、30%甘油和0.375mol·L-1Tris-HCl),摇床上平衡15min,时间不易过长。取出胶条,擦去表面残余液体,然后置于5mL胶条平衡缓冲液II(6mol·L-1尿素、2.5%碘乙酰胺、2%SDS、30%甘油和0.375mol·L-1Tris-HClpH8.8),摇床上避光平衡15min。完成后,将胶条转移至聚丙烯酰胺分离胶上(1.0mm厚,12%T),0.5%低熔点琼脂糖封胶液封胶,使用PROTEANxiCellII(Bio-RadHercules,CA,USA)系统,15mA·gel-1电泳1h,30mA·gel-1电泳至溴酚蓝到达胶下缘0.5cm。采用考马斯亮蓝G250染色法对 2-DE胶进行染色。
1.6凝胶扫描及质谱鉴定
凝胶用扫描仪进行扫描,分辨率为300dpi。每一时期分别进行3次生物学重复。凝胶图像用伯乐公司PDQuestTM8.0(Bio-RadHercules,CA,USA)图像分析软件进行图像剪裁、蛋白质点检测、凝胶匹配分析等步骤。将相对体积比在2倍以上的蛋白质点视为表达差异蛋白质。手动切取凝胶上的差异蛋白质点,并送至国家蛋白质组中心进行MALDI-TOF-TOF质谱分析。使用Mascot软件对质谱序列进行检索。检索条件:数据库为NCBInr;允许有1个不完全裂解位点;固定修饰为[Carboxymethyl(C)]或者[Carbamidomethyl(C)];可变修饰为[Oxidation(M)];离子选择MH+和单同位素;肽段质量数最大容许误差范围是±0.2D。匹配肽段数≥2;氨基酸序列覆盖率>5%;分值≥80分(P<0.05),被认为是鉴定成功的蛋白质。
2结果
2.1不同生长时期梅花鹿鹿茸蛋白质表达图谱分析
为了解梅花鹿鹿茸在不同生长时期蛋白质表达特征,选取10d(鹿茸生长初期)、40d(二杠茸生长末期)、60d(三杈茸生长末期)、130d(茸皮脱落)的梅花鹿鹿茸组织为试验材料,运用比较蛋白质组学方法,获得不同生长时期梅花鹿鹿茸双向凝胶电泳图谱,每个时期样品分别进行3次双向凝胶电泳试验。通过PDQuestTM软件对双向凝胶图谱进行分析发现,10、40、60和130d样品分别检测到(511±7.62)、(559±7.84)、(494±6.23)、(261±5.46)个蛋白质点,其中63个蛋白点的表达丰度存在显著差异。
2.2差异表达蛋白质的鉴定与分类
差异蛋白点经挖点、胶内酶解,以及生物公司质谱鉴定分析,并采用Mascot软件检索,63个差异蛋白点中的46个成功鉴定,蛋白质鉴定成功率约为73%。并对成功鉴定的46个差异蛋白质进行生物学功能分类,结果详见表1。它们分别参与细胞骨架、转运过程、信号转导、细胞凋亡、骨发育、蛋白质合成、核酸代谢、免疫、能量代谢、细胞增殖、抗氧化、蛋白质折叠等生物学过程。其中细胞骨架蛋白质最多(13个),占差异蛋白质总数的29%,其次是转运过程、信号转导、细胞凋亡、骨发育相关蛋白,分别有4个,占总差异蛋白质的9%,各类别蛋白质在成功鉴定的差异蛋白质总数中所占比例见图3。
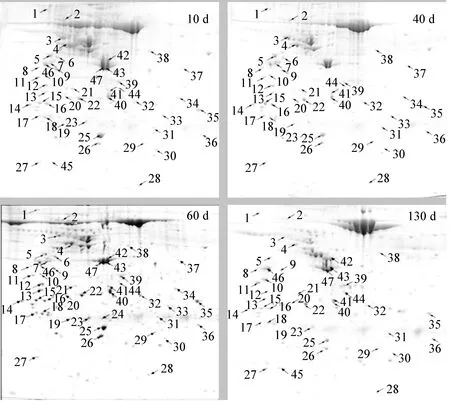
数字标出的点为鉴定蛋白质点 The marked spots were identified图2 梅花鹿鹿茸蛋白质2-DE图谱Fig.2 2-DE proteome profile of velvet antler of sika deer with different stages

表1 不同生长时期梅花鹿鹿茸差异表达蛋白质鉴定结果与功能分类

表1(续)
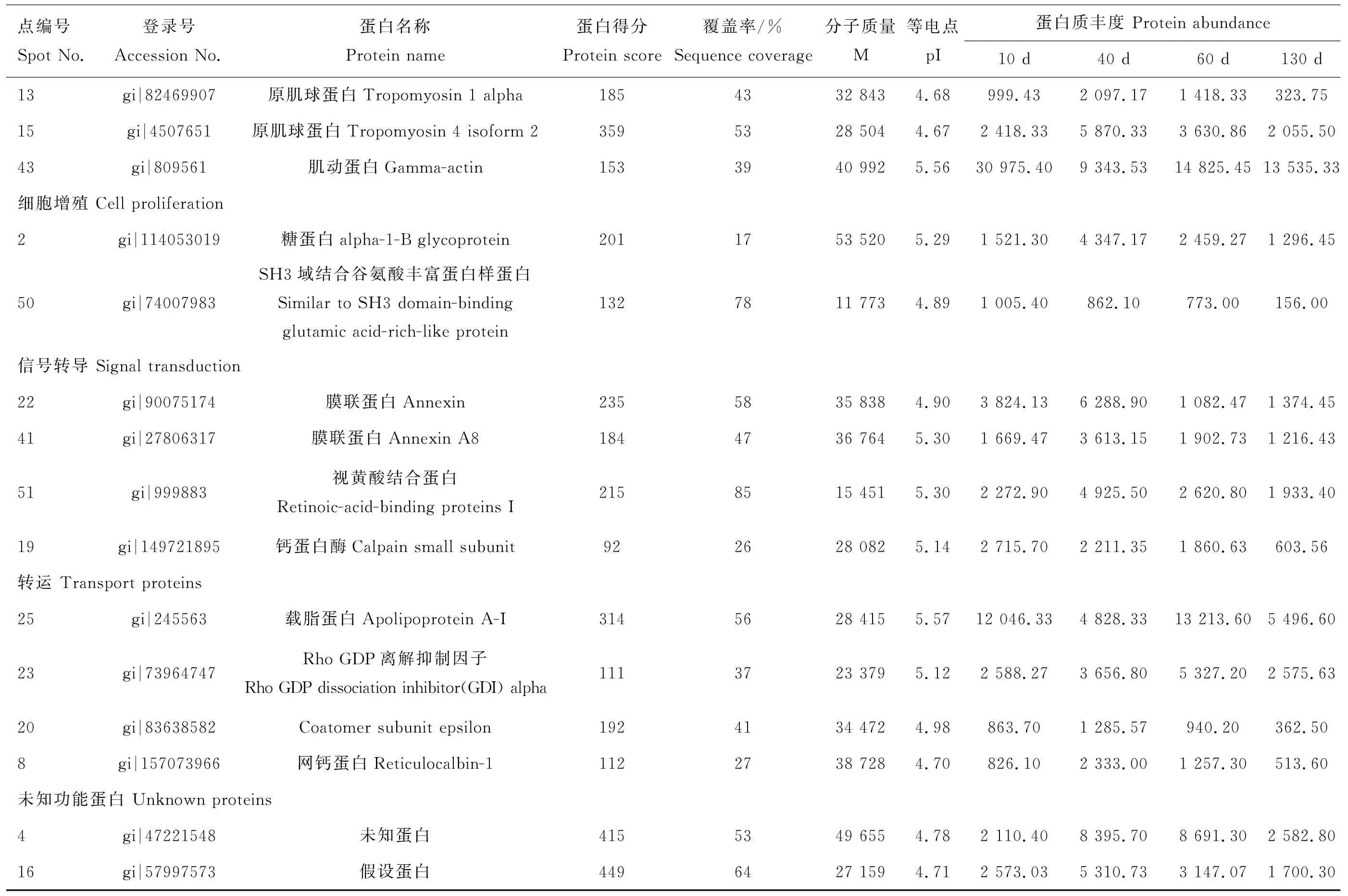
表1(续)

图3 不同生长时期梅花鹿鹿茸差异表达蛋白质功能分类Fig.3 Functional categories of the differentially expressed proteins of sika deer in different growth stages
2.3差异蛋白质层次聚类
使用Cluster3.0软件对46种差异蛋白质进行聚类分析,结果显示,10、40、60与130d鹿茸组织中分别有6、22、12与6个蛋白质表达上调。其中,10d鹿茸组织表达上调的6个蛋白质中包括蛋白质合成相关蛋白1个(点9),核酸代谢蛋白1个(点29),能量代谢蛋白1个(点30),细胞骨架蛋白1个(点43),细胞增殖蛋白1个(点50),信号转导蛋白1个(点19);40d表达上调的22个蛋白质中包括细胞骨架蛋白6个(点12、点47、点6、点1、点13、点15),细胞凋亡蛋白4个(点17、点48、点52、点5),骨发育蛋白3个(点3、点40、点46),信号转导蛋白3个(点22、点41、点51),转运蛋白2个(点20、点8),蛋白质合成相关蛋白1个(点14),能量代谢蛋白1个(点38),细胞增值蛋白1个(点2)及未知功能蛋白1个(点16);60d表达上调的12个蛋白质中包括细胞骨架蛋白3个(点32、点7、点28),转运蛋白2个(点25、点23),抗氧化蛋白2个(点26、点31),核酸代谢蛋白1个(点37),蛋白质合成相关蛋白1个(点21)、骨发育蛋白1个(点34),免疫蛋白1个(点33),未知功能蛋白1个(点4),;130d表达上调的6个蛋白质中包括细胞骨架蛋白4个(点42、点45、点10、点11),蛋白质合成相关1个(点36),免疫蛋白1个(点44)。

上调蛋白质和下调蛋白分别用红色和绿色条带,颜色的深浅代表蛋白质表达量的差异The up- or down-regulated proteins are indicated in red and blue,respectively.The intensity of the colors increases with increasing expression differences as shown on the top of the indicator图4 差异蛋白质层次聚类分析Fig.4 Hierarchical clustering of significant differential proteins
3讨论
鹿茸具有独特的生长过程,其快速生长与快速骨化的机制一直是生物学家研究的重点。本研究中发现有46种蛋白质在鹿茸生长过程中发生显著性差异表达,且主要参与了12个生物学过程,其中骨发育、抗氧化与细胞凋亡生物过程在鹿茸的快速生长与骨化过程中尤为重要。
鹿茸的快速生长是通过软骨内骨化过程实现的,软骨细胞增殖、分化为肥大软骨细胞,然后逐渐被骨组织所代替[4]。本研究中鉴定出4种骨发育相关蛋白质,并在鹿茸生长过程中发生了显著性差异表达,分别为Ⅰ型胶原蛋白前体、Ⅱ型胶原蛋白、P4HB、SPARC。其中P4HB与SPARC可促进胶原蛋白的折叠、加工、分泌与成熟,在骨重建及骨量维持中具有重要作用[5-7]。另外,SPARC可趋化并诱导多能间充质干细胞向成骨细胞分化,是正常成骨细胞形成、成熟和存活所必须的因子[8-10]。鹿茸生长过程中P4HB与SPARC表达水平的变化预示着这两种蛋白可能与鹿茸骨化过程的发生与发展密切相关。
鹿茸旺盛的代谢活动势必会产生较多的活性氧,如氧离子、过氧化氢、羟基自由基等,这些物质的大量积累会导致细胞结构、基因结构、生物大分子的破坏,严重时可导致细胞和组织的死亡[11]。研究显示,抗氧化蛋白过氧化物酶广泛存在于鹿茸组织中,包括过氧化物还原酶1、过氧化物还原酶2、过氧化物还原酶3、过氧化物还原酶4、过氧化物还原酶6[12-14],其中过氧化物还原酶2与过氧化物还原酶4的表达水平在鹿茸生长过程中发生了显著性变化。过氧化物还原酶除了抗氧化活性,还参与各种生物功能,例如细胞增殖、分化、凋亡、基因表达、细胞内信号传导等生物过程[15-16]。其中过氧化物还原酶2又称为自然杀伤细胞增强因子(NK-EF-B),能够在细胞病变或者受到严重损伤时保护组织免受进一步的损害,而且能增强肿瘤细胞对抗肿瘤药物的抵抗能力[17]。本研究结果显示,过氧化物还原酶2与过氧化物还原酶4的表达量随鹿茸生长速度的增快而逐渐增加,表明在鹿茸快速生长过程中过氧化物还原酶在抵抗氧化损伤中发挥着极其重要的作用。
鹿茸的快速生长主要取决于其生长中心细胞的分裂繁殖速度,其速度比癌细胞还要快三十几倍[18],但在如此快速生长状态下,鹿茸并没有出现癌变的迹象,而是有条不紊的完成自身的快速生长过程,所以鹿茸可能具有一种特殊的调控机制防止癌变的发生。本研究中发现半乳糖凝集素1在鹿茸生长过程中发生了显著差异表达,该蛋白是一种细胞凋亡相关蛋白,也是鹿茸干细胞重要的信号分子[14],可通过与NANOG、MYCN与SMAD4相互作用参与角柄骨膜干细胞的14-3-3信号通路,从而促进角柄骨膜干细胞的分化过程,在鹿茸生长过程中具有重要的调节作用。在人体内,半乳糖凝集素1的过表达通常会引起癌症的发生,而鹿茸中半乳糖凝集素的过表达并没有引起鹿茸组织的癌变。半乳糖凝集素1的表达通常受多种因子的调控,包括视黄酸[19]。视黄酸作为一种重要的信号分子,不仅能够调控蝾螈断肢的再生[20],还能够调控成骨细胞与破骨细胞的分化过程[21],在鹿茸再生中起重要调控作用。本研究中发现半乳糖凝集素1与视黄酸结合蛋白1的表达模式是一致的,因此推测视黄酸可能是调控半乳糖凝集素1防止鹿茸癌变的重要信号分子之一。
4结论
本研究通过蛋白质组学技术对梅花鹿鹿茸生长过程中蛋白质表达特征有了初步了解,又结合鹿茸的快速生长与快速骨化的独特生长过程,对差异表达蛋白质中的骨发育相关蛋白、抗氧化蛋白、细胞凋亡相关蛋白作进一步分析,并发现P4HB、SPARC、过氧化物还原酶2、过氧化物还原酶4、半乳糖凝集素1、视黄酸结合蛋白1在鹿茸的快速生长与快速骨化过程中起着重要的作用,为鹿茸生长与骨化机制的进一步研究奠定基础。
参考文献(References):
[1]SUIZG,ZHANGLH,HUOYS,etal.Bioactivecomponentsofvelvetantlersandtheirpharmacologicalproperties[J].J Pharm Biomed Anal,2014,87:229-240.
[2]PARKHJ,LEEDH,PARKSG.Proteomeanalysisofreddeerantlers[J].Proteomics,2004,4(11):3642-3653.
[3]BRADFORDMM.Arapidandsensitivemethodforthequantitationofmicrogramquantitiesofproteinutilizingtheprincipleofprotein-dyebinding[J].Anal Biochem,1976,72:248-254.
[4]LIC,SUTTIEJM.Lightmicroscopicstudiesofpedicleandearlyfirstantlerdevelopmentinreddeer(Cervuselaphus)[J].Anat Rec,1994,239(2):198-215.
[5]CHUAJ,SEETLF,JIANGY.IncreasedSPARCexpressioninprimaryangleclosureglaucomairis[J].Mol Vis,2008,14:1886-1892.
[6]PAJUNENL,JONESTA,GODDARDA.Regionalassignmentofthehumangenecodingforamultifunctionalpolypeptide(P4HB)actingasthebeta-subunitofprolyl4-hydroxylaseandtheenzymeproteindisulfideisomeraseto17q25[J].Cytogenet Cell Genet,1991,56(3-4):165-168.
[7]TERMINEJD,KLEINMANHK,WHITSONSW,etal.Osteonectin,abone-specificproteinlinkingmineraltocollagen[J].Cell,1981,26(1Pt1):99-105.
[8]BRADSHAWAD,SAGEEH.SPARC,amatricellularproteinthatfunctionsincellulardifferentiationandtissueresponsetoinjury[J].J Clin Invest,2001,107(9):1049-1054.
[9]DELANYAM,HANKENSONKD.Thrombospondin-2andSPARC/osteonectinarecriticalregulatorsofboneremodeling[J].J Cell Commun Signal,2009,3(3-4):227-238.
[10]MACHADODOREISL,KESSLERCB,ADAMSDJ,etal.Accentuatedosteoclasticresponsetoparathyroidhormoneunderminesbonemassacquisitioninosteonectin-nullmice[J].Bone,2008,43(2):264-273.
[11]GIUSTARINID,DALLE-DONNEI,TSIKASD,etal.Oxidativestressandhumandiseases:Origin,link,measurement,mechanisms,andbiomarkers[J].Crit Rev Clin Lab Sci,2009,46(5-6):241-281.
[12]徐代勋.梅花鹿鹿茸角柄骨膜不同部位差异蛋白的筛选[D].镇江:江苏科技大学,2011.
XUDX.ScreeningofdifferentialproteinsindifferentpartsofpedicleperiosteumofSikadeer[D].Zhenjiang:JiangsuUniversityofScienceandTechnology,2011.(inChinese)
[13]赵东.梅花鹿鹿茸双向电泳体系建立及蛋白质组学的研究[D].镇江:江苏科技大学,2012.
ZHAOD.Establishmentoftwo-dimensionalelectrophoresissystemandproteomeanalysisofSikadeerantler[D].Zhenjiang:JiangsuUniversityofScienceandTechnology,2012.(inChinese)
[14]LIC,HARPERA,PUDDICKJ,etal.Proteomesandsignallingpathwaysofantlerstemcells[J].PLoS One,2012,7(1):e30026.
[15]ARANM,FERRERODS,PAGANOE,etal.Typical2-Cysperoxiredoxins--modulationbycovalenttransformationsandnoncovalentinteractions[J].FEBS J(Online),2009,276(9):2478-2493.
[16]RHEESG,CHAEHZ,KIMK.Peroxiredoxins:Ahistoricaloverviewandspeculativepreviewofnovelmechanismsandemergingconceptsincellsignaling[J].Free Radic Bio Med,2005,38(12):1543-1552.
[17]任丽平.鮸鱼过氧化物还原酶Peroxiredoxin基因的分子克隆与表达分析[D].舟山:浙江海洋学院,2014.
RENLP.MolecularcloningandexpressionofperoxiredoxinsfromMiichthysmiiuy,miiuycroaker[D].Zhoushan:ZhejiangOceanUniversity,2014.(inChinese)
[18]冯海华,闭兴明,赵丽红,等.胰岛素样生长因子1对不同生长时期鹿茸生长中心细胞体外增殖的影响[J].中国组织工程研究与临床康复,2007,11(37):7373-7376.
FENGHH,BIXM,ZHAOLH,etal.Effectsofinsulin-likegrowthfactor1onthein vitroproliferationofantlerorganiccentercellsatdifferentgrowingperiods[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2007,11(37):7373-7376.(inChinese)
[19]LUY,LOTAND,LOTANR.Differentialregulationofconstitutiveandretinoicacid-inducedgalectin-1genetranscriptioninmurineembryonalcarcinomaandmyoblasticcells[J].Biochim Biophys Acta,2000,1491(1-3):13-19.
[20]BLUMN,BEGEMANNG.Therolesofendogenousretinoidsignalinginorganandappendageregeneration[J].Cell Mol Life Sci,2013,70(20):3907-3927.
[21]WESTONAD,HOFFMANLM,UNDERHILLTM.Revisitingtheroleofretinoidsignalinginskeletaldevelopment[J].Birth Defects Res C Embryo Today,2003,69(2):156-173.
(编辑 程金华)
ComparativeProteomicAnalysisinDifferentGrowthStagesofSikaDeerVelvetAntler
ZHANGRan-ran,LIUHua-miao,SHAOYuan-chen,ZHOUPan-yi,SUYing,WANGLei,XINGXiu-mei*
(State Key Laboratory of Special Economic Animal Molecular Biology,Institute of Special Wild Economic Animal and Plant Science,Chinese Academy of Agricultural Sciences,Changchun 130112,China)
Abstract:Tounderstandthevelvetantlerdevelopmentmechanisminthelevelmolecularbiology,proteomedifferencesofthesikadeervelvetantlersaged10,40,60and130dwerecomparedusing2-DE,massspectrometryandbioinformatics.Therefore,46proteinswerealteredtheirexpressionsinthesikadeervelvetantlersaged10,40,60and130d,whichwereinvolvedincytoskeleton,transportation,signaltransduction,apoptoticprocess,bonedevelopment,proteinsynthesis,nucleotidebiosynthesis,immunity,energymetabolism,cellproliferationandantioxidantactivityandproteinfolding.Wefocusedontheproteinsinvolvedinbonedevelopment,antioxidantactivityandapoptoticprocessduetothespecialgrowthprocesswithrapidlygrowthandossification.Therefore,Theresultsshowedthatseveralproteins(P4HB,SPARC,peroxiredoxin2,peroxiredoxin4,galectin1andretinoicacidbindingprotein1)mightplayvitalroleinthevelvetantlergrowthandossificationprocess.Takentogether,theresultprovidedabasisforfurtherresearchonthemolecularmechanismsinvolvedintheacceleratedgrowthandossificationofdeervelvetantler.
Keywords:sikadeer;velvetantler;differentgrowthstages;twodimensionalgelelectrophoresis;proteome
doi:10.11843/j.issn.0366-6964.2016.03.010
收稿日期:2015-07-30
基金项目:特种动物遗传资源创新团队(CAAS-ASTIP-201X-ISAPS);特种动物种质资源平台
作者简介:张然然(1990-),女,河北衡水人,硕士,主要从事特种经济动物种质资源保护与遗传育种研究,E-mail:heavenranran@163.com *通信作者:邢秀梅,研究员,E-mail:xingxiumei2004@126.com
中图分类号:S825.2
文献标志码:A
文章编号:0366-6964(2016)03-0493-09
