绵羊线粒体基因变异与产羔数性状的关联分析
2016-07-12陈晓勇孙洪新康振江敦伟涛赵兴波
陈晓勇,孙洪新,袁 明,康振江,敦伟涛*,赵兴波
(1.中国农业大学动物科技学院,北京 100193; 2.河北省畜牧兽医研究所,保定 071000;3.河北省畜牧良种工作站,石家庄 050000)
绵羊线粒体基因变异与产羔数性状的关联分析
陈晓勇1,2,孙洪新2,袁明3,康振江3,敦伟涛2*,赵兴波1*
(1.中国农业大学动物科技学院,北京 100193; 2.河北省畜牧兽医研究所,保定 071000;3.河北省畜牧良种工作站,石家庄 050000)
摘要:本研究旨在分析mtDNA变异与产羔数性状的关系。以杜泊、陶赛特、萨福克绵羊为研究对象,通过线粒体基因组测序、基因型分析等技术发现,杜泊羊线粒体基因组编码区存在25个突变位点,包括rRNA突变位点2个,tRNA突变位点2个,多肽编码基因突变位点21个(包括错义突变9个和同义突变12个);陶赛特羊线粒体基因组编码区存在20个突变位点,包括rRNA突变位点5个,tRNA突变位点1个,多肽编码基因突变位点14个(包括错义突变3个和同义突变11个);萨福克羊线粒体基因组编码区存在77个突变位点,包括rRNA突变位点7个,tRNA突变位点3个,多肽编码基因突变位点67个(包括错义突变7个和同义突变60个)。杜泊、陶赛特绵羊mtDNA各突变位点均与产羔数关联不显著;萨福克绵羊中发现的14个变异位点与产羔数显著相关(P<0.05),其中单个突变位点(T7759C)和单倍型(ATTCATTAAACTTT)最大效应均为0.22只·胎-1。结果表明,杜泊、陶赛特绵羊产羔数性状线粒体基因效应不显著;萨福克绵羊mtDNA变异与产羔数显著相关。
关键词:线粒体编码基因;产羔数;绵羊;遗传变异;基因效应
在动物育种中,线粒体基因(mtDNA)作为核外遗传物质,其遗传效应对经济性状的作用不容忽视,畜禽核外遗传效应最早于20世纪80年代在奶牛产奶性状的研究中提出,之后在猪、鸡、鸭、绵羊等畜种上陆续发现。如鸡的屠宰性状[1]、奶牛的产奶性状[2-3]、肉牛的生长[4]和肉质性状[5-6]、猪的繁殖[7]和肉质性状[8]、绵羊的生长性状[9]和繁殖性状[10]等。尽管mtDNA影响畜禽重要经济性状的研究时有报道,但长期以来存在争议[11-12]。因此,开展系统的线粒体基因组遗传变异研究,验证其基因效应是动物遗传育种理论的重要补充和完善。
产羔数是绵羊生产中重要的经济性状之一,长期以来,产羔数性状的研究主要集中在核基因上,线粒体基因变异与产羔数性状存在关联的研究也有报道,但存在较大争议。自20世纪90年代以来,我国从国外引入了一些肉用绵羊品种,包括杜泊、陶赛特、萨福克羊等。从基因组角度研究线粒体基因与产羔数性状的关系,将有助于全面认知绵羊产羔数性状的遗传机理。因此,本研究以杜泊、陶赛特、萨福克3个肉用绵羊品种为研究对象,进行线粒体基因组遗传变异分析,并对线粒体基因功能变异与产羔数性状作关联分析,目的是分析产羔数性状线粒体基因效应。
1材料与方法
1.1试验动物和DNA提取
肉用绵羊血液及生产数据来自河北省畜牧良种工作站种羊场。杜泊绵羊共17个家系77只母羊,217次产羔记录。陶赛特绵羊共 17个家系81只母羊,267次产羔记录。萨福克绵羊共21个家系90只母羊,251次产羔记录。试验母羊年龄为4~6岁,胎次在3胎以上。配制20 mmol·L-1EDTA(二钠盐)作为抗凝剂,高压灭菌,在每个样品管(2 mL EP管)中加入300 μL灭菌后的EDTA,放入离心管盒子待用。利用5 mL注射器由颈静脉采集全血(每只羊一个注射器),每个样品采集血液1.5 mL 左右,装入备好含有抗凝剂的2 mL EP管中,并做好耳标标记,将血液样品置于含有冰盒的保温箱内,待采血结束后带回实验室。采用酚氯仿方法提取总DNA。
1.2线粒体基因组测序
参照绵羊线粒体基因组序列(GenBank No.:AF010406),使用Primer premier version 5设计覆盖绵羊线粒体基因组序列引物,每段序列长度1~1.2 kb,相邻片段有100 bp左右的重叠区域。引物信息见表1。
PCR反应体系(25 μL):ddH2O 17.85 μL,10×PCR buffer 2.5 μL,dNTP(10 mmol·L-1) 0.5 μL,上游引物(10 mmol·L-1) 1.0 μL,下游引物(10 mmol·L-1) 1.0 μL,TaqDNA Polymerase(5 U·μL-1) 0.15 μL,DNA模板2 μL。反应条件:95 ℃预变性5 min; 95 ℃变性20 s,退火30 s(退火温度Tm见表1),72 ℃延伸90 s,35个循环;72 ℃延伸7 min;4 ℃保存。将PCR产物纯化后直接测序,获得DNA序列信息。
参考已公开的绵羊线粒体全基因组序列(GenBank No.:AF010406),利用DNASTAR软件中SeqMan模块将测序获得的每一段基因序列进行比对、拼接,获得绵羊线粒体全基因组序列。
1.3变异位点分析
以GenBank上公布的绵羊线粒体基因组全序列(GenBank No.:AF010406)为参考序列,使用DNAStar软件包中SeqMan软件将18对不同引物所测定的片段拼接为完整的基因组全序列,并根据测序峰图和序列比对获得遗传变异信息。使用DNAMAN7.0选择脊椎动物线粒体密码子对所有位点进行翻译,分析突变位点。
1.4关联分析
本研究用SAS9.0统计分析软件广义线性模型(GLM)中的LSM过程对每个品种中变异位点与产羔数分别进行关联分析,并做方差显著性检验。
Yijk为产羔数性状表型值,μ为群体平均值,Si为突变位点效应,Pj为胎次效应,eijk为环境误差。
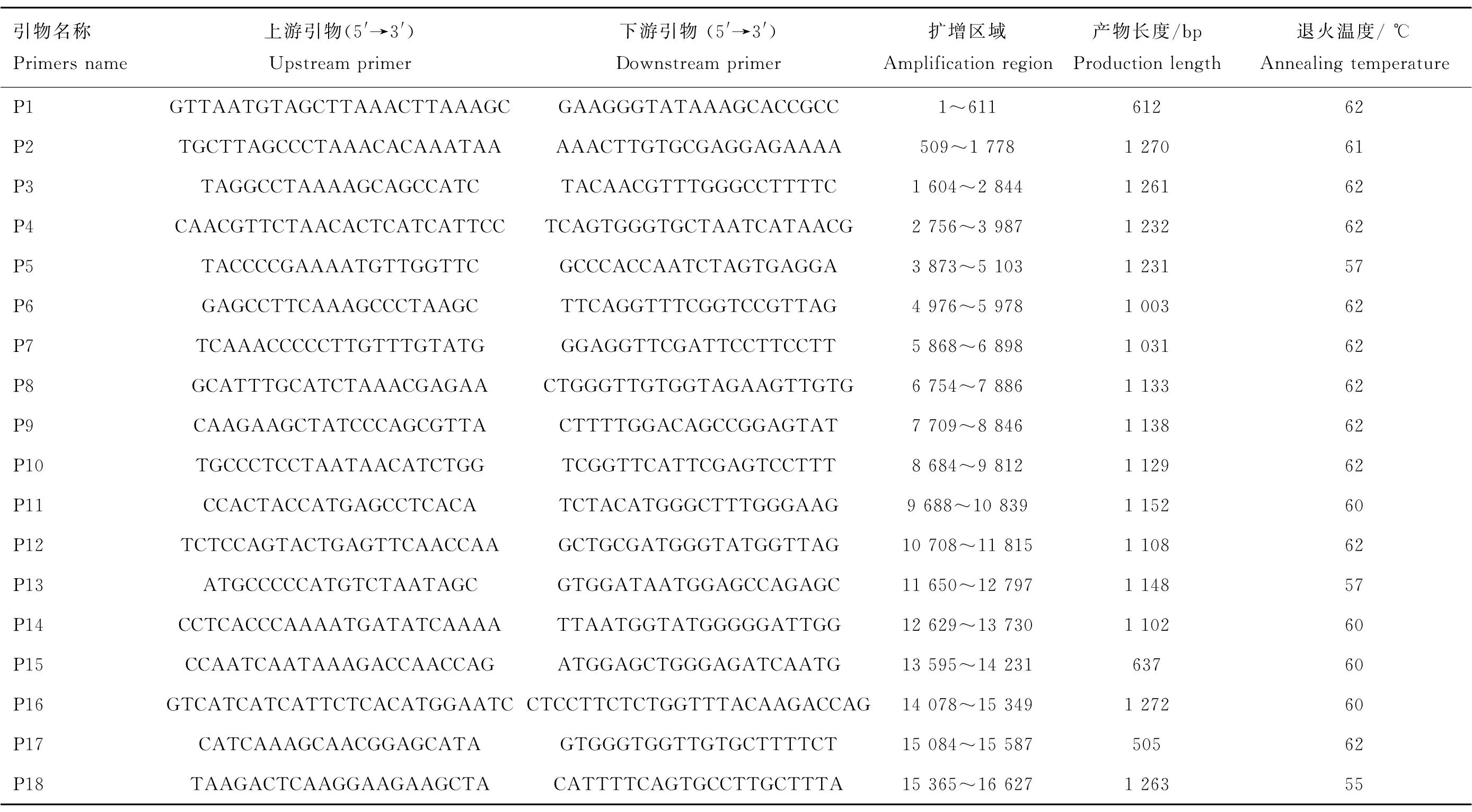
表1 绵羊线粒体基因组遗传变异分析PCR引物信息
2结果
2.1肉用绵羊线粒体基因组变异分析
杜泊绵羊线粒体基因组共检测到25个变异位点,其中多肽编码区21个,12S rRNA基因2个(T281C和A542T),tRNA基因2个(A4975T/tRNA-Trp和G11668A/tRNA-Ser),多肽编码区有9个错义突变(T3543A/ND1、T7063C/COII、G8264C/ATPase6、A8515G/ATPase6、G9117A/COIII、A9375G/COIII、G12571C/ND5、G13813C/ND6、G14459A/Cytb)。陶赛特绵羊线粒体基因组编码区共检测到20个突变位点,rRNA有5个,包括12SrRNA 3个(G711A、T809C、T958C)和16SrRNA 2个(T1112、C1162T);tRNA 基因有1个突变位点(tRNA-Lys/T7759C),多肽编码区有14个变异位点,其中3个错义突变(A7904G/ATPase 8、A8054G/ATPase 6、A8515G/ATPase 6)。萨福克绵羊线粒体基因组编码区共检测到77个变异位点,其中多肽编码区共67个,12SrRNA和16SrRNA分别含有3个变异位点(C291T、A394T、A542T)和4个变异位点(A1099T、T1112C、T1933G、C2443T),tRNA基因检测到3个变异位点(T7719G /tRNA-Lys、T7759C/ tRNA-Lys和C11606T/ tRNA-His),13个多肽编码区含有7个错义突变(A3949G/ND2、A8039G/ATPase6、A8515G/ATPase6、A8779G/COIII、C13576T/ND6、T13837C/ND6、C13855T/ND6)(表2)。
2.2肉用绵羊mtDNA功能变异位点与产羔数性状关联分析
2.2.1杜泊绵羊mtDNA功能变异位点与产羔数的关联分析关联分析结果发现,杜泊绵羊mtDNA的13个非同义突变(多肽编码区错义突变、rRNA和tRNA基因突变位点)对产羔数均无显著影响(P>0.05)(图1)。
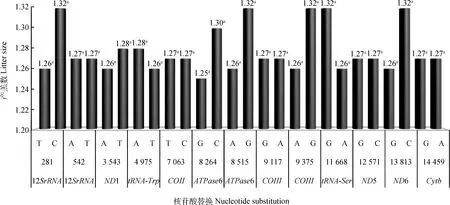
突变位点间柱形图上相同字母表示差异不显著(P>0.05)。横坐标数字代表线粒体基因组变异位点。下图同Same letters on the column means no significant difference between mutation sites(P>0.05).The number below abscissa represent the variation sites in the mitochondrial genome.The same as below图1 杜泊绵羊线粒体变异位点对产羔数的影响Fig.1 The effects of mtDNA variant sites on litter size in Dorper sheep
2.2.2陶赛特绵羊mtDNA功能变异位点与产羔数的关联分析关联分析结果发现,陶赛特绵羊mtDNA的9个非同义突变(多肽编码区错义突变、rRNA和tRNA基因突变位点)均对产羔数无显著影响(P>0.05)(图2)。
2.2.3萨福克绵羊mtDNA功能变异位点与产羔数的关联分析利用SAS9.0最小二乘法对萨福克绵羊mtDNA的17个变异位点分别与产羔数进行关联分析,结果显示,12S rRNA区域的3个变异位点(C291T、A394T、A542T)对产羔数均无显著影响(P>0.05)。而16S rRNA区域的4个变异位点(A1099T、T1112C、T1932G、C2443T)、tRNA-Lys基因2个变异位点(T7719G、T7759C)、tRNA-His基因的1个变异位点(C11606T)、以及多肽编码区的7个错义突变位点(A3949G、A8039G、A8515G、A8779G、C13576T、T13837C、C13855T)对产羔数影响显著(P< 0.05)(表3)。
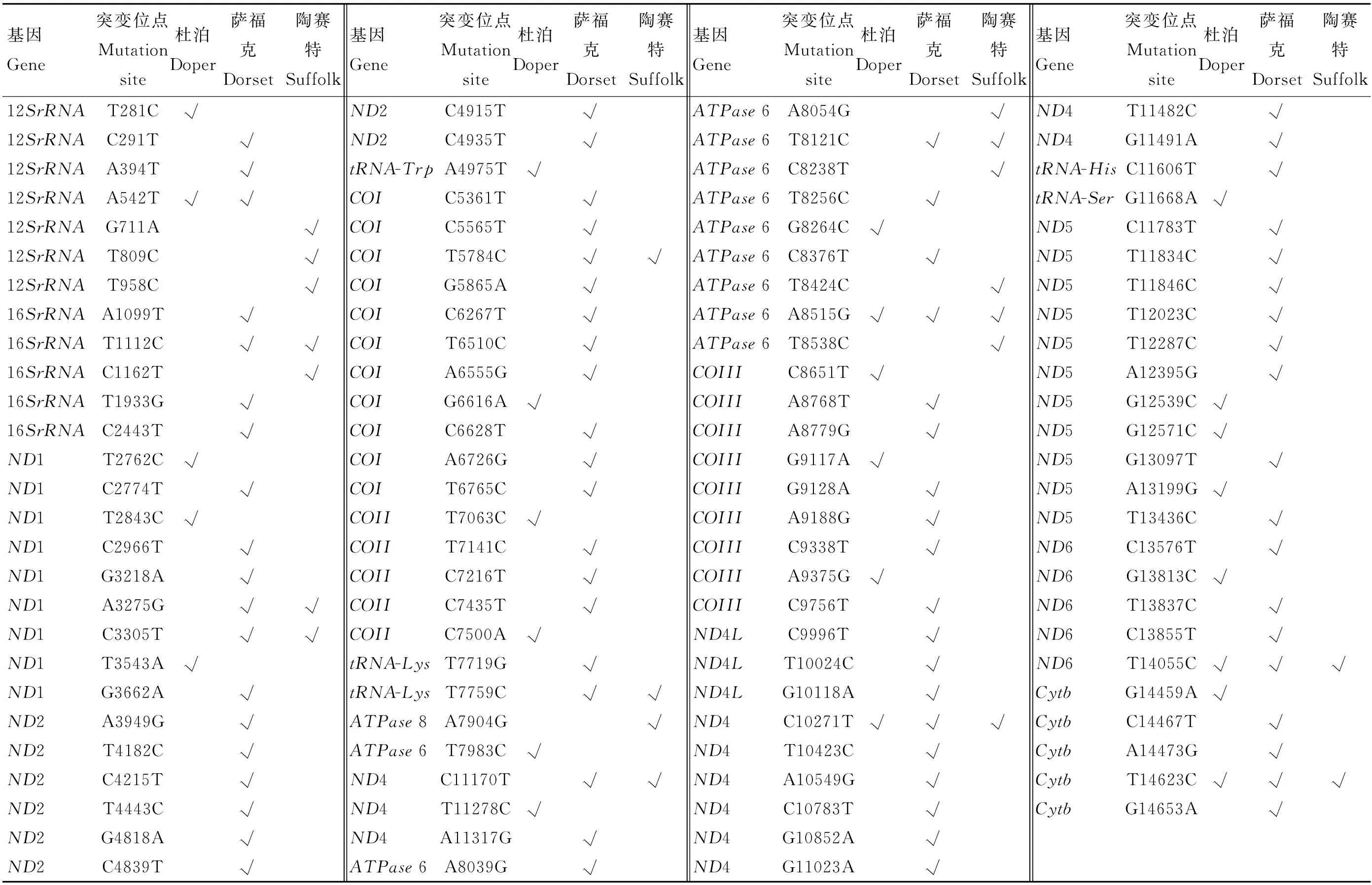
表2 不同品种绵羊线粒体基因组突变位点比较
与产羔数显著相关的突变位点分为7个单倍型。有4个个体数小于5%的稀有单倍型(TCGTGTTAGGTCCC、TCGTGTTAAACTTC、ATGT-ATTAAACTTC、TCGTGGCAGGTCCC),线性模型分析表明,ATTCATTAAACTTT单倍型母羊产羔数显著大于其他单倍型TCGTGGCGGGTCCC(P=0.005)(表4)。产羔数最大单倍型效应为0.22只·胎-1。

图2 陶赛特绵羊线粒体变异位点对产羔数的影响Fig.2 The effects of mtDNA variant sites on litter size in Dorset sheep
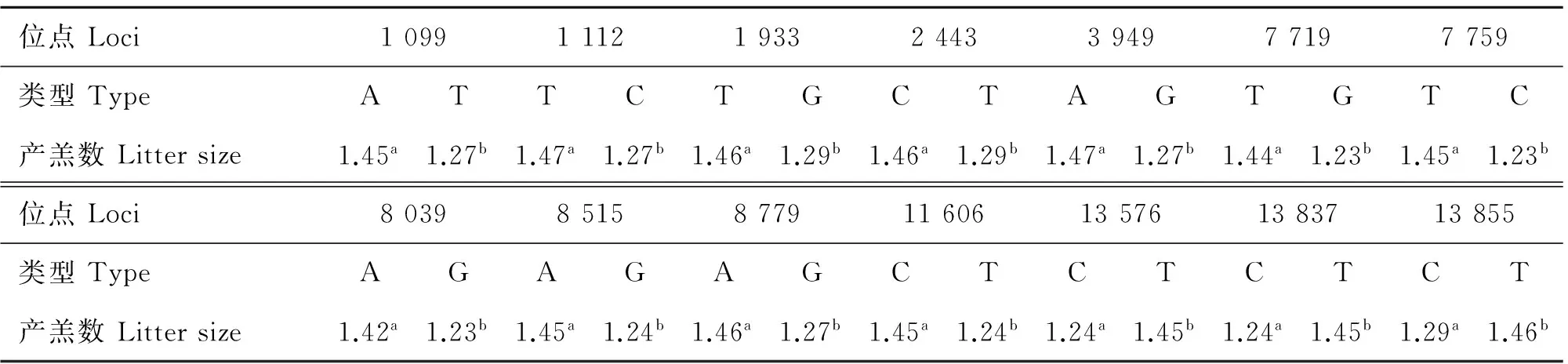
表3 萨福克绵羊线粒体基因显著非同义突变位点对产羔数的影响
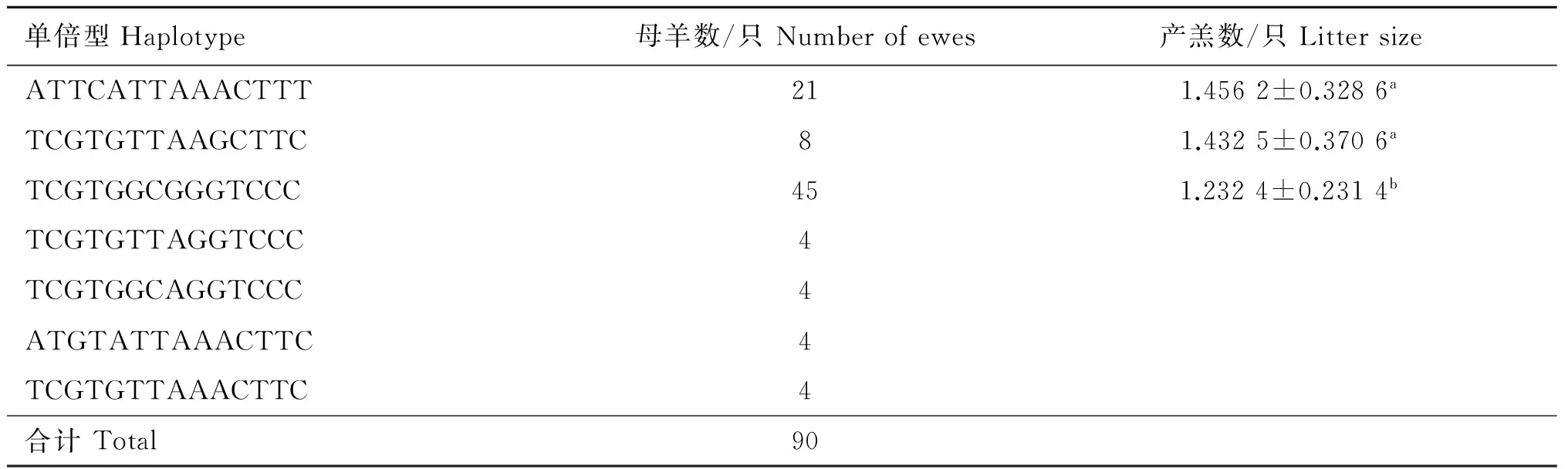
表4 基于14个显著突变位点的单倍型对产羔数性状的影响
3讨论
虽然很早就有报道mtDNA会影响动物的经济性状,但一直存在争议,且研究进展较核基因慢,近年来也有mtDNA 某个基因片段多态性与经济性状关联分析的报道,但多数是基于单个基因的几个SNP研究[10]。S.Reicher等报道,Afec-Assaf羊线粒体基因组有245个变异位点,其中26个非同义突变[10],本研究中杜泊绵羊线粒体基因组多肽编码区和tRNA基因有7个突变位点(T3543A、C7500A、G8264C、A9375G、G11668A、G12571C、T14055C)与Afec-Assaf羊相同[10];陶赛特绵羊线粒体基因组多肽编码区和tRNA基因有2个突变位点(T7759C、T14055C)与Afec-Assaf羊相同;萨福克绵羊线粒体基因组多肽编码区和tRNA基因有5个突变位点(T7719G、T7759C、A8039G、C11606T、T14055C)与Afec-Assaf羊相同。
本研究对肉用绵羊线粒体基因组变异与产羔数进行了关联分析,结果杜泊和陶赛特绵羊线粒体基因组功能突变对产羔数性状均无显著影响,说明杜泊和陶赛特这两个品种线粒体遗传变异对产羔数性状影响较小,萨福克绵羊线粒体基因组发现的14个mtDNA突变位点与产羔数性状显著相关,表明萨福克绵羊线粒体基因组变异影响产羔数,这与之前的报道结果一致[10]。此外,S.Reicher 等从基于某段mtDNA序列构成的单倍型群中选择1~2只个体进行全基因组测序,对基因组突变位点与产羔数性状作关联分析[10],本研究是随机从大群中选择不同母源家系,样本选择的随机性更强,范围更广。
引进肉用绵羊品种繁殖率低于我国地方品种小尾寒羊、湖羊、洼地绵羊等,很多研究从BMP受体基因[13-14]、性腺轴相关激素基因[15]等研究小尾寒羊繁殖性状分子遗传机理。关联分析作为研究遗传变异的一种方法,只是为解析表型性状提供了一种可能。解释功能基因和表型性状的关系需要的是生物学功能验证。对于线粒体基因效应,转线粒体细胞模型是当前最为有效也是最前沿的研究手段。深入研究绵羊产羔数性状线粒体基因遗传效应需从转线粒体细胞模型方面进行功能验证。
4结论
杜泊、陶赛特绵羊mtDNA各突变位点均与产羔数关联不显著;萨福克绵羊中发现的14个变异位点与产羔数显著相关(包括小尾寒羊中的3个显著位点),其中单个突变位点(T7759C)和单倍型(ATTCATTAAACTTT)的最大效应均为0.22只·胎-1。
参考文献(References):
[1]张胜泉.鸡线粒体基因组遗传变异与屠宰性状的相关分析[D].北京:中国农业大学,2013.
ZHANG S Q.Association of chicken mitochondrial genome variations and carcass traits[D].Beijing:China Agricultural University,2013.(in Chinese)
[2]BELL B R,MCDANIELO B T,ROBISON O W.Effects of cytoplasmic inheritance on production traits of dairy cattle[J].JDairySci,1985,68(8):2038-2051.
[3]QIN Y H,CHEN S Y,LAI S J.Polymorphisms of mitochondrial ATPase 8/6 genes and association with milk production traits in Holstein cows[J].AnimBiotechnol,2012,23(3):204-212.
[4]ZHANG B,CHEN H,HUA L,et al.Novel SNPs of the mtDNA ND5 gene and their associations with several growth traits in the Nanyang cattle breed[J].BiochemGenet,2008,46(5-6):362-368.
[5]MANNEN H,KOJIMA T,OYAMA K,et al.Effect of mitochondrial DNA variation on carcass traits of Japanese Black cattle[J].JAnimSci,1998,76(1):36-41.
[6]MANNEN H,MORIMOTO M L,OYAMAT K,et al.Identification of mitochondrial DNA substitutions related to meat quality in Japanese Black cattle[J].JAnimSci,2003,81(1):68-73.
[7]赵兴波,吴常信,李宁.太湖猪高繁殖性能的核外基因效应分析[J].中国畜牧杂志,1999,35(3):52-54.
ZHAO X B,WU C X,LI N.Analysis of extracellular genetic effect on reproductive performance in Taihu swine[J].ChineseJournalofAnimalScience,1999,35(3):52-54.(in Chinese)
[9]HIENDLEDER S.Molecular characterization of the sheep mitochondrial genome[J].JAnimBreedGenet,1996,113(1-6):293-302.
[10]REICHER S,SEROUSSI E,WELLER J I,et al.Ovine mitochondrial DNA sequence variation and its association with production and reproduction traits within an Afec-Assaf flock[J].JAnimSci,2012,90(7):2084-2091.
[11]REED P D,VAN VLECK L D.Lack of evidence of cytoplasmic inheritance in milk production traits of dairy cattle[J].JDairySci,1987,70(4):837-841.
[12]VAN VLECK L D,HANFORD K J,SNOWDER G D.Lack of evidence for cytoplasmic effects for four traits of Polypay sheep[J].JAnimSci,2005,83(3):552-556.
[13]郭建平,刘永斌,王瑞.BMPR-IB基因突变与绵羊繁殖性能的研究进展[J].当代畜禽养殖业,2008(8):9-11.
GUO J P,LIU Y B,WANG R.Research progress in BMPR-IB gene mutation and ovine reproduction productivity[J].ModernAnimalHusbandry,2008(8):9-11.(in Chinese)
[14]CAMPBELL B K,KENDALL N R,BAIRD D T.Effect of direct ovarian infusion of bone morphogenetic protein 6(BMP6) on ovarian function in sheep[J].BiolReprod,2009,81(5):1016-1023.
[15]CHU M X,MU Y L,FANG L,et al.Prolactin receptor as a candidate gene for prolificacy of small tail han sheep[J].AnimBiotechnol,2007,18(1):65-73.
(编辑郭云雁)
Association Analyses between Mitochondrial Coding Gene Variations and Sheep Litter Size
CHEN Xiao-yong1,2,SUN Hong-xin2,YUAN Ming3,KANG Zhen-jiang3,DUN Wei-tao2*,ZHAO Xing-bo1*
(1.CollegeofAnimalScienceandTechnology,ChinaAgriculturalUniversity,Beijing100193,China;2.InstituteofAnimalScienceandVeterinaryofHebeiProvince,Baoding071000,China;3.WorkstationofAnimalScienceBreedsofHebeiProvince,Shijiazhuang050000,China)
Abstract:The aim of the present study was to explore the effects of mtDNA on litter size in sheep.Genome sequencing and genotyping technologies were used for DNA variation analyses on mitochondrial coding genes in Dorper,Dorset and Suffolk sheep.In Dorper sheep,twenty-five mtDNA variations were detected,including 2 mutations in rRNA and tRNA genes,respectively,and 21 variations in polypeptide-coding genes(including 9 missense mutations and 12 synonymous mutations).For Dorset sheep,totally 20 variations,including 5 mutations in rRNA genes,1 mutation in tRNA genes,and 14 substitutions in polypeptide-coding genes(including 3 missense mutations and 11 synonymous mutations) were detected.In Suffolk sheep,there were 77 mutations in mtDNA coding genes,including 7 and 3 substitutions in rRNA and tRNA genes,and 67 mutations in polypeptide-coding genes which contained 7 missense mutations and 60 synonymous mutations.The mtDNA mutations presented poor associations with litter size in Dorper and Dorset sheep.However,in Suffolk sheep,14 mtDNA mutations were significantly associated with litter size(P<0.05),which both of the maximal values for the effects of the single mutation(T7759C) and haplotype(ATTCATTAAACTTT) were 0.22 per parity.The mtDNA had poor effects on litter size in Dorper and Dorset sheep.Mitochondrial DNA variations were significantly associated with litter size in Suffolk sheep.
Key words:mitochondrial coding genes;litter size;sheep;genetic variation;genetic effect
doi:10.11843/j.issn.0366-6964.2016.03.005
收稿日期:2015-03-12
基金项目:转基因生物新品种培育重大专项(2014ZX08009-002);河北省科技支撑计划项目(14226315D;15226308D)
作者简介:陈晓勇(1980-),男,河北滦县人,高级畜牧师,博士,主要从事动物遗传繁育及其生物技术研究,E-mail:chenxiaoyong-2000@163.com *通信作者:敦伟涛,研究员,E-mail:dwt_12323@sohu.com;赵兴波,教授,E-mail:zhxb@cau.edu.cn
中图分类号:S826;S813.3
文献标志码:A
文章编号:0366-6964(2016)03-0449-08
