栉孔扇贝、虾夷扇贝及其杂交子代线粒体COI和Cytb基因遗传多样性分析
2016-07-11杨爱国周丽青刘志鸿
于 涛,吴 彪,杨爱国,周丽青,刘志鸿
栉孔扇贝、虾夷扇贝及其杂交子代线粒体COI和Cytb基因遗传多样性分析
于涛1,吴彪2,杨爱国2,周丽青2,刘志鸿2
(1.中国水产科学研究院 长岛增殖实验站,山东 烟台 265800; 2.农业部海洋渔业资源可持续利用重点开放实验室,中国水产科学研究院 黄海水产研究所,山东 青岛266071)
摘要:为了解栉孔扇贝(Chlamys farreri)、虾夷扇贝(Patinopecten yessoensis)及其杂交子代(F1)的种群遗传多样性和遗传结构,对3个群体的线粒体COI和Cytb基因的部分序列进行了扩增和分析。经比对分别获得781bp和725bp核苷酸片段,74个样本共检测到47个单倍型; F1群体的单倍型数、单倍型多样性指数、核苷酸多样性及平均核苷酸差异数都是最高的,而双亲的较低; F1和栉孔扇贝间的遗传距离最小,其次为栉孔扇贝和虾夷扇贝群体之间,F1和虾夷扇贝群体之间的遗传距离最大; F1和栉孔扇贝之间的遗传分化系数较小而两者间的基因流比较大,F1和栉孔扇贝与虾夷扇贝之间的遗传分化系数较大而基因流较小,说明栉孔扇贝和虾夷扇贝群体群体很早就发生了遗传分化; 采用 UPGMA法和简化的中介网络法构建的系统树表明,3个群体的所有个体被分为2个族群,栉孔扇贝和F1交叉聚为一类,虾夷扇贝独自聚为一类,2个分支间没有交叉; 使用特异性引物分别对3个群体进行PCR扩增检验,结果栉孔扇贝的特异引物能在杂交子代中扩增,而虾夷扇贝的特异引物不能在子代中扩增出条带,说明栉孔扇贝和虾夷扇贝杂交,其子代的线粒体遗传模式为严格的母系遗传。本研究结果表明杂种优势的形成与线粒体遗传多样性的变化有关。
关键词:COI; Cytb; 栉孔扇贝; 虾夷扇贝; F1; 遗传多样性
[Foundation: Supported by the earmarked fund for modern agroindustry technology research system]
栉孔扇贝(Chlamys farreri)是我国北方海水传统养殖的重要经济贝类,虾夷扇贝(Patinopecten yessoensis)是原产于日本、俄罗斯远东及朝鲜部分水域的冷水性贝类,20世纪80年代引入中国。针对20世纪90年代以来扇贝在夏季高温季节大规模死亡的现象,自 2000年开始,黄海水产研究所贝类研究实验室开展了栉孔扇贝(♀)与虾夷扇贝(♂)远缘杂交的研究,杂交子代外形偏向母本,但和母本相比,具有明显的优势[1]。
线粒体(mitochondria)是细胞内呼吸的场所,与细胞周期、信号转导、受精、细胞生长、分化、衰老、凋亡等有密切关系[2],线粒体DNA(mitochondrial DNA,mtDNA)是动物细胞中唯一存在于核外的遗传物质[3],其分子质量小,为共价闭合的环状分子,具有较高突变率,突变固定后形成的多态位点可反映出群体遗传结构、种群分化和种属关系等特点[4]。绝大多数生物的线粒体遗传模式为母系遗传[5],即使在不同种间的杂交研究中,仍遵循母系遗传,徐冬冬[6]研究了褐牙鲆(Paralichthys olivaceus)和夏牙鲆(P.dentatus)杂交及回交子代的线粒体遗传模式,徐俊[7]分析了对栉孔扇贝、华贵栉孔扇贝(Chlamys nobilis)及其杂交子代线粒体遗传模式,结果都表明子代线粒体与母本完全相同,说明在杂交过程中线粒体遵循母系遗传的方式。但近年来对一些双壳贝类的研究表明[8],线粒体基因组不完全遵循母性遗传,而是双单性遗传(doubly uniparental inheritance,DUI)。
滕丽丽[9]利用16S rRNA研究了栉孔扇贝和虾夷扇贝杂交其杂交子代的线粒体遗传模式,结果证明为严格的母系遗传。一般16S rRNA基因比较保守,进化速率较低,而细胞色素氧化酶 I亚基(cytochrome oxidase subunit I,COI)和细胞色素b(cytochrome b,Cytb)则变异较大,进化速度适中,可提供丰富的DNA多态信息,是研究种间、种内分子进化和系统发育最有用的基因之一[10-11]。本文首先通过对COI、Cytb基因的扩增进一步确定栉孔扇贝和虾夷扇贝杂交其杂交子代的线粒体遗传模式; 同时,分析了3个群体线粒体的遗传多样性水平,探讨了线粒体在杂种优势表达过程中的作用,丰富了杂种优势遗传机理研究的内容。
1 材料与方法
1.1材料
栉孔扇贝(♀)与虾夷扇贝(♂)均取自山东长岛海区,经杂交产生 F1代; 取亲贝闭壳肌、杂交子代的 D型幼虫用于实验,闭壳肌于-80℃保存备用,酒精固定幼虫,-20℃保存备用。闭壳肌DNA 的提取采用酚-氯仿法进行[12]; D型幼虫 DNA 的提取参照万俊芬等[13]的方法进行。每个群体分别取30个个体进行实验。
1.2PCR扩增
COI 基因扩增引物序列为: F-GGTCAACAAAT CATAAAGATATT GG(5′-3′),R-TAAACTTCAGGGT GACCAAAAAATCA(5′-3′); Cytb 基因扩增引物序列为: F-TACCATGAGGACAA ATATCATTCTG(5′-3′),R-CCTCCTAGTTTGTTAGGGATTGATCG(5′-3′)。
PCR扩增体系为 50uL: 模板 DNA50ng、Taq DNA Polymerase 1 U(Tiangen)、1×buffer、2mmol/L Mg2+、引物分别为0.2umol/L、0.2mmol/L的dNTP,超纯水补至 50uL。优化后的反应程序: 94℃预变性5min; 94℃变性45s,48℃(COI)/50℃(Cytb)退火1min,72℃延伸1min共35个循环; 72℃延伸5min。
1.3PCR产物纯化与测序
1.5%琼脂糖凝胶检测PCR产物,DL2000 Marker确定条带大小,进行切胶、回收、纯化(Zymoclean™Gel DNA Recovery Kit)。纯化后的PCR 产物由上海生工进行双向测序,所用测序仪器为 ABI PRISM 3730,测序试剂为BigDyeterminator v3.1。
1.4数据分析
参考吕振明[14]的分析方法,序列采用 Clustal 1.83软件进行编辑、排序和校对; 采用DNAsp 5.10软件对单倍型数、单倍型多样性指数(H)、核苷酸多样性指数(Pi)、平均核苷酸差异数(K)等遗传多样性参数进行计算; 采用MEGA 4.0.2软件计算遗传距离和聚类分析,系统发生树采用UPGMA模型进行构建;采用简化的中介网络法[15]构建单倍型网络关系图;用Arlequin3.5软件计算群体间遗传分化系数Fst及显著性(重复次数 1000次),群体间基因流 Nm由公式Nm=(1-Fst)/2 Fst计算而得。
1.5特异性引物验证
为了进一步验证是否有少量的父本线粒体基因渗入子代,参照徐俊[7]的方法,根据测序所得栉孔扇贝、虾夷扇贝COI和Cytb基因序列以及二者的差异片段,利用Primer 5设计各自特异的引物,然后利用特异性引物分别对3个群体进行扩增,反应体系、程序、检测方法同上。特异性引物序列见表1。
2 结果
2.1扩增结果及碱基组成
序列经Clustal 对位排序、校对后,得到栉孔扇贝、虾夷扇贝及其杂交子代的COI和Cytb基因序列。3个群体的COI基因序列长度为781bp,与Genebank(栉孔扇贝: EU715252.2,虾夷扇贝: AB271769.1)中已有的序列进行比对,同源率都达到 99%,其中杂交子代和母本栉孔扇贝的序列一致,为母系遗传。栉孔扇贝、杂交子一代的碱基A、T、G、 C和A+T 含量分别为19.7%、40.5%、23.8%、16.0%和60.2% ; 虾夷扇贝的碱基 A、T、G、 C和 A+T 含量分别为19.3%、36.2%、25.2%、19.3%和55.5%。3个群体的Cytb基因序列长度为725bp,与Genebank(栉孔扇贝:EU715252.2,虾夷扇贝: AB271769.1)中已有的序列进行比对,同源率也都达到 99%,杂交子代和母本栉孔扇贝的序列也一致,同样说明为母系遗传,栉孔扇贝、杂交子一代的碱基A、T、G、 C和A+T 含量分别为23.6%、36.9%、26.1%、13.4%和60.5% ; 虾夷扇贝的碱基 A、T、G、 C和 A+T 含量分别为17.7%、35.2%、27.8%、17.3%和 54.9%,通过比较看出,栉孔扇贝和虾夷扇贝杂交,其杂交子代线粒体的遗传模式为严格的母系遗传。

表1 特异性引物序列及其退火温度Tab.1 Sequences and annealing temperatures of the primers

图1 栉孔扇贝与虾夷扇贝线粒体COI 和Cytb基因片段核苷酸序列Fig.1 Nucleotide sequences of COI and Cytb gene fragments of Chlamys farreri and Patinopecten yessoensis
2.2基因多态性分析
3个扇贝群体2种线粒体基因片段的遗传多样性参数如表2所示。从单倍型参数看,杂交子代群体的单倍型数及单倍型多样性指数最高,分别为11、8和0.914±0.00313、0.956±0.00353,双亲的单倍型及其多样性指数相近; 在核苷酸参数中,杂交子代群体的核苷酸多样性依旧是最高的,分别为 0.00551± 0.00630和 0.00508±0.00601,其次为虾夷扇贝群体,最低为栉孔扇贝群体; 平均核苷酸差异数仍是杂交子代的最高,双亲的最低。从以上结果可以看出,杂交子代群体的遗传多样性较双亲的有所提高。
2.3群体遗传分化和聚类分析
利用MEGA软件中的Kimura 2-paramter 双参数模型对上述3个群体进行遗传距离计算,COI和Cytb结果相似,杂交子代和栉孔扇贝间的遗传距离最小为0.004261、0.005625,其次为栉孔扇贝和虾夷扇贝群体之间,为0.7463、0.9971,遗传距离最大的是杂交子代和虾夷扇贝群体之间,为 0.7501、0.9991。这表明栉孔扇贝和虾夷扇贝很早就出现了分化,同时也表明,二者的杂交子代的线粒体遗传模式为母系遗传。
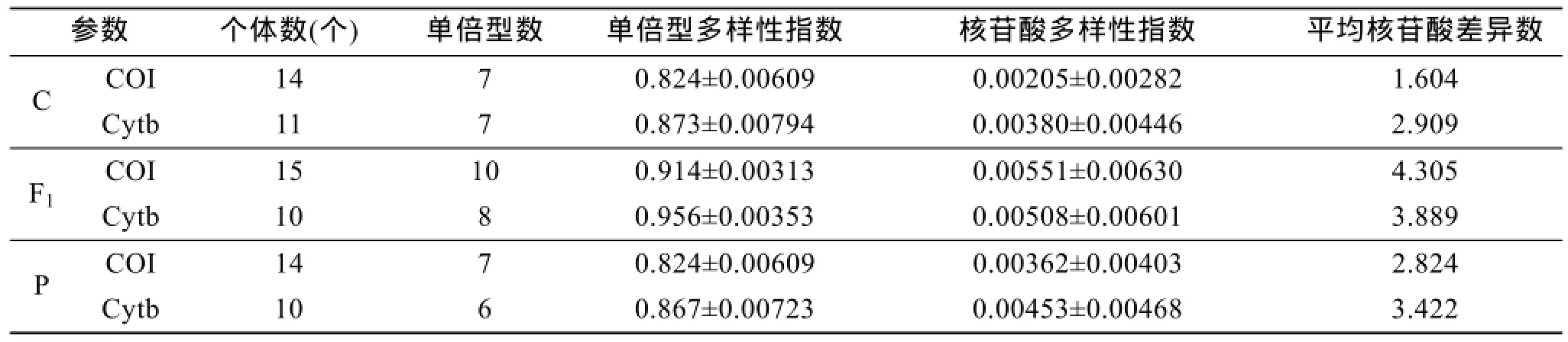
表2 3个扇贝群体的遗传变异参数Tab.2 Genetic variation parameters of three scallop populations
COI和 Cytb基因流(Nm)和遗传分化系数(Fst)分析结果也相似,杂交子代和栉孔扇贝之间的遗传分化系数较小,基因流则比较大,而杂交子代和栉孔扇贝与虾夷扇贝之间的遗传分化系数较大,基因流较小。说明栉孔扇贝和虾夷扇贝群体很早就发生了遗传分化,具体结果见表3。
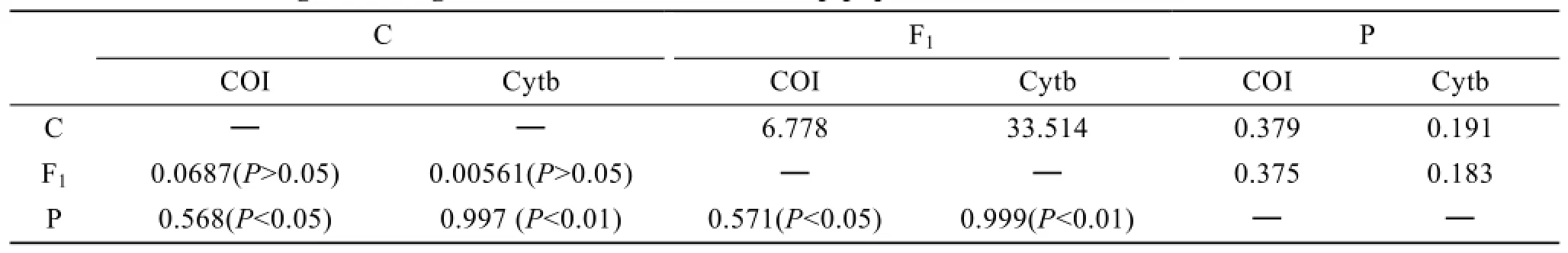
表3 3个扇贝群体间的遗传分化和基因流Tab.3 Genetic divergence and gene flow between three scallop populations
采用UPGMA 法构建3个群体2种基因的系统树,并对各分支均进行 1000 次的重复检验,2个系统树结果相似,见图3。3个群体的所有个体被分为 2个族群,栉孔扇贝和杂交子代交叉聚为一类,虾夷扇贝独自聚为一类,2个分支间没有交叉。采用简化的中介网络法对各类群单倍型网络关系图进行构建,结果也支持聚类分析结果。如图 2所示,网络关系图中栉孔扇贝和杂交子代的单倍型聚为一支,而虾夷扇贝的单倍型独自聚为另一支。
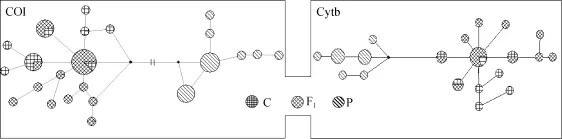
图2 3个扇贝群体单倍型网络关系图Fig.2 Reduced median network of haplotypes showing genetic relationship between three scallop populations
2.4特异引物扩增结果
使用特异性引物分别对栉孔扇贝、虾夷扇贝及其杂交子代进行PCR扩增检验。COI-C、Cytb-C2对引物能选择性的扩增栉孔扇贝的COI和Cytb部分片段,分别得到大小约为 450bp和 520bp的扩增产物,在虾夷扇贝中则无扩增产物。引物 COI-P、Cytb-P则能选择性的扩增虾夷扇贝的COI和Cytb部分片段,分别得到约450bp和520bp大小的扩增产物,而在栉孔扇贝中无扩增产物,如图4。用各自的特异引物对杂交子代进行扩增,得出的结果和在栉孔扇贝中的一致,栉孔扇贝的特异引物能在杂交子代中扩增,而虾夷扇贝的特异引物不能在子代中扩增出条带(图4),说明栉孔扇贝和虾夷扇贝杂交,其子代的线粒体遗传模式为严格的母系遗传。
3 讨论
3.1栉孔扇贝与虾夷扇贝杂交
杨爱国[1]以栉孔扇贝与虾夷扇贝作亲本,进行了正反交实验,杂交后代在同一海区进行了养殖试验。结果表明,水温15~18℃条件下,正、反交均可正常受精,受精率在 90%以上,与对照组没有明显差别; 成体的外部形态与母本基本相同,是偏向母本类型的异源二倍体; 正交组在第 2年高水温季节栉孔扇贝出现大量死亡的情况下,成活率达 95%,生长速度提高 23%,反交组在苗种中间暂养和养殖过程中的成活率比虾夷扇贝提高 16%,生长速度未见显著差别; 正、反交子一代生殖腺发育正常,可排放精、卵。试验证明,栉孔扇贝(♀)×虾夷扇贝(♂)的杂交子一代,外部形态虽与栉孔扇贝基本相同,但显著提高了栉孔扇贝的生产性能尤其是抗逆能力,远缘杂交育种是解决栉孔扇贝大面积死亡的重要途径之一,其杂交子一代已经具有生产使用价值。
为验证杂交的杂交的真实性,周丽青[16]采用扫描电镜和透射电镜技术对栉孔扇贝(♀)×虾夷扇贝(♂)的精子人卵过程进行观察。结果表明,这2种扇贝杂交与亲本自交的精子人卵过程没有本质的区别。成熟的精卵相遇时,相互激活,产生一系列胞间反应,卵子的激活集中表现为皮层反应、受精膜举起、成熟分裂重新启动; 精子激活集中表现为顶体反应和受精锥形成。杨璞[17-18]采用SSR、RAPD 和GISH 技术对栉孔扇贝(♀)和虾夷扇贝(♂)杂交子代胚后发育,其中 SSR引物P13F449和KMY134的扩增产物中可以明显地分辨出来自父母本群体的特有条带; 在 RAPD 检测中,栉孔扇贝的特异条带和虾夷扇贝特异条带均能在后代中扩增出来; GISH 结果也表明,杂交扇贝在担轮幼虫期和D 形幼虫期均继承了来自父母本遗传物质。
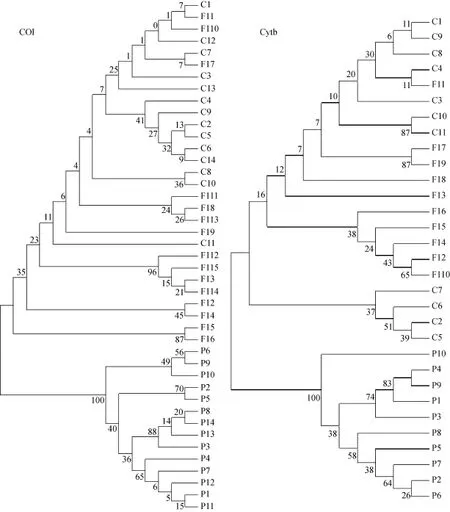
图3 3个扇贝群体的UPGMA聚类分析Fig.3 UPGMA(unweighted pair group method with arithmetic mean)tree constructed from genetic distances among three scallop populations
3.2线粒体研究
线粒体DNA是动物细胞中唯一存在于细胞核外的遗传物质,其分子量小、为共价闭合的环状分子、遗传性稳定、呈严格的母系遗传、无组织特异性、进化速度快,在群体遗传学、系统发育学、分子生态学等学科的应用越来越受到关注。秦芳[19]通过分析利川马线粒体DNA Cytb基因全序列,发现所分析的群体遗传多态性都较丰富; 吕振明[14]采用16S rRNA基因测序技术对青岛、舟山、厦门和广州 4个鳓地理群体的种群结构及遗传变异进行研究,结果表明,中国现存鳓种群仍具较高的遗传多样性水平,同时发现,青岛群体与其他 3个群体间存在显著的遗传分化,推测青岛群体的分化可能与晚更新世以来频繁的海平面变化有关; 牟希东[20]将鲫鱼和金鱼线粒体 Cytb基因序列进行比较,发现二者同源性达97.9%,表明二者还在同一种的水平上。
本研究发现,杂交子代在单倍型多样性、平均核苷酸多样性等遗传参数方面较父母本有所提高,原因可能是杂交的结果,在虾夷扇贝的精子进入栉孔扇贝的卵子时,除了核DNA进入外还有其他物质进入了卵细胞,受精卵的细胞内环境发生很大变化,致使线粒体DNA处于一种新的体系中。同种生物其细胞内环境非常相似,基因间经过长期的进化,已达到一种平衡状态,自交不会发生剧烈的变化,而当近缘种或远缘种杂交时,细胞内环境发生剧烈变化,出于本能两套基因间会相互协调达到一种平衡,由于线粒体DNA的复制酶没有校对能力和无核蛋白保护[21],变异率本来就高,这就造成在某些位点可能发生了突变但没有有效的损伤修复机制,突变就很容易固定了下来导致多样性升高。Ladoukakis[22]在双单性遗传的贝类中发现,F和M线粒体DNA有重组现象发生,且其同源重组率的高低与双亲的线粒体的差异大小有关。

图4 通用引物及特异性引物PCR扩增结果Fig.4 Amplified results of the general and special primers
a、c: COI和Cytb通用引物在3个群体中的扩增: 1~4为栉孔扇贝,5~8为杂交子代,9~12为虾夷扇贝。b、d: COI和Cytb特异性引物在3个群体中的扩增: b(左)、d(左)为虾夷扇贝的特异性引物在虾夷扇贝(b1-b4,d7-d10)、栉孔扇贝(b5-b7,d1-d3)及其杂交子代(a8-a10,d4-d6)中的扩增结果; b(右)、d(右)为栉孔扇贝的COI特异引物在栉孔扇贝(b11-b13,d11-d14)、杂交子代(b14-b16,d15-d18)和虾夷扇贝(b17-b20,d19-d22)中的扩增结果
Fig a and c was the amplified results of the general primers in the three populations: 1-4 was Chlamys farreri,5-8 was the hybrid offspring,9-12 was Patinopecten yessoensis.Fig b and d was the amplified result of the special primers in the three populations: b(left)、d(left)was the amplified results of the P.yessoensis' special primers in P.yessoensis(b1-b4,d7-d10),C.farreri(b5-b7,d1-d3),the hybrid offspring(b8-b10,d4-d6); b(right)、d(right)was the amplified results ofthe C.farreri's special primers in C.farreri(b11-b13,d11-d14),the hybrid offspring(b14-b16,d15-d18),P.yessoensis(b17-b20,d19-d22).
3.3母系遗传的研究
绝大多数生物的线粒体遗传模式为母系遗传,即后代雌雄性的线粒体DNA和母本一致。对褐牙鲆(Paralichthys olivaceus)、夏牙鲆(P.dentatus)[6]、翡翠股贻贝(Perna viridis)[23]、栉孔扇贝和华贵栉孔扇贝(Chlamys nobilis)[7]的研究表明,子代的线粒体类型都与母本完全相同,线粒体遵循母系遗传的方式。但近年来,在贻贝科(Mytilus galloprovincialis、M.edulis、M.trossulus)、帘蛤科(Venerupis philippmarum、 Tapes philippinarum)、斧蛤科(Donax trunculus)、珍珠蚌科(Margaritifera hembeli)、河蚌科(Ligumia recta)等双壳贝类的研究中[24]发现了双单性遗传(doubly uniparental inheritance,DUI)现象,即在雌性体内只有一套线粒体DNA,和母体线粒体DNA一致,称为F型线粒体基因组,而在雄性体内则有两套线粒体DNA,一套存在于身体的肌肉组织,与同代雌性个体和母本的 F型线粒体一致,而另一套则存在于雄性性腺中,称为M型线粒体基因组,F型线粒体与M型线粒体基因序列有10%~30%的差异[25]。从本文的结果可以看到,栉孔扇贝和虾夷扇贝杂交,其杂交子代的线粒体DNA和母本的相似性达到99.5%,且只有一套DNA序列,说明栉孔扇贝和虾夷扇贝杂交其子代的线粒体DNA的遗传模式为严格的母系遗传,这与滕丽丽[9]利用16S rRNA得出的结果一致。特异性引物验证实验显示,栉孔扇贝的特异性引物可以在栉孔扇贝和杂交群体中扩增出来,而不能在虾夷扇贝群体中扩增; 同样,虾夷扇贝的特异性引物可以在虾夷扇贝扩增出来,而不能在栉孔扇贝和杂交群体中扩增,进一步证明栉孔扇贝和虾夷扇贝杂交其子代的线粒体DNA的遗传模式为严格的母系遗传。
3.4细胞质遗传与杂种优势
滕丽莉[9]、何斌[26]、程宁宁等[27]利用 RAPD、ISSR、SRAP等技术研究了栉孔扇贝、虾夷扇贝及其杂交子一代的核遗传物质的多样性水平,都得到类似的结果,即杂交子代群体的遗传多样性水平都升高,得出遗传多样性的升高对杂种优势的形成有一定的贡献。群体遗传多样性水平是评价生物资源的重要指标,与生物对环境的适应能力、生长速度、抗病能力等密切相关,是物种保持进化潜能的基本条件,遗传多样性的升高将使物种表现出更强的适应性即表现出一定的优势[28]。杂种优势的表现涉及到各种基因之间、各种生理生化反应之间以及遗传物质与环境之间的相互作用,因此仅仅从核基因角度来解释杂种优势的形成显然是不够的,作为动物细胞核外的唯一的遗传物质,线粒体DNA也应该参与了杂种优势的形成。
本文利用COI和Cytb基因考察杂交子代线粒体DNA的遗传多样性水平,结果显示,在单倍型数、单倍型多样性指数、核苷酸多样性及平均核苷酸差异数等多样性指数方面得出的结果和对核基因研究得出的结果类似,即杂交子代的多样性都比两亲本的都要高。遗传多样性的升高将使物种表现出更强的适应性即表现出一定的优势,核遗传是这个原理,那么细胞质的也应该如此,线粒体遗传多样性的升高对杂种优势的形成也应该有一定的作用。
Mcdaniel[29-30]等研究发现,杂种优势的产生与线粒体的活性有密切联系,具有杂种优势的子代往往具有较高的线粒体活性; 郑兢贵等[31]的研究表明,在超微结构上,杂交子代的线粒体比亲本的发达;Sarkissian[3]研究还发现,将两亲本的线粒体混合,混合后的线粒体的活性比任何一方的亲本的都要高,但和子代的线粒体活性相当。线粒体的遗传模式为母系遗传,父本的线粒体不能传递给后代,所以是父本的某些物质进入卵子,从而形成了一个全新的细胞内环境导致子代线粒体的变化,使其多样性升高,多样性升高的结果之一就是使线粒体的活性升高,类似结论在Sarkissian[30]的研究中也有发现,具有较高线粒体活性的杂交子代其线粒体的多态性也较高。
参考文献:
[1]杨爱国,王清印,刘志鸿,等.栉孔扇贝与虾夷扇贝杂交及子一代的遗传性状[J].海洋水产研究,2004,25(5): 1-5.Yang Aiguo,Wang Qingyin,Liu Zhihong,et al.The hybrid between the scallops Chlamys farreri and Patinopecten yessoensis and the inheritance characteristics of its first filial generation[J].Marine Fisheries Research,2004,25(5): 1-5.
[2]Boore,J..Animal mitochondrial genomes[J].Nucleic Acids Research,1999,27(8): 1767.
[3]Doucet-Beaupré,H,Breton S,Chapman E,et al.Mitochondrial phylogenomics of the Bivalvia(Mollusca): searching for the origin and mitogenomic correlates of doubly uniparental inheritance of mtDNA[J].BMC Evolutionary Biology,2001,10(1): 50.
[4]张东亚,汪登强,刘绍平,等.怒江濒危鱼类缺须盆唇鱼基于线粒体 Cyt b序列的群体遗传结构分析[J].中国水产科学,2009,16(4): 477-486.Zhang Dongya,Wang Dengqiang ,Liu Shaoping,et al.Population genetic structure analysis of endangered species Placocheilus cryptonemus in the Nujiang River based on Cyt b sequences of mtDNA[J].Journal of Fishery Sciences of China,2009,16(4): 477-486.
[5]Birky Jr C.The inheritance of genes in mitochondria and chloroplasts[J].BioScience,1976,26(1): 26-33.
[6]徐冬冬.褐牙鲆和夏牙鲆杂交的遗传学研究[D].青岛: 中国科学院海洋研究所,2009.Xu Dongdong.Genetic characterization of hybridization between olive flounder and summer flounder[D].Qingdao: The Institute of Oceanology,Chinese Academy of Sciences,2009.
[7]徐俊.栉孔扇贝线粒体 DNA的初步研究[D].青岛:中国海洋大学,2005.Xu Jun.Primary Study on Mitochondrial DNA of Scallop Chlamys Farreri[D].Qingdao: Ocean University of China,2009.
[8]Passamonti M,Ghiselli F.Doubly uniparental inheritance: two mitochondrial genomes,one precious model for organelle DNA inheritance and evolution[J].DNA and Cell Biology,2009,28(2): 79-89.
[9]滕丽莉,杨爱国,赵峰,等.栉孔扇贝(♀)×虾夷扇贝(♂)子一代杂种优势的 RAPD分析[J].高技术通讯,2005,15(6): 97-101.Teng Lili,Yang Aiguo,Zhao Feng,et al.RAPDanalysis on the heterosis in reciprocal hybrids of scallop Chlamys farreri×Patinopecten yessoensis[J].High Technology Letters,2005,15(6): 97-101.
[10]程汉良,夏德全,吴婷婷,等.6种帘蛤科贝类及4个地理种群文蛤线粒体 COI基因片段序列分析[J].海洋学报,2007,29(5): 109-116.Cheng Hanliang,Xia Dequan,Wu Tingting,et al.Sequence analysis of mitochondrial COI gene fragment of six Veneridae clam(Mollusca: Bivalvia)and four population of Meretrix meretrix[J].Acta Oceanologica Sinica,2007,29(5): 109-116.
[11]赵丽媛,于志刚,甄毓,等.东海原甲藻线粒体细胞色素b(Cytb)基因的定量检测[J].中国海洋大学学报(自然科学版),2009,39(3): 448-452.Zhao Liyuan,Yu Zhigang,Zhen Yu,et al.Quantitative Detection of Mitochondrial Cytochrome b(Ctyb)Gene of Prorocentrum donghaiense[J].Periodical of Ocean University of China,2009,39(3): 448-452.
[12]于涛,杨爱国,吴彪,等.栉孔扇贝、虾夷扇贝及其杂交子代的MSAP分析[J].水产学报,2010,34(9): 1335-1342.Yu Tao,Yang Aiguo,Wu Biao,et al.Analysis of Chlamys farreri,Patinopecten yessoensis and their offspring using methylation-sensitive amplification polymorphism(MSAP)[J].Journal of Fisheries of China,2010,34(9): 1335-1342.
[13]万俊芬,包振民,刘广绪,等.扇贝种间单对杂交一代幼虫ISSR标记的分离方式[J].高技术通讯,2004,14(5): 82-87.Wan Junfen,Bao Zhenmin,Liu Guangxu.Segregation of ISSR Markers in Hybrid Larvae of Two Scallop Species[J].High Technology Letters,2004,14(5): 82-87.
[14]吕振明,许逸天,吴常文,等.中国沿海鳓不同地理群体16SrRNA基因的遗传变异分析[J].中国水产科学,2010,17(3): 463-470.Lü Zhenming,Xu Yitian,Wu Changwen,et al.Genetic variation in different populations of Ilisha elongata in China coastal water based on 16S rRNA gene analysis[J].Journal of Fishery Sciences of China,2010,17(3): 463-470.
[15]Bandelt H,Forster P,Sykes B,et al.Mitochondrial portraits of human populations using median networks[J].Genetics,1995,141(2): 743.
[16]周丽青,杨爱国,刘志鸿,等.栉孔扇贝(♀)×虾夷扇贝(♂)精子入卵过程的电镜观察[J].中国水产科学,2003,10(3): 189-193.Zhou Liqing,Yang Aiguo,Liu Zhihong,et al.Electron microscope observation on Patinopecten yessoensis sperm penetration into Chlamys farreri egg[J].Journal of Fishery Sciences of China,2003,10(3): 189-183.
[17]杨璞,杨爱国,刘志鸿,等.栉孔扇贝和虾夷扇贝通用微卫星引物的筛选及其在杂种鉴定中的应用[J].安徽农业科学,2008,36(19): 8287-8289.Yang Pu,Yang Aiguo,Liu Zhihong,et al.The selection of universal microsatellite primers between Patinopecten yessoensis and Chlamys farreri and its application in hybrid identification[J].Journal of Anhui Agricultural Sciences,2008,36(19): 8287-8289.
[18]杨璞,杨爱国,单伟华,等.栉孔扇贝(♀)×虾夷扇贝(♂)杂交子代胚后发育过程中遗传构成变化研究[J].渔业科学进展,2009,30(2): 66-70.Yang Pu,Yang Aiguo,Shan Weihua,et al.Research on genetic variation of hybrid scallop from Chlamys farreri(♀)×Patinopecten yessoensis(♂)during post-embryo growth[J].Progress in Fishery Sciences,2009,30(2):66-70.
[19]秦芳,王小斌,张云生.利川马 mtDNA Cytb 基因遗传多态性分析[J].湖北农业科学,2009,48(12): 2935-2937.Qin Fang,Wang Xiaobin,Zhang Yunsheng.Analyses on mtDNA cytb genetic diversity in Lichuan Horse[J].Hubei Agricultural Sciences,2009,48(12): 2935-2937.
[20]牟希东,白俊杰,叶星,等.金鱼线粒体 DNA Cyt b基因序列分析及与鲫鱼亲缘关系探讨[J].南方水产,2007,3(1): 26-30.Mu Xidong,Bai Junjie ,Ye Xing,et al.Sequence analysis of mitochondrial cytochrome b gene of Carassius auratus var.and phylogenetic relationships of C.auratus var.and C.auratus[J].South China Fisheries Science,2007,3(1): 26-30.
[21]徐晖,肖志忠,孔晓瑜,等.褐牙鲆(♀)夏鲆(♂)及其杂交子一代线粒体16S rDNA序列遗传特性的初步研究[J].热带海洋学报,2007,26(5): 60-63.Xu Hui,Xiao Zhizhong,Kong Xiaoyu,et al.Analysis of mitochondrial 16srDNA sequence in Paralichthys olivaceus(♀),P.dentatus(♂)and their hybrids[J].Journal of tropical oceanography,2007,26(5): 60-63.
[22]Ladoukakis E,Zouros E.Direct evidence for homologous recombination in mussel(Mytilus galloprovincialis)mitochondrial DNA[J].Molecular Biology and Evolution,2001,18(7): 1168.
[23]位正鹏,孔晓瑜,吴相云,等.基于COI序列的翡翠股贻贝Perna viridis线粒体遗传特性分析及其近缘种间的系统关系探讨[J].热带海洋学报,2009,28(6): 72-78.Wei Zhengpeng,Kong Xiaoyu,Wu Xiangyun,et al.Genetic analysis of the marine mussel Perna viridis(Bivalvia: Mytilidae)based on mitochondrial COI sequence and its phylogenetic relationshipwith other congeneric species [J].Journal of tropical oceanography,2009,28(6): 72-78.
[24]Theologidis I,Fodelianakis S,Gaspar M,et al.Doubly uniparental inheritance(DUI)of mitochondrial DNA in Donax trunculus(Bivalvia: Donacidae)and the problem of its sporadic detection in Bivalvia[J].Evolution,2008,62(4): 959-970.
[25]Skibinski D,Gallagher C,Beynon C.Sex-limited mitochondrial DNA transmission in the marine mussel Mytilus edulis[J].Genetics,1994,138(3): 801.
[26]何斌,杨爱国,王清印,等.栉孔扇贝(♀)×虾夷扇贝(♂)单对杂交子一代的 ISSR分析[J].大连水产学院学报,2007,22(4): 273-277.He Bin,Yang Aiguo,Wang Qingyin,et al.ISSR analysisof the F1 hybrids of scallop Chlamys farreri(♀)× Patinopecten yessoensis(♂)[J].Journal of Dalian Fisheries University,2007,22(4): 273-277.
[27]程宁宁,杨爱国,刘志鸿,等.栉孔扇贝(♀)×虾夷扇贝(♂)子一代杂种优势的 SRAP分析[J].海洋科学,2009,33(10): 107-111.Cheng Ningning,Yang Aiguo,Liu Zhihong,et al.Analysis on heterosis of Chlamys farreri(♀)× Patinopecten yessoensis(♂)by SRAP marker[J].Marine Sciences,2009,33(10): 107-111.
[28]牛东红,李家乐,沈和定,等.缢蛏六群体线粒体DNA-COI基因序列变异及群体遗传结构分析[J].海洋学报,2008,30(3): 109-116.Niu Donghong ,Li Jiale ,Shen Heding,et al.Sequence variability of mitochondrial DNA-COI gene fragment and population genetic structure of six Sinonovacula constricta populations[J].Acta Oceanologica Sinica,2008,30(3: 109-116.)
[29]McDaniel R,Sarkissian I.Mitochondrial heterosis in maize[J].Genetics,1968,59(4): 465.
[30]McDanie,R,Sarkissian I.Heterosis: complementation by mitochondria[J].Science,1966,152(3729): 1640.
[31]郑兢贵,刘利华.杂交水稻细胞质效应研究-叶绿体、线粒体超微结构的观察[J].中国农业科学,1987,20(3): 43-47.Zheng Jinggui,Liu Lihua.Studies on cytoplasmic effects in hybrid tice—Investigation of Ultramicroscopic sturcture of chloroplast and mitochondrion [J].Scientia Agricultura Sinica,1987,20(3): 43-47.
[32]Sarkissian I,Srivastava H.Mitochondrial polymorphism in maize.II.Further evidence of correlation of mitochondrial complementation and heterosis[J].Genetics,1967,57(4): 843.
[33]Sarkissian I,Srivastava H.Mitochondrial polymorphism.III.Heterosis,complementation,and spectral properties of purified cytochrome oxidase of wheat[J].Biochemical Genetics,1971,5(1): 57-63.
(本文编辑: 梁德海)
Genetic diversity analysis of Chlamys farreri,Patinopecten yessoensis,and their offspring based on COI and Cytb sequences
YU Tao1,WU Biao2,YANG Ai-guo2,ZHOU Li-qing2,LIU Zhi-hong2
(1.Changdao Enhancement and Experiment Station,Chinese Academy of Fishery Science,Yantai 265800,China; 2.Key Laboratory for Sustainable Utilization of Marine Fisheries Resources,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266071,China)
Received: Jul.11,2015
Key words:COI; Cytb; Chlamys farreri; Patinopecten yessoensis; F1; genetic diversity
Abstract:Mitochondrial DNA cytochrome oxidase subunit I(COI)and cytochrome b(Cytb)gene fragments were amplified and analyzed to examine the genetic diversity and structure of three scallop populations: Chlamys farreri,Patinopecten yessoensis,and their hybrid(F1).Fragments with 781 bp of the partial COI gene and 725 bp of the partial Cytb gene were obtained after alignment and emendation,and 47 haplotypes were found in the sequences of the 74 samples.The genetic diversity indexes,including the haplotype number,haplotype diversity,nucleotide diversity,and average number of nucleotide differences,showed that the genetic diversity of F1was greater than that of the parents.The genetic distance between F1and C.farreri was the nearest and that between F1and P.yessoensis was the farthest.The level of gene flow between F1and P.yessoensis was less than the level between F1and C.farreri,while the population differentiation values between F1and P.yessoensis was greater than the value between F1and C.farreri,suggesting that the differentiation between C.farreri and P.yessoensis happened a long time ago.A UPGMA tree and reduced median network of haplotypes led to the same result,with the population of C.farreri and F1gathered together and the population of P.yessoensis gathered together independently.PCR reamplification revealed that the special primers of C.farreri could be amplified but the P.yessoensis special primers could not be amplified in the F1population,indicating that the mitochondrial DNA genetic model of F1represented matrilinear inheritance.
中图分类号:S917
文献标识码:A
文章编号:1000-3096(2016)03-0001-09
doi:10.11759/hykx20141113002
收稿日期:2015-07-11; 修回日期: 2015-10-22
基金项目:国家现代农业产业技术体系建设专项基金项目
作者简介:于涛(1985-),男,工程师,主要从事贝类遗传育种和健康养殖研究,E-mail: cdyutao@126.com; 杨爱国(1957-),通信作者,男,研究员,电话: 0532-85811982,E-mail: yangag@ysfri.ac.cn
