南烛叶多酚氧化酶最适提取条件的研究
2016-07-10冯佳丽何新叶笪荣辉金奎何志勇陈洁
冯佳丽 何新叶 笪荣辉 金奎 何志勇 陈洁

摘要[目的]深入探讨南烛叶多酚氧化酶(PPO)的酶学性质,对南烛叶PPO的最适提取条件进行研究。[方法]以南烛叶为原料,分别研究了交联聚乙烯吡咯烷酮(PVPP)添加含量、料液比、浸提时间和pH各因素对其提取的PPO酶活的影响。[结果]试验表明,适量南烛叶粉末,以料液比1∶15 g/mL,加入含9%PVPP(W/V)pH 7.6的柠檬酸-磷酸氢二钠缓冲液(0.1 mol/L),匀浆并于4 ℃下浸提9 h,过滤,滤液经冷冻离心(4 ℃,12 000 r/min,20 min)后得到酶活最高的PPO酶液(11 335 U/mL)。[结论]研究结果可为促进南烛叶的工业化应用提供参考。
关键词 南烛叶;多酚氧化酶;酶活;提取
中图分类号 S789.4 文献标识码 A 文章编号 0517-6611(2016)05-128-03
Abstract[Objective]The aim was to explore the enzymatic properties of PPO from Vaccinium bracteatum Thunb leaf and research the optimum extraction conditions of PPO.[Method]Effects of PVPP content, solidliquid ratio, extraction time, pH on PPO enzyme activity were studied respectively.[Result]The results showed that appropriate amount of V. bracteatum power was added into citric acidphosphate buffer (0.1 mol/L pH 7.6) containing 9% PVPP(W/V) with solidliquid ratio 1∶15 g/mL, extracted at 4 ℃ for 9 h, through filtering, centrifuging at 4 ℃, 12 000 r/min for 20 minutes, PPO with the highest enzyme activity (11 335 U/mL) was obtained.[Conclusion]The study can provide reference for promoting industrialized application of V. bracteatum leaf.
Key words Vaccinium bracteatum Thunb leaf; Polyphenol oxidase(PPO); Enzyme activity; Extraction
南烛(Vaccinium bracteatum Thunb),又名乌饭树,属杜鹃花科(Ericaceae)越橘属(Vaccinium),由于江浙、福建、湖广一带以其茎叶浸渍染米,加工乌饭,故而得名。研究南烛叶多酚氧化酶(PPO)的最适提取条件,可为南烛叶PPO的分离纯化以及南烛叶染色机制的相关研究奠定基础。目前,植物活体内直接提取PPO的方法有丙酮法、匀浆法等,PPO可分为游离态和束缚态2种,通常用丙酮法提取所得的是PPO总酶活,而用匀浆法提取所得则为可溶性酶活性[1]。很多试验表明,匀浆法有助于游离态可溶性酶活性提高。李立祥等以安徽农业大学茶园福鼎大白茶品种一芽二叶以及一芽三叶初展为原料时,利用匀浆法和匀浆浸提法进行酶活测定的试验数据显示,匀浆浸提对PPO活性确有提高,其原因为:一方面缓冲液匀浆法增大了料液的接触面积,酶蛋白易于溶出,同时也可使束缚态的PPO部分转化为可溶性的酶溶出,使得PPO酶得率提高;另一方面,缓冲液与茶鲜叶细胞液生理特性比较接近,酶溶出后活性损失小[2]。笔者采用缓冲液匀浆浸提的方法,并通过对各单因素的研究,对反应条件进行优化,希望为南烛叶的工业化应用提供参考指导。
1 材料与方法
1.1 材料
1.1.1 原料。南烛叶采自江苏省宜兴市,洗净,冷冻干燥后存于冰箱中备用。
1.1.2
主要仪器。Sigma3K15高速冷冻离心机,美国西格玛奥德里奇集团;HWS24 电热恒温水浴锅,上海一恒科技公司;AL204电子天平,梅特勒-托利多上海有限公司;Alph1102可见分光光度计,上海谱元仪器有限公司;BCD191CR冰箱,合肥荣事达电器有限公司;FE20 pH计,瑞士梅特勒-托利多仪器公司。
1.1.3 主要试剂。交联聚乙烯吡咯烷酮(PVPP)、磷酸氢二钠、柠檬酸、邻苯二酚,均为分析纯。
1.2 方法
1.2.1 不同添加量PVPP对提取南烛叶PPO的影响。
参照文献方法[3],称取南烛叶粉末5份,每份0.5 g,料液比1∶12 g/mL,分别加入内含0%、5%、7%、9%、11% PVPP(W/V)经遇冷的pH 6.8的柠檬酸-磷酸盐缓冲液(0.1 mol/L),将匀浆于4 ℃下浸提6 h,6层纱布过滤,滤液在4 ℃、12 000 r/min下离心20 min,上清液即为粗制酶液,测定PPO酶活性,分析不同PVPP添加量提取南烛叶PPO的效果。
1.2.2 不同料液比对提取南烛叶PPO的影响。
参照文献方法[3],称取南烛叶粉末6份,每份0.5 g,料液比1∶9、1∶12、1∶15、1∶18、1∶21、1∶24 g/mL,加入内含5% PVPP(W/V)经遇冷的pH 6.8的柠檬酸-磷酸盐缓冲液(0.1 mol/L),后续提取过程同“1.2.1”,分析不同料液比提取南烛叶PPO的效果。
1.2.3 不同浸提时间对提取南烛叶PPO的影响。
参照文献方法[3],称取南烛叶粉末4份,每份0.5 g,料液比1∶12 g/mL,加入内含5% PVPP(W/V)经遇冷的pH 6.8的柠檬酸-磷酸盐缓冲液(0.1 mol/L),分别将匀浆于4 ℃下浸提3、6、9、12 h,后续提取同“1.2.1”,分析不同浸提时间提取南烛叶PPO的效果。
1.2.4 不同pH的磷酸盐缓冲液对提取南烛叶PPO影响。
参照文献方法[3],称取南烛叶粉末8份,每份0.5 g,料液比1∶12 g/mL,分别加入内含5% PVPP(W/V)经遇冷的pH为5.2、5.6、6.0、6.4、6.8、7.2、7.6、8.0的柠檬酸-磷酸盐缓冲液(0.1 mol/L),后续提取同“1.2.1”,分析不同pH的缓冲液提取南烛叶PPO的效果。
1.2.5 PPO酶活性的测定。
参照文献方法[4-5],在试管中加入2 mL pH 6.8的柠檬酸-磷酸盐缓冲液(0.1 mol/L),0.9 mL的0.1 mol/L 的邻苯二酚,在30 ℃恒温水浴中保温5 min,然后加入0.1 mL粗酶液,迅速摇匀,测定反应体系在420 nm波长下的吸光度,以最初直线段的斜率计算酶活力。
双空白:一份以缓冲溶液及邻苯二酚作为空白,另一份以缓冲溶液和粗酶液作为空白,并保证体积与反应试剂相同。
酶活性的定义:以1 min内420 nm 处吸光值(A)变化 0.001 定义为 1 个酶活力单位(1 U),酶活性表示为:
酶活力(UmL)=A0.001×反应时间(min)×测定时酶液用量(mL)
2 结果与分析
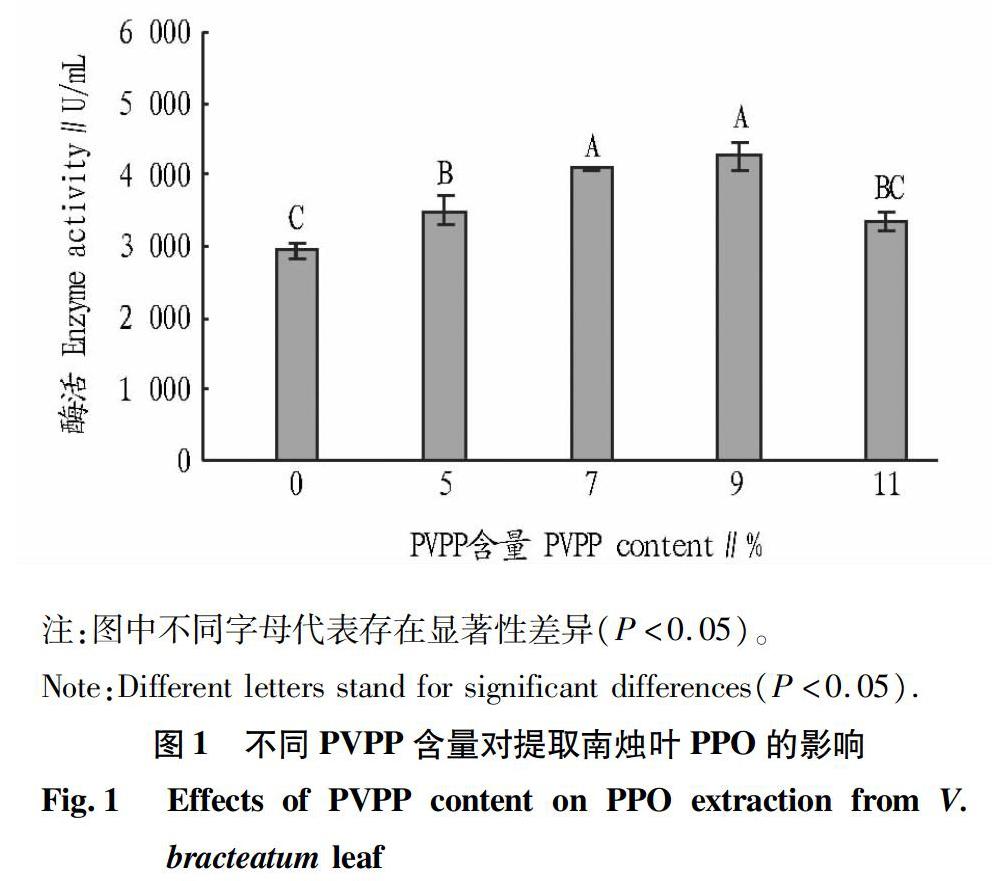
2.1 PVPP不同添加量对南烛叶PPO提取的影响
PVPP不同添加量提取南烛叶PPO的效果如图1所示。结果表明,加入PVPP的效果比不加PVPP要好,且提取过程中加入9%的PVPP的酶活最高。 PVPP是一种酚类吸附剂,通过疏水作用、氢键和范德华力与多酚形成复合物[6]。在缓冲液中加入PVPP可以除去PPO的酚类底物,同时也可以阻止提取过程中酶的聚合与失活[7]。随着PVPP含量的提高,PVPP吸附酚类物质效果变好,可以有效防止PPO的活性受损,但添加较多时,又会对酶活产生抑制作用。
2.2 不同料液比对南烛叶PPO提取的影响
不同料液比对提取南烛叶PPO的效果图如图2所示。结果表明,料液比1∶15 g/mL时,提取所得的酶液的活性最高。料液比中溶剂用量过低导致原料中的PPO不能完全从组织中萃取出来,提取不彻底造成其酶活较低;随着料液比中溶剂用量的增加,可溶性蛋白全部溶出,酶活达到峰值[8],再增加缓冲液的用量时,稀释了PPO的浓度,酶活性降低。由总酶活可知,在液料比1∶15 g/mL时缓冲液体积差不多达到饱和水平,其不再是酶活的限制因素,故而再增加缓冲液体积时总酶活基本保持不变。
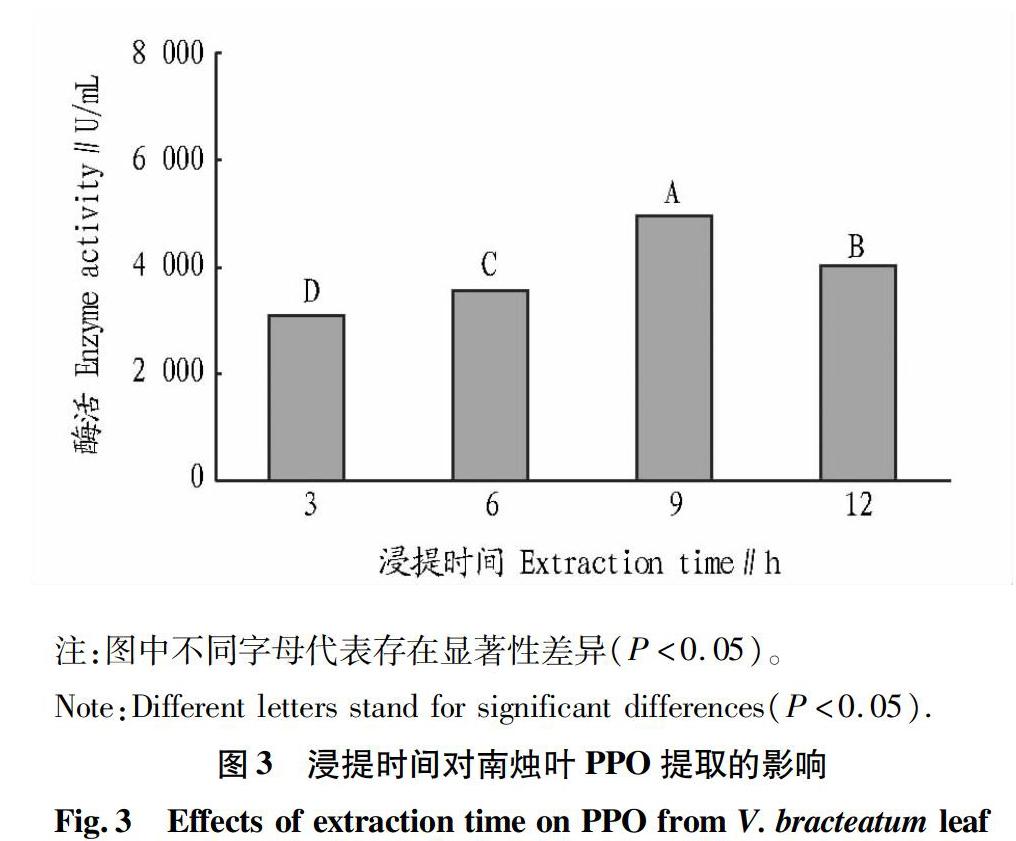
2.3 不同浸提时间对南烛叶PPO提取的影响
浸提时间对南烛叶PPO提取效果的影响如图3所示。结果表明,9 h的浸提时间下酶活性最高。数据表明,在一定时间范围内,浸提时间越长,酶活呈现增长的趋势,但时间过长同时也会对酶活有所抑制。浸提时间过短,酶不能完全从细胞中萃取出来;随着时间的增加,由于酶蛋白在溶液状态下的构象不稳定,以及南烛酚类等其他物质溶出,均容易导致酶活性的降低[9-10]。
2.4 pH不同的缓冲液对南烛叶PPO提取的影响
不同pH缓冲液对南烛叶PPO提取效果的影响如图4所示。结果表明,pH 7.6的缓冲液浸提南烛叶效果最佳,酶活性最高。缓冲液在提取中的主要作用是中和细胞破碎时从空泡中放出的大量的酸,保持pH接近7.5以及离子强度在0.1~0.5,高离子强度有助于将酶从结合的膜上解析下来[11]。pH在5.6~6.4的范围内,对维持pH和离子强度的作用相差不大,当缓冲液的pH达到7.6时,酶活急剧增加,该环境下酶蛋白易于被全部溶解。
3 结论与讨论
通过不同单因素的提取试验,确定南烛叶PPO的最适提取条件为:适量南烛叶粉末,料液比1∶15 g/mL,加入内含9%的PVPP(W/V)经遇冷的pH 7.6的柠檬酸-磷酸氢二钠缓冲液(0.1 mol/L),将匀浆于4 ℃下浸提9 h,6层纱布过滤,滤液在4 ℃、12 000 r/min下离心20 min,上清液即为粗制酶液,其酶活为11 335 U/mL。
多酚氧化酶是一种含铜的氧化还原酶,广泛存在于果蔬细胞的质体中[12],而果蔬中又含有大量的酚类物质,在PPO的催化作用下进一步氧化、聚合生成黑色素,对PPO的有效提取造成一定困难,故需要对提取条件进行研究。研究表明,不同来源的多酚氧化酶其提取条件有一定的差异,缓冲液的最适pH浮动较大。该研究以乌饭树叶为原料时,最适提取条件为:pH 7.6、PVPP含量9%、料液比为1∶15 g/mL;在刘琨等以苏州碧螺春为原料的试验中,采用pH 5.6的缓冲液,料液比为1∶4.5 g/mL[13];而卢丽娜等以奉化水蜜桃为原料的试验中,采用pH 8.0的缓冲液,料液比为1∶12 g/mL[14]。同时也有研究指出,提取过程中加入一定的NaCl、PMSF、Trition100等物质对PPO的提取有一定的帮助,所得酶液的活性较高。选用最适的提取条件可带来良好的生产效益,该研究对未来南烛叶工业化的生产加工有指导意义。
参考文献
[1]萧伟祥.茶的多酚氧化和过氧化物酶的研究进展[J].茶业通报,1983(6):3-7.
[2]李立祥,吴红梅.提取方法对茶多酚氧化酶活性的影响[J].中国茶叶加工,2001(4):26-31.
[3]许雷.茶树多酚氧化酶的提取、分离纯化及其部分酶性质研究[D].武汉:华中农业大学,2014:9-18.
[4]徐广洲.乌饭树叶黑色素形成相关的酶与底物的初步研究[D].无锡:江南大学,2014:12-22.
[5]梁建荣.甘薯叶多酚氧化酶的分离纯化及部分与功能基团研究[D].重庆:西南大学,2011:32-40.
[6]WUYTS N,WAELE D D,SWENEN R.Extraction and partial characterization of polyphenol oxidase from banana (Musa acuminate Grand naine)roots[J].Plant physiology and biochemistry,2006,44:308-314.
[7]BNDICTE L,VIRGINIE M L,TRISTAN R,et al.PVPPpolyphenol complexes:A mole cular approach[J].Journal of agricultural and food chemistry,2006,54(12):4383-4389.
[8]SUN X H,ZHU K,ZHOU H M.Optimization of a novel backward extraction of defatted wheat germ protein from reverse micelles[J].Innovative food science and emerging technologies,2009,10:328-333.
[9]GAO Z J,HAN X H,XIAO X G.Puri cation and characterisation of polyphenol oxidase from red swiss chard[J].Food chemistry,2009,117:342-348.
[10]贺寅,王强,钟葵.响应面优化酶法提取龙眼多糖工艺[J].食品科学,2012,33(2):79-83.
[11]王璋.食品酶学[M].北京:中国轻工业出版社,2002.
[12]YORUK R,MARSHALL M R.Physicochemical properties and function of plant polyphenol oxidase:A review[J].Journal of food biochemistry,2003,27(5):361-422.
[13]刘琨,钱和,汪何雅.茶叶中多酚氧化酶提取的响应面优化[J].食品科技,2013,38(1):206-210.
[14]卢丽娜,卢婕,刘亮,等.奉化水蜜桃多酚氧化酶提取纯化工艺研究[J].湖北农业科学,2011,50(7):1451-1453.
