Wnt诱导分泌蛋白1在PHC中的表达及意义
2016-07-10简易成过欣来郑亚新熊伍军
陈 晟, 简易成, 周 玮, 过欣来, 郑亚新, 熊伍军
(1. 同济大学附属东方医院消化内科,上海 200120; 2. 同济大学附属东方医院普外科,上海 200120;3. 第二军医大学附属东方肝胆医院肝脏外科,上海 200438)
·基础研究·
陈 晟1, 简易成1, 周 玮2, 过欣来2, 郑亚新3, 熊伍军1
(1. 同济大学附属东方医院消化内科,上海 200120; 2. 同济大学附属东方医院普外科,上海 200120;3. 第二军医大学附属东方肝胆医院肝脏外科,上海 200438)
目的 探讨Wnt诱导分泌蛋白-1(Wnt induced secreted protein-1, WISP-1)在原发性肝癌(primary hepatic carcinoma, PHC)中表达水平变化及其意义。方法 收集34例PHC患者及12例肝血管瘤患者手术组织标本(包括肿瘤组织及其相应的癌旁/瘤旁组织),用RT-qPCR方法检测各组WISP-1基因表达水平,用Western印迹法测定WISP-1蛋白表达水平,分析WISP-1表达与PHC患者临床特征的相关性。结果 WISP-1基因在70.6%(24/34)的PHC患者中高表达,肝癌组织中WISP-1的平均表达水平是正常肝组织的(2.65±1.16)倍,差异有统计学意义(P=0.011);Western印迹法测定的蛋白表达水平与基因表达水平一致。WISP-1基因表达与肝癌的病理分级及肿瘤分期有明显相关性,而与年龄、性别、AFP水平、肝癌类型及肿瘤位置无明显相关性。结论 WISP-1在PHC中高表达,并与其病程进展相关,WISP-1可能是治疗PHC的潜在靶点。
Wnt诱导分泌蛋白-1; 原发性肝肿瘤; 临床意义
Wnt诱导分泌蛋白-1(Wnt induced secreted protein-1, WISP-1)是Wnt信号通路活化后的下游靶基因之一,参与调控细胞生长、分化、黏附和迁移,在炎症、伤口修复、血管生成及肿瘤生长等病理生理过程中起重要作用[1-2]。WISP-1参与恶性涎腺肿瘤、口腔鳞状细胞癌、胰腺导管癌(pancreatic ductal adenocarcinoma, PDA)、肺癌、乳腺癌、结肠癌、前列腺癌等多种肿瘤的发生、发展、转移,并与其临床预后密切相关。研究[3-5]发现,Wnt信号通路活化介导肝纤维化、肝硬化、肝癌的发生和发展。但是,有关WISP-1在肝癌中的表达水平变化及其意义少有报道。本研究拟观察WISP-1在原发性肝癌(primary hepatic carcinoma, PHC)中表达水平变化及其与PHC病程进展的相关性,为寻找治疗PHC的潜在分子靶点提供前期实验依据。
1 材料与方法
1.1 材料
2014年在同济大学附属东方医院肝脏外科进行手术治疗的34例PHC手术患者,手术前均未接受过化疗、放疗等辅助治疗;12例为肝血管瘤患者。PHC患者的年龄为36~80岁,平均(52.6±13.7)岁: 男性28例,女性6例。根据癌细胞的分化程度,将肝癌分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四级,其中Ⅰ级为高分化型,Ⅱ、Ⅲ级为中分化型,Ⅳ级为低分化型,10例患者病理分级为Ⅰ级,24例患者为Ⅱ-Ⅲ;根据原发性肝癌分期标准(中国抗癌协会肝癌专业委员会2001年修订),14例患者肿瘤分期为Ⅰ期,8例患者为Ⅱ期,12例患者为Ⅲ期;24例肝细胞癌患者,10例肝胆管癌患者;12例患者肿瘤位于肝左侧,18例患者肿瘤位于右侧,4例患者位于肝门部;23例患者血清AFP>400ng/ml,11例<400ng/ml。
1.2 研究设计
12例肝血管瘤患者病理学上确定无肝纤维化或肝硬化,由于肝血管瘤为良性肿瘤,故将其瘤旁组织作为正常肝组织。以上每例手术患者取肝癌或者肝血管瘤作为实验组,相邻的癌旁或者瘤旁组织作为对照组。部分标本于液氮保存备用,剩余组织进行RT-qPCR和Western印迹法检测。
1.3 实验方法
本实验中的研究标本均来自于同济大学附属东方医院南院中心手术室肝胆外科手术标本,标本取材后浸泡于4%多聚甲醛,置于冰上运输。以下RT-qPCR和Western印迹法实验均重复3次。
1.3.1 RT-qPCR (1) 引物设计。WISP-1上游引物: 5′-ACACTCATTAAGGCAGGGAAGAAG-3′;下游引物: 5′-TCAGGACACTGGAAGGACACG-3′。GAPDH上游引物: 5′-ACCCAGAAGACTGTGG-ATGG-3′;下游引物: 5′-CAGTGAGCTTCCC-GTTCAG-3′。
(2) 实验步骤: RNA提取和cDNA的合成: 采用TRIzol试剂提取肝组织总RNA(Invitrogen公司),行琼脂糖凝胶电泳紫外灯下检测mRNA完整性。取1μg RNA用Oligo(dT)引物反转录cDNA。实时定量聚合酶链反应: WISP-1和GAPDH的扩增片段长度分别为185、171bp。结果表达: RT-qPCR结果以2-ΔΔCt表示,2-ΔΔCt值>1定义为表达水平上调。
1.3.2 Western印迹法 用裂解液提取肝组织总蛋白,BCA法测蛋白浓度并进行蛋白定量。取定量后的蛋白上样,10% SDS-PAGE(恒压80V 30min,110V 1h),并在恒流200mA下120min将蛋白从SDS-PAGE凝胶转至PVDF膜。转膜结束后,将膜取出,封闭2h,分别加入人1∶1000稀释的WISP-1、β-actin抗体,4℃过夜。次日,孵育辣根酶标记二抗1h后,采用ECL发光试剂进行显影。
1.4 统计学处理
2 结 果
2.1 肝癌组织与正常肝组织WISP-1基因表达水平的差异
WISP-1基因在70.6%(24/34)的PHC患者中高表达,表达水平高于正常肝组织1.06~19.56倍,其平均表达水平是正常肝组织的(2.65±1.16)倍,显著高于正常对照组,差异有统计学意义(P= 0.011),见图1。
2.2 肝癌组织与正常肝组织WISP-1蛋白表达水平的差异
共检测34例PHC患者癌组织及癌旁组织WISP-1蛋白表达水平情况。Western印迹法测定表明肝癌组织中WISP-1蛋白表达水平显著高于癌旁组织及正常对照组,WISP-1蛋白表达水平与基因表达水平一致(此处仅展示5例),见图2。

图1 WISP-1在12例肝血管瘤及34例原发性肝癌组织中的表达水平变化Fig.1 The expression of WISP-1 mRNA in 12 liver hemangioma and 34 primary hepatic cancer tissues

图2 WISP-1蛋白在肝脏组织中的表达Fig.2 The expression of WISP-1 protein in PHC and matched normal liver tissues
2.3 WISP-1基因水平与临床病理指标的关系
WISP-1基因表达与肝癌的病理分级及肿瘤分期有相关性,而与年龄、性别、AFP水平、肝癌类型及肿瘤位置无相关性,见表1。
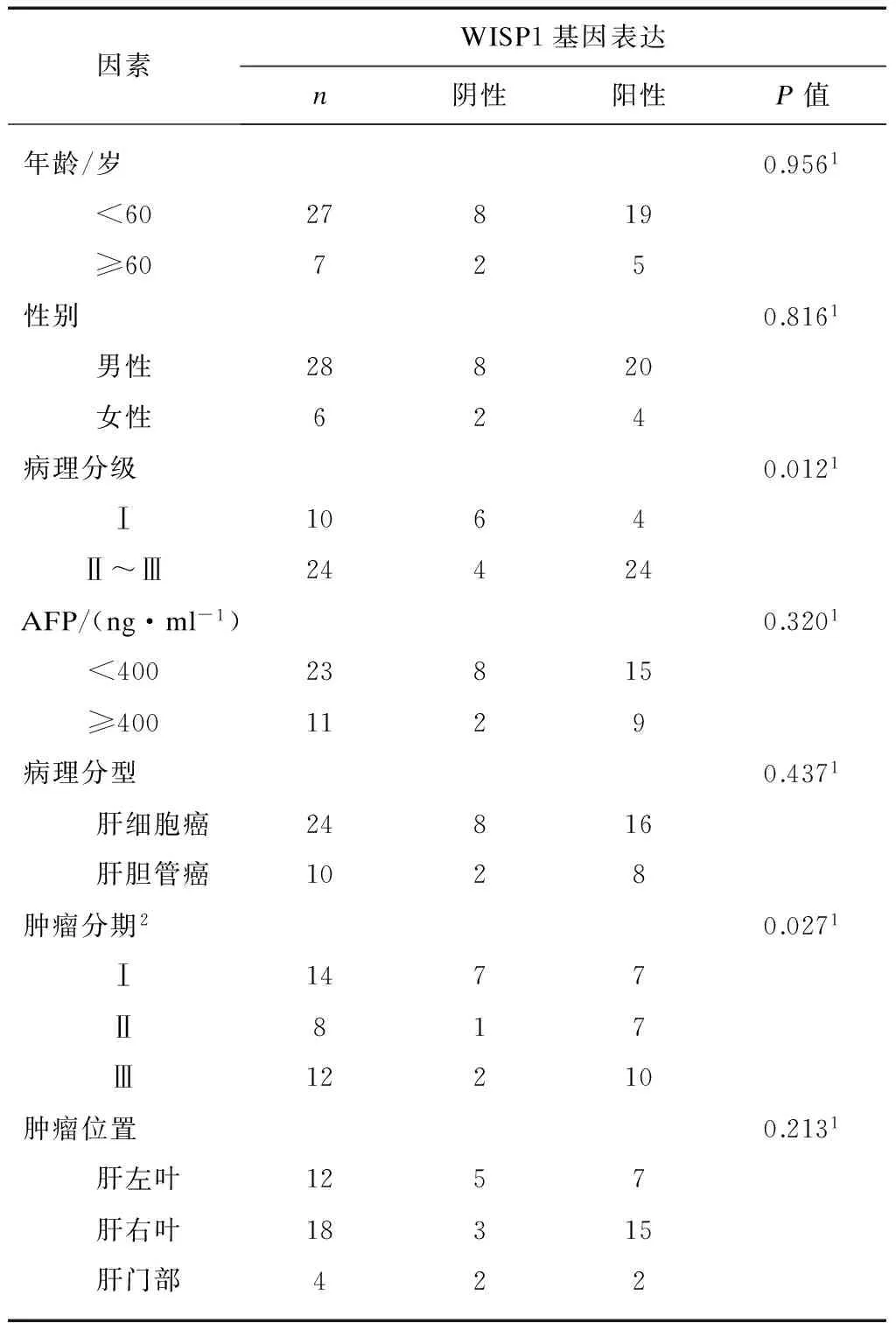
表1 肝癌组织WISP-1表达水平与临床和病理指标之间的关系
注:1为双侧t检验;2表示肿瘤Ⅱ和Ⅲ期合并;2-ΔΔCt值>1为阳性,<1为阴性
3 讨 论
PHC是我国常见的消化道恶性肿瘤。2015年,PHC在我国所有恶性肿瘤中的发病率居第4位,而由PHC导致的死亡在所有恶性肿瘤中居第3位[6],严重威胁着人民的生命健康,有关PHC的发病机制及干预靶点是目前研究的热点。
20世纪90年代,Hashimoto等[7]在对大鼠高转移性和低转移性黑色素细胞突变体进行RNA差异筛选时首次在低转移性的细胞中发现了一种新的表达基因(expressed in low-metastatic cells, Elm-1),即WISP-1。WISP-1的生物学功能使得其与多种疾病,尤其是恶性肿瘤的发生密切相关。目前,研究[8]显示,WISP-1在很多肿瘤中呈高表达,并与多种组织恶性肿瘤的发生、进展、浸润、转移及其预后有着密切的联系,其中的分子机制有待进一步探究和揭示。WISP-1在恶性涎腺肿瘤的表达明显升高,可能是诊断恶性涎腺肿瘤的新的分子标记[9]。Tai等[10]的研究表明,WISP-1在结肠癌组织中高表达,参与结肠癌的发生、发展,并与结肠癌临床分期及预后相关。肺癌中也得到类似的结果,WISP-1在肺癌中高表达,并与其临床预后密切相关[11]。
目前,有关WISP-1在肝癌中的表达水平及其临床意义的研究较少。本研究通过检测WISP-1在PHC患者临床手术标本中表达水平变化,发现PHC癌组织中WISP-1在mRNA和蛋白水平的表达都显著高于正常对照组。分析其与PHC病程进展的相关性,结果显示WISP-1的表达水平与PHC的病理分级和肿瘤分期相关,而与年龄、性别、AFP水平、肝癌类型及肿瘤位置无明显关联。本研究结果与WISP-1在结肠癌[10]、肺癌[11]等恶性肿瘤中表达水平变化及与临床预后相关性所观察到的结果类似。因此,推测WISP-1在PHC中高表达并参与PHC的发生、发展。
研究[12]显示,Wnt/β-catenin信号通路的过度激活可以促进肝癌细胞增殖,进而加速PHC的进程。由于WISP-1是Wnt/β-catenin信号通路活化下游的靶基因,后续实验可以检测其上游Wnt/β-catenin信号通路的蛋白marker,例如p-GSK3β/GSK3β, β-catenin等蛋白的变化情况。至于WISP-1下游的分子机制,目前报道较多的是其可以作用于整合素信号通路来参与肿瘤的进程。例如,在骨肉瘤中,WISP-1通过整合素受体信号转导通路促进MMP-2和MMP-9的表达而促进骨肉瘤细胞迁移[13];在前列腺癌中,WISP-1通过αVβ1整合素信号通路促进前列腺癌骨转移[14]。因此,推测在肝癌中,WISP-1可能也作用于整合素信号通路,可以对该通路进行检测。如果结论得到证实,则可以利用免疫共沉淀及竞争抑制实验鉴定与WISP-1结合的整合素受体,从而进一步揭示WISP-1在肝癌进程中的分子机制。
本研究表明,WISP-1在肝癌组织中过度表达,WISP-1的表达水平与肝癌组织的病理分级和肿瘤分期相关,WISP-1是否可以作为肝癌治疗的潜在靶点值得进一步研究。后续的研究可以在肝癌细胞中构建WISP-1低表达的稳转细胞系,通过BrdU/CCK8、划痕修复实验及Transwell小室实验以及流式细胞术等,探究WISP-1对肝癌细胞增殖、迁移以及凋亡等方面的影响。
[1] Berschneider B, Königshoff M. WNT1 inducible signaling pathway protein 1(WISP1): a novel mediator linking development and disease[J]. Int J Biochem Cell Biol, 2011,43(3): 306-309.
[2] Chen CC, Lau LF. Functions and mechanisms of action of CCN matricellular proteins[J]. Int J Biochem Cell Biol, 2009,41(4): 771-783.
[3] Cheng JH, She HY, Han YP, et al. Wnt antagonism inhibits hepatic stellate cell activation and liver fibrosis [J]. Am J Physiol Gastrointest Liver Physiol, 2008,294(1): G39-G49.
[4] Monga SP. β-catenin signaling and roles in liver homeostasis, injury, and tumorigenesis[J]. Gastroe-nterology, 2015,148(7): 1294-1310.
[5] Thompson MD, Monga SP. WNT/beta-catenin signaling in liver health and disease[J]. Hepatology, 2007,45(5): 1298-1305.
[6] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2): 115-132.
[7] Hashimoto Y, Shindo-Okada N, Tani M, et al. Identification of genes differentially expressed in association with metastatic potential of K-1735 murine melanoma by messenger RNA differential display[J]. Cancer Res, 1996,56(22): 5266-5271.
[8] Schneider S, Kloimstein P, Pammer J, et al. New diagnostic markers in salivary gland tumors[J]. Eur Arch Otorhinolaryngol, 2014,271(7): 1999-2007.
[9] Chuang JY, Chen PC, Tsao CW, et al. WISP-1 a novel angiogenic regulator of the CCN family promotes oral squamous cell carcinoma angiogenesis through VEGF-A expression[J]. Oncotarget, 2015,6(6): 4239-4252.
[10] Tai HC, Chang AC, Yu HJ, et al. Osteoblast-derived Wnt-1-induced secreted protein 1 increases VCAM-1 expression and enhances prostate cancer metastasis by down-regulating miR-126[J].Oncotarget, 2014,5(17): 7589-7598.
[11] Chen PP, Li WJ, Wang Y, et al. Expression of Cyr61, CTGF, and WISP-1 correlates with clinical features of lung cancer[J]. PLoS One, 2007,2(6): e534.
[12] Takigawa Y, Brown AM. Wnt signaling in liver cancer[J]. Curr Drug Targets, 2008,9(11): 1013-1024.
[13] Wu CL, Tsai HC, Chen ZW, et al. Ras activation mediates WISP-1-induced increases in cell motility and matrix metalloproteinase expression in human osteosarcoma[J]. Cell Signal, 2013,25(12): 2812-2822.
[14] Yang JY, Yang MW, Huo YM, et al. High expression of WISP-1 correlates with poor prognosis in pancreatic ductal adenocarcinoma[J]. Am J Transl Res, 2015,7(9): 1621-1628.
Expression of Wnt induced secreted protein-1 in primary
hepatic carcinoma and its clinical significance
CHENSheng1,JIANYi-cheng1,ZHOUWei2,GUOXin-lai2,ZHENGYa-xin3,XIONGWu-jun1
(1. Dept. of Gastroenterology, East Hospital, Tongji University, Shanghai 200120, China; 2. Dept. of General Surgery,East Hospital, Tongji University, Shanghai 200120, China; 3. Dept. of Hepatic Surgery, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China)
Objective To investigate the expression of Wnt induced secreted protein-1(WISP-1) in primary hepatic carcinoma(PHC) and its clinical significance. Methods The expression of WISP-1 mRNA and protein in 34 PHC specimens and matched normal liver tissues was detected by quantitative RT-qPCR assay and Western blot, respectively. The correlation between the expression level and clinical features was analyzed. Results WISP-1 gene overexpression was found in 70.6%(24/34) hepatic cancers, and the average expression level of WISP-1 in HCC tissues was 2.65+1.16 times higher than that in normal liver tissues(P=0.011). The WISP-1 protein expression was basically in accordance with mRNA expression. The expression of WISP-1mRNA was correlated with pathologic grade and tumor stage, but no with age, sex, AFP level, histological type and tumor site. Conclusion Our results suggest that WISP-1 might be involved in the development and progression of PHC and may serve as a potential target for therapeutic intervention of PHC.
WISP-1; primary liver cancer; clinical significance
10.16118/j.1008-0392.2016.05.006
2016-06-01
上海市浦东新区肝脏病专科区重点专科基金(PWZz2013-05)
陈 晟(1989—),女,硕士.E-mail: chensheng1116@163.com
熊伍军.E-mail: xiongwujun@126.com
R 735.7
A
1008-0392(2016)05-0029-05
