离子液体萃取分离有机物研究进展
2016-07-08张香平白银鸽闫瑞一高红帅
张香平,白银鸽,闫瑞一,高红帅
(中国科学院过程工程研究所,北京 100190)
离子液体萃取分离有机物研究进展
张香平,白银鸽,闫瑞一,高红帅
(中国科学院过程工程研究所,北京 100190)
摘要:离子液体是一种结构可调的绿色溶剂,在催化、分离和电化学等领域具有广泛应用,特别是在有机物萃取分离方面,由于其低挥发性及功能可调,避免了传统有机溶剂可能导致的VOCs二次污染,有望成为绿色高效的新型萃取剂。本文系统地综述了离子液体在萃取分离烃类化合物、有机酸、醇类、酚类以及天然产物中的应用研究进展,详细论述了离子液体萃取分离有机物的萃取机理和影响因素,离子液体与溶质分子之间强的氢键、π-π、范德华力以及静电作用使其具有良好的萃取分离能力,表明离子液体是一类可替代有机溶剂实现高效萃取分离有机化合物的潜在溶剂。针对实际工作应用,还需解决其高黏度、高成本等问题,此外萃取后离子液体的回收仍是其大规模应用而需要亟待解决的难题。
关键词:离子液体;萃取;碳氢化合物;有机酸;醇;酚类化合物;天然化合物
第一作者及联系人:张香平(1969-),女,研究员,从事绿色化工及清洁技术研究。E-mail xpzhang@ipe.ac.cn。
产物分离与提纯是化工生产中重要的一个环节,同时也是导致高能耗和二次污染的因素之一。液体混合物的分离常用的是精馏单元操作,对于相对挥发度低(如苯/正己烷)或者共沸物(如乙醇/水)体系普通精馏不能达到分离的目的,则可以采用共沸精馏、萃取精馏进行产物的分离提纯,但通常这些操作工艺复杂、能耗大、生产成本高,因此采用液-液萃取的分离方法也是行之有效的措施。工业上常用液-液萃取分离烃类混合物,以及从发酵液中提取有机酸、醇类产品和回收废水中的酸类、酚类等。此外,固-液萃取也常用于从天然产物中提取得到高附加值产品,同时,为了提高萃取效率也采用微波或超声辅助萃取以强化该过程。
萃取剂的选择是萃取操作的关键。一般采用有机溶剂作为萃取剂,因此为了提高萃取效率,大量的有机溶剂被使用,增加了溶剂回收的成本,同时有机溶剂易挥发、易燃、有毒,在使用过程中带来环境和安全问题。因此选择高效绿色的溶剂来替代有机溶剂是该领域的发展趋势,离子液体是其中一个选择。
离子液体是由有机阳离子和有机或无机阴离子组成的熔点低于100℃的盐。组成离子液体的阴阳离子种类很多,可以通过改变阴阳离子结构来调控离子液体的性质,因此离子液体被认为是一种可设计的溶剂,总之,离子液体可忽略的蒸气压、不易燃、优良的热稳定性、宽液程、稳定的电化学窗口以及对有机/无机物的强溶解能力,有望在萃取过程中发挥重要作用。自1998年ROGERS等[1]首次用[Bmim]PF6离子液体从水溶液中萃取分离得到苯基衍生物以来,离子液体在萃取分离有机物方面应用日益广泛,包括用于烃类化合物、有机酸、醇类、酚类以及生物质中产物提取等。本文着重对离子液体萃取分离有机物的基础及应用研究进行系统综述和分析。
1 离子液体萃取分离烃类化合物
烃类化合物包括脂肪烃和芳香烃,特别是对于结构相近的烃类化合物,沸点相近且易形成共沸物,普通的精馏操作很难将其分离,因此采用离子液体萃取分离烃类化合物是一个可行的途径,离子液体用于萃取分离的烃类化合物主要有芳香烃/直链烃(苯/正己烷、甲苯/正庚烷等)[2]、芳香烃/环烷烃(苯/环己烷、乙苯/环辛烷等)[3]、直链烃/环烷烃(正己烷/环己烷)[4]、烯烃/烷烃(1-己烯/正己烷)[5]等。
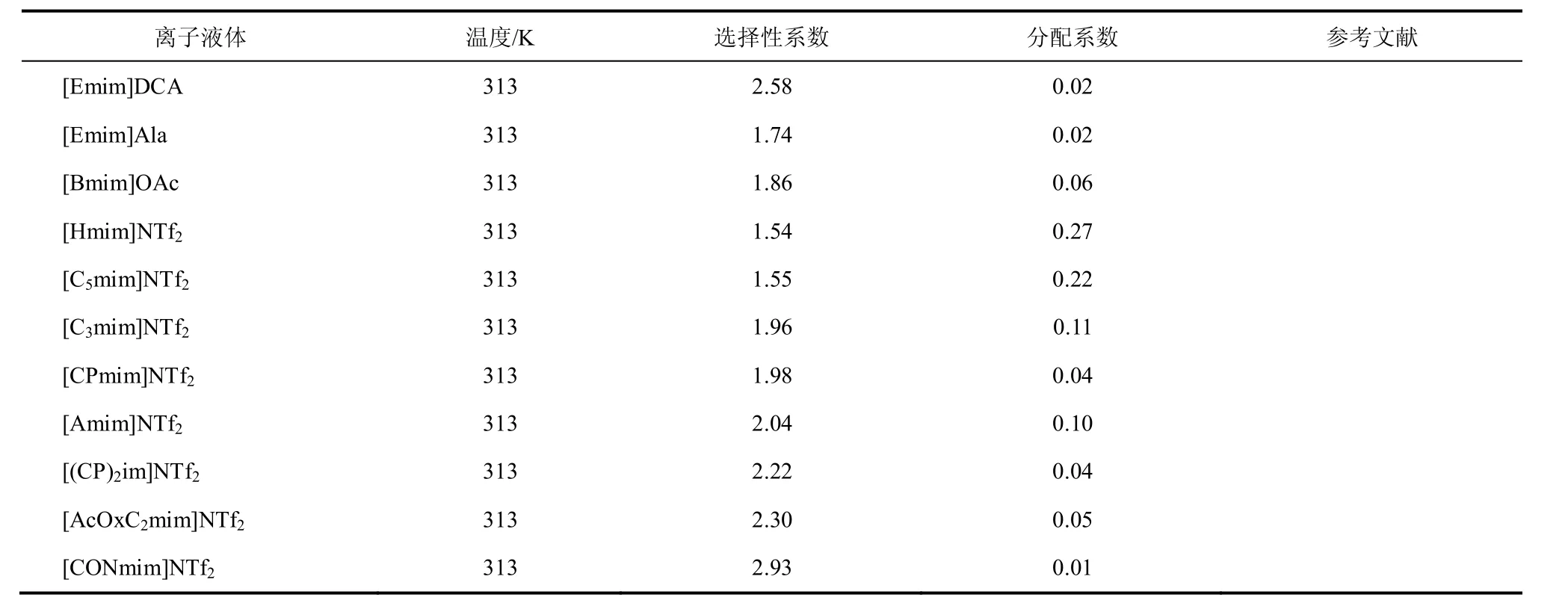
ARCE等[6-7]采用1-烷基-3-甲基咪唑双三氟甲磺酰亚胺作为萃取剂萃取分离甲苯和正己烷混合物,通过实验测定了298.15K下不同烷基侧链长度的离子液体/甲苯/正己烷的液-液平衡数据。实验结果表明,烷基侧链最短的离子液体[Emim]NTf2作为溶剂萃取甲苯/正己烷的选择性最高,随着离子液体烷基侧链长度的增加,离子液体对甲苯和正己烷的亲和性均增加,导致选择性系数(selectivity, S)随着离子液体烷基侧链的长度增加而减小,溶质的分配系数(distribution coefficient, D)则随着离子液体烷基侧链的增加而增大。苯分子与1-烷基-3-甲基咪唑双三氟甲磺酰亚胺离子液体的阴阳离子均具有相互作用,苯环上的氢原子和1-烷基-3-甲基咪唑双三氟甲磺酰亚胺离子液体的阴离子上的氟原子以及磺酰基中的氧原子之间能形成氢键作用,并且苯和离子液体阳离子之间还存在π-π作用,因此离子液体对苯具有很好的溶解作用。对于1-烷基-3-甲基咪唑双三氟甲磺酰亚胺离子液体,阴阳离子相互靠近形成一个带电区域,并且离子液体之间形成规整结构。当正己烷和短链的离子液体混合时,打乱了离子液体的规整结构,因此短链的离子液体萃取苯/正己烷混合物具有较大的选择性。对于长链的离子液体,正己烷和甲苯能被离子液体的长烷基侧链包容,从而增加在离子液体中的溶解,因此烷基侧链较长的离子液体萃取分配系数增加而选择性系数降低[6]。LARRIBA等[8]考察了[Emim]DCA、[Bmim]DCA和[Emim]TCM三种离子液体从正庚烷中萃取分离甲苯的性能,和环丁砜的萃取效果对比发现,[Emim]DCA离子液体的萃取选择性系数是环丁砜的两倍,但是甲苯的分配系数较小;[Bmim]DCA离子液体的萃取能力较好,但是其黏度较大(是相同温度下环丁砜黏度的近两倍);[Emim]TCM的萃取选择性系数和分配系数均比环丁砜要好,并且黏度与环丁砜相比也比较接近,因此可以作为芳烃萃取的替代溶剂。CORDERÍ等[9]通过实验手段测定了庚烷/环己烷+甲苯+[Emim]MeSO4三元体系和庚烷+环己烷+甲苯+[Emim]MeSO4四元体系的液-液平衡数据。对三元体系和四元体系[Emim]MeSO4离子液体均具有较高的选择性系数,因此可以用[Emim]MeSO4离子液体将甲苯从庚烷或环己烷溶液中萃取出来[9]。但是相较于三元体系,[Emim]MeSO4离子液体在四元体系中的萃取选择性和甲苯的分配系数较小,说明[Emim]MeSO4离子液体适用于萃取单一烷烃中的甲苯,对于含有多组分体系的萃取效果会受到影响[9]。
除了用单一离子液体作为萃取剂,也有研究者提出采用离子液体混合溶剂作为萃取剂萃取分离烃类化合物,其中混合溶剂可以是离子液体与有机溶剂混合物也可以是两种离子液体混合物。为了克服离子液体的高黏度和高成本问题,MANOHAR等[10]用离子液体-乙腈混合溶剂作为萃取剂来萃取分离苯和正己烷,选用[Emim]EtSO4和[Emim]OAc来萃取分离正己烷中的甲苯,结果发现对于两种离子液体的萃取体系,正己烷在萃取相(即离子液体相)和萃取剂(离子液体和乙腈)在萃余相(即正己烷相)中的含量几乎为零,表明离子液体-乙腈作为萃取剂能够避免萃取过程的交叉污染,并且萃取的选择性系数高(达到150),因此离子液体是萃取分离苯/正己烷的优良溶剂。POTDAR等[11]用[Bmim]BF4和[Omim]BF4混合溶剂萃取分离甲苯和正庚烷,[Emim]EtSO4和[Emim]MeSO4的混合物作为萃取剂萃取分离苯和正己烷,但是混合离子液体的萃取分配系数没有单一离子液体[Emim]EtSO4好。LARRIBA等[12]用[Emim]TCM和[Emim]DCA离子液体混合溶剂萃取分离正庚烷和甲苯,离子液体混合物中[Emim]TCM摩尔分数为0.8时,萃取剂物理性质和萃取能力要优于环丁砜萃取剂,因此这种离子液体溶剂可以作为萃取分离芳烃化合物的替代溶剂。
烯烃和烷烃是石油化工中较难分离的混合物之一。烯烃和烷烃分子结构相近,特别是当碳链增长时它们分子结构中的差异会进一步被削弱,造成长链的烯烃/烷烃分离更加困难。工业上正己烷和1-己烯的分离采用低温精馏法,要完成正己烷和1-己烯的分离至少需要100块精馏塔版和高的回流比,并且需要在低温和高压下操作,整个工艺是一个高能耗高成本的过程[13]。因此,LI等[14]提出用离子液体萃取分离1-己烯和正己烷混合物,考察了313K下几种离子液体萃取的选择性系数和分配系数,结果表明离子液体对1-己烯具有更好的溶解能力,1-己烯对正己烷的选择性系数在1.5~3.0之间。同时分别考察了离子液体阴阳离子结构对1-己烯和正己烷的萃取分离的影响,几种离子液体阴阳离子结构见图1。对于[Bmim]NTf2、 [Bmim]TfO、[Bmim]PF6、[Bmim]BF4这4种离子液体,1-己烯在两相中的分配系数大小顺序为:[Bmim]NTf2>[Bmim]TfO>[Bmim]PF6>[Bmim]BF4;1-己烯对正己烷的选择性系数大小顺序正好相反。离子液体极性对萃取分离具有较大影响,上述4种离子液体极性顺序为:[Bmim]NTf2<[Bmim]TfO<[Bmim]PF6<[Bmim]BF4。1-己烯和正己烷均为非极性分子,所以极性较弱的[Bmim]NTf2与1-己烯和正己烷具有更强的亲和性,因此具有更强的分配系数;而极性较强的离子液体如[Bmim]BF4萃取分离1-己烯/正己烷得到较高的选择性系数。同时,萃取剂与溶质分子中的不饱和双键上的H之间的氢键作用也能影响1-己烯和正己烷的分离。上述4种离子液体中BF4
-阴离子上的F具有最高的电子云密度,与不饱和双键上的H之间具有最强的氢键作用,因此[Bmim]BF4离子液体对1-己烯/正己烷具有最高的选择性系数。而NTf2-和TfO-阴离子上的亲电性基团S=O导致F原子上的电子云密度降低,从而降低了氢键作用能力,导致较低选择性系数[14]。对[Emim]NTf2、[C3mim]NTf2、[Bmim]NTf2、[C5mim]NTf2、[Hmim]NTf2这5种阴离子相同、阳离子上碳链长度不同的离子液体,随着烷基链长度的增加1-己烯在两相中的分配系数增加,选择性系数降低。这主要是因为随着离子液体阳离子上烷基链长度的增加,离子液体与1-己烯/正己烷之间的范德华作用增强,从而提高了分配系数。而增加阳离子上烷基链长度增强了离子液体的位阻效应,从而影响了咪唑环与C=C双键之间的π-π作用导致萃取选择性系数降低[14]。离子液体萃取烃类化合物液-液平衡数据见表1。
2 离子液体萃取分离有机酸

图1 萃取分离1-己烯/正己烷的离子液体阴阳离子结构1—[Emim]+;2—[C3mim]+;3—[Bmim]+;4—[C5mim]+;5—[Hmim]+;6—[NTf2]-;7—[TfO]-;8—[PF6]-;9—[BF4]-

表1 离子液体萃取分离烃类化合物液-液平衡数据
和食品工业中。其中有机酸生产过程中酸的分离纯化占总生产成本很大的比重。常用的精馏法回收酸能耗大且经济性差,所以常用萃取法回收酸。传统的萃取工艺中用到易挥发、易燃和有毒的有机溶剂,对环境和人体健康造成很大损害。而离子液体作为一种基本不挥发、结构可调的绿色溶剂可替代常规有机溶剂被用于有机酸的分离回收中[16-17]。
(续表)
生物发酵法生产乳酸是一条绿色环保的工艺路线,且其生产工艺的经济性是由乳酸的回收成本决定,据统计乳酸从发酵液中分离和纯化成本占到整个生产成本的50%。因此为了开发一种高效且经济的回收乳酸工艺,MATSUMOTO等[18]用咪唑类离子液体为萃取剂从发酵液中回收乳酸,系统考察了[Bmim]PF6、[Hmim]PF6和[Omim]PF6离子液体的萃取能力和溶剂毒性,虽然3种离子液体毒性要比有机溶剂(甲苯)小,但3种离子液体的萃取能力较低(对乳酸萃取的分配系数分别为0.024、0.040和0.025)。同时作者用离子液体作为稀释剂与磷酸三丁酯复配得到的萃取剂与常规有机溶剂性能相近[18]。WANG等[19]也报道了用咪唑类离子液体([Bmim]PF6、[Hmim]PF6、[Hmim]BF4和[Omim]BF4)作为萃取剂,从水溶液中回收氨基酸(色氨酸、苯丙氨酸、酪氨酸、亮氨酸和缬氨酸)的研究结果。实验结果表明氨基酸在离子液体相和水相中的分配系数与氨基酸的憎水性有关,憎水性强的氨基酸其分配系数较大;并且氨基酸的分配系数受到水溶液pH值的影响,当在pH < pK1范围内,增加pH值则氨基酸的分配系数急剧减小,当pH值在pK1< pH < pK2范围内变化时氨基酸的分配系数变化不大(图2)[19]。这是因为氨基酸在溶液中的存在形式受溶液pH值的影响,在酸性溶液中(pH < pK1),—COO−被质子化为—COOH,氨基酸分子带正电荷;在碱性溶液(pH > pK2)中—NH3+失去质子,氨基酸分子带负电;在pK1< pH < pK2范围内氨基酸分子呈两性离子状态(图3)。在pH < pK1范围内,阳离子态的氨基酸含量随着pH值增加而减少,与氨基酸萃取分配系数的变化吻合,该作者认为这是因为阳离子形式的氨基酸和离子液体阴离子之间的强的静电作用造成的[19]。即阳离子状态下氨基酸的—COOH与离子液体阴离子(BF4
-或F6
-)之间存在氢键作用,当溶液pH值升高氨基酸中的—COOH基团失去质子成为-COO-,其与离子液体之间的氢键作用被打破,从而造成氨基酸在离子液体中的分配系数减少。
由于咪唑类离子液体萃取有机酸的萃取能力较低,MARTÁK等[21-23]提出了高效的膦类离子液体萃取分离水溶液中的乳酸和丁酸。该作者[22]选用[P6,6,6,14]Phos离子液体萃取分离水中的乳酸和

图2 不同pH值下色氨酸在离子液体和水相中的分配系数[19]

图3 氨基酸在溶液中的存在状态随溶液pH值的变化[20]
有机丁酸,离子液体与有机酸之间的氢键作用使低浓度下乳酸的分配系数能达到40。OLIVEIRA等[24]用憎水性的膦类离子液体从水溶液中回收乳酸、苹果酸和琥珀酸等3种短链有机酸,所用到的膦类离子液体为[P6,6,6,14]Cl、[P6,6,6,14]Dec和[P6,6,6,14]Phos,考察了离子液体阴离子结构和有机酸浓度对酸的萃取率和分配系数的影响(图4和图5)。由图可知,乳酸萃取率和分配系数随着酸浓度增加而增加,[P6,6,6,14]Cl和[P6,6,6,14]Dec萃取乳酸的分配系数较小(在1.4~2.0之间),萃取率也较低,低于66%;[P6,6,6,14]Phos萃取乳酸的分配系数在2~5之间,萃取率高于67%,最大达到83%,说明萃取乳酸的离子液体[P6,6,6,14]Phos的性能要优于另外两种离子液体[24]。对于苹果酸和琥珀酸(二羧酸)酸浓度的影响和乳酸不同,如[P6,6,6,14]Cl萃取苹果酸和琥珀酸在低浓度下具有更高的萃取率和分配系数,随着酸浓度增加酸的萃取率和分配系数呈降低趋势;[P6,6,6,14]Dec对苹果酸和琥珀酸的萃取也是在低浓度下具有最大的萃取率和分配系数,但是随着酸浓度增加萃取率和分配系数先减小后增大;[P6,6,6,14]Phos对苹果酸的萃取率和分配系数随酸浓度的变化规律和乳酸的类似,但是在高浓度下酸的分配系数则增加很大(由0.05mol/L下的1.5增加为0.5mol/L下的4.4);[P6,6,6,14]Phos对琥珀酸的萃取随着酸浓度增加萃取率和分配系数先减小后增大,并且在低浓度下(0.05mol/L)具有最大的萃取率和分配系数,分别为89.6%和8.6[24]。
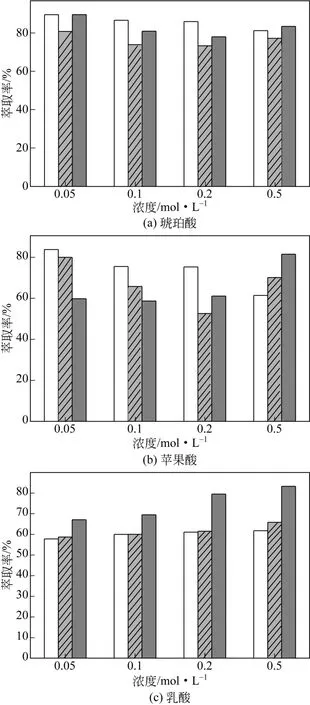
图4 膦类离子液体萃取分离不同浓度有机酸的萃取率[24]

图5 不同浓度有机酸在膦类离子液体和水溶液中的分配系数[24]
除了咪唑类离子液体和膦类离子液体,铵类离子液体由于价格低廉、萃取能力强是目前萃取有机酸较常用的离子液体。KYUCHOUKOV等[25]用铵类离子液体[A336]Cl萃取回收水溶液中的乳酸。[A336]Cl萃取乳酸有两种形式:对乳酸根离子(L-)的化学萃取[式(1)]和对未解离的乳酸分子的物理萃取过程[式(2)],总的萃取过程受溶液pH值和乳酸浓度影响[25]。

随着乳酸浓度的升高乳酸根离子的化学萃取呈先增加后下降趋势,乳酸的物理萃取则先降低后增加;在低pH值的溶液中主要是乳酸分子的物理萃取过程,随着pH值升高,乳酸根离子的萃取量增加,但总的来说未解离酸的物理萃取处于主导地位[25]。2008—2009年,KESHAV等[26-29]报道了用[A336]Cl离子液体萃取丙酸、丙烯酸和丁酸等有机酸的研究。[A336]Cl能同时萃取解离态和非解离态的有机酸,在低pH值下酸以非解离态存在。[A336]Cl通过与有机酸形成配合物的形式将酸从水溶液中提取出来,并且一分子的[A336]Cl可以和多分子的有机酸作用,从而具有很高的萃取能力[27-28]。以丙酸为例,[A336]Cl∶丙酸配合物可以形成1∶1或者1∶2的结构,甚至还能形成1∶3的结构,如图6所示[27]。
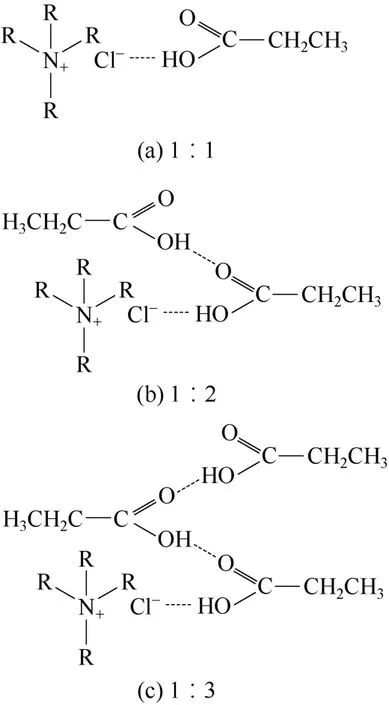
图6 1∶n [A336]Cl-丙酸配合物结构[27]
3 离子液体从生物质中萃取天然化合物
从生物质中提取高附加值的化学品愈来愈受到人们的重视。一方面是由于某些化学品的合成过程步骤多,线路长,合成成本高,从生物质中提取成本较低。另一方面生物质是可再生的,从中提取产品是一条可持续发展的线路。从废弃的生物质中提取高附加值的产品,如从虾壳中提取甲壳素也是资源再利用的一种方法[30]。另外,消费者对天然产品的认可度要高于合成化学品,虽然合成的化学物质安全性上来说不一定低于天然物质,但天然产物的市场价格要高于化学合成得到的同种物质[31]。传统的用有机溶剂从天然原料萃取得到高附加值的产物效率低、选择性差、能耗高以及可能破坏目标产物[32],而且有机溶剂易挥发、易燃、有毒,易引起环境和安全问题。离子液体以其独特的性质,作为一种“绿色溶剂”用于生物质中萃取分离高附加值产品,具有潜在优势。
从生物质中提取的产品有类脂、生物碱、类黄酮、芳烃化合物、酚类化合物、酚酸类化合物等。常用的萃取手段有固-液萃取(solid-liquid extraction,SLE),微波辅助萃取(microwave-assisted extraction,MAE)和超声辅助萃取(ultrasound-assisted extraction,UAE)。
3.1 类脂
类脂包括许多类型的化合物,一般可分为复脂和单脂两种。复脂是指可以水解成为简单成分的脂,大部分复脂是长链羧酸的酯即脂肪酸酯,如蜡和甘油酯,其中蜡是长链醇的酯,甘油酯是丙三醇的酯。单脂是指不容易被酸或者碱水解的脂,如类固醇、前列腺素和萜烯等。
3.1.1 微藻中提取脂
生物柴油具有与石化柴油相似的燃烧特性,并且具有可生物降解、不含氮氧化合物、低毒性等特点,是一种优良的可替代石化柴油的可再生能源。生物柴油主要是以油脂为原料,通过酯交换反应或者酯化反应来得到,从而造成生物柴油生产成本高,限制了其发展。有数据显示生物柴油生产过程中的原料成本占总生产成本的75%。另一方面,目前生产生物柴油的原料大多是可食用的植物油如棕榈油、菜籽油和大豆油,在世界范围内粮食供应还不充足的情况下,不可能大量用来生产生物柴油。因此为了避免能源和粮食危机,选择不可食用的微藻作为生产生物柴油的原料——脂的来源具有一定现实和经济意义。微藻具有高的光合成效率和生产效率,种植过程不用像油料作物那样占用大量田地;并且微藻中脂含量很高,在合适的生长条件下一些微藻物种可以集聚50%~70%的脂。
目前从微藻中提取脂常用的方法有索氏提取法(Soxhlet extraction)和Bligh & Dyer法(Bligh and Dyer’s method)[33]。索氏提取法用正己烷作为溶剂,Bligh & Dyer法采用氯仿和甲醇混合溶剂。近年来有研究者利用离子液体作为溶剂从微藻中提取脂。
YOUNG等[34]报道了一种亲水性离子液体[Emim]MeSO4和甲醇的混合溶剂作为一种高性能的萃取剂从Chlorella微藻中提取脂,结果得到占微藻干重38%的脂,而从Duniella微藻中仅得到8.6%的脂。KIM等[35]用[Bmim]TfO和甲醇的混合溶剂从Chlorella vulgaris微藻中提取脂,结果表明离子液体/甲醇混合溶剂萃取脂的收率比常规的Bligh & Dyer法提高了72%。该作者对比了离子液体阴阳离子结构对脂萃取率的影响,结果表明离子液体阴离子的结构对脂萃取具有更大的影响,并且通过LSER(linear solvation energy relationship)分析表明离子液体的偶极/极化率和氢键酸性对脂的萃取具有重要影响[35]。到2013年KIM等[36]又提出了一种超声辅助离子液体萃取Chlorella vulgaris微藻中脂的方法。该法采用纯[Bmim]MeSO4离子液体作为萃取溶剂,由于[Bmim]MeSO4离子液体强的溶解能力,能打破微藻的细胞壁使类脂从细胞中释放出来,故用[Bmim]MeSO4离子液体从Chlorella vulgaris微藻中得到47mg/g干细胞质量的脂,分别是索氏提取法和Bligh & Dyer法的2.24倍和1.62倍[36]。同时该作者研究发现通过超声辅助的方法不仅能提高萃取过程脂的收率,还能大大缩短萃取时间[36]。CHOI等[37]研究了熔盐和离子液体的混合物从Chlorella vulgaris微藻提取脂,熔盐阴离子和离子液体阴离子之间的协同作用使得脂的收率大大提高,结果表明FeCl3·6H2O/[Emim]OAc混合物萃取脂收率达到227.6mg/g细胞。目前萃取微藻中脂常用的离子液体是咪唑类离子液体,这类离子液体萃取剂虽然能得到较高的脂收率,但该类离子液体成本较高。最近,OLKIEWICZ等[38]提出了一种膦类离子液体[P(CH2OH)4]Cl从微藻中提取脂的方法。该类离子液体之前作为一种阻燃剂使用,其价格要比咪唑类离子液体低[39]。由于离子液体[P(CH2OH)4]Cl阳离子上-OH基以及阴离子Cl-,使得其具有强的氢键作用能力,能溶解/改性微藻细胞壁使得细胞中的类脂顺利释放出来,从而得到较高的脂收率[38]。
从微藻中萃取脂需要将微藻细胞壁破坏,传统的物理和化学方法是一个高耗能的过程[40]。离子液体对纤维素、半纤维素、蛋白质等具有很好的溶解能力,因此能很好地打破或者改性微藻细胞壁,使得脂从微藻细胞中释放出来,并且由于离子液体对类脂几乎不溶解,释放出来的脂很容易分离回收,加上低成本离子液体的开发,使得离子液体萃取分离微藻中的脂具有很好的应用前景[41-45]。从微藻中提取脂所使用的离子液体列于表2。
3.1.2 萜类化合物
萜类化合物是存在于生物质中最大的一类天然产物,这类化合物与萜烯(碳骨架由异戊二烯单元组成的各种化合物)相似,即使没有由专门的异戊二烯单元组成的碳骨架,但是一般也是通过异戊二烯碳骨架重排或者引入新的元素如碳、氧等得到[32]。萜类化合物具有抗癌、消炎以及抗疟疾等活性,具有重要的药用价值。离子液体萃取得到的几种萜类结构式见图7。
2009年,WU等[47]用离子液体超声辅助萃取法从中草药丹参中提取丹参酮化合物。该作者[47]选取了长链离子液体[Cnmim]Br(n=8,10,12,14,16)作为萃取剂,对比了不同链长的离子液体对隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA的萃取效果,发现短链的离子液体[Omim]Br对隐丹参酮和丹参酮IIA没有萃取效果,当碳链长度大于10时对3种丹参酮才能有效地萃取,并且随着碳链长度的增加3种丹参酮的萃取收率增加,[C16mim]Br离子液体具有最好的萃取收率,对隐丹参酮、丹参酮I和丹参酮IIA这3种组分的收率分别达到了0.6mg/g、1.2mg/g和1.4mg/g。由于碳链长度会影响离子液体的胶束形成能力,对于短链离子液体([Omim]Br)具有较大的临界胶束浓度,长链离子液体在低浓度下就容易聚集形成胶束[47]。丹参酮是一种亲油性的化合物,在水中的溶解是一个胶束化的过程,离子液体扮演了表面活性剂的作用,其亲油性的烷基侧链与丹参酮分子结合,亲水性的基团在外与水结合形成胶团从而将丹参酮提取出来,所以易形成胶束的长链离子液体对丹参酮具有较好的萃取收率[47]。BI等[50]提出了一种用超声辅助萃取和预富集丹参酮的方法。该法用离子液体水溶液作为萃取剂,从丹参中萃取得到了隐丹参酮、丹参酮I和丹参酮IIA,通过对4种具有相同阴离子的离子液体[Emim]Cl、[Bmim]Cl、[Hmim]Cl和[Omim]Cl的萃取效果考察,发现增加烷基链长度3种丹参酮的萃取率均增加;离子液体氢键碱性和亲油性随着阳离子烷基侧链的增加而增加,使得4种离子液体中[Omim]Cl与丹参酮具有最强的作用,因此具有最好的萃取率。同时,BI等[50]提出了一种预富集丹参酮的新方法,即通过离子置换将亲水性的离子液体(阴离子为Cl-)部分转化成疏水的离子液体(阴离子为PF6-和Tf2N-),这样亲水性的离子液体将生物质中的丹参酮萃取到水溶液中,然后疏水的离子液体能捕集这些被萃取的丹参酮,从而达到富集的目的(图8),结果表明对于[Omim]Cl/[Omim]PF6体系,离子液体相能分别富集水相中84.3%的隐丹参酮、96.2%的丹参酮I和94.3%的丹参酮IIA。

表2 微藻中脂萃取所使用的离子液体以及萃取条件和收率
BI等[49]用离子液体超声辅助萃取法从虾壳中提取虾青素。虾青素是一种高价值的类胡萝卜素,具有强抗氧化特性,常用于食品、保健品以及化妆品中[51]。该作者首先筛选了几种分子溶剂:水、甲醇、乙醇、正己烷、乙酸乙酯、丙酮和二氯甲烷,其中乙醇的萃取收率最佳[49]。然后以乙醇作为溶剂,考察了离子液体的萃取性能,对比[Bmim]Br、[Bmim]Cl、[Bmim]BF4和[Bmim]MeSO4,[Bmim]Br的萃取收率最高;与上述丹参酮的萃取类似,离子液体阳离子上碳链长度增加,虾青素的萃取率增加。该作者还设计了一种功能化离子液体[C3NH2mim]Br来萃取虾青素,并得到了最佳的萃取收率,平均每克干虾壳能得到80μg的虾青素[49]。[C3NH2mim]Br离子液体一方面能保持和虾青素之间强的π-π、n-π以及氢键作用,另一方面分子结构中存在的还原性基团-NH2能保护虾青素避免被氧化,保证所萃取的虾青素的活性[49]。LIU等[52]用离子液体微波辅助萃取技术从迷迭香中萃取鼠尾草酸。在研究的几种离子液体中,阴离子为Br-的离子液体具有较好的萃取效果,并且随着离子液体阳离子上碳链长度的增加萃取能力增加[52]。其他用离子液体萃取得到的萜类化合物还有柠檬烯[48,53]、白桦脂醇[54]以及人参皂苷[55]等。

图8 可溶/不溶离子液体萃取丹参酮示意图[50]
3.2 生物碱类化合物
生物碱是一种广泛存在于生物质中的含氮碱性化合物,具有很广泛的药理活性[56]。比如生物碱吗啡和可待因能作用于人类的神经系统,是一种优良的镇痛药;可卡因具有致幻作用,被用作兴奋剂;奎宁具有抗疟疾性能;并且生物碱具有抗哮喘、抗癌、抗心律失常、镇痛、抗菌以及抗高血糖等活性,因此生物碱在药物和制药工业上具有重要的科研和经济价值[56]。生物碱主要是从植物中提取,常用的提取方法有加热回流萃取法(heating reflux extraction)、索氏提取法和常温浸渍法等[57]。这些方法从生物质中萃取生物碱化合物效率较低,能量消耗大并且需要使用有毒易挥发的有机溶剂,因此发展一种高效绿色的从生物质中提取生物碱的新方法是研究的热点[58]。近年来,有一些研究者用离子液体作为萃取剂从天然原料中提取生物碱(图9)得到了比较好的效果[57,59-61]。
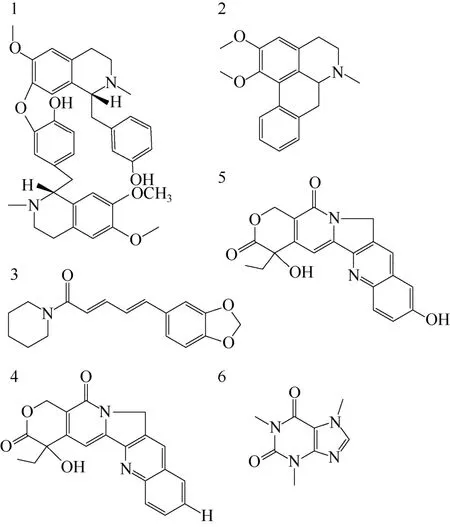
图9 离子液体萃取得到生物碱的化学结构式[56]
LU等[58]于2008年采用微波辅助萃取的方法首次用离子液体从中药材莲子心中提取了莲心碱、异莲心碱和甲基莲心碱3种莲心碱。这3种莲心碱是中药材莲子心的活性组分,用于组织炎症、神经系统疾病以及心血管疾病,如高血压和心律失常的治疗。LU等[58]以咪唑基离子液体([Emim]BF4, [Bmim]Cl, [Bmim]Br, [Bmim]BF4, [Bmim]PF6, [Hmim]BF4, [Omim]BF4)的水溶液作为萃取剂,考察了几种离子液体的萃取效果,结果[Bmim]BF4离子液体对这3种生物碱具有更好的萃取效果;并且对比常规微波辅助萃取和加热回流萃取,离子液体微波辅助萃取方法不仅提高了生物碱的萃取率(增加20%~50%),还大大缩短了萃取时间(从2h缩减至90s)。该团队[62]用同样的方法从莲叶中提取了荷叶碱、N-去甲荷叶碱和O-去甲荷叶碱等3种生物碱,几种咪唑类离子液体中[Bmim]Br具有最佳的萃取效果。对萃取条件微波辐射功率、萃取时间和固-液比的考察发现微波辐射功率对3种生物碱的萃取率影响不大,但是微波辅助下能在短时间内提高生物碱的萃取率,同时降低固-液比能增加萃取率。ZHANG等[63]用超声辅助萃取法用[Bmim]BF4从防己中提取防己诺林碱和汉防己碱两种生物碱,与常规方法相比,两种生物碱的萃取效率具有明显提升。该作者研究发现用[Bmim]BF4水溶液作为萃取剂,离子液体在1.5mol/L的浓度下萃取效果最佳,超声功率达到150W后增加超声功率对萃取的影响不大,并且对己诺林碱和汉防己碱超声40min后两种生物碱的萃取过程基本上达到平衡[63]。另外,该作者还发现溶剂的pH值对两种生物碱的萃取率具有较大影响,当pH值从0.2增加到9.8时,生物碱的萃取率增加,pH值从9.8继续增加到13.8的过程中生物碱的萃取率降低。分析认为[Bmim]BF4与生物碱之间具有氢键作用,在低pH值下生物碱碱性位被酸中和,从而使得其与离子液体的氢键作用减弱,而在高pH值下防己中所含的淀粉被碱化使得淀粉的颗粒结构分解生成淀粉糊,阻碍了生物碱的萃取[63]。CAO等[64]报道了超声辅助萃取法从白胡椒中萃取胡椒碱,用离子液体作为萃取剂缩短了萃取时间,提高胡椒碱的萃取率。RESSMANN等[65]用具有长碳链的离子液体从黑胡椒中提取胡椒碱。WANG等[66-67]报道了分别用微波辅助萃取和超声辅助萃取从喜树中提取喜树碱和10-羟基喜树碱的方法。喜树碱是一种具有抗癌特性的生物碱,10-羟基喜树碱具有更强的抗癌性,并且比喜树碱的毒性更低,用于肝癌、胃癌、结肠癌和白血病的实验和临床研究中[68]。该作者[66-67]考察了几种咪唑类离子液体,结果发现[Omim]Br具有最佳的萃取效果,并优化了萃取条件,对于微波辅助萃取法在最佳的萃取条件下(离子液体浓度,0.8mol/L;浸泡时间,2h;微波辐射功率,385W;辐射时间,8min;固-液比,1∶12)喜树碱和10-羟基喜树碱的收率分别为674.5μg/g和104.0μg/g;用超声辅助萃取的方法在最佳条件下(离子液体浓度,0.75mol/L;超声功率,239W;超声时间,35min;固-液比,1∶12)喜树碱和10-羟基喜树碱的萃取率达到100.2%。YANG等[69]用离子液体作为萃取剂从长春花中萃取得到文朵灵、长春质碱、长春花碱等生物碱。BOGDANOV等[59,70-71]提出了用咪唑类离子液体从黄海罂粟中提取海罂粟碱,得到了较好的萃取效果。其他的生物碱提取,如从瓜拉纳种子中提取咖啡因[72],黄檗中提取黄连素、药根碱和巴马汀等[60],近年来均有报告。
离子液体的黏度大,纯离子液体的萃取过程传质效率低,因此生物质中生物碱的萃取常用离子液体的水溶液来作为萃取剂[58-60,62-67,69-72]。这样降低了萃取剂的黏度,增强了萃取过程的传质,降低了能量消耗[32],比如对于熔点较高的离子液体,可将其溶于水中制成水溶液,从而在常温下也能正常使用。研究表明离子液体对于生物碱的萃取阴离子起主要作用[69,71-72]。BOGDANOV等[59,70-71]用几种咪唑类离子液体提取海罂粟碱,考察了离子液体结构(阴离子:Cl-,Br-,Ace-,Sac-。阳离子:不同碳链长度)对萃取的影响,结果表明对于海罂粟碱的萃取阴离子的影响要比阳离子显著。植物细胞壁主要是由纤维素组成,离子液体对纤维素具有较好的溶解能力。离子液体对纤维素的溶解主要是离子液体阴离子和纤维素上-OH基之间的氢键作用引起的[73]。因此,含有强氢键碱性阴离子的离子液体如[Bmim]Cl、[Bmim]OAc具有很强的纤维素溶解能力,能有效地打破细胞壁,提高萃取效率[72-73]。虽然离子液体阴离子在生物碱萃取中起主要作用,但是离子液体阳离子结构的作用也不能忽视。CLÁUDIO等[72]在从瓜拉纳种子中萃取咖啡因的实验中,用[Bmim]Cl和NaCl水溶液作为萃取剂,在相同的条件下[Bmim]Cl水溶液萃取剂萃取咖啡因的萃取率要远远高于NaCl水溶液萃取剂,这说明离子液体的咪唑阳离子对萃取过程具有促进作用。具有π键电子云的芳香环结构离子液体如咪唑类离子液体与极性分子(如生物碱)具有强的作用,因此离子液体与生物碱之间的范德华作用的强弱影响离子液体从生物质中提取生物碱的性能[32]。MA 等[67]和YANG等[69]的研究表明生物碱萃取率随着离子液体阳离子烷基侧链长度增加而增加,并且对于具有链状和环状侧链阳离子的离子液体,链状侧链的离子液体对生物碱具有更好的萃取能力。此外,具有长烷基侧链离子液体在水溶液中的聚集行为也会影响对生物碱的萃取能力。RESSMANN等[65]研究了几种长烷基侧链的咪唑类离子液体([Cnmim]∶n=10、12和14)从黑胡椒中提取胡椒碱,长碳链离子液体在水溶液中聚集形成胶束,离子液体浓度低于临界胶束浓度时胡椒碱的萃取率小于0.2%(质量分数),当离子液体浓度高于临界胶束浓度时(100mmol/L)胡椒碱的萃取率增到4.0%(质量分数)。作者推测离子液体浓度在临界胶束浓度以上时所形成的胶束聚集体能部分的打破生物质的细胞结构,促进生物碱的萃取,不过这方面的研究需要进一步进行[65]。
3.3 黄酮类化合物
黄酮类化合物是以黄酮结构为母核而衍生的一类化合物,广泛存在于植物体中。黄酮类化合物具有抗动脉硬化、抗肿瘤、消炎、抗骨质疏松和抗病毒的特性,因此常用于药物中。离子液体从天然资源中萃取得到的黄酮类化合物见图10。
DU等[74]用离子液体微波辅助萃取法从番石榴叶和菝葜块茎中提取得到槲皮素,即3,3′,4′,5,7-五羟基黄酮,分别考察了离子液体结构,离子液体浓度以及萃取条件(样品粒径、液-固比、萃取温度和萃取时间)对槲皮素萃取收率的影响。DU等[74]选择了11种离子液体([Bmim]Cl, [Bmim]Br, [Bmim]BF4, [Emim]BF4, [Bmim]DCA, [Bmim]2SO4, [Bmim]H2PO4, [N1,1,1,1]Cl, [bPy]Cl, [Emim]Br, [Hmim]Br)作为萃取剂,结果发现采用[Bmim]H2PO4和[Bmim]Br从番石榴叶和菝葜块茎得到了最高的槲皮素收率,分别为74.5%和59.6%。具有相同阴离子的离子液体如[Emim]Br、[Bmim]Br 和[Hmim]Br、[Bmim]Br的萃取效果最好,说明离子液体阳离子碳链长度影响萃取效率,随着碳链长度的增加离子液体的氢键碱性增强,亲水性降低,对于[Bmim]Br既有较强的氢键碱性(相较于[Emim]Br)又有较好的亲水性(相较于[Hmim]Br),对槲皮素具有强的溶剂化作用,从而得到比[Emim]Br和[Hmim]Br更好的萃取收率。离子液体[bPy]Cl从番石榴叶和菝葜块茎中萃取得到的收率为50.7%和26.4%,要优于[Bmim]Cl(收率分别为41.5%和21.3%),[N1,1,1,1]Cl的萃取收率最低,分别为21.4%和4.3%,说明离子液体阳离子种类对槲皮素的萃取具有较大影响。具有芳香环阳离子结构的离子液体与溶质分子具有π-π和n-π相互作用[80]。吡啶阳离子比咪唑阳离子具有更强的π-π相互作用,因此具有更强的溶解能力[81]。非芳香环的季铵阳离子与槲皮素分子间没有π-π和n-π相互作用,因此[N1,1,1,1]Cl的萃取能力要弱于[bPy]Cl和[Bmim]Cl两种离子液体。XU等[79]报道了用离子液体从龙须藤中提取槲皮素的微波辅助萃取法,与DU等的工作类似,[Bmim]Br离子液体具有最佳的萃取效果,得到槲皮素的最佳收率为0.1352mg/g。
芦丁是一种重要的药物成分,被用于治疗高血压、胃病、皮肤病、糖尿病以及心脑血管疾病。芦丁可从三白草和槐米中提取得到,其中槐米是国槐花的干花蕾,芦丁在其中的含量达到23.5%[82]。传统上,芦丁的萃取采用加热回流萃取法,需要消耗大量的有毒易挥发的有机溶剂,并且萃取效率也不高。ZENG等[76]用离子液体作为萃取剂,微波辅助萃取法从三白草和槐米中萃取得到了芦丁。芦丁结构含有多个-OH基和芳香环结构(结构见图10),和离子液体的阴离子之间能形成氢键作用,具有强的氢键碱性(阴离子是强的氢键受体)的离子液体对芦丁具有较好的萃取能力,如[Bmim]Br和[Bmim]TsO离子液体对芦丁萃取收率最高[76]。儿茶酚是一种植物性丹宁,其用于皮革鞣制中比铬鞣剂更环保、对人体伤害更小的特性使其使用受到推荐[83]。植物丹宁可以从生物质中提取得到,常用的萃取方法需要高温和大量有机溶剂,并且萃取效率也不高。因此需要开发一种高效萃取植物中丹宁的路线。CHOWDHURY等[75]用一种可蒸馏的质子离子液体([N1,1,0,0][N(CH3)2CO2])室温下从儿茶中萃取得到了儿茶酚。[N1,1,0,0][N(CH3)2CO2]是二甲胺和CO2以2∶1的比例形成的一种离子液体,在45℃下能被蒸馏分解生成二甲胺和CO2,该过程可逆,降温重新生成离子液体(图11),因此萃取后蒸馏将离子液体除去即得到所需要的产品。结果用离子液体萃取儿茶酚相比于水萃取收率提高了40%[75]。

图10 黄酮类化合物结构式[74-79]

图11 [N1,1,0,0][N(CH3)2CO2]离子液体生成及分解示意图[75]
SUN等[77]用咪唑类离子液体从鸢尾根茎中萃取得到了3种异黄酮类化合物:鸢尾黄酮苷、鸢尾甲黄素B和鸢尾甲黄素A,萃取过程在超声辅助下进行,萃取后用高速逆流色谱(high-speed counter-current chromatography)技术将萃取得到的异黄酮混合物分离以得到纯品,3种异黄酮收率分别为:鸢尾黄酮苷37.45mg/g,鸢尾甲黄素B 2.88g/g,鸢尾甲黄素A 5.28mg/g。该作者对比了[Bmim]BF4、[Hmim]Br、[Omim]Br这3种离子液体和甲醇以及NaCl对异黄酮的萃取效果,结果表明[Omim]Br具有最佳的萃取收率,[Hmim]Br和甲醇分别次之[77]。XU等[79]应用微波辅助萃取技术用离子液体萃取剂从龙须藤中提取莰非醇和杨梅酮,研究了几种咪唑类离子液体[Emim]Br、[Bmim]Br和[Hmim]Br的萃取效果,其中[Bmim]Br效果最好,这与前面讨论槲皮素的情况一致,其他几种离子液体[Bmim]H2PO4、[Bmim]HSO4和[HOOCCH2mim]Cl能提供质子促进莰非醇、杨梅酮和槲皮素等黄酮类化合物的水解,从而得到较高的萃取收率。
3.4 其他化合物
除了上述的类脂、生物碱和黄酮类化合物,其他用离子液体从生物质中萃取得到的天然产物如苯并呋喃类化合物、酚酸类化合物、酚类化合物、植物精油以及天然颜料等的研究也有报道。与上述报道的萃取过程类似,最常用的萃取手段是微波辅助萃取和超声辅助萃取,咪唑类离子液体水溶液是使用最多的萃取剂。
洋川穹内酯I、洋川穹内酯H和嵩木内酯是存在于中草药川穹中的苯并呋喃类化合物(图12)。CHI等[86]用微波辅助萃取技术从川穹中萃取得到了这3种化合物,用铵类阳离子和丙酸根阴离子组成的质子型离子液体DMCEAP和DMHEEAP作为萃取剂;除了离子液体结构,同时考察了萃取温度、萃取时间、固-液比以及川穹颗粒大小等萃取条件对3种苯并呋喃类化合物萃取效果的影响。洋川穹内酯H和嵩木内酯的萃取收率不受温度影响,而洋川穹内酯I用DMCEAP离子液体萃取收率随着温度升高而增加;其中,DMCEAP离子液体的萃取效果最好,但是DMCEAP离子液体萃取3种化合物达到平衡的时间(5min)要比DMHEEAP离子液体(1min)长;固-液比以及川穹颗粒大小对萃取收率没有太大影响。鞣花酸、没食子酸和迷迭香酸都属于酚酸类,结构见图12。LIU等[52]用离子液体微波辅助同时萃取和精馏的方法从迷迭香草中得到了迷迭香酸。DU等[74]报道了用离子液体微波辅助萃取法从番石榴叶中提取得到鞣花酸和没食子酸,所用到的11种离子液体中(见3.3节)[Bmim]H2PO4和[Bmim]Br得到的萃取收率最高。CHOWDHURY等[75]于2010年报道了用离子液体室温下从儿茶和诃子中萃取得到鞣花酸和没食子酸。

图12 离子液体萃取的其他种类化合物结构式[52,75,84-86]
CHOWDHURY等[75]从儿茶和诃子中萃取得到鞣花酸和没食子酸的同时也得到了邻苯二酚。萃取所使用的可蒸馏质子离子液体[N1,1,0,0][N(CH3)2CO2],使得萃取后产物的分离通过简单蒸馏即可实现[75]。莽草酸是生产抗流感药达菲的原料(图13),虽然已经有人提出了发酵法生产莽草酸的路线,但是目前莽草酸主要还是从八角茴香的豆荚中提取得到[87-88]。为了提高莽草酸的萃取效率,RESSMANN等[84]用Brønsted酸性离子液体作为溶剂溶解八角茴香提取其中的莽草酸,同时离子液体作为催化剂直接将莽草酸转化为莽草酸乙酯和二乙基酮中间体,以进一步合成达菲。所用的离子液体有[(HSO3)Bmim]HSO4、[(HSO3)Bmim]Br、[(HSO3)Bmim]Cl 、 [(HSO3)Bmim]NTf2、 [(HSO3)Bmim] H2PO4、[Emim]HSO4和[(H)Bim]HSO4等7种,其中[(HSO3)Bmim]HSO4、[(HSO3)Bmim]Br和[(HSO3)Bmim]NTf2催化莽草酸的转化率要高于H2SO4的转化率(83%),[(HSO3)Bmim]NTf2的催化酯化率最高,达到了99%[84]。为了扩大莽草酸的来源,USUKI等[89]用纯[Bmim]Cl作为溶剂从银杏叶中提取得到了莽草酸,在适当的条件下离子液体的萃取收率是甲醇和二甲基甲酰胺的两倍多。
ZHAI等[90]首次采用离子液体微波辅助萃取法从八角茴香和枯茗中提取植物精油。离子液体微波辅助萃取法得到的植物精油成分与水蒸气蒸馏法相比差别不大,但是离子液体微波辅助萃取法避免水的使用减少了萃取后水的分离成本,并且萃取效率更高,15min就能萃取完全,而水蒸气蒸馏法则需要180min[90]。JIAO等[91-92]研究了用离子液体[Amim]Cl、[Emim]OAc、[Bmim]Cl和[Bmim]Br预处理然后用水蒸气蒸馏法从香鳞毛蕨和连翘中提取植物精油,结果发现,采用[Emim]OAc预处理后得到的植物精油收率最高,从香鳞毛蕨和连翘得到植物精油收率分别为0.82%和8.06%。GARCIA等[93-94]报道了软木中软木脂的离子液体提取法。研究发现,[Emim]Cl和[Bmim]Cl离子液体不能从软木中提取软木脂,但是将离子液体的Cl-阴离子替换成乳酸根阴离子(LAc-)和乙酸根阴离子(OAc-),离子液体对软木脂的溶解能力会大大提升;另外胆碱阳离子的离子液体要比咪唑阳离子的离子液体萃取能力强,特别是对软木脂中芳烃组分的溶解[93]。离子液体从软木中萃取软木脂的萃取能力为:[Emim]C5CO2(30%)<[N1,1,1,(2OH)]C9CO2(59%)<[N1,1,1,(2OH)]C7CO2(64%) < [N1,1,1,(2OH)]C5CO2(67%)[94]。

图13 莽草酸生产达菲路线[84]
离子液体从植物中萃取得到的另外一类化合物就是天然染料。苏丹红染料(Ⅰ、Ⅱ、Ⅲ和Ⅳ)常被用作一些产品如蜡、织物以及地板和鞋子擦亮剂等的着色添加剂[95]。对位红是一种与苏丹红染料结构相似的染料,苏丹红和对位红染料均对人体具有致癌作用,严禁用作食品添加剂使用。但是因为其颜色鲜艳,被一些食品工厂作为添加剂为食品增色,这对人身体健康具有严重威胁[85]。高效液相色谱被用来检测食品中苏丹红含量,但是其检测前预处理过程需要用到有毒的挥发性有机溶剂,并且萃取效率也不高。为了解决这些问题,FAN等[85]报道了一种新的简单分析方法,即离子液体萃取结合高效液相色谱的方法来确定辣椒粉、辣椒油和食品添加剂样品中苏丹红和对位红的含量。对比两种离子液体[Bmim]PF6和[Omim]PF6的萃取率,[Omim]PF6具有更高的萃取收率,说明5种染料的萃取收率随着离子液体阳离子碳链长度增加而升高,其原因可能是随着离子液体阳离子上碳链长度增加离子液体与染料之间的色散力作用增加。FAN等[85]同时比较了[Omim]PF6和另一种常用于萃取苏丹染料的有机溶剂乙腈的萃取效果,结果表明除了辣椒油体系中对位红的萃取两者结果比较接近,其余几种染料的萃取离子液体的萃取收率要远远高于乙腈。说明离子液体萃取是一种简单、有效并且绿色的过程,有可能取代常规的萃取路线。
4 离子液体萃取分离其他有机化合物
醇类如乙醇和丁醇作为一种液体燃料需求逐年递增,可以采用生物质通过发酵法来制得。发酵法往往得到低浓度醇的水溶液,需要将醇从水中分离出来,常用的精馏方法是一个高能耗的过程,因此从水中萃取回收醇类具有一定的优势。由于离子液体独特的特性,用离子液体通过简单的液-液萃取即可将醇从水中分离出来[96-99]。CHAPEAUX等[96]用[Hmim]NTf2离子液体分别萃取分离乙醇/水和丁醇/水体系,并测定了[Hmim]NTf2-乙醇-水和[Hmim]NTf2-丁醇-水三元体系相图,结果表明[Hmim]NTf2对丁醇的萃取效果较好;对乙醇萃取虽然选择性较高(选择性系数达到11),分配系数较低只有0.15,所以乙醇的萃取回收需要较大的溶剂比。基于此,NEVES等[98]提出了用膦类离子液体萃取分离乙醇/水体系,得到了较高的萃取分配系数(表3)。STOFFERS等[99]以混合澄清槽作为萃取设备,用离子液体[Hmim]TCB萃取剂萃取分离正丁醇/水体系,三级逆流萃取后正丁醇的回收率达到99%。
YANG等[100-102]提出用离子液体通过液-液萃取来选择性的分离生育酚同系物。生育酚是维生素E的主要组成成分,由于其抗氧化特性,对人体健康起着重要作用[103]。生育酚广泛存在于蔬菜和水果中,从生物质中直接提取得到的常是生育酚的4种同系物的混合物,结构见图14。生育酚四种同系物中-OH基团邻位的取代基不同,即-OH所处的化学环境不同导致生育酚同系物具有不同的氢键酸性。YANG等[102]通过量化计算表明生育酚同系物氢键供体能力(氢键酸性)强弱顺序为 δ-生育酚 > γ-生育酚 > α-生育酚,因此用离子液体萃取剂通过与生育酚之间氢键作用强弱不同可将生育酚同系物分离开来(表4)。
5 结 语
萃取过程是被萃取物在萃取相和萃余相两相溶解过程之间的竞争过程,而实质上是由于溶质分子与两相溶剂分子之间相互作用强弱不同引起的。离子液体作为一种可设计的溶剂,可以调控其结构以适应不同的萃取体系。氢键、π-π、范德华力和静电力是离子液体与其他被萃取物分子之间的主要相互作用,其中氢键作用可能更重要一些,如离子液体对有机酸、醇类以及酚类的分离主要利用溶质分子中的特别官能团(—OH)与离子液体之间形成的氢键作用将被萃取物质分离出来。对于芳香烃/脂肪烃的分离,则利用芳香烃与离子液体之间的π-π作用和氢键作用。烯烃和烷烃的分离则利用两者与离子液体之间范德华力的不同,烯烃中的C=C键电子云迁移率要比C—C键高,更容易被极性溶剂离子液体极化,因此与离子液体之间的范德华作用要强于烷烃。对于从生物质中萃取天然化合物,一方面离子液体与这些天然化合物之间具有复杂的相互作用(包括氢键、π-π、范德华力和静电力等);另一方面离子液体对纤维素、蛋白质等高效溶解能力使得其能有效打破生物的细胞壁,促进被萃取化合物的释放,提高萃取效率。
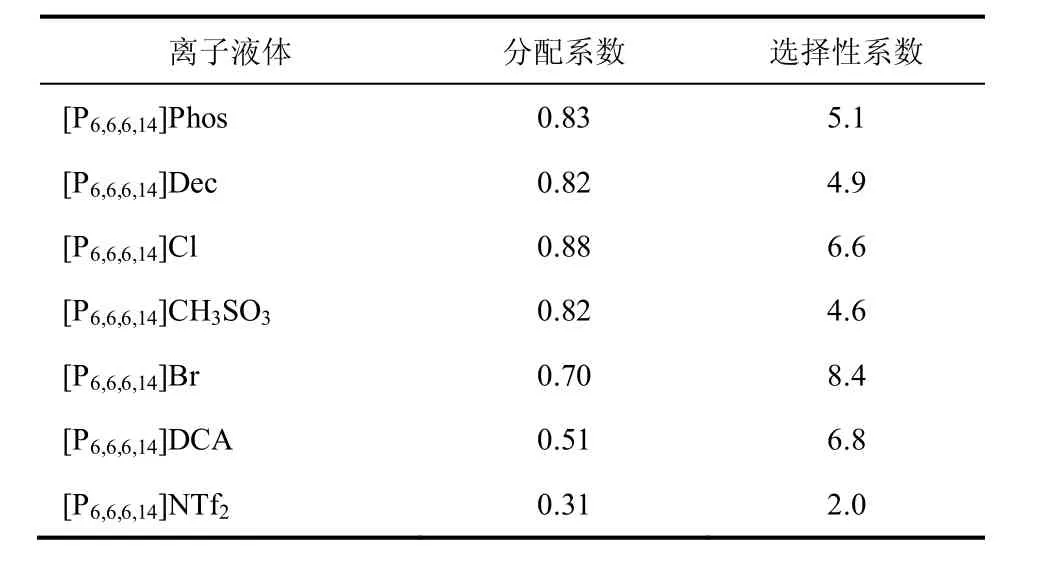
表3 乙醇在膦类离子液体和水之间的分配系数和选择性[98]

表4 不同离子液体-乙腈混合溶液萃取分离生育酚同系物[101-102]
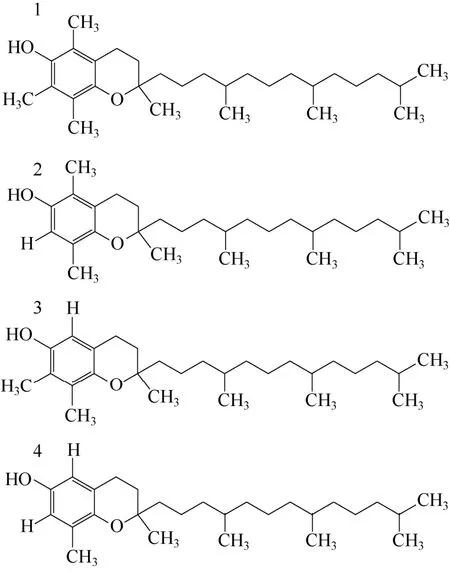
图14 生育酚结构式[102]
虽然离子液体在萃取过程中具有很强的萃取能力,但是离子液体高黏度特性限制了其使用。可以通过提高萃取过程的温度来降低离子液体的黏度,但可能会导致萃取工艺的能耗增加,另外对于一些热敏性的物质也不适用。通过上述文献综述,大多采用与其他溶剂混合的方式来降低离子液体的黏度,如天然化合物提取中,常用的是离子液体水溶液作为萃取剂;有机酸的萃取回收中也常常添加惰性稀释剂以降低离子液体黏度。
尽管离子液体在萃取分离方面具有了较好的效果和工业前景,但总体来看,离子液体生产成本和价格仍然比较高,限制了大规模的应用。因此,一方面通过控制生产成本,包括筛选离子液体结构、降低原料成本、简化合成路线、优化工艺参数等措施,从离子液体设计开始,控制全过程的成本和能耗;另一方面,开发低能耗的萃取后离子液体的回收技术十分重要,由于离子液体几乎不挥发,当离子液体的微量组成是低沸点物质时,采用蒸馏方法可以达到较好效果,而对一些高沸点或热敏性的化合物如长链羧酸、天然产物分子等,则可采用反萃的方法,如使用有机溶剂、水或者超临界CO2作为反萃剂将产品从离子液体中反萃出来,回收得到的离子液体可以返回萃取工艺中重复使用。除了精馏和反萃外,膜蒸发、反渗透和电渗析等分离技术也正在用于离子液体的回收。但目前这些离子液体的回收方法仍处于实验室研究阶段,工业化的大规模应用未见报道。
离子液体作为一种高效的萃取溶剂,应该充分利用其特性,选择合适的萃取分离体系使离子液体的功能发挥到最大,如由于离子液体的高性能和高成本,其对高附加值的产品回收具有一定的前景。同时开发低成本的离子液体和离子液体回收方面仍需要进一步的研究。
参 考 文 献
[1] HUDDLESTON J G,WILLAUER H D,SWATLOSKI R P,et al.Room temperature ionic liquids as novel media for 'Clean' liquid-liquid extraction[J]. Chemical Communications,1998,16:1765-1766.
[2] LARRIBA M,NAVARRO P,GARCÍA J,et al.Liquid-liquid extraction of BTEX from reformer gasoline using binary mixtures of [4empy][Tf2N] and [Emim][DCA] ionic liquids[J].Energy & Fuels,2014,28(10):6666-6676.
[3] DOMÍNGUEZ I,GONZÁLEZ E J,DOMÍNGUEZ Á.Liquid extraction of aromatic/cyclic aliphatic hydrocarbon mixtures using ionic liquids as solvent:literature review and new experimental LLE data[J].Fuel Processing Technology,2014,125:207-216.
[4] LARRIBA M,NAVARRO P,GARCÍA J,et al.Separation of toluene from n-heptane,2,3-dimethylpentane,and cyclohexane using binary mixtures of [4empy][Tf2N] and [Emim][DCA] ionic liquids as extraction solvents[J].Separation and Purification Technology,2013,120:392-401.
[5] JACQUEMIN J,ZHENG Y,WANG Y,et al.Proceedings of the 4th international gas processing symposium[C].Oxford:Elsevier,2015:243-250.
[6] ARCE A,EARLE M J,RODRIGUEZ H,et al.Separation of benzeneandhexanebysolventextractionwith 1-alkyl-3-methylimidazolium bis{(trifluoromethyl)sulfonyl}amide ionic liquids:effect of the alkyl-substituent length[J].Journal of Physical Chemistry B,2007,111(18):4732-4736.
[7] ARCE A,EARLE M J,RODRIGUEZ H,et al.Separation of aromatic hydrocarbons from alkanes using the ionic liquid 1-ethyl-3-methylimidazoliumbis {(trifluoromethyl) sulfonyl} amide [J].Green Chemistry,2007,9(1):70-74.
[8] LARRIBA M,NAVARRO P,GARCÍA J,et al.Liquid-liquid extraction of toluene from heptane using [Emim][DCA],[Bmim][DCA],and [Emim][TCM] ionic liquids[J].Industrial & Engineering Chemistry Research,2013,52(7):2714-2720.
[9] CORDERÍ S,CALVAR N,GÓMEZ E,et al.Quaternary (liquid+liquid) equilibrium data for the extraction of toluene from alkanes using the ionic liquid [Emim][MSO4][J]. The Journal of Chemical Thermodynamics,2014,76:79-86.
[10] MANOHAR C V,BANERJEE T,MOHANTY K.Co-solvent effects for aromatic extraction with ionic liquids[j].Journal of Molecular Liquids,2013,180:145-153.
[11] POTDAR S,ANANTHARAJ R,BANERJEE T.Aromatic extraction using mixed ionic liquids:experiments and COSMO-RS predictions[J].Journal of Chemical & Engineering Data,2012,57 (4):1026-1035.
[12] LARRIBA M,NAVARRO P,GARCÍA J,et al.Liquid-liquid extractionoftoluenefromn-heptaneby {[Emim][TCM]+[Emim][DCA]}binaryionicliquid mixtures[J].Fluid Phase Equilibria,2014,364:48-54.
[13] ELDRIDGE R B.Olefin/paraffin separation technology:a review[J].Industrial & Engineering Chemistry Research,1993,32 (10):2208-2212.
[14] LI R,XING H,YANG Q,et al.Selective extraction of 1-hexene against n-hexane in ionic liquids with or without silver salt[J].Industrial & Engineering Chemistry Research,2012,51 (25):8588-8597.
[15] REQUEJO P F,GÓMEZ E,CALVAR N,et al.Application of pyrrolidinium-based ionic liquid as solvent for the liquid extraction ofbenzenefromitsmixtureswithaliphatic hydrocarbons[J].Industrial & Engineering Chemistry Research,2015,54(4):1342-1349.
[16] PRATIWI A I,YOKOUCHI T,MATSUMOTO M,et al.Extractionof succinic acid by aqueous two-phase system using alcohols/salts and ionic liquids/salts[J].Separation and Purification Technology,2015,155:127-132.
[17] NASIR S S,KALLIDANTHIYIL C L,GONFA G,et al.Extraction of naphthenic acid from highly acidic oil using phenolate based ionic liquids[J].Chemical Engineering Journal,2016,284:487-493.
[18] MATSUMOTO M,MOCHIDUKI K,FUKUNISHI K,et al.Extraction of organic acids using imidazolium-based ionic liquids and their toxicity to lactobacillus rhamnosus[J].Separation and Purification Technology,2004,40(1):97-101.
[19] WANG J,PEI Y,ZHAO Y,et al.Recovery of amino acids by imidazolium based ionic liquids from aqueous media[J].Green Chemistry,2005,7(4):196-202.
[20] WADE L G.Organic chemistry[M]. Boston:Pearson Education,2013:1160-1162.
[21] MARTÁK J,SCHLOSSER Š.Phosphonium ionic liquids as new,reactive extractants of lactic acid[J].Chemical Papers,2006,60 (5):395-398.
[22] MARTAK J,SCHLOSSER S.Extraction of lactic acid by phosphonium ionic liquids[J].Separation and Purification Technology,2007,57(3):483-494.
[23] MARTÁK J,SCHLOSSER Š.Liquid-liquid equilibria of butyric acid for solvents containing a phosphonium ionic liquid[J].Chemical Papers,2008,62(1):42-50.
[24] OLIVEIRA F S,ARAÚJO J M M,FERREIRA R,et al.Extraction of L-lactic,L-malic,and succinic acids using phosphonium-based ionic liquids[J].Separation and Purification Technology,2012,85:137-146.
[25] KYUCHOUKOV G,YANKOV D,ALBET J,et al.Mechanism of lactic acid extraction with quaternary ammonium chloride (aliquat 336)[J].Industrial & Engineering Chemistry Research,2005,44 (15):5733-5739.
[26] KESHAV A,WASEWAR K L,CHAND S.Extraction of propionic acid using different extractants (tri-n-butylphosphate,tri-n-octylamine,and aliquat 336)[J].Industrial & Engineering Chemistry Research,2008,47(16):6192-6196.
[27] KESHAV A,CHAND S,WASEWAR K L.Recovery of propionic acid from aqueous phase by reactive extraction using quarternary amine(aliquat 336)in various diluents[J].Chemical Engineering Journal,2009,152(1):95-102.
[28] KESHAV A,WASEWAR K L,CHAND S.Extraction of acrylic,propionic,and butyric acid using aliquat 336 in oleyl alcohol:equilibria and effect of temperature[J].Industrial & Engineering Chemistry Research,2009,48(2):888-893.
[29] KESHAV A,WASEWAR K L,CHAND S,et al.Effect of binary extractants and modifier-diluents systems on equilbria of propionic acid extraction[J].Fluid Phase Equilibria,2009,275(1):21-26.
[30] BARBER P S,GRIGGS C S,GURAU G,et al.Coagulation of chitin and cellulose from 1-ethyl-3-methylimidazolium acetate ionic-liquid solutions using carbon dioxide[J].Angewandte Chemie International Edition,2013,52(47):12350-12353.
[31] POKORNÝ J.Are natural antioxidants better – and safer – than synthetic antioxidants?[J].European Journal of Lipid Science and Technology,2007,109(6):629-642.
[32] PASSOS H,FREIRE M G,COUTINHO J A.Ionic liquid solutions as extractive solvents for value-added compounds from biomass[J].Green Chem.,2014,16(12):4786-4815.
[33] BLIGH E G,DYER W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
[34] YOUNG G,NIPPGEN F,TITTERBRANDT S,et al.Lipid extraction from biomass using co-solvent mixtures of ionic liquids and polar covalent molecules[J].Separation and Purification Technology,2010,72(1):118-121.
[35] KIM Y H,CHOI Y K,PARK J,et al.Ionic liquid-mediated extraction of lipids from algal biomass[J].Bioresource Technology,2012,109:312-315.
[36] KIM Y H,PARK S,KIM M H,et al.Ultrasound-assisted extraction of lipids from chlorella vulgaris using [Bmim][MeSO4][J].Biomass and Bioenergy,2013,56:99-103.
[37] CHOI S A,LEE J S,OH Y K,et al.Lipid extraction from chlorella vulgaris by molten-salt/ionic-liquid mixtures[J].Algal Research,2014,3:44-48.
[38] OLKIEWICZ M,CAPORGNO M P,FONT J,et al.A novel recovery process for lipids from microalgae for biodiesel production using a hydrated phosphonium ionic liquid[J].Green Chemistry,2015,17(5):2813-2824.
[39] WEIL E D,LEVCHIK S V.Flame retardants in commercial use or development for textiles[J].Journal of Fire Sciences,2008,26(3):243-281.
[40] KIM D Y,VIJAYAN D,PRAVEENKUMAR R,et al.Cell-wall disruption and lipid/astaxanthin extraction from microalgae:chlorella and haematococcus[J].Bioresource Technology,2016,199:300-310.
[41] EL SEOUD O A,KOSCHELLA A,FIDALE L C,et al.Applications of ionic liquids in carbohydrate chemistry:a window of opportunities[J].Biomacromolecules,2007,8(9):2629-2647.
[42] VITZ J,ERDMENGER T,HAENSCH C,et al.Extended dissolution studies of cellulose in imidazolium based ionic liquids[J].Green Chemistry,2009,11(3):417-424.
[43] ABO-SHADY A M,MOHAMED Y A,LASHEEN T.Chemical composition of the cell wall in some green algae species[J].Biologia Plantarum,1993,35(4):629-632.
[44] FUJITA K,MACFARLANE D R,FORSYTH M.Protein solubilising and stabilising ionic liquids[J].Chemical Communications,2005,38:4804-4806.
[45] ORR V C A,PLECHKOVA N V,SEDDON K R,et al.Disruption and wet extraction of the microalgae chlorella vulgaris using room-temperature ionic liquids[J].ACS Sustainable Chemistry & Engineering,2016,4(2):591-600.
[46] CHOI S A,OH Y K,JEONG M J,et al.Effects of ionic liquid mixtures on lipid extraction from chlorella vulgaris[J].Renewable Energy,2014,65:169-174.
[47] WU K,ZHANG Q,LIU Q,et al.Ionic liquid surfactant-mediated ultrasonic-assisted extraction coupled to HPLC:application to analysis of tanshinones in salvia miltiorrhiza bunge[J].Journal of Separation Science,2009,32(23/24):4220-4226.
[48] BICA K,GAERTNER P,ROGERS R D.Ionic liquids and fragrances - direct isolation of orange essential oil[J].Green Chemistry,2011,13(8):1997-1999.
[49] BI W,TIAN M,ZHOU J,et al.Task-specific ionic liquid-assisted extraction and separation of astaxanthin from shrimpwaste[J].Journal of Chromatography B,2010,878(24):2243-2248.
[50] BI W,TIAN M,ROW K H.Ultrasonication-assisted extraction and preconcentration of medicinal products from herb by ionic liquids[J].Talanta,2011,85(1):701-706.
[51] DESAI R K,STREEFLAND M,WIJFFELS R H,et al.Novel astaxanthin extraction from haematococcus pluvialis using cell permeabilising ionic liquids[J].Green Chemistry,2016,DOI:10.1039/C5GC01301A.
[52] LIU T,SUI X,ZHANG R,et al.Application of ionic liquids based microwave-assisted simultaneous extraction of carnosic acid,rosmarinic acid and essential oil fromrosmarinus officinalis[J].Journal of Chromatography A,2011,1218(47):8480-8489.
[53] LAGO S,RODRÍGUEZ H,ARCE A,et al.Improved concentration of citrus essential oil by solvent extraction with acetate ionic liquids[J].Fluid Phase Equilibria,2014,361:37-44.
[54] RESSMANN A K,STRASSL K,GAERTNER P,et al.New aspects for biomass processing with ionic liquids:towards the isolation of pharmaceutically active betulin[J].Green Chemistry,2012,14(4):940-944.
[55] LIN H,ZHANG Y,HAN M,et al.Aqueous ionic liquid based ultrasonic assisted extraction of eight ginsenosides from ginseng root[J].Ultrasonics Sonochemistry,2013,20(2):680-684.
[56] ANISZEWSKI T.Alkaloids:chemistey,biology,ecology,and applications[M].2nd ed.Amsterdam:Elsevier B. V.,2015:1-70.
[57] TENG H,CHOI Y H.Optimization of ultrasonic-assisted extraction of bioactive alkaloid compounds from rhizoma coptidis(coptis chinensis franch.)using response surface methodology[J].Food Chemistry,2014,142:299-305.
[58] LU Y,MA W,HU R,et al.Ionic liquid-based microwave-assisted extraction of phenolic alkaloids from the medicinal plant nelumbo nucifera gaertn[J].Journal of Chromatography A,2008,1208(1/2):42-46.
[59] BOGDANOV M G,KEREMEDCHIEVA R,SVINYAROV I.Ionic liquid-supportedsolid-liquidextractionofbioactive alkaloids.Ⅲ.Ionic liquid regeneration and glaucine recovery from ionic liquid-aqueous crude extract of glaucium flavum Cr. (papaveraceae)[J].Separation and Purification Technology,2015,155:13-19.
[60] WANG W,LI Q,LIU Y,et al.Ionic liquid-aqueous solution ultrasonic-assisted extraction of three kinds of alkaloids from phellodendron amurense rupr and optimize conditions use response surface[J].Ultrasonics Sonochemistry,2015,24:13-18.
[61] FLIEGER J,CZAJKOWSKA-ŻELAZKO A.Aqueous two phase system based on ionic liquid for isolation of quinine from human plasma sample[J].Food Chemistry,2015,166:150-157.
[62] MA W,LU Y,HU R,et al.Application of ionic liquids based microwave-assisted extraction of three alkaloids N-nornuciferine,O-nornuciferine,and nuciferine from lotus leaf[J].Talanta,2010,80(3)1292-1297.
[63] ZHANG L,GENG Y,DUAN W,et al.Ionic liquid-based ultrasound-assisted extraction of fangchinoline and tetrandrine from stephaniae tetrandrae[J].Journal of Separation Science,2009,32 (20):3550-3554.
[64] CAO X,YE X,LU Y,et al.Ionic liquid-based ultrasonic-assisted extraction of piperine from white pepper[J].Analytica Chimica Acta,2009,640(1/2):47-51.
[65] RESSMANN A K,ZIRBS R,PRESSLER M,et al.Surface-active ionic liquids for micellar extraction of piperine from black pepper[J].Zeitschrift für Naturforschung B,2013,68b:1129-1137.
[66] WANG S Y,YANG L,ZU Y G,et al.Design and performance evaluationofionic-liquids-basedmicrowave-assisted environmentally friendly extraction technique for camptothecin and 10-hydroxycamptothecinfromsamaraofcamptotheca acuminata[J].Industrial & Engineering Chemistry Research,2011,50(24):13620-13627.
[67] MA C H,WANG S Y,YANG L,et al.Ionic liquid-aqueous solution ultrasonic-assistedextractionofcamptothecinand 10-hydroxycamptothecinfromcamptothecaacuminata samara[J].Chemical Engineering and Processing:Process Intensification,2012,57-58:59-64.
[68] WALL M E,WANI M C,COOK C E,et al.Plant antitumor agents.Ⅰ.the isolation and structure of camptothecin,a novel alkaloidal leukemia and tumor inhibitor from camptotheca acuminata1,2[J].Journal of the American Chemical Society,1966,88(16):3888-3890.
[69] YANG L,WANG H,ZU Y G,et al.Ultrasound-assisted extraction of the three terpenoid indole alkaloids vindoline,catharanthine and vinblastine from catharanthus roseus using ionic liquid aqueous solutions[J].Chemical Engineering Journal,2011,172(2/3):705-712.
[70] BOGDANOV M G,SVINYAROV I,KEREMEDCHIEVA R,et al.Ionic liquid-supported solid-liquid extraction of bioactive alkaloids.Ⅰ.New HPLC method for quantitative determination of glaucine in glaucium flavum cr. (papaveraceae)[J].Separation and Purification Technology,2012,97:221-227.
[71] BOGDANOV M G,SVINYAROV I.Ionic liquid-supported solid-liquid extraction of bioactive alkaloids.Ⅱ.Kinetics,modeling and mechanism of glaucine extraction from glaucium flavum cr. (papaveraceae)[J].Separation and Purification Technology,2013,103:279-288.
[72] CLAUDIO A F M,FERREIRA A M,FREIRE M G,et al.Enhanced extraction of caffeine from guarana seeds using aqueous solutions of ionic liquids[J].Green Chemistry,2013,15(7):2002-2010.
[73] SWATLOSKI R P,SPEAR S K,HOLBREY J D,et al.Dissolution of cellose with ionic liquids[J].Journal of the American Chemical Society,2002,124(18):4974-4975.
[74] DU F Y,XIAO X H,LUO X J,et al.Application of ionic liquids in the microwave-assisted extraction of polyphenolic compounds from medicinal plants[J].Talanta,2009,78(3):1177-1184.
[75] CHOWDHURY S A,VIJAYARAGHAVAN R,MACFARLANE D R.Distillable ionic liquid extraction of tannins from plant materials[J].Green Chemistry,2010,12(6):1023-1028.
[76] ZENG H,WANG Y,KONG J,et al.Ionic liquid-based microwave-assisted extraction of rutin from Chinese medicinal plants[J].Talanta,2010,83(2):582-590.
[77] SUN Y,LI W,WANG J.Ionic liquid based ultrasonic assisted extraction of isoflavones from iris tectorum maxim and subsequently separation and purification by high-speed counter-current chromatography[J].Journal of Chromatography B,2011,879 (13/14):975-980.
[78] LU C,WANG H,LV W,et al.Ionic liquid-basedultrasonic/microwave-assisted extraction combined with UPLC-MS
MS for the determination of tannins in galla Chinensis[J]. Natural Product Research,2012,26(19):1842-1847.
[79] XU W,CHU K,LI H,et al.Ionic liquid-based microwave-assisted extraction of flavonoids from bauhinia championii(benth.)benth[J].Molecules,2012,17(12):14323-14335.
[80] ANDERSON J L,DING J,WELTON T,et al.Characterizing ionic liquids on the basis of multiple solvation interactions[J].Journal of the American Chemical Society,2002,124(47):14247-14254.
[81] GUO Z,LUE B M,THOMASEN K,et al.Predictions of flavonoid solubility in ionic liquids by COSMO-RS:experimental verification,structuralelucidation,andsolvation characterization[J].Green Chemistry,2007,9(12):1362-1373.
[82] 曾礼娜,夏之宁,颜磊.槐米的高效毛细管电泳指纹图谱研究[J].西南大学学报(自然科学版),2008(1):17-20.
[83] Hauber C.Formation,prevention & determination of Cr(Ⅵ) in leather-a short overview of recent publications[Z].UNIDO,2000.
[84] RESSMANN A K,GAERTNER P,BICA K.From plant to drug:ionic liquids for the reactive dissolution of biomass[J].Green Chemistry,2011,13(6):1442-1447.
[85] FAN Y,CHEN M,SHENTU C,et al.Ionic liquids extraction of para red and sudan dyes from chilli powder,chilli oil and food additive combinedwithhighperformanceliquid chromatography[J].Analytica Chimica Acta,2009,650(1):65-69.
[86] CHI Y,ZHANG Z,LI C,et al.Microwave-assisted extraction of lactones from Ligusticum Chuanxiong hort. using protic ionic liquids[J].Green Chemistry,2011,13(3):666-670.
[87] FEDERSPIEL M,FISCHER R,HENNIG M,et al.Industrial synthesis of the key precursor in the synthesis of the anti-influenza drug oseltamivir phosphate (ro 64-0796/002,gs-4104-02):ethyl (3R,4S,5S)-4,5-epoxy-3-(1-ethyl-propoxy)-cyclohex-1-ene-1-carbox ylate[J].Organic Process Research & Development,1999,3(4):266-274.
[88] ZIRBS R,STRASSL K,GAERTNER P,et al.Exploring ionic liquid-biomass interactions:towards the improved isolation of shikimic acid from star anise pods[J].RSC Advances,2013,3(48):26010-26016.
[89] USUKI T,YASUDA N,YOSHIZAWA-FUJITA M,et al.Extraction and isolation of shikimic acid from ginkgo biloba leaves utilizing an ionic liquid that dissolves cellulose[J].Chemical Communications,2011,47(38):10560-10562.
[90] ZHAI Y,SUN S,WANG Z,et al.Microwave extraction of essential oils from dried fruits of illicium verum hook. f. and cuminum cyminum L. using ionic liquid as the microwave absorption medium[J].Journal of Separation Science,2009,32(20):3544-3549.
[91] JIAO J,GAI Q Y,FU Y J,et al.Microwave-assisted ionic liquids pretreatment followed by hydro-distillation for the efficient extraction of essential oil from dryopteris fragrans and evaluation of its antioxidant efficacy in sunflower oil storage[J].Journal of Food Engineering,2013,117(4):477-485.
[92] JIAO J,GAI Q Y,FU Y J,et al.Microwave-assisted ionic liquids treatment followed by hydro-distillation for the efficient isolation of essential oil from fructus forsythiae seed[J].Separation and Purification Technology,2013,107:228-237.
[93] GARCIA H,FERREIRA R,PETKOVIC M,et al.Dissolution of cork biopolymers in biocompatible ionic liquids[J].Green Chemistry,2010,12(3):367-369.
[94] FERREIRA R,GARCIA H,SOUSA A F,et al.Suberin isolation from cork using ionic liquids: characterisation of ensuing products[J]. New Journal of Chemistry,2012,36(10):2014-2024.
[95] HABIBI M H,HASSANZADEH A,MAHDAVI S.The Effect of operational parameters on the photocatalytic degradation of three textile azo dyes in aqueous TiO2suspensions[J].Journal of Photochemistry and Photobiology A:Chemistry,2005,172(1):89-96.
[96] CHAPEAUX A,SIMONI L D,RONAN T S,et al.Extraction of alcohols from water with 1-hexyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide[J].Green Chemistry,2008,10 (12):1301.
[97] SIMONI L D,CHAPEAUX A,BRENNECKE J F,et al.Extraction of biofuels and biofeedstocks from aqueous solutions using ionic liquids[J].Computers & Chemical Engineering,2010,34(9):1406-1412.
[98] NEVES C,GRANJO J F O,FREIRE M G,et al.Separation of ethanol-water mixtures by liquid-liquid extraction using phosphonium-based ionic liquids[J].Green Chemistry,2011,13 (6):1517-1526.
[99] STOFFERS M,GÓRAK A.Continuous multi-stage extraction of n-butanolfromaqueoussolutionswith 1-hexyl-3-methylimidazolium tetracyanoborate[J].Separation and Purification Technology,2013,120:415-422.
[100] YANG Q W,XING H B,CAO Y F,et al.Selective separation of tocopherol homologues by liquid-liquid extraction using ionic liquids[J].Industrial & Engineering Chemistry Research,2009,48 (13):6417-6422.
[101] NG Q,XING H,SU B,et al.Improved separation efficiency using ionic liquid-cosolvent mixtures as the extractant in liquid-liquid extraction:a multiple adjustment and synergistic effect[J].Chemical Engineering Journal,2012,181:334-342.
[102] NG Q,XING H,SU B,et al.The essential role of hydrogen-bonding interaction in the extractive separation of phenolic compounds by ionic liquid[J].AIChE Journal,2013,59(5):1657-1667.
[103] KER L.Protective role of vitamin e in biological systems[J].The American Journal of Clinical Nutrition,1991,53(4):1050S-1055S.
Progress in ionic liquids for extraction of organic compounds
ZHANG Xiangping,BAI Yinge,YAN Ruiyi,GAO Hongshuai
(Institute of Process Engineering,Chinese Academy of Sciences,Beijing 100190,China)
Abstract:Ionic liquids are described as “green solvents” since there is a large degree of cation/anion combinations which make them with the possibility of tuning their properties,as well as their very low volatility. Ionic liquids have been widely used in catalysis,separation and electrochemistry. Thereinto,ionic liquids have been regarded as an efficient extractant for extraction organic compounds. In this work,the ionic liquids used in the separate of hydrocarbon compounds,organic acids,alcohols,phenols and nature compounds by extraction were summarized and reviewed. The mechanism of the ionic liquids extraction process and the effect of extraction conditions were discussed in detail. It was concluded that the strong hydrogen bond,π-π,van der Waals and electrostatic interactions between ionic liquids and solute molecule make ionic liquids be potential solvents to replace some conventional organic solvents for the extractive separation of organic compounds. Meanwhile,the high viscosity and high costs as well as the recovery of the ionic liquids after extraction process could limit the industrial utilization of ionic liquids,and thus it is still an urgent task.
Key words:ionic liquids;extraction;hydrocarbons;organic acids;alcohol;phenolic compounds;nature compounds
中图分类号:TQ 342
文献标志码:A
文章编号:1000–6613(2016)06–1587–19
DOI:10.16085/j.issn.1000-6613.2016.06.002
收稿日期:2016-01-27;修改稿日期:2016-02-23。
基金项目:国家杰出青年科学基金(21425625)及International S&T Cooperation Program of China(2014DFA61670)项目。
