TNFAIP8在卵巢癌中的表达及其对卵巢癌细胞增殖的影响
2016-07-08杨大磊毕芳芳于大海
杨大磊,毕芳芳,于大海
(中国医科大学附属盛京医院妇产科,沈阳110004)
TNFAIP8在卵巢癌中的表达及其对卵巢癌细胞增殖的影响
杨大磊,毕芳芳,于大海
(中国医科大学附属盛京医院妇产科,沈阳110004)
摘要目的探讨TNFAIP8在卵巢癌组织中的表达情况,以及TNFAIP8对卵巢癌细胞增殖能力的影响。方法采用免疫组织化学方法检测189例卵巢癌组织中TNFAIP8蛋白的表达情况。通过双向调控TNFAIP8基因的表达,观察TNFAIP8对细胞增殖能力的影响。结果在189例卵巢癌组织中,TNFAIP8阳性表达率为84.66%(160/189),其阳性表达与卵巢癌的分级显著相关。在卵巢癌细胞中上调TNFAIP8表达后,卵巢癌细胞的增殖能力显著增加,而干扰其表达后,卵巢癌细胞的增殖能力显著下降。结论TNFAIP8在卵巢癌组织中高表达,并且其高表达与卵巢癌的分级显著相关。TNFAIP8过表达促进卵巢癌细胞的增殖,可能成为卵巢癌诊断治疗的新靶点。
关键词卵巢癌;TNFAIP8;增殖
网络出版地址
网络出版时间:
卵巢癌是导致女性死亡的主要恶性肿瘤之一[1]。尽管近年来卵巢癌的手术方式和药物治疗有了很大的进步,但由于卵巢癌发生的部位以及缺乏特异性症状和筛选方法,导致患者的整体生存率仍然很低[2-3]。因此,探索卵巢癌发生和进展的分子机制,对于深入理解该肿瘤的生物学行为并开发相应的靶向治疗手段具有十分重要的意义。肿瘤坏死因子α诱导蛋白8(tumor necrosis factor α-induced protein 8,TNFAIP8)又叫SCC-S2、GG2-1和MDC-3.13,分子量为21 000,含有一个DED结构域。其作为一个肿瘤致癌基因,最初在人头颈部鳞状细胞癌细胞系中发现[4],其过表达能够被肿瘤坏死因子α和活化的核因子κB诱导,后来研究[5-9]发现TNFAIP8在前列腺癌、食道癌、肺癌、子宫内膜癌、结直肠癌等许多人类肿瘤中均发挥作用。过表达TNFAIP8能够抑制caspase-8和caspase-3的活性,从而抑制细胞凋亡,促进乳腺癌细胞MDA-MB-435的体外增殖能力与侵袭能力[10]。TNFAIP8还能够调节血管内皮细胞生长因子受体2、基质金属蛋白酶1、基质金属蛋白酶9的表达[11]。然而,有关TNFAIP8在卵巢癌组织中的表达模式及其与临床病理因素的相关性目前尚无报道,其在卵巢癌细胞中的生物学功能也未见报道。
本文中,我们研究了TNFAIP8蛋白在卵巢癌组织中的表达情况,并进行了临床病理因素相关分析。此外,我们还在卵巢癌细胞中通过双向调控TNFAIP8蛋白的表达,发现了TNFAIP8在卵巢癌细胞系中的促肿瘤作用,并为TNFAIP8促进卵巢癌细胞系增殖提供了证据。
1 材料与方法
1.1组织样本
本研究通过中国医科大学附属盛京医院伦理委员会批准。189例卵巢癌标本来自中国医科大学附属盛京医院病理科2007年至2010年的存档蜡块。根据WHO组织学分类标准,由2位病理医师独立做出组织学诊断。临床病理信息从患者的病案记录中获得。所有患者在术前均未接受过化疗或放射治疗。
1.2免疫组织化学检测
所有组织均经中性甲醛固定、石蜡包埋后,制成4 μm厚度的切片。切片在二甲苯中脱蜡,梯度乙醇水化以及柠檬酸修复液中进行高温高压抗原修复2 min。采用过氧化氢阻断内源性过氧化物酶活性,并采用正常山羊A血清孵育以减少非特异性结合位点。一抗使用单克隆鼠源性TNFAIP8抗体(1∶400,美国Abcam公司)4℃孵育过夜。以非免疫IgG代替一抗作为阴性对照。生物素标记的二抗(中国迈新生物科技有限公司)37℃孵育30 min,DAB显色。苏木素复染,脱水,封片。每张切片随机选择5个视野,每个视野计数100个细胞。根据计数细胞着色的百分比及着色的强度,对TNFAIP8的表达进行半定量评分。胞质着色视为阳性。根据细胞着色百分比分为4个等级:1,1%~25%;2,26%~50%;3,51%~75%;4,76%~100%。根据细胞着色强度分为3个等级:0,无染色;1,弱阳性染色;2,强阳性染色。TNFAIP8的表达又被划分成3个等级:0分,无着色;1分,浅黄色颗粒;2分,深黄色或者黄褐色颗粒。每一张组织切片都对应一个百分比分数和着色分数,将二者相乘,所得的乘积(0~8分)即为该切片的最终得分。将得分≤4分定义为低表达,>4分定义为高表达。
1.3细胞培养和转染
人卵巢癌细胞系SKOV3从ATCC(美国Manassas)细胞库获得。细胞系用含有10%小牛血清(美国Invitrogen公司)的RPMI 1640(美国Gibco公司)培养基(美国Invitrogen公司)培养,并将其置于5% 的CO2细胞培养箱中培养。细胞在6孔板中培养24 h后,进行转染。pCMV6-TNFAIP8质粒以及对照的空白质粒pCMV6购自美国Origene公司。TNFAIP8 siRNA和对照siRNA均购自美国Dharmacon公司。根据说明书,使用Attractene转染试剂(德国Qiagen公司)对细胞进行转染。转染后48 h,采用PCR和Western b1ot检测干扰效率。
1.4实时定量PCR
对于培养细胞或卵巢癌组织采用TRIZOL(美国Invitrogen公司)提取总RNA。采用ABI high capacity cDNA RT kit(美国App1ied Biosystems公司)进行反转录。使用ABI7900实时定量PCR仪,并使用TNFAIP8特异性探针(Hs00405413_m1)检测其在组织与细胞中的含量,内参采用β- actin (Hs99999903_m1)。
1.5Western b1ot
采用Pierce细胞裂解液(美国Thermo公司)对细胞进行充分裂解,然后分别提取其总蛋白,取40 μg的总蛋白通过12%浓度的SDS-PAGE进行蛋白电泳,然后转印到PVDF膜(美国Mi11ipore公司)上。1%脱脂奶粉封闭2 h,兔源性一抗TNFAIP8(1∶800,美国Sigma公司)4℃过夜。山羊抗兔鼠二抗(1∶2 000,美国Santa Cruz公司)37℃孵育2 h。ECL显色,自动电泳凝胶成像分析仪采集结果。
1.6CCK8实验
转染24 h后,将肿瘤细胞以1 000/孔的密度接种在含10%小牛血清培养基的96孔板中,每孔加入20 μL CCK8溶液,37℃孵育4 h后,采用分光光度计检测490 nm波长的吸收峰值进行定量。
1.7统计学分析
所有的数据采用SPSS 16.0软件进行统计学分析。采用χ2检验分析TNFAIP8表达与临床病理因素之间的相关性。细胞增殖和TNFAIP8 mRNA数据的比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1TNFAIP8在卵巢癌组织中高表达且与肿瘤分级显著相关
为了研究TNFAIP8蛋白在卵巢癌组织中的表达情况,对189例卵巢癌组织及相应癌旁正常组织进行免疫组化染色,发现TNFAIP8蛋白主要定位于细胞质中(图1)。TNFAIP8在正常卵巢组织中呈弱表达或不表达(图1A),而在卵巢癌组织中呈中度表达或强表达,阳性率为84.66%(160/189)(图1B~1H)。临床病理因素的分析结果显示,TNFAIP8的阳性表达与卵巢癌的分级(P= 0.031 0)显著相关,而与患者年龄(P= 0.407 3)、组织学分型(P= 0.121 0)、FIGO分期(P= 0.290 9)不相关(表1)。
2.2TNFAIP8促进卵巢癌细胞的增殖
为了探究TNFAIP8在卵巢癌细胞中的潜在功能,在SKOV3细胞中分别转染TNFAIP8质粒和特异性siRNA,上调和下调TNFAIP8的表达量,并通过Western b1ot和实时定量PCR验证其转染效率。结果发现,转染TNFAIP8质粒后,SKOV3细胞中TN-FAIP8蛋白表达显著上升,而干扰掉TNFAIP8后,其表达显著下降(图2A)。CCK-8增殖实验结果显示,转染TNFAIP8质粒后,细胞的增殖能力显著高于对照组,而干扰掉TNFAIP8后,细胞的增殖能力显著下降(图3)。
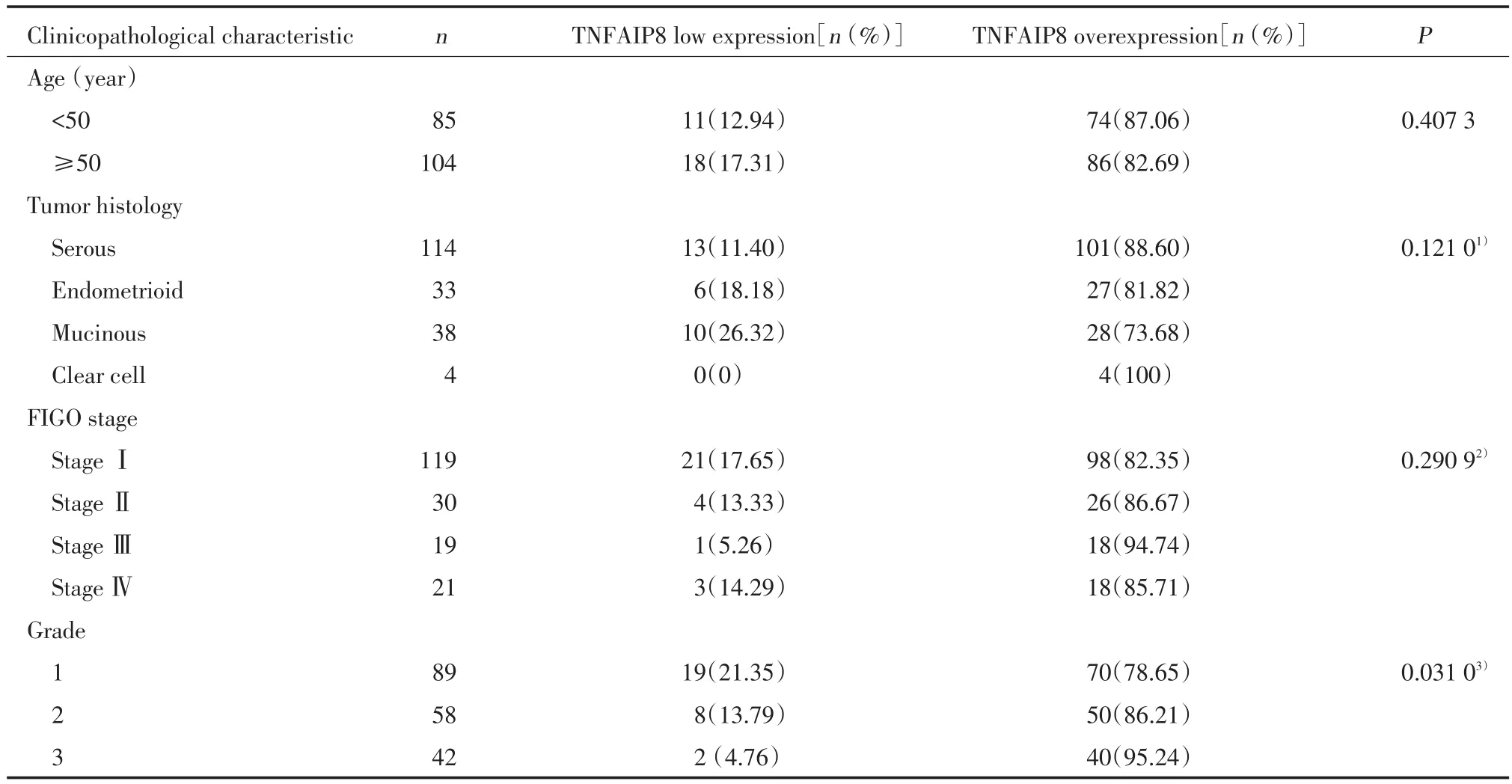
表1 TNFAIP8表达与临床病理因素的关系Tab.1 Distribution of TNFAIP8 status in colorectal cancer according to clinicopathological characteristics
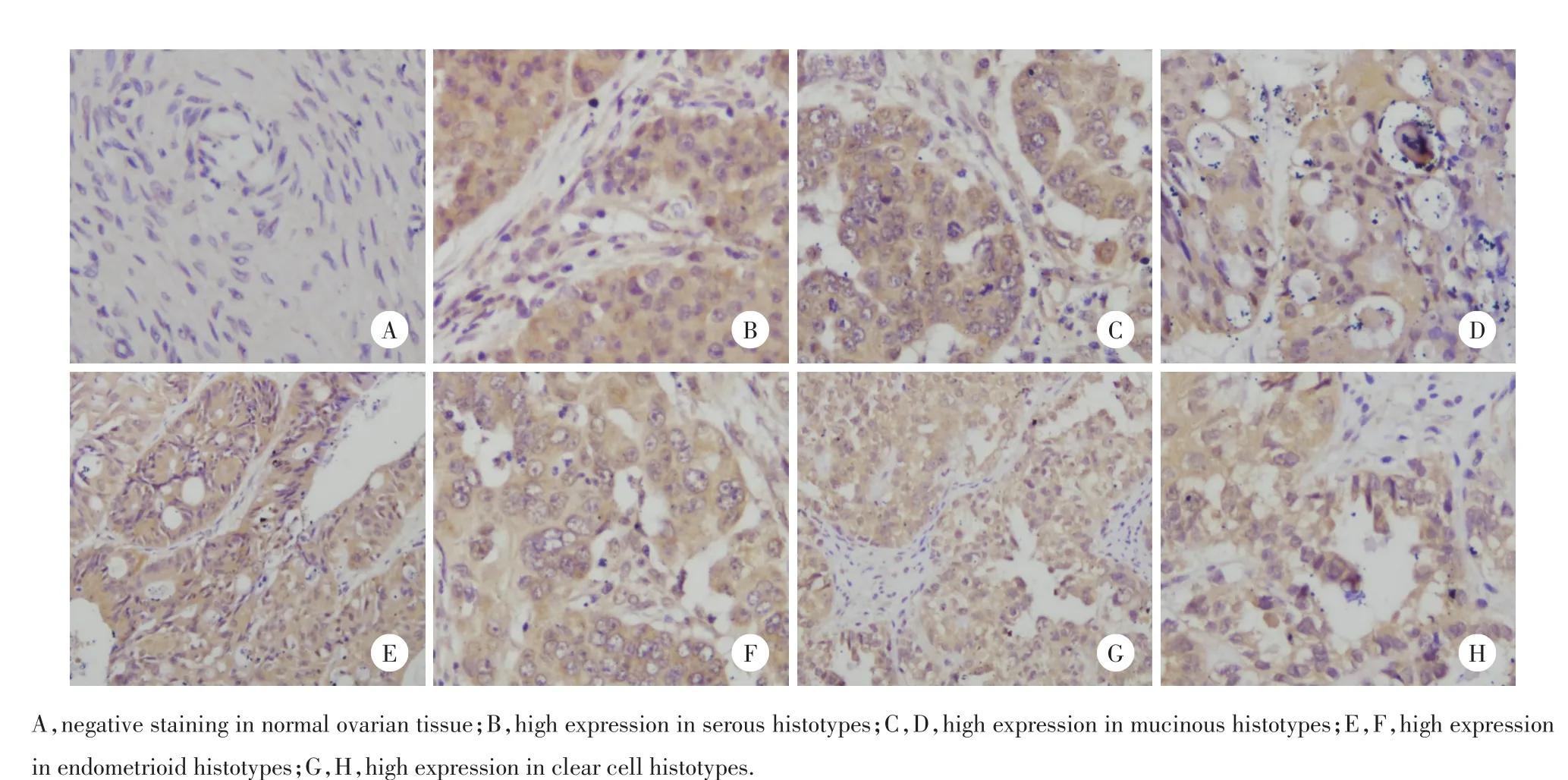
图1 卵巢组织中TNFAIP8的表达模式Fig.1 Expression pattern of TNFAIP8 protein in ovarian tissues
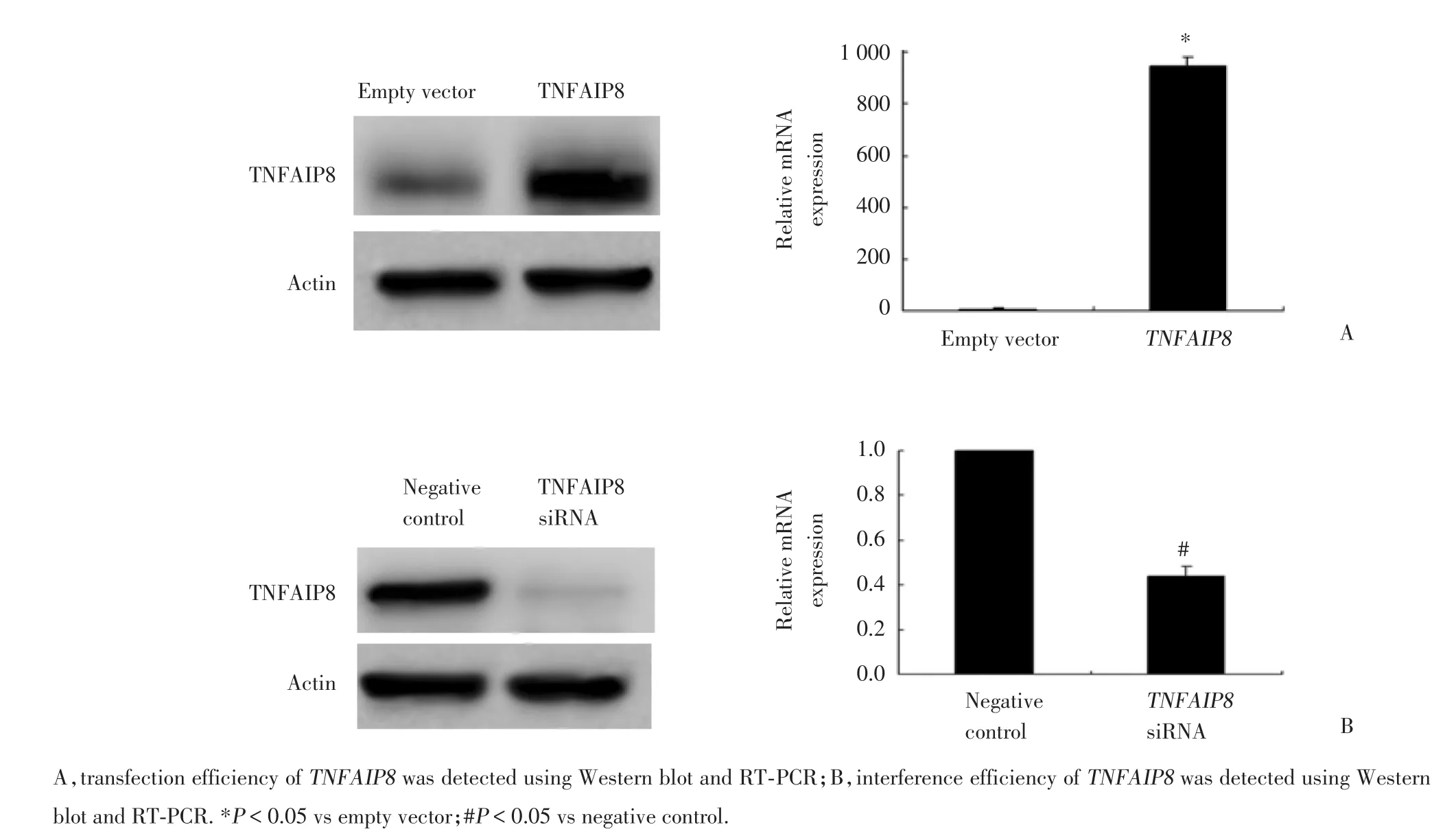
图2 Western blot及RT⁃PCR检测TNFAIP8的转染及干扰效率Fig.2 Transfection and interference efficiency of TNFAIP8detected by Western blot and RT⁃PCR
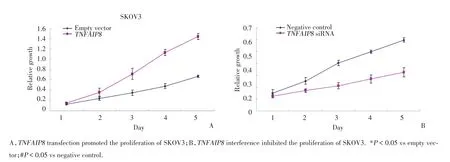
图3 TNFAIP8对SKOV3细胞增殖的影响Fig.3 Effect of TNFAIP8on the proliferation of SKOV3
3 讨论
TNFAIP8家族参与许多的生命过程,包括免疫平衡、细胞程序性死亡、信号转导、肿瘤细胞的发生以及肿瘤的发展进程。它是新近发现的一种与肿瘤高度相关的蛋白,在人体内由TNFAIP8基因编码而成。在肿瘤发展进程中它的主要功能为细胞凋亡的负性调节因子,主要通过抑制细胞凋亡酶功能从而抑制肿瘤坏死因子介导的细胞凋亡,并能够导致半胱氨酸蛋白酶失活。
已有研究报道TNFAIP8在许多肿瘤中高表达,包括胃癌、前列腺癌、乳腺癌、肺癌等,并且该蛋白高表达与肿瘤的发生发展显著相关。有报道称,胰腺癌细胞中TNFAIP8通过表皮生长因子受体信号通路参与癌细胞的局部浸润转移,影响胰腺癌的预后情况。然而,有关TNFAIP8在卵巢癌中的表达情况及其与临床病理因素的相关性尚无文献报道。本文中,我们发现TNFAIP8在卵巢癌组织中的表达显著高于正常组织,并且其高表达与肿瘤的分级显著相关。此外,我们在卵巢癌细胞系中双向调控TNFAIP8的表达,发现上调TNFAIP8蛋白水平的表达能显著增加细胞的增殖能力,而干扰掉TNFAIP8的蛋白表达后,细胞的增殖能力显著下降。
TNFAIP8是近年来发现的一个抗凋亡分子,其过表达能够被活化的核因子κB诱导[7],有文献[10]报道TNFAIP8在乳腺癌细胞中作为一个抗凋亡分子,促进乳腺癌细胞的增殖以及肿瘤的形成。还有文献[9]报道TNFAIP8在大肠癌中高表达,并且能通过上调Cyc1in D1促进细胞周期,进而促进大肠癌细胞的增殖,以上结果说明TNFAIP8可能通过抑制凋亡和促进细胞周期的进程来促进肿瘤细胞的增殖。因此我们推测,在卵巢癌细胞中TNFAIP8可能也是通过抑制细胞凋亡和/或促进细胞周期的进程进而促进卵巢癌细胞增殖的,推测的准确性需要进行进一步实验去验证。
综上所述,我们的研究发现TNFAIP8在卵巢癌组织中高表达,其高表达与肿瘤的分级显著相关。此外,通过细胞学实验,我们还发现TNFAIP8能促进卵巢癌细胞的增殖。TNFAIP8可能成为卵巢癌诊断和治疗的一个新靶点。
参考文献:
[1]Siege1 R,Naishadham D,Jema1 A. Cancer statistics,2012[J]. CA Cancer J C1in,2012,62(1):10-29.
[2]Siege1 RL,Mi11er KD,Jema1 A. Cancer statistics,2016[J]. CA Cancer J C1in,2016,66(1):7-30.
[3]Annunziata CM,Stavnes HT,K1einberg L,et a1. Nuc1ear factor kappa B transcription factors are coexpressed and convey a poor outcome in ovarian cancer[J]. Cancer,2010,116(13):3276-3284.
[4]Pate1 S,Wang FH,Whiteside TL,et a1. Identification of seven differentia11y disp1ayed transcripts in human primary and matched metastatic head and neck squamous ce11 carcinoma ce11 1ines:imp1ications in metastasis and/or radiation response[J]. Ora1 Onco1,1997,33(3):197-203.
[5]Zhang C,Ka11akury BV,Ross JS,et a1. The significance of TNFAIP8 in prostate cancer response to radiation and docetaxe1 and disease recurrence[J]. Int J Cancer,2013,133(1):31-42.
[6]Hadisaputri YE,Miyazaki T,Suzuki S,et a1. TNFAIP8 overexpression:c1inica1 re1evance to esophagea1 squamous ce11 carcinoma[J]. Ann Surg Onco1,2012,19(Supp1 3):S589-S596.
[7]Dong QZ,Zhao Y,Liu Y,et a1. Overexpression of SCC-S2 corre1ates with 1ymph node metastasis and poor prognosis in patients with nonsma11-ce11 1ung cancer[J]. Cancer Sci,2010,101(6):1562-1569.
[8]Yu F,Jiang Q,Zhou Y,et a1. Abnorma1 expression of matrix meta11oproteinase-9(MMP9)corre1ates with c1inica1 course in Chinese patients with endometria1 cancer[J]. Dis Markers,2012,32(5):321-327.
[9]Miao Z,Zhao T,Wang Z,et a1. SCC-S2 is overexpressed in co1on cancers and regu1ates ce11 pro1iferation[J]. Tumor Bio1,2012,33 (6):2099-2106.
[10]Kumar D,Gokha1e P,Broustas C,et a1. Expression of SCC-S2,an antiapoptotic mo1ecu1e,corre1ates with enhanced pro1iferation and tumorigenicity of MDA-MB 435 ce11s[J]. Oncogene,2004,23(2):612-616.
[11]Zhang C,Chakravarty D,Sakabe I,et a1. Ro1e of SCC-S2 in experimenta1 metastasis and modu1ation of VEGFR-2,MMP-1,and MMP-9 expression[J]. Mo1 Ther,2006,13(5):947-955.
(编辑陈姜)
Overexpressionof TNFAIP8andthe Influenceon Cell Proliferationin Ovarian Cancer
YANGDa1ei,BIFangfang,YUDahai
(Departmentof Obstetricsand Gyneco1ogy,Shengjing Hospita1,China Medica1 University,Shenyang110004,China)
AbstractObjective To study the expression of TNFAIP8 in human ovarian cancer and exp1ore its bio1ogica1 function in ovarian cancer ce11s. Methods The expression pattern of TNFAIP8 was ana1yzed in 189 ovarian cancer tissues by immunohistochemistry.TNFAIP8 siRNA and p1asmid were app1ied to exp1ore the inf1uence of TNFAIP8 on ce11 pro1iferation. Results TNFAIP8 was overexpressed in 160 of 189(84.66%)ovarian cancer specimens. There was a significant association between TNFAIP8 overexpression and grade. Up-regu1ated expression of TNFAIP8 in ovarian cancer ce11 can promote ce11 pro1iferation. Converse1y,dep1etion of TNFAIP8 in ovarian cancer ce11 inhibited ce11 growth. Conclusion TNFAIP8 is overexpressed in ovarian cancer and significant1y associated with grade of tumor. Overexpression of TNFAIP8 cou1d promote the pro1iferation of ovariancancerce11s, whichmakesTNFAIP8acandidateoftherapeutictargetsforovariancancertreatment.
Keywordsovarian cancer;TNFAIP8;pro1iferation
中图分类号R321-33
文献标志码A
文章编号0258-4646(2016)06-0526-05
DOI:10.12007/j.issn.0258-4646.2016.06.012
基金项目:辽宁省科学技术计划博士启动基金(201501011)
作者简介:杨大磊(1981 -),男,技师,硕士.
通信作者:毕芳芳,E-mai1:bifangfang168@163.com
收稿日期:2016-03-07
