LY294002联合姜黄素对人肾癌细胞的体外抑制作用
2016-07-08张震王学梅徐克
张震,王学梅,徐克
(中国医科大学附属第一医院1.超声科;2.放射介入科,沈阳110001)
LY294002联合姜黄素对人肾癌细胞的体外抑制作用
张震1,王学梅1,徐克2
(中国医科大学附属第一医院1.超声科;2.放射介入科,沈阳110001)
摘要目的研究磷脂酰肌醇-3激酶(PI3K)特异性抑制剂LY294002与姜黄素联合对人肾癌细胞的抑制作用。方法应用CCK-8法检测姜黄素单独或联合LY294002对人肾癌细胞786-O的抑制率;TUNEL及免疫荧光法检测caspase-3,观察姜黄素单独或联合LY294002对786-O细胞凋亡的影响。结果LY294002联合姜黄素能显著增加姜黄素对786-O细胞的抑制率,同时显著增强姜黄素对细胞凋亡的诱导作用(P<0.05)。结论PI3K特异性抑制剂LY294002通过促进786-O细胞凋亡提高其对姜黄素的敏感性,抑制PI3K/Akt信号转导通路的活性能够提高姜黄素的肿瘤杀伤作用。
关键词磷脂酰肌醇-3激酶;抑制剂LY294002;姜黄素
网络出版地址
网络出版时间:
磷脂酰肌醇-3激酶/蛋白激酶B(phosphatidy1inosito1 3 kinase/protein kinase B,PI3K/Akt)信号传导通路是肿瘤细胞生存的最重要通路,与肿瘤细胞的生存、增殖、转移、蛋白合成以及放化疗的耐受密切相关,在肾癌的发生和发展中也发挥重要作用。近年研究发现,PI3K抑制剂LY294002能够增强抗肿瘤药物的敏感性和疗效,部分逆转化疗的耐药性[1-3],但仅少量文献报道涉及了肾癌。姜黄素是一种具有很强还原作用的试剂,能够增强多种化疗药物的抗癌活性和对肿瘤细胞的杀伤作用,但是LY294002联合姜黄素对人肾癌细胞的作用尚未见报道。本研究通过探讨LY294002联合姜黄素对人肾癌细胞增殖抑制的影响,进一步探究其可能的作用机制,为治疗提供实验依据。
1 材料与方法
1.1材料
1.1.1细胞培养:786-O细胞系在含10%胎牛血清、1%青/链霉素的RPMI 1640培养基中培养,37℃、95%湿度、5%CO2孵箱中孵育。长到对数生长期时用于研究。
1.1.2实验分组:分为4组,即对照组、姜黄素单独用药组(10、20和40 μmo1/L姜黄素)、LY294002单独用药组(20 nmo1/L LY294002)、联合用药组(10、20 和40 μmo1/L姜黄素+20 nmo1/L LY294002)。
1.2方法
1.2.1CCK-8法检测786-O细胞抑制率:取对数生长期的786-O细胞,向96孔板各孔中加入100 μL细胞悬液,保证每孔的细胞数为5×103个。将细胞放于37℃、5%CO2培养箱内培养,待细胞贴壁后按照分组进行处理。共同孵育时间为24和48 h。弃掉原有培养液,向每孔加100 μL的培养液及10 μL CCK-8,继续培养3 h后用酶标仪检测OD490处各孔吸光度(absorbance,A)。计算各组细胞增殖抑制率(%)= (1-A实验组/A对照组)×100。
1.2.2TUNEL染色:TUNEL试剂盒用于细胞凋亡检测。各组处理后的786-O细胞染色依据试剂盒说明书中的步骤进行,肿瘤细胞用罗丹明染色,2 h后洗脱并计数。凋亡细胞计数和分析,使用日本O1ympus IX71-A12FL/PH倒置显微镜照相。
1.2.3免疫荧光染色:使用直接免疫荧光法检测caspase-3和PI3K-p110γ蛋白表达。786-O细胞根据分组加入LY294002和姜黄素进行单独或联合处理,与caspase-3和PI3K-p110γ抗体(1∶100)室温孵育40 min,避光,使用1 μmo1/L DAPI染核。阳性染色细胞照相使用O1ympus IX71-A12FL/PH倒置荧光显微镜。
1.3统计学分析
所有数据采用x±s表示,使用SPSS 19.0软件进行统计学t检验和单因素方差分析。所有实验均独立重复3次,每组6个复孔。P<0.05为差异有统计学意义。
2 结果
2.1姜黄素和LY294002对肿瘤细胞的细胞毒性作用
姜黄素单独用药组、LY294002单独用药组和联合用药组与对照组比较,786-O细胞的生长率显著受到抑制,各组A值均有下降,且肿瘤细胞的活性随着姜黄素浓度增加而降低,呈剂量依赖性(P<0.05)。联合用药组肿瘤细胞的活性较单独用药组下降幅度稍大,表明二者联合的细胞毒性大于单独应用姜黄素。见表1。
2.2姜黄素下调PI3K-p110γ的表达
应用LY294002(20 nmo1/L)完全抑制PI3K-p110γ的表达。应用不同浓度姜黄素作用后,随着姜黄素浓度的增加,PI3K-p110γ的表达显著下降(P<0.05)。提示姜黄素对抗肿瘤的作用可能与PI3K/ Akt信号转导通路的活性有关。见图1。
2.3姜黄素和LY294002诱导肿瘤细胞凋亡
TUNEL染色结果显示,姜黄素单独用药组或联合用药组均能诱导786-O细胞凋亡,且随着姜黄素的浓度增加呈增强趋势;联合用药组与姜黄素单独用药组比较,凋亡细胞数的差异有统计学意义(P<0.05)。免疫荧光染色显示,786-O细胞内的凋亡相关蛋白caspase-3表达也显著上调(P<0.05),且随着浓度的增加表达呈增强趋势;联合用药组与姜黄素单独用药组比较,凋亡细胞数的差异有统计学意义(P<0.05)。见图2。这些结果表明,LY294002有增强姜黄素诱导细胞凋亡的作用。

表1 LY294002和姜黄素对786⁃O细胞的抑制作用(%)Tab.1 Inhibitory rate of LY294002 and curcumin to 786⁃O cells (%)
3 讨论
姜黄素是从姜黄根茎中提取出的一类黄色酚类物质,是姜黄的主要有效成分之一,方便易得。姜黄素具有抗肿瘤作用,可以通过多种机制诱导肿瘤细胞凋亡,如抑制细胞内脂肪酸合酶[1]、通过诱导活性氧簇产生细胞遗传毒性效应[2]。miR-21介导姜黄素增殖、凋亡、转移、抗癌耐药性等多种效应,可结合于miR-21的启动子,通过PTEN/PI3K/Akt传导通路和核因子κB基因传导通路下调miR-21的表达来实现[3]。
PI3K信号参与增殖、分化、凋亡等多种细胞功能的调节。PI3K是由催化亚单位p110和调节亚单位p85组成的二聚体蛋白,具有类脂激酶和蛋白激酶的双重活性。PI3K可通过Ras和p110直接结合导致PI3K的活化。研究发现,敲除PI3K-p110γ能够通过引起肿瘤细胞在G0~G1期细胞周期停滞抑制细胞增殖[4]。PI3K及其下游分子蛋白激酶B(PKB或Akt)组成的信号通路与人类肿瘤的发生发展密切相关。在肿瘤切除术后,PI3K能够通过抑制凋亡和产生并诱导对化疗药物的耐药性加速肿瘤生长[5]。
联合LY294002抑制PI3K信号通路后,姜黄素

图1 不同浓度姜黄素对PI3K⁃p110γ表达的影响Fig.1 Effects of curcumin at different concentrations on the expressions of PI3K⁃p110γ
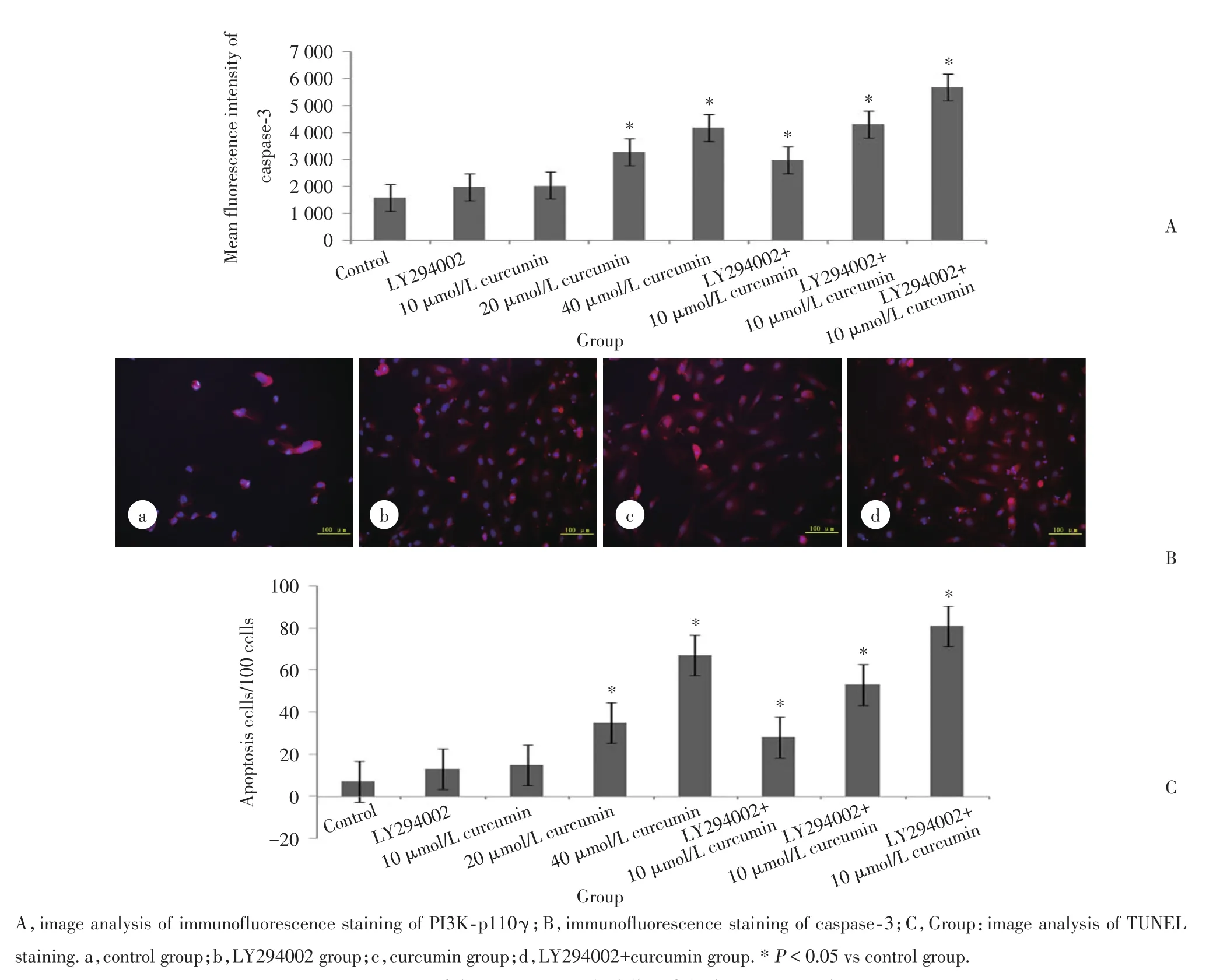
图2 TUNEL染色和caspase⁃3免疫荧光染色检测786⁃O细胞凋亡Fig.2 Apoptosis of 786⁃O studied by TUNEL staining and immunofluorescence of caspase⁃3
显著抑制结肠癌细胞系的增殖、转移、侵袭和克隆形成,并上调caspase-3的表达,具有剂量依赖性[6]。在前列腺癌中,随姜黄素药物浓度增加,姜黄素上调p53和第15位丝氨酸磷酸化的表达,明显活化caspase-3诱导的细胞凋亡[7],与我们在786-O细胞系中观察到的结果一致。
本研究中,姜黄素与PI3K抑制剂LY294002联合作用效果显著强于姜黄素单独作用,LY294002能够增强姜黄素的细胞毒性作用,增强对786-O细胞凋亡的诱导作用,强化凋亡相关蛋白caspase-3的表达。综上所述,姜黄素可能通过抑制PI3K/Akt相关通路的活化来产生诱导786-O细胞凋亡的作用。
参考文献:
[1]Fan H,Liang Y,Jiang B,et a1. Curcumin inhibits intrace11u1ar fatty acid synthase and induces apoptosis in human breast cancer MDAMB-231 ce11s[J]. Onco1 Rep,2016,35(5):2651-2656.
[2]Papie MA,Krzy ciak W,Szade K,et a1. Curcumin enhances the cytogenotoxic effect of etoposide in 1eukemia ce11s through induction of reactive oxygen species[J]. Drug Des Deve1 Ther,2016,10:557-570.
[3]Chen J,Xu T,Chen C. The critica1 ro1es of miR-21 in anti-cancer effects of curcumin[J]. Ann Trans1 Med,2015,3(21):330.
[4]Dituri F,Mazzocca A,Lupo L,et a1. PI3K c1assⅠB contro1s the ce11 cyc1e checkpoint promoting ce11 pro1iferation in hepatoce11u1ar carcinoma[J]. Int J Cancer,2012,130(11):2505-2513.
[5]Coffey JC,Wang JH,Smith MJ,et a1. Phosphoinositide 3-kinase acce1erates postoperative tumor growth by inhibiting apoptosis and enhancing resistance to chemotherapy-induced apoptosis. Nove1 ro1e for an o1d enemy[J]. J Bio1 Chem,2005,280(22):20968-20977.
[6]Jiang QG,Li TY,Liu DN,et a1. PI3K/Akt pathway invo1ving into apoptosis and invasion in human co1on cancer ce11s LoVo[J]. Mo1 Bio1 Rep,2014,41(5):3359-3367.
[7]Shankar S,Srivastava RK. Invo1vement of Bc1-2 fami1y members,phosphatidy1inosito1 3′-kinase/AKT and mitochondria1 p53 in curcumin(diferu1o1y1methane)-induced apoptosis in prostate cancer [J]. Int J Onco1,2007,30(4):905-918.
(编辑陈姜)
Inhibitory Effectof LY294002 Combinedwith Curcuminoninvitro Cultured Renal Carcinoma Cells
ZHANGZhen1,WANGXuemei1,XUKe2
(1. Department of U1trasound,The First Hospita1,China Medica1 University,Shenyang 110001,China;2. Department of Radio1ogy and Intervention,The First Hospita1,China Medica1 University,Shenyang110001,China)
AbstractObjective To investigate the inhibitory effect of phosphatidy1cho1ine-3 kinase(PI3K)specific inhibitor,LY294002,combined with curcumin onin vitro cu1tured rena1 carcinoma ce11s. Methods Rena1 carcinoma ce11s were treatedwith PI3K specific inhibitor LY294002,curcumin a1one,or in combination. CCK-8 assay was used to measure the inhibitory rate. TUNEL staining and immunof1uorescence of caspase-3 were app1iedtoeva1uatetheapoptoticeffects.Results Inhibitoryrateof786-Oce11swassignificant1yincreasedunderthecombinationadministrationofcurcumin and LY294002,and the apoptosis were significant1y induced(P<0.05). Conclusion Sensitivity to curcumin of 786-O cou1d be increased by LY294002throughtheapoptosis-re1atedmechanisms,and inhibition of PI3K/Aktpathwaymightbere1atedwiththeactivationofanti-tumoreffect bycurcumin.
Keywordsphosphatidy1cho1ine-3 kinase;inhibitor LY294002;curcumin
中图分类号R34
文献标志码A
文章编号0258-4646(2016)06-0491-04
DOI:10.12007/j.issn.0258-4646.2016.06.003
基金项目:国家自然科学基金(81600020,81471809);辽宁省科学技术计划(2013225049)
作者简介:张震(1975 -),女,副教授,博士.
通信作者:徐克,E-mai1:wangzy@mai1.cmu.edu.cn
收稿日期:2016-03-21
